Method Article
מערכת צנצנות זכוכית רב-תכליתית ליצירת פרופיל הפרשה סמי-הידרופוני של שורשים
In This Article
Summary
אנו מציגים פרוטוקול למערכת ניסויית סמי-הידרופונית מבוססת זכוכית התומכת בגידול של מגוון צמחים מובחנים פילוגנטית עם או בלי מיקרואורגניזמים. המערכת תואמת למצעי גידול שונים ומאפשרת דגימת הפרשה שורשית לא הרסנית לניתוח במורד הזרם.
Abstract
הפרשות שורשים מעצבות את ממשק הצמח-קרקע, מעורבות במחזור חומרי מזון ומווסתות אינטראקציות עם אורגניזמים בקרקע. הפרשות שורשים הן דינמיות ומעוצבות על ידי תנאים ביולוגיים, סביבתיים וניסיוניים. בשל המגוון הרחב והריכוזים הנמוכים שלהם, קשה לקבוע פרופילי הפרשה מדויקים, על אחת כמה וכמה בסביבות טבעיות שבהן אורגניזמים אחרים נוכחים, הופכים תרכובות שמקורן בצמחים ומייצרים תרכובות נוספות בעצמם. המערכת הניסיונית של צנצנת זכוכית סמי-הידרופונית שהוצגה כאן מאפשרת שליטה על גורמים ביולוגיים, סביבתיים וניסיוניים. הוא מאפשר גדילה של מיני צמחים שונים מבחינה פילוגנטית למשך עד מספר חודשים עם או בלי מיקרואורגניזמים, במגוון מצעי גידול שונים. העיצוב מבוסס הזכוכית מציע רקע מטבוליט נמוך לרגישות גבוהה והשפעה סביבתית נמוכה מכיוון שניתן לעשות בו שימוש חוזר. ניתן לדגום הפרשות באופן לא הרסני, ותנאים יכולים להשתנות במהלך ניסוי אם רוצים. ההתקנה תואמת לניתוח ספקטרומטריית מסות ופרוצדורות אנליטיות אחרות במורד הזרם. לסיכום, אנו מציגים מערכת גידול ורסטילית המתאימה לניתוח הפרשה רגישה של שורשים במגוון מצבים.
Introduction
בתוך קרקעות מאוכלסות בצפיפות, הריזוספרה מציגה נישה עשירה בפחמן. הוא מעוצב על ידי שורשי צמחים באמצעות הפרשה של עד 20% מהפחמן המתבולל ומכיל קהילות מיקרוביאליות הנבדלות ממיקרוביום הקרקע המקומי 1,2,3,4,5,6. בעוד חוקרים מנצלים את הפונקציות המועילות של מיקרובים הקשורים לשורשים ואת הפוטנציאל לחקלאות בת-קיימא שמתלווה לכך7, תצפית זו, המכונה לעתים קרובות אפקט ריזוספרה, עמדה במוקד המאמצים המדעיים ההולכים וגדלים. עם זאת, עד כה, הדיאלוג הכימי בין מיקרואורגניזמים וצמחים, אשר מוצע להיות המניע של אפקט ריזוספרה, נותר מובן היטב ולכן, ההבנה המכניסטית לפיתוח פתרונות מיקרוביאליים אמינים בחקלאות מוגבלת 8,9,10.
פענוח הפרשות שורשים בסביבות קרקע שבהן מטבוליטים נספגים בקלות על ידי חלקיקי קרקע והופכים במהירות על ידי קהילות מיקרוביאליות אינו פשוט, במיוחד עבור מיני צמחים עם מערכות שורשים עדינות כגון צמח המודל Arabidopsis thaliana11. זו הסיבה שברוב המחקרים, הפרשות שורש נדגמות ממערכות הידרופוניות. במיקרוקוסמוס זה, חלקים אוויריים של צמחים מוחזקים במקום על ידי מחזיקי צמחים מותאמים אישית או חומרים נמוכים יותר כגון רשת, אגר וחרוזי זכוכית. המיכלים המשמשים נעים בין צלחות פטרי מעל צלחות מרובות בארות לקופסאות מותאמות אישית ומסחריות שונות עם או בלי מסנני אוורור 12,13,14,15,16,17,18,19. בהתאם למערכת, תנאי הגידול של הצמח ישתנו מאוד וישקפו את התנאים הטבעיים במידה רבה יותר או פחות.
כאן, אנו מציגים מערכת סמי-הידרופונית מבוססת זכוכית, הניתנת לניסוי ומפיקה תוצאות הניתנות לשחזור ברמה גבוהה. הוא פשוט להרכבה ולשימוש ומבוסס על חומרים זמינים בדרך כלל. המערכת מבוססת על צנצנת זכוכית מלאה בחרוזי זכוכית, תוך ניצול האופי הרב-פעמי ותכונות הקשירה הנמוכה של כלי זכוכית (איור 1). החרוזים מספקים תמיכה פיזית לצמח הגדל ומדמים עכבה מכנית, ותורמים לארכיטקטורת שורשים דמוית קרקע יותר בהשוואה למערכים הידרופוניים 19,20,21. אם מחסנים אותם בחיידקים, חרוזי הזכוכית מציגים משטחים שחיידקים יכולים להיצמד אליהם.
ניתן לסגור את צנצנת הזכוכית כדי לשמור על סטריליות והמערכת מתוכננת לאפשר מרחב ראש וזרימת אוויר מספיקים, תוך הימנעות מסביבה רוויה בלחות. הצנצנות מתאימות לגדילה ממושכת של מיני צמחים שונים וניתן להגדיל ולהקטין אותן באמצעות קנקנים בגדלים שונים. כאן, יישומים עבור שישה מיני צמחים מוצגים, המכסים C3 ו C4 עשבים, דיקוטים, קטניות. ביניהם הם מיני המודל A. thaliana (dicot), Brachypodium distachyon (C3 monocot), Medicago truncatula (קטניות), כמו גם מיני יבול כגון Solanum lycopersicum (עגבניה, dicot), Triticum aestivum (חיטה, C3 monocot), ו Sorghum bicolor (דורה, C4 monocot). הפרוטוקול שהוצג כולל את המערך הניסיוני של המערכת, עיקור ונביטה של זרעים של שישה מיני צמחים, השתלת שתילים בצנצנות, מצעי גידול שונים, חיסון מיקרואורגניזמים, דגימת הפרשה שורשים ועיבוד exudate לניתוח.
Protocol
1. הכנת שתילים: עיקור פני השטח של זרעים
הערה: עיקור פני השטח של זרעים וכל השלבים הבאים חייבים להיעשות בתנאים סטריליים אלא אם כן צוין אחרת. שלבים 1.1 עד 1.4 ספציפיים לעיקור פני השטח של זרעי A. thaliana . למיני צמחים אחרים יש שינויים חלופיים בגודל הצינור (בהתאם למספר הזרעים וגודל הזרעים), זמן בתמיסות ופתרונות עיקור (טבלה 1).
- מוסיפים זרעים לצינור מיקרוצנטריפוגה (מקסימום 20 מ"ג זרעים) ומכסים את הזרעים באתנול 70%.
אזהרה: אתנול דליק. אין להשתמש ליד להבה גלויה. - מעבירים את צינורות המיקרוצנטריפוגות הסגורות לשייקר למשך 15 דקות, ומכוונים את הסיבוב כך שהזרעים יהיו נסערים בעדינות.
- בזהירות להסיר 70% אתנול עם פיפטה ולהחליף אותו עם 100% אתנול. חזור על שלב 1.2.
- הסר 100% אתנול וייבש את הזרעים על ידי השארת מכסי צינור מיקרוצנטריפוגה פתוחים בזרימת אוויר סטרילית.
- לאחר שהזרעים יבשים, פזרו אותם באופן שווה על מדיום 0.5x Murashige ו-Skoog (MS) עם 0.7% פיטו אגר על ידי הזזת הצינור או שימוש במלקחיים סטריליים. סגרו את צלחות האגר ואטמו אותן בסרט מיקרו-נקבוביות בקוטר 1.25 ס"מ.
- מניחים את הלוחות אופקית על מדף בתא הגידול (16 שעות בהיר / 8 שעות כהות, 22 ° C יום / 18 ° C לילה, 150-160 μmol m-2 s-1).
2. הכנת שתילים: העברת זרעים מונבטים לצלחות טריות
הערה: השלבים הבאים ספציפיים עבור A. thaliana ואינם נחוצים עבור מינים אחרים.
- לאחר הנביטה, העבירו 5 עד 6 שתילים לצלחות פיטו אגר חדשות של 0.7% עם מדיום 0.5x MS על-ידי מיקום השתילים באופן ליניארי, כ-3 ס"מ מלמעלה (ראו את מיקום הרוזטה באיור 2D).
- אטמו צלחות אגר עם סרט מיקרו-נקבוביות בקוטר 1.25 ס"מ וגדלו במאונך בתא הגידול (איור 2D) עד שהשתילים מוכנים להעברה לצנצנות 15-18 יום לאחר הנביטה (טבלה 2).
3. הכנת מערכת הידרופונית: התקנת צנצנת
- הוסיפו 150 מ"ל של חרוזי זכוכית נקיים בקוטר 5 מ"מ לכל צנצנת נקייה וסגרו עם המכסה (איור 1A).
הערה: בפרוטוקול זה, חרוזי זכוכית 5 מ"מ מתאימים לרוב המינים22, אך ניתן להתאים את גודל החרוז במידת הצורך. - הניחו מספיק נייר אלומיניום על הצנצנות הסגורות כדי לכסות את צומת המכסה לצנצנת ואת האוטוקלאבה (121°C למשך 20 דקות) (איור 1B).
- שמרו את הצנצנות המוכנות מכוסות עד שהצמחים מוכנים להעברה (טבלה 2).
4. הכנת מערכת הידרופונית: הוספת שתילים
- כאשר השתילים מוכנים להעברה לצנצנות (טבלה 2), הסירו את רדיד האלומיניום ואת מכסי הצנצנות בספסל הסטרילי.
- אם יש לחסן את הצנצנות בחיידקים, בצע את השלבים הבאים לפני המעבר לשלב 4.3; אחרת, דלג על שלב 4.2.
- באמצעות לולאת חיסון סטרילית, בחר מושבות בודדות מתרביות חיידקים טהורות על צלחות אגר ותלה אותן ב 750 μL של סטרילי 10 mM MgCl2. חזור על הפעולה עד שהפתרון עכור.
- אופציונלי: יש לשטוף את המתלה 3x עם 750 μL של 10 mM MgCl2 סטרילי על ידי 5 דקות צנטריפוגה ב 1,000 × גרם ובטמפרטורת החדר ולאחר מכן הסרת supernatant ותרחיף של הגלולה ב 750 μL של 10 mM MgCl2.
- אופציונלי: אם מחסנים מספר זני חיידקים שונים, ערבבו את המתלים של זנים בודדים שהוכנו בשלבים 4.2.1-4.2.2 ביחסים שווים לפני שתמשיכו.
- כוונן את הצפיפות האופטית באורך גל 600 ננומטר (OD600) ל- 0.2-0.4 אינץ' בתווך MS 0.5x (pH 5.7 עד 5.9, מותאם עם KOH) או אמצעי גידול אחר לפי בחירה (ראה שלב 4.3). מדוד שוב את OD600 כדי לבדוק אם התמיסה דוללה כראוי.
זהירות: KOH הוא קורוזיבי; יש ללבוש כפפות ומעיל מעבדה. - לדלל את המתלה עוד יותר OD600 0.002-0.004 באותו מדיום (דילול 1:100).
הערה: צפיפות התאים הסופית תהיה תלויה בזן החיידקי בו נעשה שימוש, אך מניסיוננו, חיסון זה מתאים לכ 3-6 × 105 תאים mL-1. - מוסיפים 35 מ"ל מהדילול הסופי לכל צנצנת. הוסף 35 מ"ל של מדיום גידול סטרילי כדי לשלוט בצנצנות. ערבבו את החרוזים לציפוי אחיד במדיה של 0.5x MS לפני העברת הצמח, כך שהשורשים לא יתייבשו. המשך לשלב 4.4.
- הוסף 35 מ"ל של 0.5x MS בינוני לכל צנצנת (pH 5.7 עד 5.9, להתאים עם KOH). ערבבו את החרוזים לציפוי אחיד עם מדיה של 0.5x MS לפני העברת הצמח כדי שהשורשים לא יתייבשו.
הערה: ניתן לשנות את מדיום הגידול, לדוגמה, על ידי הסרת חומרים מזינים, תוספת של אוסמוליטים כדי לגרום ללחץ מלח, או שימוש בערכי pH שונים או אמצעי צמיחה. זהירות: KOH הוא קורוזיבי; יש ללבוש כפפות ומעיל מעבדה. - מניחים 3-5 צמחי A. thaliana בצנצנת על ידי הנחת מערכות השורשים בין חרוזי הזכוכית.
הערה: מספר הצמחים בכל צנצנת שונה עבור מינים אחרים (טבלה 2). - הניעו את החרוזים בעזרת מלקחיים סטריליים או כפות כדי לכסות את השורשים ולהרים את העלים מחוץ למדיה (איור 1C).
הערה: הזיזו בזהירות את הצמחים והחרוזים כדי למנוע שבירת שורשים ולחץ על הצמחים. - הוסיפו 2 רצועות של סרט מיקרו-נקבוביות בקוטר 1.25 ס"מ לאורך החלק העליון של הצנצנות והניחו בעדינות את המכסה מעל (איור 1D-F).
הערה: אין ללחוץ כלפי מטה על המכסה כדי למנוע הפרעה לחילוף האוויר. - כסו את הרווח בין המכסה לצנצנת בסרט מיקרו-נקבוביות בקוטר 2.5 ס"מ כדי לשמור על סטריליות תוך מתן אפשרות לחילופי אוויר, והכניסו את הצנצנות לתא גדילה (איור 1G,H).
- הציבו 4-8 צנצנות לכל תנאי ניסוי, בהתאם לשאלה הביולוגית ולשונות הצפויה.
- הקפד לכלול בקרות ביולוגיות שליליות (למשל, צנצנות ללא צמחים) כדי להסביר את הרקע המטבוליטי של מערכת הניסוי. הגדר את אותו מספר משכפלים לבקרות שליליות כמו עבור טיפולים ניסיוניים (למשל, quadruplicates).
- לתקופות צמיחה ממושכות, החלף את מדיום הצמיחה מדי שבוע: הסר את שארית מדיום הגידול בפיפט נפחי של 25 מ"ל והוסף 35 מ"ל של מדיום טרי.
5. אוסף של הפרשות שורש
- כאשר הצמחים מגיעים לגיל הרצוי, הסירו את סרט המיקרו-נקבוביות בקוטר 2.5 ס"מ ואת המכסה בספסל הסטרילי.
הערה: עבור A. thaliana בתנאי הצמיחה שלנו, 21 יום לאחר הנביטה מייצג שלב וגטטיבי בוגר לפני תחילת הפריחה. שלב ההתפתחות הווגטטיבית הוא ספציפי למיני הצמחים, ועיתוי תקופת הצמיחה משתנה עם מיני הצמחים; עיתוי זה ניתן לשינוי בהתאם לשאלת המחקר. - לבדיקת סטריליות, aliquot 20 μL של מדיום צמיחה ו pipet על לוחות אגר LB.
- עבור צנצנות מחוסנות, aliquot 100 μL של מדיום גידול לשימוש עבור ספירת יחידה יוצרת-מושבה (CFU) (למשל, בסדרת דילול23).
הערה: מניסיוננו, צפיפות החיידקים נעה בטווח של 105-10 8 תאים חיים mL-1 של מדיום גידול.
- עבור צנצנות מחוסנות, aliquot 100 μL של מדיום גידול לשימוש עבור ספירת יחידה יוצרת-מושבה (CFU) (למשל, בסדרת דילול23).
- הסר כמה שיותר מדיום צמיחה עם צינור נפח 25 מ"ל, הימנעות נזק לשורשים.
- הוסף 50 מ"ל של אמצעי איסוף (למשל, 20 מ"מ אמוניום אצטט; pH 5.7-5.9 מותאם עם HCl) על ידי פיפטוף לאורך דפנות הצנצנת כדי למנוע הרטבת העלים. סוגרים את הצנצנות עם מכסים ודגרים עליהן בתנאים סטריליים לזמן הרצוי של איסוף exudate. עבור ניסויים תלויי זמן, שעתיים הן חלון איסוף טוב.
אזהרה: HCl הוא קורוזיבי; יש ללבוש כפפות ומעיל מעבדה. לזמני איסוף שורשים ארוכים יותר, עטפו שוב את העפעפיים בנייר דבק והעבירו את הצנצנות לתא הצמיחה. - לאחר שעתיים, הסר את הכמות הרצויה של אמצעי איסוף לתוך צינורות (למשל, 50 מ"ל עבור בדיקות או ניתוחים באמצעות exudates מרוכז, או 2 מ"ל לשימוש ישיר). אחסן את הפרשת השורש שנאספה ב -80 °C עד לעיבוד או ניתוח נוספים.
- כאשר עובדים עם צנצנות מחוסנות, צנטריפוגו את ההפרשים שנאספו במשך 10 דקות ב 5,000 × גרם ו 4 ° C ורק להשתמש supernatants עבור הניתוח. לחלופין, יש לעקר את ההפרשה באמצעות מסנן של 0.22 מיקרומטר או 0.45 מיקרומטר.
- אם הניסוי הוא חלק מסדרת זמן, הסר את כל אמצעי האיסוף הנותרים מהצנצנות והוסף 35 מ"ל של מדיום 0.5x MS. החליפו את המכסה ואת סרט הדבק בקוטר 2.5 ס"מ לפני החזרת הצנצנות לתא הגידול.
- מדדו את השורש וירו במשקל טרי של כל הצמחים בצנצנת אחת כדי לנרמל מאוחר יותר את הפרשת השורש לפי משקל הצמח.
הערה: ניתן לדגום רקמות צמח בנוסף במידת הצורך.
6. עיבוד הפרשות שורש עבור ספקטרומטריית מסות
- בהתאם לשיטה האנליטית, יבש בהקפאה את השורש מפריש כדי להתרכז ולהסיר את מדיום האיסוף (-80 ° C ב 0.37 mbar עד שאין נוזל). יש לאחסן בטמפרטורה של -80°C עד לניתוח מוכן.
הערה: הנתונים המוצגים כאן נוצרו באמצעות ניתוח TOF-MS בהזרקת זרימה במכשיר זמן טיסה מרובע בעל מסה מדויקת. - לפני ההזרקה למכשיר האנליטי, יש ליצור מחדש הפרשים מיובשים בהקפאה או לדלל הפרשי שורש לא מעובדים באמצעי איסוף בהתאם למשקל הטרי של השורש.
הערה: מדיום האיסוף נבחר כך שיתאים לספקטרומטר המסות. עם זאת, בהתאם לשיטה האנליטית, ייתכן שיהיה צורך בשלבי התפלה לפני ההזרקה.
תוצאות
המערכת הניסויית שהוצגה כאן מאפשרת בקרה על גורמים ניסיוניים וסביבתיים המשנים פרופילי הפרשה של שורשים. השווינו את גידול A. thaliana בתנאי תאורה שונים, גיל הצמח וצפיפויות צמחים בשתי מעבדות שונות (איור 3). צמחים נראו בריאים במעבדות שונות (איור 3A,B). תנאים של יום קצר (10 שעות אור לעומת 16 שעות אור, איור 3) גרמו למסת שורשים גבוהה יותר בהשוואה לתנאים של ימים ארוכים (איור 3C,D). באופן דומה, מסת השורשים הכוללת של כל הצמחים שגדלו בתנאים של יום ארוך הייתה קטנה יותר מאשר בתנאים קצרים (איור 3C). בסך הכל, השונות בגידול בתוך ובין צנצנות הייתה נמוכה במעבדות.
מערכת קנקני הזכוכית מתאימה למגוון מיני צמחים ולשלבי התפתחות. נקודת הסיום של ניתוח הפרשת שורשים היא בדרך כלל 21 יום, מאחר שבתנאי הניסוי שלנו, מיני צמחים רבים נמצאים בשלב וגטטיבי בוגר לפני המעבר לשלב הרבייה (איור 4A-E). ניתן להוציא צמחים בקלות ממערכת הניסוי ללא נזק נראה לעין למערכת השורשים. לכן, קביעת משקלי רקמות או שימוש ברקמות לניתוח במורד הזרם היא פשוטה. משקלי הנבטים הגבוהים ביותר נמצאו עבור חיטה, ואחריה דורה ועגבנייה. משקלי השורש הגבוהים ביותר נמצאו עבור דורה, ואחריה חיטה ו- M. truncatula. יחס השורש:יורה שונה בין המינים. בסך הכל, משקל הרקמה נע בין 100 מ"ג ל 800 מ"ג.
היבט מרכזי של מערכות ניסיוניות המאפשרות איסוף הפרשת שורשים הוא חיסון מבוקר עם מיקרובים כדי לחקור אינטראקציות צמחים-מיקרואורגניזמים בסביבה מוגדרת. המערכת הניסיונית המוצגת יכולה להישמר סטרילית אפילו עם מניפולציות חוזרות ונשנות (ראו מצב "בקרה" באיור 5), וניתן להוסיף חיידקים ולתחזק אותם לפרקי זמן ממושכים. כאשר צמחי A. thaliana בני 33 יום חוסנו בתערובת של חיידקים קומנסליים ב-OD600 0.004, חיידקים שרדו במשך 12 יום, שזה היה משך הזמן המלא של הניסוי (איור 5). יחידות יוצרות מושבה אפילו גדלו פי 100 בתווך הגידול וגם התיישבו בשורשים (איור 5C). לא ניתן היה להבחין בין פנוטיפים של צמחים מחוסנים לבין אלה של צמחים סטריליים (איור 5A,B).
מערכת הניסוי המוצגת מאפשרת איסוף exudate בתנאי ניסוי רבים. כאן אנו מציגים פרופילי הפרשה של A. thaliana Col-0 שנאספו באמוניום אצטט או במים מאותם צמחים ברציפות (איור 6A). הפרשות אוחסנו בטמפרטורה של -80 מעלות צלזיוס עד לאנליזה, נורמלו לפי משקל שורש ונותחו על ידי ספקטרומטריית מסות. דגימות של צנצנות שהכילו צמחים סוננו כנגד בקרות ניסיוניות (צנצנות ללא צמחים). מתוך 2,163 מטבוליטים, 436 הראו אות מעל הרקע (20.16%) ונשמרו לניתוח. מתוכם, 416 או 95% מהתרכובות הראו שפע מובהק בין תנאי הניסוי. עם זאת, לא ניתן לייחס 26 מטבוליטים לכל סוג של תרכובת ולכן אינם מוגדרים. רוב המטבוליטים (406 או 98%) היו נפוצים יותר בהפרשות שנאספו במים. האוסף העוקב של הפרשה תחילה באמוניום אצטט ולאחר מכן במים עשוי להשפיע על פרופיל ההפרשה, שכן אותות מטבוליים עשויים לדלל עם הזמן. עם זאת, אות ההפרשה הגבוה כמעט באופן בלעדי במים שנאסף כנקודת זמן שנייה אינו תומך בהשערה זו: איסוף הפרשה במים טהורים יוצר ככל הנראה זעזוע אוסמוטי לצמחים, הגורם לשפע מטבוליטים מוגבר בהשוואה לממס איסוף שווה ערך לתמיסת הגידול (20 מילימטר אמוניום אצטט שווה ערך ל-0.5x MS בינוני). חקירת סוגים כימיים של תרכובות מזוהות של שני תנאי הגידול הראתה כי רוב התרכובות הן חומצות אורגניות ונגזרות (28.6%) ואחריה תרכובות חמצן אורגניות (18%), תרכובות אורגנו-הטרוציקליות (14.2%) ושומנים (13.2%). רק תת-קבוצה קטנה של מטבוליטים שייכים לפנילפרופנואידים ופוליקטידים (8.7%) ובנזנואידים (6%). תרכובות חנקן אורגניות, נוקלאוזידים, תרכובות אורגנו-גופרית, אלקלואידים, ליגנאנים ותרכובות קשורות מייצגים בין 2% ל-0.5% מהתרכובות המסווגות (איור 6B). התפלגות המטבוליטים המתוארת כאן תואמת לנתונים שכבר פורסמו באמצעות סוגים אחרים של מערכות איסוף הפרשה שורש24.

איור 1: התקנת צנצנת זכוכית. (A) צנצנת עם חרוזי זכוכית. (B) צנצנת עם חרוזי זכוכית מוכנה לאוטוקלב. (C) שתילים בצנצנות (מבט למעלה). (D) שתילים בצנצנת (מבט מלמעלה) עם סרט מיקרו-נקבוביות בקוטר 1.25 ס"מ. (E) שתילים בצנצנות (מבט מהצד) עם סרט מיקרו-נקבוביות בקוטר 1.25 ס"מ. (F) שתילים בצנצנות (מבט מהצד) עם סרט מיקרו-נקבוביות בקוטר 1.25 ס"מ ומכסה. (ז) מערך שלם של צנצנת עם שתילים בצנצנות (מבט מהצד) עם סרט מיקרו-נקבוביות בקוטר 1.25 ס"מ, מכסה וסרט מיקרו-נקבוביות בקוטר 2.5 ס"מ. (H) הגדרת צנצנת מלאה (מבט למעלה). (I) צמחים בני 21 יום ומוכנים לקטיף (מבט מלמעלה). גודל צנצנת 147 מ"מ גובה x 100 מ"מ קוטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
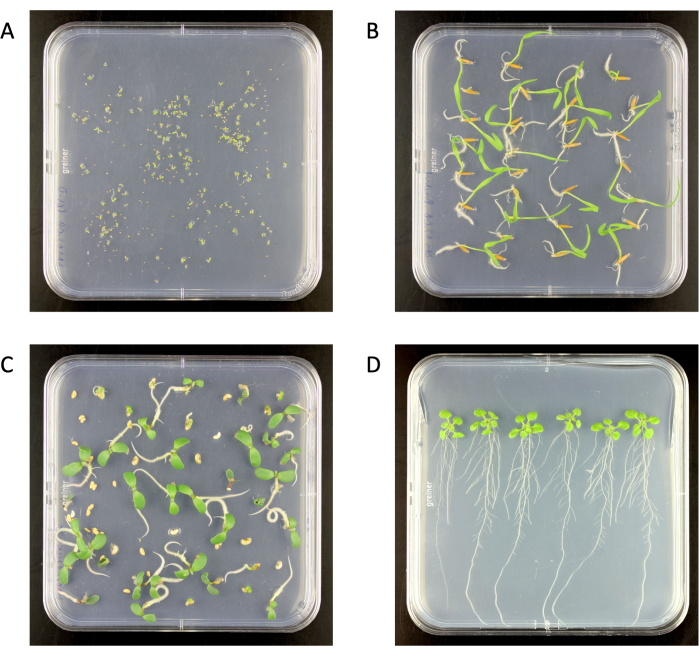
איור 2: שתילים מעוקרים על פני השטח על לוחות אגר בינוניים 0.5x Murashige ו-Skoog בתא גידול. (A) Arabidopsis thaliana (בן 6 ימים), (B) Brachypodium distachyon (בן 6 ימים), (C) Medicago truncatula (בן 6 ימים), (D ) A. thaliana (בן 18 ימים). גודל צלחת אגר 120 מ"מ x 120 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
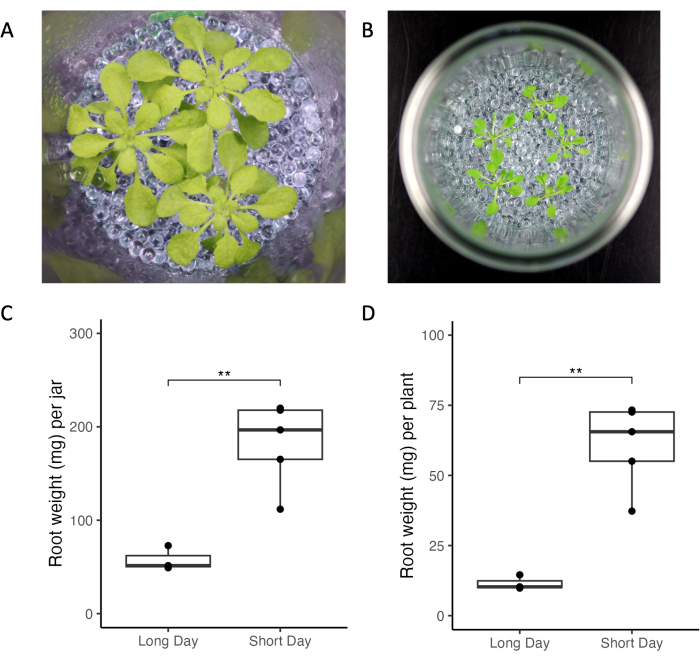
איור 3: צמחי Arabidopsis thaliana Col-0 שגדלים בצנצנות בתנאי אור של יום קצר וארוך. (A) צנצנת עם שלושה צמחים בני 33 יום שגדלו בתנאי יום קצרים (10 שעות אור/14 שעות כהות, 220 μmol m-2 s-1 עוצמת אור, 21 מעלות צלזיוס יום/18 מעלות צלזיוס בלילה) ו-(B) צנצנת עם חמישה צמחים בני 21 יום שגדלו בתנאים של יום ארוך (16 שעות אור / 8 שעות כהות, 150-160 μmol m-2 s-1 עוצמת אור, 22 ° C יום / 18 ° C הלילה). משקל שורש של (C) כל הצמחים של צנצנת אחת ו-(D) של צמחים בודדים. ** מייצגים ערכי מובהקות של מבחן T (P < 0.05). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
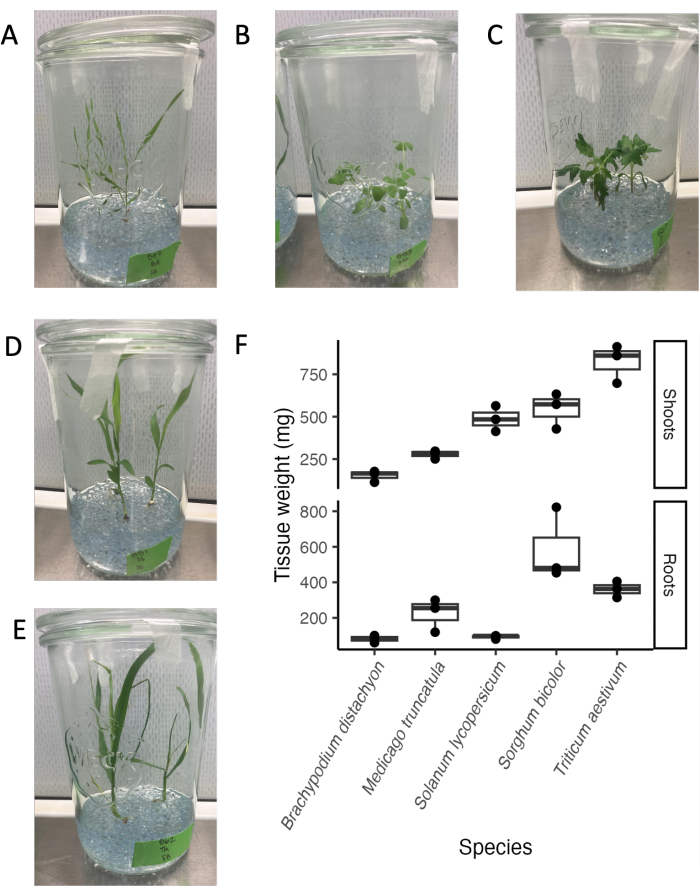
איור 4: חמישה מינים נבדלים פילוגנטית ביום ה-21 במערכת צנצנות הזכוכית הסטרילית. (A) דגם מונוקוט Brachypodium distachyon, (B) דגם קטניות Medicago truncatula, (C) dicot Solanum lycopersicum (עגבניה), (D) dicot Sorghum bicolor, (E) מונוקוט Triticum aestivum (חיטה). (F) משקל טרי של שורשים ונבטים של המינים הגדלים בצנצנות זכוכית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
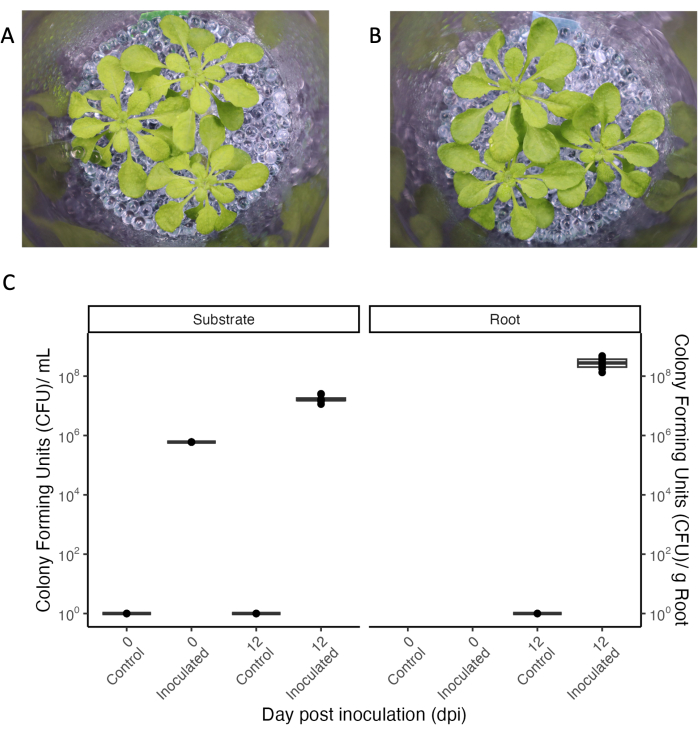
איור 5: Arabidopsis thaliana Col-0 (בן 33 יום) גדל בתנאים קצרים. (א) במערך סטרילי או (ב) מחוסן במשך 12 ימים בקונסורציום של חיידקים קומנסליים. (C) יחידות יוצרות מושבה לצנצנות סטריליות (בקרה) ומחוסנות של מצע הגידול (משמאל) והשורש (מימין). N = 4 צנצנות עבור תנאי הבקרה הסטרילית, ו- n = 8 צנצנות עבור המצב המחוסן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
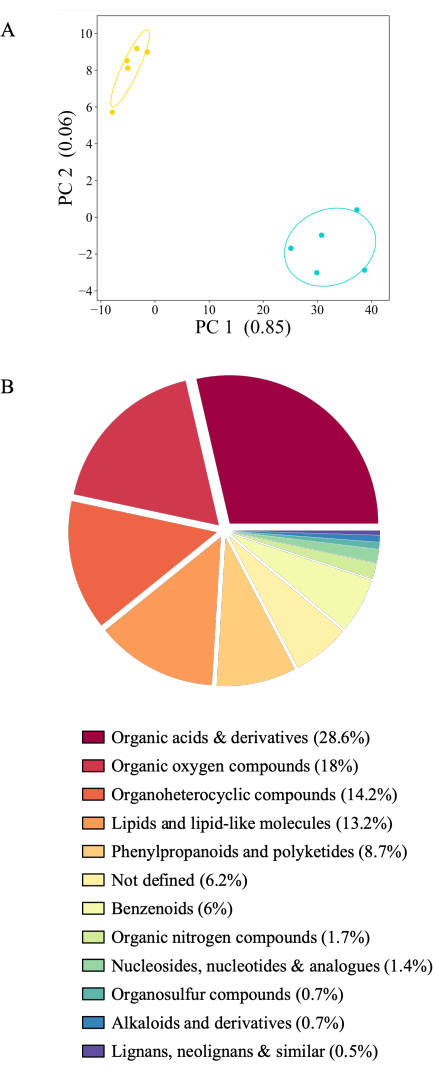
איור 6: פרופילי הפרשה שורשיים מובהקים עבור A. thaliana Col-0 בן 21 יום. הפרשות נאספו במשך שעתיים באמוניום אצטט סטרילי של 20 מ"מ (pH 5.7) ולאחר מכן איסוף של שעתיים במים מסוננים סטריליים שעברו דה-יוניזציה. מטבוליטים זוהו על ידי ספקטרומטריית מסות באמצעות הזרקה ישירה. (A) ניתוח רכיבים עיקריים של 436 מטבוליטים שזוהו מעל רמת הרקע (השוואה של צנצנות עם צמחים לעומת צנצנות ללא צמחים). PC: מרכיב עיקרי עם כמות השונות המוסברת. כחול: הפרשות שנאספו במים, צהוב: אמוניום אצטט - exudates שנאספו. (B) תרשים עוגה של 416 מטבוליטים שונים באופן משמעותי בין תנאי ניסוי (מבחן Tukey) הצבועים לפי מחלקת העל (https://cfb.fiehnlab.ucdavis.edu/). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מינים | הכנת זרעים | זמן ב-70% אתנול (מינ') | ריכוז נתרן היפוכלוריט (NaClO) (v/v % אקונומיקה) | זמן באקונומיקה (דקות) | ||
| Arabidopsis thaliana | 15 | ללא; 100% אתנול | 15 | |||
| Brachypodium distachyon* | דהוסק | 0.5 | 6 | 5 | ||
| Medicago truncatula*a | 30 | 6 | 30 | |||
| סולנום ליקופרסיקום * | 0.5 | 6 | 5 | |||
| Sorghum bicolor* | דהוסק | 0.5 | 6 | 30 | ||
| Triticum aestivum* | דהוסק | 0.5 | 12 | 20 | ||
טבלה 1: שיטות עיקור זרעי שטח עבור מינים מרובים. *שטוף 4-5x עם מים מסוננים deionized בין אתנול אקונומיקה ובסוף; דגירה למשך3-6 שעות לאחר אקונומיקה, החלפה במים מסוננים כל 30 דקות.
| מינים | יום לצנצנות | מספר צמחים |
| Brachypodium distachyon | 4 עד 5 | 3 |
| סורגום דו-צבע | 4 עד 5 | 3 |
| Triticum aestivum | 4 עד 5 | 2 |
| Medicago truncatula | 5 עד 6 | 3 |
| סולנום ליקופרסיקום | 7 עד 8 | 3 |
| Arabidopsis thaliana | 17 | 3 עד 5 |
טבלה 2: גיל השתילים בימים להעברה לצנצנות ומספר הצמחים לצנצנת למיני צמחים שונים.
Discussion
המערכת הניסיונית המוצגת כאן מבוססת על צנצנות זכוכית וחרוזי זכוכית ובכך מספקת מערכת סמי-הידרופונית פשוטה, בעלת תחזוקה נמוכה ורב-תכליתית לחקר הפרשה שורשית בהקשרים שונים. נעשה בו שימוש במחקרים שחקרו את פרופילי ההפרשה של מיני צמחים שונים25, את תגובות ההפרשה לתנאי צמיחה שונים25, כמו גם את השפעת התכונות הפיזיוכימיות של הקרקע על הפרשה22. המערכת מתאימה לכל מיני הצמחים שנבדקו כאן לתקופות גידול ממושכות, החל משבועות ועד חודשים. השמירה על תנאים סטריליים היא פשוטה, כמו גם החיסון עם חיידקים, אשר נמשכים על פני תקופת הצמיחה 2 שבועות מנותח. לפיכך, מערכת הניסוי לא רק מאפשרת איסוף מבוקר של הפרשות שורשים בתנאים סטריליים, אלא היא יכולה לשמש גם לחקר אינטראקציות צמחים-מיקרובים. יתר על כן, ניתן לגוון את מצע הגידול של הצמח כדי לחקור תגובות מטבוליות לרמות שונות של חומרים מזינים, וניתן להתאים את תקופות הצמיחה על ידי התאמת תנאי האור או שימוש בצנצנות בגדלים שונים.
חקר הפרשות שורשים בתנאים הידרופוניים או סמי-הידרופוניים נותר סטנדרטי בתחום בעיקר בגלל הרזולוציה המשופרת של מטבוליטים בריכוז נמוך11. גישות הידרופוניות רבות מסתמכות על צלחות פטרי, צלחות מרובות בארות או מיכלים קטנים אחרים המאפשרים סטריליות ותפוקה גבוהה אך מגבילים את הניסויים לצמחים קטנים או שתילים הגדלים בסביבות לחות גבוהה 17,18,26,27. במערך צנצנות הזכוכית המוצגות, מקום ראש מספיק מסופק על ידי הצנצנות הגדולות יחסית, מה שמאפשר תקופות צמיחה ממושכות. פסי סרט מיקרו-נקבוביות מבטיחים תחלופת אוויר תוך שמירה על סטריליות. לכן, אפילו מונוקוטים גבוהים כמו שעורה ותירס ניתן לגדל במערך צנצנת זכוכית במשך מספר שבועות. צמחים קטנים כגון A. thaliana ותלתן ניתן לחקור במשך 4-5 שבועות לאחר הנביטה, כולל שלבי צומח ורבייה.
תצורות הידרופוניות חלופיות זמינות גם עבור צמחים גדולים יותר, אך אלה דורשים לעתים קרובות קופסאות ופתחים בהתאמה אישית העשויים מרשת, לוחות קצף וסלי גריפה לתמיכה בצמח 15,28,29,30. בנוסף, מכשירים אלה בדרך כלל אינם מוגדרים להיות סטריליים, או שהם דורשים הליכי התקנה ותחזוקה מאתגרים כדי לשמור עליהם נקיים מזיהומים מיקרוביאליים ו / או כימיים. התקנה ותחזוקה של סטריליות במערכת הניסוי המוצגת הם פשוטים. בנוסף, השימוש בזכוכית לצנצנות וחרוזים מפחית את נוכחותם של מזהמים הזולגים מפלסטיק וחוסך משאבים מכיוון שניתן לשטוף אותו בקלות ולעשות בו שימוש חוזר.
חרוזי זכוכית יושמו בעבר כדי לחקות חלקיקי אדמה. הם גורמים להתפתחות שורשים טבעית במכשירי דגימת הפרשה שורשים כגון מלכודות הפרשה31 או מערכות סמי-הידרופוניות אחרות19. מערך צנצנות הזכוכית מנצל את הפיתוח הזה ומציג את החרוזים כמשטח התיישבות לחיידקים. באדמה, המיקרוביום סביב שורשי הצמחים מתפתח בסביבה מוצקה למחצה, עם חלקיקים דחוסים וחללים מלאים באוויר או במים. אף על פי שמערך צנצנת הזכוכית אינו כולל אוורור פעיל של מדיום הגידול שבגללו סביר להניח שהפאזה הנוזלית התחתונה אינה מכילה רמות חמצן אופטימליות, השילוב של נפח חרוז גדול יותר עם נפח בינוני גידול קטן יותר יוצר שלב עליון לח אך מאוורר שבו חיידקים יכולים לגדול בתנאים אוקסיים. אחרים הציעו לנער מיכלי גידול26,28 או להשתמש בצינורות המחוברים למשאבות אוויר19,29 כדי לשמור על אספקת האוויר במערכות גידול הידרופוניות. עם זאת, מערכות אלה בנויות כך שאינן סטריליות, או דורשות חומר מיוחד ומעקב מתמיד כדי לשמור על סטריליות. בנוסף, במקרה של רעידות, יש להקפיד מאוד להימנע משקיעת יורה בתמיסות צמיחה ופגיעה במערכות השורש. עם זאת, אם תרצה, ניתן יהיה להתאים את מערך הניסוי שהוצג עם חומר נוסף לאוורור.
היבט מכריע שיש לקחת בחשבון בכל מחקרי האינטראקציה בין צמחים למיקרואורגניזמים החוקרים מטבוליזם הוא שמיקרובים מפרקים תרכובות שמקורן בצמחים ומייצרים מטבוליטים בעצמם. ללא מערך ניסוי סטרילי מיוחד, לא ניתן להבחין בין מטבוליטים שמקורם בצמחים ובמיקרואורגניטים. כדי לעכב פעילות מיקרוביאלית ולהעשיר תרכובות שמקורן בצמחים, Oburger et al. הציעו לעקר כימית את תמיסת דגימת ההפרשה של השורש כדי לעכב פירוק חיידקים32. ההשפעה של מעכבים כימיים יכולה להיחקר במערכת הניסוי המוצגת, תוך השוואת פרופילי הפרשה של צמחים סטריליים לעומת לא סטריליים שטופלו עם או בלי המעכב.
מגבלה עיקרית של מערך צנצנות הזכוכית המוצגות היא שתנאי הגידול נותרו מלאכותיים מאוד בהשוואה לאדמה. הפרשות מצמחי קרקע נאספות לעתים קרובות ממערכות חלחול13, שבהן נאספים זרימות ממס בבסיס מיכלי צמיחה, או ממערכות היברידיות הידרופוניות בקרקע, שבהן צמחים גדלים תחילה באדמה ולאחר מכן מועברים לתנאים הידרופוניים 16,33. בניגוד להתקנת צנצנת זכוכית, הליכים אלה הם בדרך כלל הרסניים, ואינם מאפשרים אוספים מרובים לאורך זמן בסביבות גידול משתנות. יתר על כן, בעוד שבמערכות חלחול נדגם רקע הקרקע יחד עם ההפרשות, במערכות היברידיות קרקע-הידרופוניות עוקפים את בעיית הרקע המטבולי הגבוה בקרקע עם המעבר לתנאים הידרופוניים לאיסוף אקסדטים. למרות שזמני ההחלמה יושמו כדי להפחית את דליפת המטבוליטים דרך שורשים פצועים11, העברת הצמח מפריעה מאוד והפצעים צפויים להימשך, וחילוף החומרים של הצמח עשוי להשתנות בתגובה להעברה לתנאים הידרופוניים. יתר על כן, במקרים רבים, זעזוע אוסמוטי נגרם על ידי העברת צמחים למים במקום פתרון גידול מתאים16,33. בפרוטוקול המוצג, פתרון הצמיחה מוחלף עם פתרון שווה משקל כדי לשמור על איזון אוסמוטי, עדיין מאפשר ללכוד exudation בתוך חלון זמן קצר ומוגדר. שינוי פתרון הצמיחה הוא פרקטיקה נפוצה במחקרים רבים שפורסמו וניתן להשיג אותו בקלות במערכים הידרופוניים ללא פגיעה בשורש 12,16,26,34. בשל הרבגוניות שלה, המערכת הניסיונית המוצגת יכולה בקלות להיות מותאמת לחקות תנאים טבעיים יותר, למשל, באמצעות תמצית קרקע סטרילית או לא סטרילית כפתרון צמיחה עם או בלי נוכחות של חלקיקי קרקע מוצקים. השינוי ההדרגתי לעבר התנאים הטבעיים מאפשר לחקור את ההשפעה של תכונות הקרקע הפיזיוכימיות השונות והנוכחות המיקרוביאלית על חילוף החומרים והפיזיולוגיה של הצמח. לפני שהקהילה המדעית תבין היטב את ההפרשה בסביבות שונות, רצוי להשתמש במערכות קרקעיות והידרופוניות במקביל, שכן לשני המערכים יתרונות ומגבלות13.
לסיכום, המערך הניסיוני המוצג סמי-הידרופוני, מבוסס זכוכית, בולט בגלל פשטותו בשילוב עם רב-תכליתיות גבוהה של יישומים. הוא מציג דרך נגישה וזולה לאסוף ולחקור הפרשה בתנאים סטריליים, או בשילוב עם מיקרובים ואינטראקציות צמחים-מיקרובים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לפרופ' ד"ר ניקולה זמבוני ולפרופ' ד"ר אווה סאוור מהמכון הטכנולוגי של ציריך, שוויץ, על קביעת פרופילי הפרשה לשורש בהזרקה ישירה, ולפרופ' ד"ר קלאוס שלאפי מאוניברסיטת בזל על חיידק A. thaliana commensal. יתר על כן, אנו מודים לקרן הלאומית השוויצרית למדע (PR00P3_185831 ל- J.S., התומכת ב- S.M., A.S., E.M.S.) ובתוכנית המלגות PSC-Syngenta (שהוענקה לפרופ 'ד"ר קלאוס Schläppi ו- J.S., התומכים ב- C.J.).
Materials
| Name | Company | Catalog Number | Comments |
| Agar powder for bacteriology | VWR | 20767.298 | |
| Aluminum foil | FORA GmbH | ||
| Ammonium acetate | Sigma-Aldrich | 32301-1KG | ACS reagent, Eur >- 98% |
| Autoclave VX-150 | Systec | 1150 | |
| Balance | Sartorius | QUINTIX64-1S | |
| Centrifuge | Hermle Labortechnik GmbH | 305.00 V05 | |
| Cuvettes | Greiner Bio-One | 613101 | |
| Difco LB Broth, Lennox | BD | 240210 | |
| Ethanol | Reuss-Chemie AG | RC-A15-A-005L | |
| Filtered deionized water | Merck Millipore | Milli-Q IQ7000 | |
| Glass beads | Carl Roth | HH56.1 | 5 mm |
| Hydrochloric acid | Merk | 1.00317.1000 | |
| Inoculation loop | Karl Hammacher GmbH | HWO_070-21 | |
| Jars | Weck | 105741 | 850 mL |
| Lyophilizer | Christ | Alpha 2-4 LSCplus | |
| Magnesium chloride hexahydrate | Carl Roth | 2189.1 | |
| Matrix Orbital thermoshaker | IKA | 10006248 | |
| Microcentrifuge tube | Sarstedt AG & Co. KG | 72.695.500 | SafeSeal reaction tube, 2 mL, PP |
| Micropore tape | 3M | 1530-0 | 1.25 cm x 9.1 m |
| Micropore tape | 3M | 1530-1 | 2.5 cm x 9.1 m |
| Murashige & Skoog Medium (MS) | Duchefa Biochemie | M0221.0050 | |
| Growth chamber | Percival | SE41-TLCU4 | 16 hour light/8 dark. 22 °C day/18 night |
| Phyto agar | Duchefa Biochemie | P1003.1000 | |
| Potassium hydroxide | Sigma-Aldrich | 8.14353.0100 | |
| SmartSpec Plus Spectrophotometer | Bio-Rad | 170-2525 | |
| Sodium hypochlorite solution, 12% Cl | Carl Roth | 9062.4 | |
| Square petri dish | Greiner Bio-One | 688102 | 120x120x17 mm, with vents |
| Stericup Quick release | Millipore | S2GPU05RE | 0.22 µm PES, 500 mL |
| Sterile bench | FASTER S.r.l. | FlowFast H 18 |
References
- Sasse, J., Martinoia, E., Northen, T. Feed your friends: do plant exudates shape the root microbiome. Trends in Plant Science. 23 (1), 25-41 (2018).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Lopez, J. L., et al. Growth rate is a dominant factor predicting the rhizosphere effect. The ISME Journal. 17 (9), 1396-1405 (2023).
- Hu, L., et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota. Nature Communications. 9 (1), 2738 (2018).
- Edwards, J., et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences. 112 (8), 911-920 (2015).
- Bulgarelli, D., et al. Structure and function of the bacterial root microbiota in wild and domesticated barley. Cell Host Microbe. 17 (3), 392-403 (2015).
- Li, J., Wang, J., Liu, H., Macdonald, C. A., Singh, B. K. Application of microbial inoculants significantly enhances crop productivity: A meta-analysis of studies from 2010 to 2020. Journal of Sustainable Agriculture and Environment. 1 (3), 216-225 (2022).
- Escudero-Martinez, C., Bulgarelli, D. Engineering the crop microbiota through host genetics. Annual Review of Phytopathology. 61, 257-277 (2023).
- Poppeliers, S. W., Sanchez-Gil, J. J., de Jonge, R. Microbes to support plant health: understanding bioinoculant success in complex conditions. Current Opinion in Microbiology. 73, 102286 (2023).
- O'Callaghan, M., Ballard, R. A., Wright, D. Soil microbial inoculants for sustainable agriculture: Limitations and opportunities. Soil Use and Management. 38 (3), 1340-1369 (2022).
- Oburger, E., Jones, D. L. Sampling root exudates - Mission impossible. Rhizosphere. 6, 116-133 (2018).
- Yuan, J., et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection. Microbiome. 6 (1), 156 (2018).
- Vismans, G., et al. Coumarin biosynthesis genes are required after foliar pathogen infection for the creation of a microbial soil-borne legacy that primes plants for SA-dependent defenses. Scientific Reports. 12 (1), 22473 (2022).
- Strehmel, N., Böttcher, C., Schmidt, S., Scheel, D. Profiling of secondary metabolites in root exudates of Arabidopsis thaliana. Phytochemistry. 108, 35-46 (2014).
- Song, Y., Pieterse, C. M. J., Bakker, P., Berendsen, R. L. Collection of sterile root exudates from foliar pathogen-inoculated plants. Methods in Molecular Biology. 2232, 305-317 (2021).
- Oburger, E., et al. A quick and simple spectrophotometric method to determine total carbon concentrations in root exudate samples of grass species. Plant Soil. 478 (1-2), 273-281 (2022).
- Koprivova, A., et al. Root-specific camalexin biosynthesis controls the plant growth-promoting effects of multiple bacterial strains. Proceedings of the National Academy of Sciences of the United States of America. 116 (31), 15735-15744 (2019).
- Gao, J., et al. Ecosystem fabrication (EcoFAB) protocols for the construction of laboratory ecosystems designed to study plant-microbe interactions. Journal of Visualized Experiments. (134), e57170 (2018).
- Lopez-Guerrero, M. G., et al. A glass bead semi-hydroponic system for intact maize root exudate analysis and phenotyping. Plant Methods. 18 (1), 25 (2022).
- Boeuf-Tremblay, V., Plantureux, S., Guckert, A. Influence of mechanical impedance on root exudation of maize seedlings at two development stages. Plant and Soil. 172, 279-287 (1995).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Influence of plant morphology on root exudation of maize subjected to mechanical impedance in hydroponic conditions. Plant and Soil. 201, 231-239 (1998).
- Sasse, J., et al. Root morphology and exudate availability are shaped by particle size and chemistry in Brachypodium distachyon. Plant Direct. 4 (7), 00207 (2020).
- Katagiri, F., Thilmony, R., He, S. Y. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. 1, 0039 (2002).
- Monchgesang, S., et al. Natural variation of root exudates in Arabidopsis thaliana-linking metabolomic and genomic data. Scientific Reports. 6, 29033 (2016).
- McLaughlin, S., Zhalnina, K., Kosina, S., Northen, T. R., Sasse, J. The core metabolome and root exudation dynamics of three phylogenetically distinct plant species. Nature Communications. 14 (1), 1649 (2023).
- Badri, D. V., Chaparro, J. M., Zhang, R., Shen, Q., Vivanco, J. M. Application of natural blends of phytochemicals derived from the root exudates of Arabidopsis to the soil reveal that phenolic-related compounds predominantly modulate the soil microbiome. Journal of Biological Chemistry. 288 (7), 4502-4512 (2013).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Nathoo, N., Bernards, M. A., MacDonald, J., Yuan, Z. C. A hydroponic co-cultivation system for simultaneous and systematic analysis of plant/microbe molecular interactions and signaling. Journal of Visualized Experiments. (125), e55955 (2017).
- Nguyen, N. T., McInturf, S. A., Mendoza-Cozatl, D. G. Hydroponics: a versatile system to study nutrient allocation and plant responses to nutrient availability and exposure to toxic elements. Journal of Visualized Experiments. (113), e54317 (2016).
- Yi, Y., Li, Z., Kuipers, O. P. Plant-microbe interaction: transcriptional response of Bacillus Mycoides to potato root exudates. Journal of Visualized Experiments. (137), e57606 (2018).
- Phillips, R. P., Erlitz, Y., Bier, R., Bernhardt, E. S. New approach for capturing soluble root exudates in forest soils. Functional Ecology. 22 (6), 990-999 (2008).
- Oburger, E., et al. Root exudation of phytosiderophores from soil-grown wheat. New Phytologist. 203 (4), 1161-1174 (2014).
- Neal, A. L., Ahmad, S., Gordon-Weeks, R., Ton, J. Benzoxazinoids in root exudates of maize attract Pseudomonas putida to the rhizosphere. PLoS One. 7 (4), e35498 (2012).
- Miao, Y., et al. Exogenous salicylic acid alleviates salt stress by improving leaf photosynthesis and root system architecture in cucumber seedlings. Scientia Horticulturae. 272, 109577 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved