Method Article
检测小鼠视网膜血管系统免受糖尿病相关死亡保护的检测方法
摘要
开发了一种保护测定法来监测视网膜血管系统对糖尿病/糖尿病视网膜病变相关损伤(如氧化应激和细胞因子)死亡的恢复能力。
摘要
糖尿病视网膜病变 (DR) 是一种复杂且进行性的眼部疾病,其发病机制有两个不同的阶段。第一阶段涉及失去对糖尿病引起的视网膜损伤的保护,而第二阶段则集中在这种损伤的积累上。传统检测主要侧重于评估毛细血管变性,毛细血管变性表明损伤的严重程度,主要针对 DR 的第二阶段。然而,它们只能间接地提供关于视网膜血管系统的保护机制是否受到损害的见解。为了解决这一局限性,开发了一种新的方法来直接评估视网膜的保护机制 - 特别是它对糖尿病引起的损伤(如氧化应激和细胞因子)的恢复力。这种保护性检测虽然最初是为糖尿病视网膜病变设计的,但在生理和病理环境中都有更广泛的应用潜力。总之,了解糖尿病视网膜病变的发病机制涉及识别保护丧失和损伤积累的双重阶段,这种创新的保护测定法为研究提供了有价值的工具,并可能扩展到其他医疗条件。
引言
糖尿病视网膜病变 (DR) 是糖尿病 (DM) 的微血管并发症之一,也是发达国家工作年龄个体失明的主要原因1。糖尿病视网膜病变的主要危险因素是高血糖的持续时间和程度2,3,4。虽然 DM 会导致视网膜的血管和神经成分功能障碍5,但 DR 的诊断基于视网膜脉管系统的形态特征6。
高血糖诱导的氧化应激是 DR 发病机制的驱动因素之一 7.氧化应激的增加会导致广泛的损伤,从而损害线粒体的功能,从而进一步增加活性氧的水平。这些事件伴随着视网膜血管渗漏、炎性细胞因子水平升高以及视网膜内神经和血管细胞类型的死亡。血管细胞的丧失,以及视网膜广泛毛细血管网络的功能,导致缺氧,这是各种反应的有力刺激5.这些反应包括驱动通透性和血管生成的血管内皮生长因子 (VEGF) 表达增加、DR 晚期、威胁视力的阶段的主要特征 - 糖尿病性黄斑水肿和增殖性糖尿病视网膜病变6。
DR 的某些特征表明,生物体(患者和实验动物)具有抵抗这种适应症的内在能力。患者在发展为危及视力的 DR8、9、10、11、12、13 之前会经历数十年的 DM。虽然 DM 的啮齿动物模型不会发展为 DR14 的高级、威胁视力的阶段,但表现出的初始/轻度 DR 形式仅在 DM15,16 数周或数月后才会出现。此外,在患者和实验动物中,DR 都是进行性的,并且视网膜功能障碍/损伤随着 DM 持续时间的延长而增加。最后,一些糖尿病患者从未发生过 DR。在某些情况下,这是因为这些人经历糖尿病的时间不够长,无法发展 DR。在其他情况下,这是因为它们对 DR 表现出非凡的抵抗力;与 Medalist 研究的参与者一样,他们在 DM17 50 年或更长时间后没有发生 DR。尽管有如此令人信服的支持,支持DR保护的存在及其巨大的转化相关性,但尚未积极研究保护背后的机制。
本文所述的保护测定旨在促进研究为什么 DR 在糖尿病小鼠中从 DM 发作延迟。该测定法应用于 DM 和非 DM 小鼠的关键步骤包括 (1) 对眼睛(离体 或 体内)提供次最大死亡诱导损伤,(2) 分离视网膜脉管系统,(3) 用 TUNEL 和 DAPI 染色脉管系统,(4) 拍摄所得图像并量化 TUNEL/DAPI 双阳性物种的百分比。
研究方案
所有动物研究均已获得伊利诺伊大学芝加哥分校动物护理和机构生物安全办公室的批准。将7周龄的雄性C57 / BL6 / J小鼠饲养在无病原体环境中的群笼中,以12小时光/暗循环,并提供免费食物和水。通过CO2 窒息对小鼠实施安乐死,并立即将眼睛去核并处理18。这些动物是从商业来源获得的(见 材料表)。研究所需的基本工具如 图1所示。
1. 致死侮辱的传递
- 用TBH(ex vivo)进行氧化应激。
- 按照机构批准的方案对小鼠实施安乐死并摘除它们的眼睛18 (图2A)。
- 将眼球直接放入含有DMEM + 1%BSA的24孔板的单个孔中,有或没有5mM叔丁基过氧化氢(TBH)(见 材料表);在37°C孵育1小时。 用DNase(50U / 100μL)处理阳性对照样品10分钟以片段化DNA。
注意:选择TBH(诱导氧化应激的药物)的剂量以在分离的视网膜血管内诱导易于检测的次最大水平的细胞死亡18。 - 将眼睛固定在10%缓冲福尔马林中过夜(至少16小时)。
- 使用细胞因子混合物诱导炎症(体内)。
- 用腹膜内注射100mg / kg氯胺酮和5mg / kg甲苯噻嗪麻醉小鼠。
- 使用定制的 33 G 针头(参见 材料表)将 1 μL/眼的细胞因子混合物注射到玻璃体中;注射部位距离角膜缘2-3毫米(图2B)。
注意:细胞因子混合物含有 1 μg/mL TNF-α、1 μg/mL IL-1β 和 1500 U/μL IFN-γ18 的 1:1:1 比例(参见 材料表)。 - 注射后24小时,对小鼠实施安乐死(遵循机构批准的方案),摘除眼睛并用10%缓冲福尔马林固定过夜。
注意:实验可以在固定后暂停最多 1 周,然后稍后重新开始。
2.视网膜隔离
- 切开眼球。
- 使用直镊子轻轻抓住视神经(图2C)。用另一只手握住微型刀,在角膜缘后方切开2-3毫米的切口。
- 从微型刀切换到微型剪刀,平行于角膜缘进行切割,同时与视神经一起旋转眼球,直到眼球被切成两半。
- 丢弃眼睛的前半部分,包括晶状体(图2C)。
- 切除巩膜。
- 使用直镊子轻轻地将巩膜从视网膜上抬起 1-3 毫米。
- 使用微型剪刀在巩膜部分到视神经的部分进行两个径向切口。避免切割下面的视网膜。
- 用一把弯曲的镊子抓住巩膜皮瓣并将其从视网膜上撕下。RPE 层将随着巩膜脱落。
- 清洗视网膜。
- 使用微型刮刀将分离的视网膜转移到装满双蒸水的 24 孔培养皿内的孔中。
- 在室温下以中中速轻轻摇晃盘子。每 30 分钟至 1 小时换水一次,至少 4-5 次,然后过夜。
3.视网膜脉管系统隔离
- 消化:用 800 μL YL 胰蛋白酶溶液(0.1 M Tris 缓冲液 (pH 7.8) 中的 3% 胰蛋白酶)代替双蒸水。在37°C下孵育,轻轻至无摇晃4小时15分钟19 (图2D)。
注意: 避免快速摇晃,因为这会损坏脉管系统。 - 转移:用YL胰蛋白酶溶液浸入玻璃转移移液管的宽端,将视网膜转移到含有无绒双蒸水的35毫米培养皿中。
- 去除外核层(光感受器)(图2E)。
- 将视网膜半球体朝下翻转。使用直的单毛刷将视网膜轻轻按压到盘子底部。
- 使用环刷轻轻刷掉视网膜的感光器。笔触沿视神经向视网膜外围的方向应用。感光器可以大片分离,因为它们没有通过血管固定在视网膜的其余部分。
- 使用 200 μL 移液器收集并弃去神经组织片。
- 取出玻璃体。
- 翻转视网膜半球体,使其朝上。使用一对弯曲的镊子(A)在解剖显微镜下尽可能多地抓住玻璃体。
注意:玻璃体看起来像附着在视神经或视网膜上的透明组织。 - 使用另一个弯曲的镊子 (B) 抓住玻璃体连接视神经的末端。通过将镊子 A 从镊子 B 上拉开来取出玻璃体。
- 丢弃玻璃体。检查玻璃体的残留物并重复此步骤以去除所有玻璃体,因为残留物会阻碍后续步骤。
- 翻转视网膜半球体,使其朝上。使用一对弯曲的镊子(A)在解剖显微镜下尽可能多地抓住玻璃体。
- 去除剩余的神经和神经胶质组织(图2F)。
- 翻转视网膜半球体,使其再次朝下。再一次,用直刷将视网膜轻轻按压到盘子的底部(不要使用发尖)。
- 使用环刷轻轻刷过从视神经头向外周的脉管系统,以去除剩余的神经组织20。
- 用直刷缓慢旋转视网膜,然后使用环刷去除视网膜血管系统上的所有小块神经组织,直到血管网络得到充分清洁(图2G,H)。
4. 将分离的视网膜脉管系统安装在显微镜载玻片上
- 放置显微镜载玻片。
- 将干净的安装盒(见 材料表)放在解剖显微镜下。用双蒸水填充盒式磁带。
- 在解剖显微镜下使用黑色背景来帮助产生对比度,以查看照明的透明脉管系统。
- 使用镊子将干净的、贴有标签的显微镜载玻片放入安装盒的底部。
- 转移视网膜脉管系统。
- 用YL胰蛋白酶溶液浸入玻璃移液管的宽端。
- 转移清洁的视网膜脉管系统,并轻轻地将脉管系统移入安装盒内和显微镜载玻片上方的双蒸水中。
- 安装视网膜脉管系统。
注意:当脉管系统漂浮在显微镜载玻片上方时,分离的脉管系统将获得其正常的碗状。- 使用环形刷将视网膜半球朝上翻转,轻轻地将脉管系统向下推到载玻片上,然后用头发将打开的脉管系统固定到载玻片的中心。脉管系统在接触载玻片时应粘附在载玻片上。
- 通过将碗状视网膜血管从视神经刷到外周来平安装脉管系统。
- 向各个方向重复刷牙,直到脉管系统完全粘在载玻片上。
- 风干视网膜脉管系统。
- 一旦整个视网膜脉管系统附着在载玻片上,通过轻轻抬起一个边缘或缓慢排出盒一角的水以尽量减少电流,然后将其拉出,将载玻片从水中取出(图2I)。
注意:一旦风干,脉管系统将变得容易可见(图2J)。 - 用记号笔在载玻片背面标记视网膜脉管系统的周长。
- 继续对样品进行染色,不要停顿。
- 一旦整个视网膜脉管系统附着在载玻片上,通过轻轻抬起一个边缘或缓慢排出盒一角的水以尽量减少电流,然后将其拉出,将载玻片从水中取出(图2I)。
5. TUNEL染色死亡检测
注:有关此过程的详细信息,请参阅 Zheng 等人 21。缺血 +/- ox 应激诱导的细胞凋亡小体在孤立的视网膜血管中的代表性图像如 图 3 所示。
- 用PBS对分离的脉管系统进行补水处理。在PBS中冲洗3次,然后用PBS中的1%Triton X-100在冰上孵育2分钟,以透化分离的脉管系统。
- 用 PBS 冲洗载玻片两次以去除残留的 Triton X-100。擦干样品周围的区域。
- 在样品中加入50μL TUNEL反应混合物(参见 材料表)。将载玻片在37°C的加湿气氛中在黑暗中孵育60分钟。
- 用PBS冲洗载玻片3次以除去TUNEL反应混合物。擦干样品周围的区域。
- 加入一滴DAPI封固剂,用DAPI染色细胞核,并用盖玻片封贴样品。在4°C的避光下储存。
注意:在捕获图像之前,该协议最多可以暂停 1 周。 - 用共聚焦荧光显微镜拍摄产生的脉管系统(参见 材料表)。在视神经周围的远周边捕获六到八个随机选择的野(图4)。
注:细胞因子诱导的细胞凋亡小体在分离的视网膜血管中的代表性图像如 图5所示。 - 分析结果。
- 对于经过 TBH 处理的 离体样品,请执行以下步骤。
- 使用图像 J 计算每个字段中凋亡小体(TUNEL/DAPI 双阳性物种)的数量(参见 材料表)。计算单个样品所有场中凋亡小体的平均值。
- 计算随机选择的一对非DM和DM样品之间凋亡小体数量的倍数变化。
- 使用双尾学生 t 检验18 确定是否存在统计学显着差异。
注意:在同一场合对对照样品和实验样品(非DM和DM)进行染色,因为即使以相同的方式进行,TUNEL染色的程度也会有所不同。由于有经验的用户每天最多可以清洁和安装 10 个视网膜,因此在开始此协议之前,计划处理相同数量的对照和实验视网膜。
- 对于 体内细胞因子混合物处理的样品,请执行以下步骤。
- 手动计数整个视网膜脉管系统中的凋亡小体(TUNEL/DAPI 双阳性物种)的数量。
- 计算随机选择的一对非DM和DM样品之间凋亡小体数量的倍数变化。
- 使用双尾学生 t 检验确定是否存在统计学上的显著差异。
- 对于经过 TBH 处理的 离体样品,请执行以下步骤。
结果
视网膜脉管系统的成功分离导致小鼠视网膜脉管系统整个网络的平坦安装,结构完整性完好无损(图2J)。用高碘酸苏木精(PASH)染色后,可以区分两种血管细胞类型:内皮细胞(EC)和周细胞(PC)(图6)。内皮细胞核细长,略有染色,完全位于血管壁内。周细胞核呈圆形,染色致密,从毛细血管壁突出。PASH染色的样本还显示缺乏细胞核的无细胞毛细血管。
诱导死亡的方法遵循以下基本原理。据推测,保护是有限的,即可能会被非常强烈的致死侮辱所淹没。因此,对损伤(缺血/氧化应激和细胞因子18)进行了优化,以便它们会引起易于检测的死亡增加,但低于最大程度(图3 和 图5)。
需要强调的是,TUNEL阳性细胞核的存在取决于用于触发细胞死亡的特定类型的损伤。缺血/氧化应激损伤导致细胞凋亡的电车轨迹模式,如 图 3 所示,而细胞因子损伤导致明显且定义明确的模式,如 图 5 所示。在DR患者22的视网膜血管中可以观察到这两种模式,这表明这两种类型的药物都会诱导人类的细胞死亡。此外,观察到的形态学差异提供了一种评估病理学是由氧化应激还是细胞因子驱动的手段。
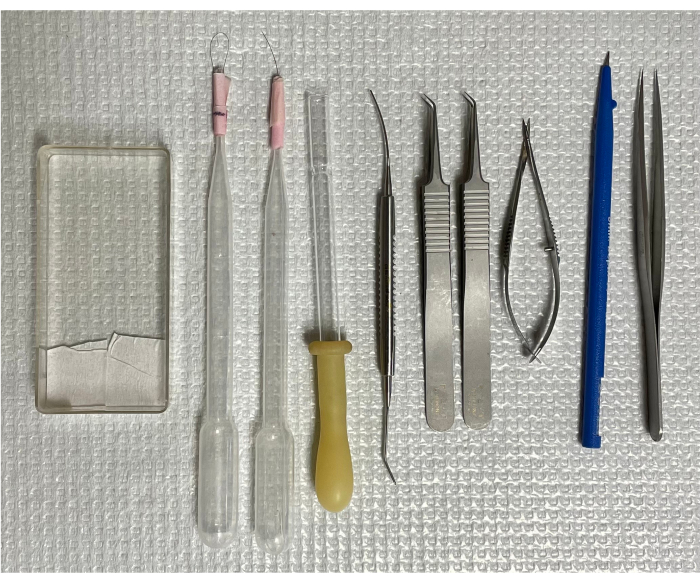
图 1:用于分离小鼠视网膜脉管系统的工具。 从左到右:安装盒、两个单毛刷、一个倒置移液管、微型刮刀、两个弯曲的镊子、弹簧剪刀、微型刀和直头镊子。 请点击这里查看此图的较大版本.

图 2:示意图显示了提供致死损伤然后从小鼠眼睛中分离视网膜脉管系统的关键步骤。 (A) 诱导缺血/氧化损伤, 离体。摘除后,眼球在TBH存在下缺血。(B)细胞因子 的体内 给药(玻璃体内注射)。(C) 将眼球切成两半。(D)视网膜酶消化:去除巩膜,用双蒸水清洗视网膜过夜。在37°C的YL胰蛋白酶溶液中在24孔板的孔中孵育4小时15分钟。(E) 去除感光器。(F) 去除剩余的神经和神经胶质组织。(G) 清洁的碗状血管网络朝上。(H) 解剖显微镜载物台上具有黑色背景的 35 mm 培养皿中的分离血管网络。(I) 载玻片上的平板视网膜脉管系统。(J)载玻片上风干的视网膜脉管系统。该图已修改自Li et al.18。 请点击这里查看此图的较大版本.
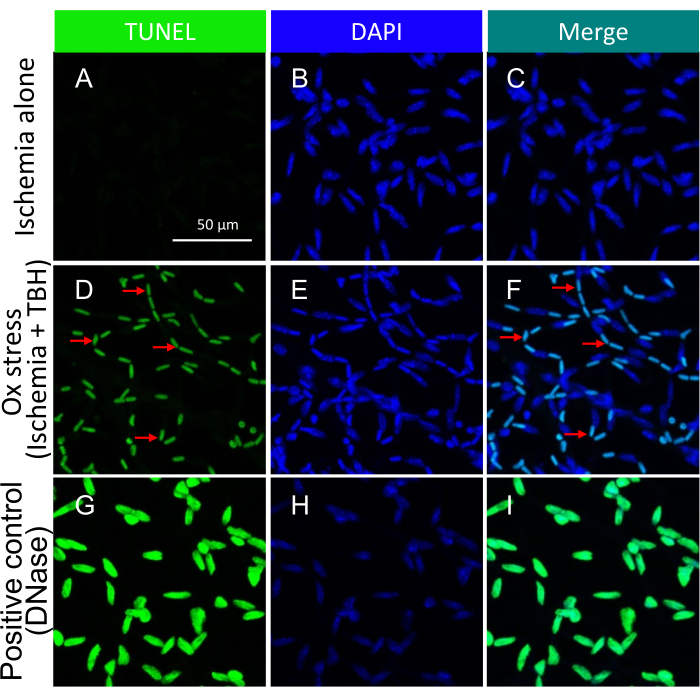
图 3:用缺血 +/- TBH 离体处理的小鼠视网膜血管内凋亡小体的检测。孤立视网膜血管中缺血 +/- ox 应激诱导的凋亡小体的代表性图像。每列的标题表示染色。(A-C)从仅缺血 1 小时的眼球中分离出的视网膜血管。(D-F)与(A-C)相同,除了1小时损伤是缺血和氧化应激(5mM TBH)的组合。红色箭头指向具有代表性的 TUNEL/DAPI 双阳性物种。(G-I)用 DNase 处理的阳性对照。比例尺 = 50 μm。该图已修改自Li et al.18。请点击这里查看此图的较大版本.

图 4:用于结果量化的字段选择图示。 视网膜脉管系统的 5 x 5 平铺扫描,合并 TUNEL 和 DAPI 信号。视神经周围远周的 6 到 8 个视野的选择用红色方块显示。放大倍率,200 倍。比例尺 = 100 μm. 请点击这里查看此图的较大版本.
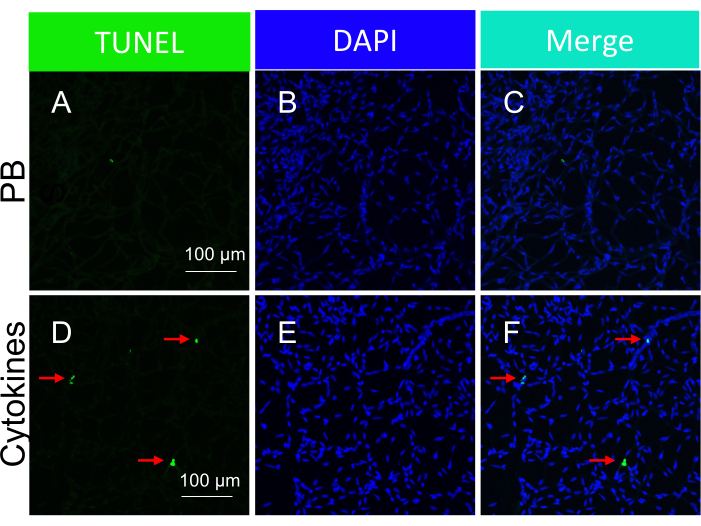
图5:小鼠视网膜血管内细胞因子响应细胞因子注射(体内给药)的凋亡小体的检测。 细胞因子诱导的细胞凋亡体在分离的视网膜血管中的代表性图像。每列的标题表示染色。(A-C)从玻璃体内注射PBS的小鼠中分离出的视网膜血管的图像。(D-F)与(A-C)相同,只是与PBS一起注射了细胞因子混合物。红色箭头指向具有代表性的 TUNEL 阳性物种。比例尺 = 100 μm。该图已修改自Li et al.18。请点击这里查看此图的较大版本.
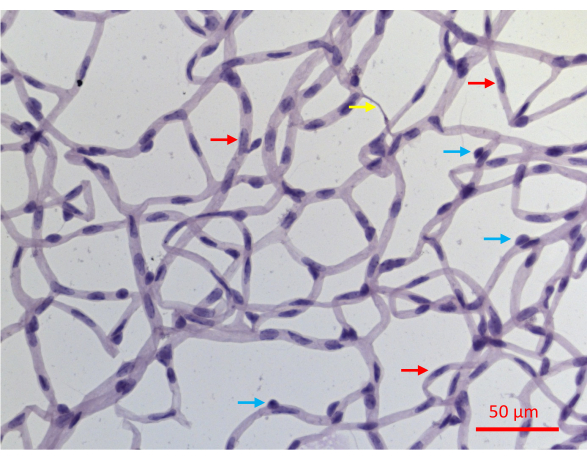
图 6:PASH 染色视网膜血管的代表性图像。 如 图 2 所示,分离经历 20 周 STZ 诱导 DM 的小鼠的视网膜血管,用 PASH 染色,并在可见光照射下成像。毛细血管中的周细胞核往往更圆且染色较密(蓝色箭头),而细长且染色密度较低的细胞核可诊断为内皮细胞(红色箭头)。黄色箭头指向脱细胞毛细血管。比例尺 = 50 μm。 请点击这里查看此图的较大版本.
讨论
在这项研究中,建立了一种测定法来检测由 DM/DR 相关损伤(如缺血/氧化应激和细胞因子)诱导的视网膜血管系统对死亡的抵抗/脆弱性。本手稿提供了该测定的详细描述,该测定是对几种已发表的方案 19,20,21 的修改。
该协议包括几个关键阶段。首先,必须仔细解剖视网膜,确保血管网络的保存并防止大量撕裂。这可以通过在角膜缘后方 2-3 毫米处切开一个切口来实现,因为视网膜紧紧地粘附在锯齿上,并且将其分离具有挑战性。其次,在整个过程中将胰蛋白酶浸入 YL 胰蛋白酶溶液中,将所有与血管接触的器械(例如,单毛刷、转移移液管和镊子)涂上胰蛋白酶。这可以防止脉管系统粘附在本协议中使用的器械上。第三,由于微血管系统在正常光线下几乎看不见,因此在碎片吸入和转移到显微镜载玻片时需要提高警惕,以防止意外丢失。
视网膜各层的适当程度的酶消化至关重要;消化不足会阻止神经元组织与血管网络分离,而过度消化会溶解血管丛。据报道,从 1 小时19 到过夜 23 的各种消化时间。根据观察,与2小时,3小时和4小时的持续时间相比,4小时和15分钟的消化时间产生最有利的结果。将消化时间延长到这一点之后不太可能增强该过程,反而可能会损害脉管系统的完整性。
如果消化的视网膜粘附在单发刷上,请多次将头发浸入 YL 胰蛋白酶溶液中。这样可以减少刷子的粘性区域。如果发刷仍然粘附在血管组织上,则检查其是否有残留的玻璃体碎片,并用镊子将其取出。
完全切除玻璃体的最佳时机是在消除光感受器之后,但在切除剩余的神经和神经胶质组织之前。视网膜保持刚性,直到光感受器被移除。在这个阶段提取玻璃体可能会撕裂视网膜/脉管系统。残留的神经和神经胶质组织的脆弱层在保持血管结构的弯曲形式方面起着关键作用。当玻璃体与视神经分离时,它们可防止视网膜在其中心撕裂。
如果孤立的脉管系统根本没有粘附在显微镜载玻片上,则表明预计会发生粘连的载玻片部分很脏。尝试在载玻片表面移动容器以找到粘性点,切换到不同的载玻片或仔细清洁载玻片并重试。如果容器在展开成碗状之前粘在载玻片上,请从载玻片上提起脉管系统,使其再次自由漂浮在水中。使用反复浸入YL胰蛋白酶溶液中的镊子执行此步骤。
已经报道了几种用于分离脉管系统的替代技术,这些技术不适合本文所述的保护测定。例如,渗透裂解已被用于从未固定的视网膜样本中分离脉管系统,从而促进了组织的生化研究24,25。然而,该过程可能无法保留脉管系统的解剖结构以及本文采用的方法。类似地,虽然分离大段微血管系统的组织打印方法可以分析脉管系统的电渗结构26,但整个血管床通常不会恢复。
开发该测定法是因为现有的毛细血管变性监测方法无法解决保护问题。毛细血管变性发生在长期糖尿病后,提示是否发生了 DR。除了诊断 DR 外,该结果还有助于评估药物/疗法是否能预防 DR。然而,现有的毛细血管变性检测并不能说明该药剂的潜在作用机制。这种药物可以防止驱动DR的病理事件,例如氧化应激或细胞因子增加。或者,该试剂可以通过增强对氧化应激和细胞因子的恢复力和/或促进损伤的修复来加强保护。这种新的保护测定可用于确定给定疗法的有益效果是否涉及加强防止 DM 相关死亡的内源性系统。
这种保护测定的一个缺点是它不能区分视网膜血管内的两种细胞类型:内皮细胞 (EC) 和周细胞 (PC)。虽然它们在PASH染色切片中的细胞核外观是细胞类型特异性的(图6),但并非每个细胞核都显示出诊断特征。大约 30% 的细胞核不能明确定义为 EC 或 PC,至少部分原因是从 PASH 染色样品中获得的二维图像不能完全解析血管丛的三维结构。这一障碍可以通过额外的分析来克服,例如使用细胞类型特异性标记物进行免疫荧光染色。这种区分两种细胞类型的图像可以与TUNEL共同染色,以确定每种血管细胞类型的耐药性/脆弱性。
这种以血管为重点的测定不提供有关神经视网膜的任何信息。可以开发其他检测方法来提供此类信息。例如,可以生成整个视网膜的单个细胞悬浮液,而不是分离视网膜脉管系统,然后分析(通过荧光激活的细胞分选)抵抗力/脆弱性。包括细胞类型特异性标记物(神经和血管)以及细胞死亡指标将提供更完整的视网膜细胞类型,这些细胞类型具有保护免受DM / DR介导的死亡的能力。
总之,本文中描述的保护测定提供了一种强有力的方法来研究导致小鼠 DM 发作和 DR 表现之间延迟的机制。
披露声明
作者没有利益冲突需要报告。
致谢
这项工作得到了伊利诺伊州防盲协会、美国国立卫生研究院(EY031350和EY001792)的资助,以及预防失明研究基金会的无限制资助。
材料
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
参考文献
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。