Method Article
Un test per rilevare la protezione della vascolarizzazione retinica dalla morte correlata al diabete nei topi
In questo articolo
Riepilogo
È stato sviluppato un test di protezione per monitorare la resilienza della vascolarizzazione retinica alla morte per insulti correlati al diabete/retinopatia diabetica come lo stress ossidativo e le citochine.
Abstract
La retinopatia diabetica (DR) è una malattia oculare complessa e progressiva caratterizzata da due fasi distinte nella sua patogenesi. La prima fase comporta la perdita di protezione dal danno alla retina indotto dal diabete, mentre la seconda fase si concentra sull'accumulo di questo danno. I test tradizionali si concentrano principalmente sulla valutazione della degenerazione capillare, che è indicativa della gravità del danno, affrontando essenzialmente la seconda fase della DR. Tuttavia, forniscono solo indirettamente informazioni sul fatto che i meccanismi protettivi della vascolarizzazione retinica siano stati compromessi. Per affrontare questa limitazione, è stato sviluppato un nuovo approccio per valutare direttamente i meccanismi protettivi della retina, in particolare la sua resilienza contro gli insulti indotti dal diabete come lo stress ossidativo e le citochine. Questo test di protezione, sebbene inizialmente progettato per la retinopatia diabetica, ha il potenziale per applicazioni più ampie in contesti sia fisiologici che patologici. In sintesi, la comprensione della patogenesi della retinopatia diabetica implica il riconoscimento delle due fasi di perdita di protezione e accumulo di danni, con questo innovativo test di protezione che offre uno strumento prezioso per la ricerca e potenzialmente si estende ad altre condizioni mediche.
Introduzione
La retinopatia diabetica (DR) è una delle complicanze microvascolari del diabete mellito (DM) e la principale causa di cecità negli individui in età lavorativanei paesi sviluppati. I principali fattori di rischio per la retinopatia diabetica sono la durata e il grado di iperglicemia 2,3,4. Mentre la DM causa disfunzioni sia della componente vascolare che di quella neurale della retina5, la diagnosi di DR si basa sulle caratteristiche morfologiche della vascolarizzazione retinica6.
Lo stress ossidativo indotto dall'iperglicemia è uno dei fattori che determinano la patogenesi della DR7. L'aumento dello stress ossidativo provoca danni diffusi, che compromettono la funzionalità dei mitocondri e quindi aumentano ulteriormente il livello di specie reattive dell'ossigeno. Questi eventi sono accompagnati da perdita di vasi retinici, aumento del livello di citochine infiammatorie e morte di entrambi i tipi di cellule neurali e vascolari all'interno della retina. La perdita di cellule vascolari, e quindi la funzionalità dell'estesa rete capillare della retina, provoca ipossia, un potente stimolo per una varietà di risposte5. Tali risposte includono l'aumento dell'espressione del fattore di crescita dell'endotelio vascolare (VEGF) che guida sia la permeabilità che l'angiogenesi, le caratteristiche cardinali degli stadi avanzati e pericolosi per la vista della DR - edema maculare diabetico e retinopatia diabetica proliferativa6.
Alcune caratteristiche della DR suggeriscono che un organismo (sia i pazienti che gli animali da esperimento) ha una capacità intrinseca di resistere a questa indicazione. I pazienti sperimentano diversi decenni di DM prima di sviluppare DR 8,9,10,11,12,13 che minaccia la vista. Mentre i modelli di DM nei roditori non sviluppano gli stadi avanzati e pericolosi per la vista della DR14, la forma iniziale/lieve di DR che si manifesta lo fa solo dopo un periodo di settimane o mesi di DM15,16. Inoltre, sia nei pazienti che negli animali da esperimento, la DR è progressiva e la disfunzione/danno retinico aumenta con il prolungarsi della durata della DM. Infine, alcuni pazienti con DM non sviluppano mai la DR. In alcuni casi, ciò è dovuto al fatto che tali individui non sperimentano il diabete abbastanza a lungo da sviluppare la DR. In altri casi, è perché mostrano una straordinaria resistenza alla DR; come nel caso dei partecipanti allo studio Medalist, che non sviluppano DR dopo 50 o più anni di DM17. Nonostante questo convincente sostegno all'esistenza della protezione dalla DR e alla sua enorme rilevanza traslazionale, il meccanismo alla base della protezione non è stato indagato in modo aggressivo.
Il test di protezione qui descritto è stato sviluppato per facilitare lo studio del motivo per cui la DR è ritardata dall'insorgenza del DM nei topi diabetici. I passaggi chiave di questo test, applicato a topi DM e non-DM, includono (1) la somministrazione di un insulto sub-massimale che induce la morte all'occhio (ex vivo o in vivo), (2) l'isolamento della vascolarizzazione retinica, (3) la colorazione della vascolarizzazione con TUNEL e DAPI, (4) la fotografia delle immagini risultanti e la quantificazione della percentuale di specie TUNEL/DAPI doppiamente positive.
Protocollo
Tutti gli studi sugli animali sono stati approvati dall'Office of Animal Care and Institutional Biosafety dell'Università dell'Illinois a Chicago. I topi maschi C57/BL6/J di sette settimane sono stati alloggiati in gabbie di gruppo in un ambiente privo di agenti patogeni con un ciclo di 12 ore luce/buio e hanno avuto accesso gratuito a cibo e acqua. I topi sono stati soppressi mediante asfissia da CO2 e gli occhi sono stati enucleati e processati immediatamente18. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali). Gli strumenti essenziali necessari per lo studio sono illustrati nella Figura 1.
1. Consegna dell'insulto mortale
- Eseguire lo stress ossidativo con TBH (ex vivo).
- Sopprimere i topi seguendo protocolli istituzionalmente approvati ed enucleare i loro occhi18 (Figura 2A).
- Inserire i bulbi oculari direttamente nei singoli pozzetti di una piastra a 24 pozzetti contenente DMEM + 1% BSA, con o senza 5 mM di idroperossido di terz-butile (TBH) (vedi tabella dei materiali); incubare per 1 ora a 37 °C. Un campione di controllo positivo viene trattato con DNasi (50 U/100 μL) per 10 minuti per frammentare il DNA.
NOTA: La dose di TBH (l'agente che induce lo stress ossidativo) è stata scelta per indurre un livello di morte cellulare prontamente rilevabile e sub-massimale all'interno dei vasi retinici isolati18. - Fissare gli occhi in formalina tamponata al 10% per una notte (minimo 16 ore).
- Utilizzare il cocktail di citochine per indurre l'infiammazione (in vivo).
- Anestetizzare i topi con un'iniezione intraperitoneale di 100 mg/kg di ketamina e 5 mg/kg di xilazina.
- Utilizzare un ago personalizzato da 33 G (vedere Tabella dei materiali) per iniettare 1 μL/occhio del cocktail di citochine nel vitreo; il sito di iniezione si trova a 2-3 mm dal limbus (Figura 2B).
NOTA: Il cocktail di citochine contiene un rapporto 1:1:1 di 1 μg/mL di TNF-α, 1 μg/mL di IL-1β e 1500 U/μL di IFN-γ18 (vedere la tabella dei materiali). - 24 ore dopo l'iniezione, sopprimere i topi (seguendo i protocolli istituzionalmente approvati), enucleare i loro occhi e fissarli con formalina tamponata al 10% durante la notte.
NOTA: L'esperimento può essere messo in pausa dopo la fissazione per un massimo di 1 settimana e poi ripreso in un secondo momento.
2. Isolamento della retina
- Taglia il bulbo oculare.
- Utilizzare una pinza diritta per afferrare delicatamente il nervo ottico (Figura 2C). Tenere un micro-coltello con l'altra mano per praticare un'incisione di 2-3 mm posteriormente al limbus.
- Passare dal micro-coltello alla micro-forbice per tagliare parallelamente al limbus ruotando il bulbo oculare insieme al nervo ottico fino a quando il bulbo oculare non è stato tagliato in due metà.
- Scartare la metà anteriore dell'occhio, compreso il cristallino (Figura 2C).
- Rimuovere la sclera.
- Utilizzare una pinza diritta per sollevare delicatamente la sclera di 1-3 mm dalla retina.
- Usa le microforbici per fare due tagli radiali nella sclera che parte del percorso verso il nervo ottico. Evitare di tagliare la retina sottostante.
- Usa un paio di pinze curve per afferrare il lembo sclerale e strapparlo dalla retina. Lo strato RPE si staccherà con la sclera.
- Lavare la retina.
- Utilizzare una microspatola per trasferire la retina isolata in un pozzetto all'interno di un piatto da 24 pozzetti che è stato riempito con acqua bidistillata.
- Agitare delicatamente il piatto a velocità medio-moderata a temperatura ambiente. Cambiare l'acqua ogni 30 minuti a 1 ora, almeno 4-5 volte, quindi lasciare per tutta la notte.
3. Isolamento della vascolarizzazione retinica
- Digestione: Sostituire l'acqua bidistillata con 800 μL di soluzione di tripsina YL (tripsina al 3% in tampone Tris 0,1 M (pH 7,8)). Incubare a 37 °C agitando delicatamente o senza agitare per 4 h 15 min19 (Figura 2D).
NOTA: Evitare agitazioni rapide in quanto ciò può danneggiare la vascolarizzazione. - Trasferimento: immergere l'estremità larga di una pipetta di trasferimento in vetro con una soluzione di tripsina YL per trasferire la retina in una capsula di Petri da 35 mm contenente acqua bidistillata priva di lanugine.
- Rimuovere lo strato nucleare esterno (fotorecettori) (Figura 2E).
- Capovolgi la semisfera della retina rivolta verso il basso. Usa la spazzola liscia a pelo singolo per premere delicatamente la retina sul fondo del piatto.
- Usa lo spazzolino ad anello per spazzolare via delicatamente i fotorecettori della retina. Le pennellate vengono applicate in una direzione dal nervo ottico verso la periferia della retina. I fotorecettori possono staccarsi in fogli di grandi dimensioni perché non sono ancorati al resto della retina dai vasi sanguigni.
- Utilizzo di una pipetta da 200 μL per raccogliere ed eliminare i fogli di tessuto neurale.
- Rimuovere il vitreo.
- Capovolgi la semisfera della retina in modo che sia rivolta verso l'alto. Utilizzare un paio di pinze curve (A) per afferrare il vitreo il più possibile al microscopio da dissezione.
NOTA: Il vitreo ha l'aspetto di un foglio di tessuto trasparente attaccato al nervo ottico o alla retina. - Utilizzare un'altra pinza curva (B) per afferrare l'estremità del vitreo nel punto in cui collega il nervo ottico. Rimuovere il vitreo tirando la pinza A dalla pinza B.
- Scartare il vitreo. Esamina il residuo del vitreo e ripeti questo passaggio per rimuovere tutto il vitreo poiché il residuo ostacolerà i passaggi successivi.
- Capovolgi la semisfera della retina in modo che sia rivolta verso l'alto. Utilizzare un paio di pinze curve (A) per afferrare il vitreo il più possibile al microscopio da dissezione.
- Rimuovere il tessuto neurale e gliale rimanente (Figura 2F).
- Capovolgi la semisfera della retina in modo che sia di nuovo rivolta verso il basso. Ancora una volta, usa la spazzola dritta per premere delicatamente la retina sul fondo del piatto (non usare la punta dei capelli).
- Utilizzare lo spazzolino ad anello per spazzolare delicatamente la vascolarizzazione dalla testa del nervo ottico verso la periferia per rimuovere il tessuto neurale rimanente20.
- Ruotare lentamente la retina con lo spazzolino dritto e utilizzare lo spazzolino ad anello per rimuovere tutti i piccoli pezzi di tessuto neurale sulla vascolarizzazione retinica, fino a quando la rete vascolare non è ben pulita (Figura 2G,H).
4. Montaggio della vascolarizzazione retinica isolata su un vetrino da microscopio
- Posizionare un vetrino da microscopio.
- Posizionare una cassetta di montaggio pulita (vedere la tabella dei materiali) sotto un microscopio da dissezione. Riempire la cassetta con acqua bidistillata.
- Usa uno sfondo nero sotto il microscopio da dissezione per aiutare a generare contrasto per vedere la vascolarizzazione trasparente illuminata.
- Utilizzare una pinza per posizionare un vetrino da microscopio pulito ed etichettato nella parte inferiore della cassetta di montaggio.
- Trasferire la vascolarizzazione retinica.
- Immergere l'estremità larga di una pipetta di trasferimento in vetro con una soluzione di tripsina YL.
- Trasferire la vascolarizzazione retinica pulita e rimuovere delicatamente la vascolarizzazione nell'acqua bidistillata all'interno della cassetta di montaggio e sopra il vetrino del microscopio.
- Montare la vascolarizzazione retinica.
NOTA: Mentre la vascolarizzazione fluttua sopra il vetrino del microscopio, la vascolarizzazione isolata acquisirà la sua normale forma a ciotola.- Usa il pennello ad anello per capovolgere la semisfera della retina rivolta verso l'alto e spingi delicatamente la vascolarizzazione verso il basso sul vetrino, quindi usa i capelli per fissare la vascolarizzazione aperta al centro del vetrino. La vascolarizzazione dovrebbe aderire al vetrino mentre tocca.
- Montare in piano la vascolarizzazione spazzolando il vaso retinico a forma di ciotola dal nervo ottico alla periferia.
- Ripetere la spazzolatura in tutte le direzioni fino a quando la vascolarizzazione non si attacca completamente al vetrino.
- Asciugare all'aria la vascolarizzazione retinica.
- Una volta che l'intera vascolarizzazione retinica si è attaccata al vetrino, estrarre il vetrino dall'acqua sollevando delicatamente un bordo o scaricando lentamente l'acqua nell'angolo della cassetta per ridurre al minimo le correnti, quindi estraendolo (Figura 2I).
NOTA: La vascolarizzazione diventerà prontamente visibile una volta asciugata all'aria (Figura 2J). - Segna la circonferenza della vascolarizzazione retinica sul retro del vetrino con un pennarello.
- Procedere alla colorazione del campione senza pause.
- Una volta che l'intera vascolarizzazione retinica si è attaccata al vetrino, estrarre il vetrino dall'acqua sollevando delicatamente un bordo o scaricando lentamente l'acqua nell'angolo della cassetta per ridurre al minimo le correnti, quindi estraendolo (Figura 2I).
5. Rilevamento dei decessi con la colorazione TUNEL
NOTA: Per i dettagli su questa procedura, fare riferimento a Zheng et al.21. Nella Figura 3 sono rappresentate immagini rappresentative di corpi apoptotici indotti da stress ox +/- in vasi retinici isolati.
- Reidratare la vascolarizzazione isolata con PBS. Sciacquare 3 volte in PBS e poi incubare con Triton X-100 all'1% in PBS per 2 minuti su ghiaccio per permeabilizzare la vascolarizzazione isolata.
- Sciacquare i vetrini due volte con PBS per rimuovere i residui di Triton X-100. Asciugare l'area intorno al campione.
- Aggiungere 50 μL di miscela di reazione TUNEL (vedere la tabella dei materiali) sul campione. Incubare il vetrino in atmosfera umidificata per 60 minuti a 37 °C al buio.
- Sciacquare il vetrino 3 volte con PBS per rimuovere la miscela di reazione TUNEL. Asciugare l'area intorno al campione.
- Aggiungere una goccia di terreno di montaggio DAPI per colorare i nuclei con DAPI e montare il campione con un vetro di copertura. Conservare a 4 °C al buio.
NOTA: Il protocollo potrebbe essere messo in pausa per un massimo di 1 settimana prima di acquisire le immagini. - Fotografare la vascolarizzazione risultante con un microscopio a fluorescenza confocale (vedi Tabella dei materiali). Cattura da sei a otto campi selezionati in modo casuale nell'estrema periferia che circonda il nervo ottico (Figura 4).
NOTA: Nella Figura 5 sono illustrate immagini rappresentative di corpi apoptotici indotti da citochine in vasi retinici isolati. - Analizza i risultati.
- Per i campioni ex vivo trattati con TBH, eseguire i seguenti passaggi.
- Contare il numero di corpi apoptotici (specie TUNEL/DAPI a doppio positivo) in ciascun campo utilizzando l'immagine J (vedi Tabella dei materiali). Calcola la media dei corpi apoptotici in tutti i campi di un singolo campione.
- Calcolare la variazione di piega nel numero di corpi apoptotici tra una coppia selezionata casualmente di campioni non-DM e DM.
- Determinare se c'è una differenza statisticamente significativa utilizzando il test t di studente a due code18.
NOTA: Colorare i campioni di controllo e sperimentali (non-DM e DM) nella stessa occasione perché l'entità della colorazione TUNEL può variare, anche se eseguita allo stesso modo. Poiché fino a 10 retine possono essere pulite e montate al giorno da un utente esperto, pianifica di elaborare un numero uguale di retine di controllo e sperimentali prima di iniziare questo protocollo.
- Per i campioni trattati con cocktail di citochine in vivo, eseguire i seguenti passaggi.
- Contare manualmente il numero di corpi apoptotici (specie TUNEL/DAPI doppiamente positive) nell'intera vascolarizzazione retinica.
- Calcolare la variazione di piega nel numero di corpi apoptotici tra una coppia selezionata casualmente di campioni non-DM e DM.
- Determinare se c'è una differenza statisticamente significativa utilizzando il test t di Student a due code.
- Per i campioni ex vivo trattati con TBH, eseguire i seguenti passaggi.
Risultati
Il successo dell'isolamento della vascolarizzazione retinica si traduce in un montaggio piatto dell'intera rete della vascolarizzazione retinica del topo, con l'integrità architettonica intatta (Figura 2J). Dopo la colorazione con ematossilina acido-schiff periodica (PASH), è possibile distinguere i due tipi di cellule vascolari: cellule endoteliali (EC) e periciti (PC) (Figura 6). I nuclei delle cellule endoteliali sono allungati, leggermente colorati e risiedono interamente all'interno delle pareti dei vasi. I nuclei dei periciti sono circolari, densamente colorati e sporgono dalle pareti dei capillari. I campioni colorati con PASH rivelano anche capillari acellulari, che mancano di nuclei.
L'approccio per indurre la morte è stato guidato dalla seguente logica. Si ipotizzava che la protezione fosse limitata, cioè che potesse essere sopraffatta da un insulto molto forte che induceva alla morte. Di conseguenza, gli insulti (sia ischemia/stress ossidativo che citochine18) sono stati ottimizzati in modo da indurre un aumento prontamente rilevabile ma ancora un'estensione submassimale della morte (Figura 3 e Figura 5).
È importante sottolineare che la presenza di nuclei TUNEL-positivi era contingente al tipo specifico di insulto impiegato per innescare la morte cellulare. L'insulto ischemia/stress ossidativo ha portato a un modello di apoptosi cellulare, come illustrato nella Figura 3, mentre l'insulto alle citochine ha portato a un modello distinto e ben definito, come illustrato nella Figura 5. Entrambi i modelli possono essere osservati nei vasi retinici dei pazienti con DR22, suggerendo che entrambi i tipi di agenti inducono la morte cellulare negli esseri umani. Inoltre, le distinzioni morfologiche osservate offrono un mezzo per valutare se la patologia è stata guidata dallo stress ossidativo o dalle citochine.
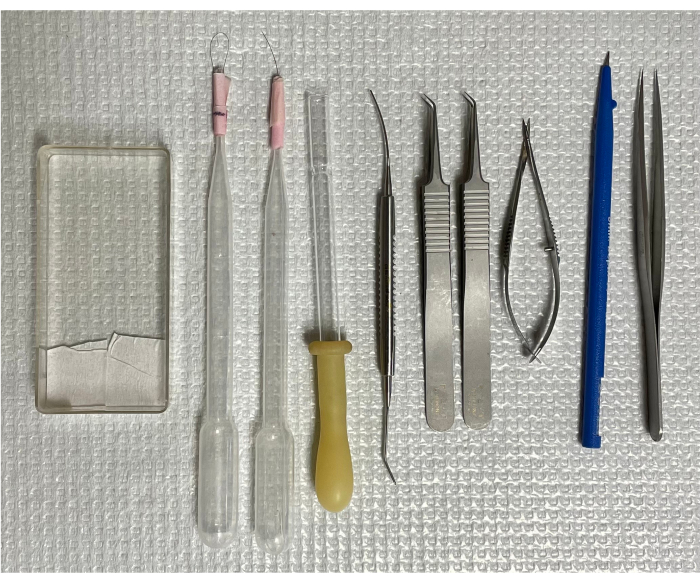
Figura 1: Strumenti per isolare la vascolarizzazione retinica del topo. Da sinistra a destra: la cassetta di montaggio, due spazzole a pelo singolo, una pipetta di trasferimento rovesciata, una microspatola, due pinze curve, forbici a molla, microcoltello e pinze con punte dritte. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Schema che mostra i passaggi chiave per l'invio di un insulto mortale e quindi l'isolamento della vascolarizzazione retinica dall'occhio di un topo. (A) Induzione di ischemia/danno ossidativo, ex vivo. Dopo l'enucleazione, il bulbo oculare è soggetto a ischemia in presenza di TBH. (B) Somministrazione in vivo (iniezione intravitreale) di citochine. (C) Tagliare il bulbo oculare in due metà. (D) Digestione enzimatica retinica: rimozione della sclera e lavaggio della retina in acqua bidistillata per una notte. Incubazione in soluzione di tripsina YL a 37 °C per 4 ore e 15 minuti in un pozzetto di una piastra a 24 pozzetti. (E) Rimozione dei fotorecettori. (F) Rimozione del tessuto neurale e gliale rimanente. (G) Rete vascolare pulita a forma di ciotola rivolta verso l'alto. (H) Rete vascolare isolata in una capsula di 35 mm con sfondo nero sul tavolino di un microscopio da dissezione. (I) Vascolarizzazione retinica piatta su vetrino. (J) Vascolarizzazione retinica essiccata all'aria su un vetrino. Questa cifra è stata modificata da Li et al.18. Fare clic qui per visualizzare una versione più grande di questa figura.
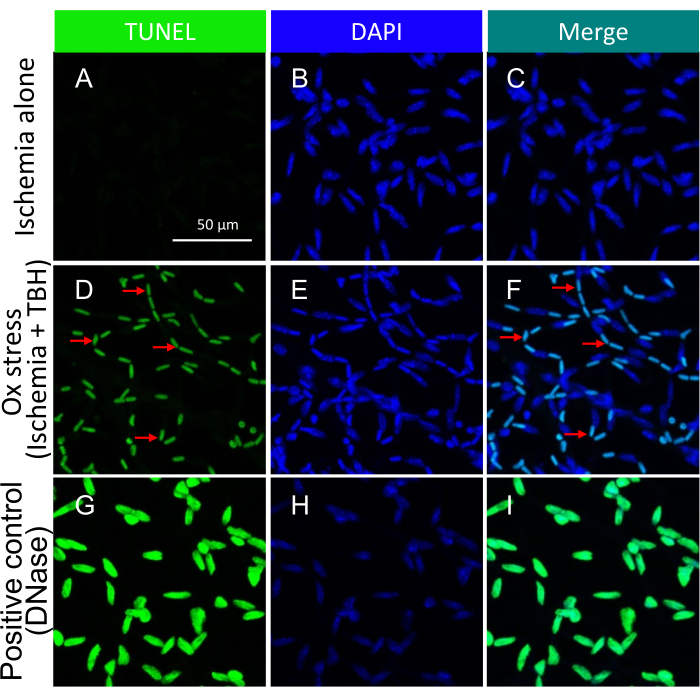
Figura 3: Rilevamento di corpi apoptotici all'interno di vasi retinici di topo trattati ex vivo con ischemia +/- TBH. Immagini rappresentative di corpi apoptotici indotti da stress ox +/- ischemia in vasi retinici isolati. L'intestazione di ogni colonna indica la colorazione. (A-C) Vasi retinici isolati da bulbi oculari che hanno subito 1 ora di sola ischemia. (D-F) Come (A-C), tranne per il fatto che l'insulto di 1 ora era una combinazione di ischemia e stress ossidativo (5 mM TBH). Le frecce rosse indicano le specie rappresentative TUNEL/DAPI a doppio positivo. (G-I) Controllo positivo trattato con DNasi. Barra graduata = 50 μm. Questa cifra è stata modificata da Li et al.18. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Illustrazione della selezione del campo per la quantificazione dei risultati. Una scansione a piastrelle 5 x 5 della vascolarizzazione retinica con la fusione del segnale TUNEL e DAPI. La selezione di sei-otto campi nell'estrema periferia che circonda il nervo ottico è mostrata con quadrati rossi. Ingrandimento, 200x. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
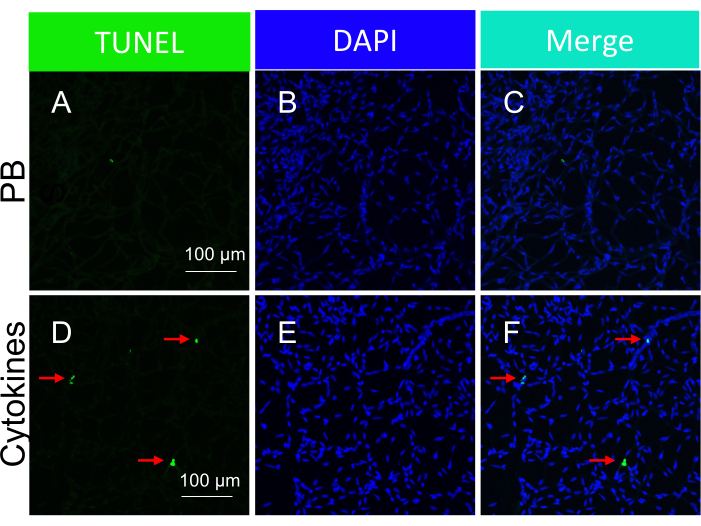
Figura 5: Rilevamento dei corpi apoptotici all'interno dei vasi retinici di topo in risposta all'iniezione intravitreale di citochine (somministrazione in vivo). Immagini rappresentative di corpi apoptotici indotti da citochine in vasi retinici isolati. L'intestazione di ogni colonna indica la colorazione. (A-C) Immagini dei vasi retinici isolati da topi iniettati per via intravitrea con PBS. (D-F) Come (A-C), tranne per il fatto che un cocktail di citochine è stato iniettato insieme al PBS. Le frecce rosse indicano le specie rappresentative positive a TUNEL. Barre di scala = 100 μm. Questa cifra è stata modificata da Li et al.18. Fare clic qui per visualizzare una versione più grande di questa figura.
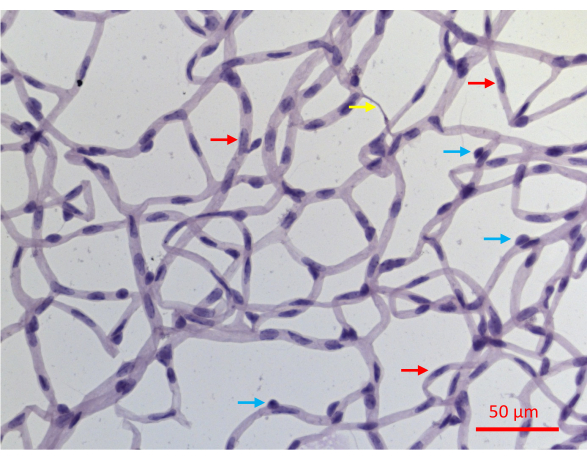
Figura 6: Un'immagine rappresentativa di un vaso retinico colorato con PASH. I vasi retinici di un topo che ha sperimentato 20 settimane di DM indotto da STZ sono stati isolati come descritto nella Figura 2, colorati con PASH e sottoposti a imaging mentre erano illuminati con luce visibile. I nuclei dei periciti nei capillari tendono ad essere più circolari e densamente colorati (frecce blu), mentre i nuclei allungati e meno densamente colorati sono diagnostici delle cellule endoteliali (frecce rosse). La freccia gialla indica un capillare acellulare. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, è stato stabilito un test per rilevare la resistenza/vulnerabilità della vascolarizzazione retinica alla morte indotta da insulti correlati a DM/DR come ischemia/stress ossidativo e citochine. Questo manoscritto fornisce una descrizione dettagliata di questo saggio, che è una modifica di diversi protocolli pubblicati 19,20,21.
Il protocollo comprende diverse fasi cruciali. Innanzitutto, è imperativo sezionare meticolosamente la retina, garantendo la conservazione della rete vascolare e prevenendo lacerazioni sostanziali. Ciò può essere ottenuto praticando un'incisione di 2-3 mm posteriori al limbus poiché la retina aderisce strettamente all'ora serrata e separarla è difficile. In secondo luogo, rivestire tutti gli strumenti che entrano in contatto con i vasi (ad es. spazzole a pelo singolo, pipetta di trasferimento e pinze) con tripsina immergendo questi strumenti nella soluzione di tripsina YL durante la procedura. Ciò impedisce alla vascolarizzazione di aderire agli strumenti utilizzati in questo protocollo. In terzo luogo, poiché la microvascolarizzazione è quasi invisibile in condizioni di luce normale, è necessaria una maggiore vigilanza durante l'aspirazione dei detriti e il trasferimento al vetrino del microscopio per evitare perdite accidentali.
Un adeguato grado di digestione enzimatica dei vari strati della retina è fondamentale; Una digestione insufficiente impedisce la separazione del tessuto neuronale dalla rete vascolare, mentre un'eccessiva digestione dissolve il plesso vascolare. Sono stati riportati vari tempi di digestione che vanno da 1 ora e19 a 23 ore notturne. Sulla base delle osservazioni, un tempo di digestione di 4 ore e 15 minuti produce i risultati più favorevoli rispetto alle durate di 2 ore, 3 ore e 4 ore. È improbabile che prolungare la digestione oltre questo punto migliori il processo e potrebbe invece compromettere l'integrità della vascolarizzazione.
Nei casi in cui la retina digerita aderisce alla spazzola a pelo singolo, immergere i capelli in una soluzione di tripsina YL più volte. In questo modo si riducono le aree appiccicose del pennello. Se la spazzola per capelli aderisce ancora al tessuto vascolare, ispezionarla per verificare la presenza di frammenti residui di vitreo e rimuoverli con una pinza.
Il momento ottimale per la rimozione completa del vitreo è dopo l'eliminazione dei fotorecettori, ma prima della rimozione del tessuto neurale e gliale rimanente. La retina mantiene la rigidità fino a quando i fotorecettori non vengono rimossi. L'estrazione del vitreo in questa fase potrebbe potenzialmente lacerare la retina/vascolarizzazione. I delicati strati di tessuto neurale e gliale residuo svolgono un ruolo fondamentale nel preservare la forma curva della struttura vascolare. Impediscono alla retina di lacerarsi al centro quando il vitreo si stacca dal nervo ottico.
Se la vascolarizzazione isolata non aderisce affatto al vetrino del microscopio, indica che la sezione del vetrino in cui si prevede che si verifichi l'adesione è sporca. Prova a spostare i vasi sulla superficie del vetrino per individuare un punto appiccicoso, passando a un altro vetrino o pulendo meticolosamente il vetrino e riprovando. Se i vasi si attaccano allo scivolo prima che si aprano nella loro forma a ciotola, sollevare la vascolarizzazione dal vetrino per consentirgli di galleggiare liberamente nell'acqua ancora una volta. Eseguire questo passaggio con le pinze che sono state ripetutamente immerse nella soluzione di tripsina YL.
Sono state descritte diverse tecniche alternative per isolare la vascolarizzazione, che non sarebbero adatte per il saggio di protezione qui descritto. Ad esempio, la lisi osmotica è stata impiegata per isolare la vascolarizzazione da campioni di retina non fissati, facilitando le indagini biochimiche del tessuto24,25. Tuttavia, questa procedura potrebbe non preservare l'anatomia della vascolarizzazione e l'approccio utilizzato in questo articolo. Allo stesso modo, mentre il metodo di stampa tissutale per isolare ampi segmenti di microvascolarizzazione consente l'analisi dell'architettura elettrotonica della vascolarizzazione26, l'intero letto vascolare in genere non viene recuperato.
Questo test è stato sviluppato perché gli approcci esistenti per monitorare la degenerazione capillare non affrontano il problema della protezione. La degenerazione capillare, che si verifica dopo un DM prolungato, indica se la DR si è sviluppata. Oltre a diagnosticare la DR, questo risultato è utile per valutare se un agente/terapia previene la DR. Tuttavia, i test di degenerazione capillare esistenti non parlano del meccanismo d'azione sottostante dell'agente. Tale agente può prevenire gli eventi patologici che guidano la DR, come l'aumento dello stress ossidativo o delle citochine. In alternativa, l'agente può rafforzare la protezione migliorando la resilienza allo stress ossidativo e alle citochine e/o promuovere la riparazione del danno. Questo nuovo test di protezione può essere utilizzato per determinare se l'effetto benefico di una determinata terapia comporta l'applicazione del sistema endogeno che protegge dalla morte correlata al DM.
Uno svantaggio di questo test di protezione è che non distingue i due tipi di cellule all'interno dei vasi retinici: cellule endoteliali (EC) e periciti (PC). Mentre l'aspetto dei loro nuclei nelle sezioni colorate con PASH è specifico per il tipo di cellula (Figura 6), non tutti i nuclei mostrano caratteristiche diagnostiche. Circa il 30% dei nuclei non può essere definito in modo univoco come EC o PC, almeno in parte, perché le immagini bidimensionali ottenute da campioni colorati con PASH risolvono in modo incompleto la struttura tridimensionale del plesso vascolare. Questo ostacolo potrebbe essere superato da ulteriori analisi come la colorazione immunofluorescente con marcatori specifici per tipo di cellula. Tali immagini, che distinguono i due tipi di cellule, potrebbero essere co-colorate con TUNEL per determinare la resistenza/vulnerabilità di ciascuno dei tipi di cellule vascolari.
Questo test focalizzato vascolare non fornisce alcuna informazione sulla retina neurale. Potrebbero essere sviluppati ulteriori saggi per fornire tali informazioni. Ad esempio, invece di isolare la vascolarizzazione retinica, una sospensione cellulare singola dell'intera retina potrebbe essere generata e quindi analizzata (mediante selezione cellulare attivata da fluorescenza) per resistenza/vulnerabilità. L'inclusione di marcatori specifici del tipo di cellula (sia neurali che vascolari) insieme agli indicatori di morte cellulare fornirebbe un quadro più completo dei tipi di cellule retiniche che hanno la capacità di proteggere dalla morte mediata da DM/DR.
In conclusione, il saggio di protezione qui descritto fornisce un potente approccio per studiare il meccanismo responsabile del ritardo tra l'insorgenza della DM e la manifestazione della DR nei topi.
Divulgazioni
Gli autori non hanno conflitti di interesse da segnalare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della Illinois Society to Prevent Blindness, National Institute of Health (EY031350 and EY001792) e da una sovvenzione illimitata della Research to Prevent Blindness Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
Riferimenti
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon