Method Article
マウスの糖尿病関連死からの網膜血管系の保護を検出するためのアッセイ
要約
酸化ストレスやサイトカインなどの糖尿病/糖尿病性網膜症関連の侮辱による死に対する網膜血管系の回復力を監視するために、保護アッセイが開発されました。
要約
糖尿病性網膜症(DR)は、その病因の2つの異なる段階を特徴とする複雑で進行性の眼疾患です。第1段階は糖尿病による網膜の損傷からの保護の喪失を含み、第2段階はこの損傷の蓄積に集中する。従来のアッセイは、損傷の重症度を示す毛細血管変性の評価に主眼を置き、基本的にDRの第2段階に対処しています。しかし、それらは網膜血管系の保護メカニズムが損なわれているかどうかについての洞察を間接的に提供しているにすぎません。この限界に対処するために、網膜の保護メカニズム、特に酸化ストレスやサイトカインなどの糖尿病誘発性傷害に対する回復力を直接評価する新しいアプローチが開発されました。この保護アッセイは、当初は糖尿病性網膜症用に設計されましたが、生理学的および病理学的状況の両方でより幅広い用途の可能性を秘めています。要約すると、糖尿病性網膜症の病因を理解するには、保護の喪失と損傷の蓄積の二重段階を認識することが必要であり、この革新的な保護アッセイは研究のための貴重なツールを提供し、他の病状に拡張する可能性があります。
概要
糖尿病性網膜症(DR)は、糖尿病(DM)の微小血管合併症の1つであり、先進国の労働年齢の人々の失明の主な原因です1。糖尿病性網膜症の主な危険因子は、高血糖の期間と程度です2,3,4。DMは網膜の血管成分と神経成分の両方の機能障害を引き起こすが5、DRの診断は網膜血管系の形態学的特徴に基づいている6。
高血糖誘発性酸化ストレスは、DRの病因の要因の1つである7。酸化ストレスの増加は広範囲にわたる損傷を引き起こし、ミトコンドリアの機能が損なわれ、それによって活性酸素種のレベルがさらに上昇します。これらのイベントは、網膜血管の漏出、炎症性サイトカインのレベルの上昇、および網膜内の神経細胞と血管細胞の両方のタイプの死を伴います。血管細胞の喪失、したがって網膜の広範な毛細血管ネットワークの機能の喪失は、さまざまな反応のための強力な刺激である低酸素症をもたらします5。このような反応には、透過性と血管新生の両方を促進する血管内皮増殖因子(VEGF)の発現の増加、DRの進行した視力を脅かす段階の基本的な特徴である糖尿病黄斑浮腫、および増殖性糖尿病性網膜症が含まれます6。
DRの特定の特徴は、生物(患者と実験動物の両方)がこの適応症に抵抗する本質的な能力を持っていることを示唆しています。患者は、視力を脅かすDR8、9、10、11、12、13を発症する前に、数十年のDMを経験します。DMのげっ歯類モデルは、DR 14の高度で視力を脅かす段階を発症しませんが、DM15,16の数週間または数か月後にのみ現れるDRの初期/軽度の形態は発症します。さらに、患者と実験動物の両方で、DRは進行性であり、DMの期間が長くなるにつれて網膜機能障害/損傷が増加します。最後に、DMの患者さんの中には、DRを発症しない人もいます。場合によっては、そのような人はDRを発症するのに十分な期間糖尿病を経験しないためです。他の例では、DRに対して並外れた耐性を示すためです。メダリスト研究の参加者の場合と同様に、DM17 の 50 年以上後に DR を発症しません。DRからの保護の存在とその膨大なトランスレーショナル関連性に対する説得力のある支持にもかかわらず、保護の根底にあるメカニズムは積極的に調査されていません。
本明細書に記載の保護アッセイは、糖尿病マウスにおいてDMの発症からDRが遅れる理由の調査を容易にするために開発された。DMおよび非DMマウスに適用されるこのアッセイの重要なステップには、(1)眼に最大下死を誘発する侮辱を送達すること(ex vivo または in vivo)、(2)網膜血管系を単離すること、(3)血管系をTUNELおよびDAPIで染色すること、(4)得られた画像を撮影すること、およびTUNEL / DAPI二重陽性種の割合を定量化することが含まれます。
プロトコル
すべての動物実験は、イリノイ大学シカゴ校の動物管理および施設バイオセーフティ局によって承認されました。生後7週齢の雄のC57/BL6/Jマウスを、病原体のない環境下で12時間の明暗サイクルでグループケージに収容し、餌と水を無料で提供しました。マウスはCO2 窒息によって安楽死させられ、眼球は直ちに摘出され、処理された18。動物は市販の供給源から入手した( 資料表参照)。研究に必要な必須ツールを 図1に示します。
1. 死を誘発する侮辱の配信
- TBH(ex vivo)で酸化ストレスを実行します。
- 施設で承認されたプロトコルに従ってマウスを安楽死させ、眼球を摘出します18 (図2A)。
- 5 mM Tert-ブチルヒドロペルオキシド(TBH)の有無にかかわらず、DMEM + 1% BSAを含む24ウェルプレートの個々のウェルに眼球を直接入れます( 材料表を参照)。37°Cで1時間インキュベートします。 ポジティブコントロールサンプルをDNase(50 U/100 μL)で10分間処理し、DNAを断片化します。
注:TBH(酸化ストレスを誘発する薬剤)の用量は、単離された網膜血管内の細胞死の容易に検出可能で最大以下のレベルを誘発するように選択されました18。 - 10%緩衝ホルマリンで一晩(最低16時間)眼球を固定します。
- サイトカインカクテルを使用して炎症を誘発します(in vivo)。
- 100 mg / kgケタミンと5 mg / kgキシラジンの腹腔内注射でマウスを麻酔します。.
- カスタマイズされた33 G針( 材料表を参照)を使用して、サイトカインカクテル1 μL/眼を硝子体に注入します。注射部位は辺縁部から2〜3mmです(図2B)。
注:サイトカインカクテルには、1 μg/mLのTNF-α、1 μg/mLのIL-1β、および1500 U/μLのIFN-γ18 が1:1:1の比率で含まれています( 材料表を参照)。 - 注射の24時間後、マウスを安楽死させ(施設で承認されたプロトコルに従って)、眼球を摘出し、10%緩衝ホルマリンで一晩固定します。
注:実験は、固定後に最大1週間一時停止し、後で再開することができます。
2.網膜の分離
- 眼球を切り開きます。
- まっすぐな鉗子を使用して視神経をそっとつかみます(図2C)。もう一方の手でマイクロナイフを持ち、辺縁部の後方2〜3mmを切開します。
- マイクロナイフからマイクロハサミに切り替えて、眼球を視神経と一緒に回転させながら、眼球を2つに切るまで輪部と平行に切断します。
- 水晶体を含む眼の前半分を捨てます(図2C)。
- 強膜を取り除きます。
- まっすぐな鉗子を使用して、強膜を網膜から1〜3mmそっと持ち上げます。
- マイクロハサミを使用して、視神経に向かう途中の強膜に2つの橈骨切り込みを入れます。下にある網膜を切らないでください。
- 湾曲した鉗子を使用して強膜フラップをつかみ、網膜から引き剥がします。RPE層は強膜とともに剥がれ落ちます。
- 網膜を洗います。
- マイクロスパチュラを使用して、単離された網膜を、二重蒸留水で満たされた24ウェル皿内のウェルに移します。
- 室温で中程度の速度で皿を静かに振ってください。30分ごとに水を1時間、少なくとも4〜5回交換し、一晩放置します。
3.網膜血管系の分離
- 消化:二重蒸留水を800 μLのYLトリプシン溶液(0.1 Mトリスバッファー(pH 7.8)中の3%トリプシン)と交換します。37°Cで4時間15分19 秒間、穏やかに振とうしながらインキュベートします(図2D)。
注意: 急激な振とうは血管系を損傷する可能性があるため、避けてください。 - 転写:ガラス転写ピペットの広端をYLトリプシン溶液に浸し、糸くずの出ない二重蒸留水を入れた35mmシャーレに網膜を移します。
- 外側の核膜(光受容体)を除去します(図2E)。
- 網膜の半球を下向きに反転させます。まっすぐな一本毛のブラシを使用して、網膜を皿の底にそっと押し込みます。
- ループブラシを使用して、網膜の視細胞をやさしく払い落とします。ブラシストロークは、視神経から網膜の末梢に向かって適用されます。視細胞は、血管によって網膜の残りの部分に固定されていないため、大きなシート状に剥離する可能性があります。
- 200μLのピペットを使用して、神経組織のシートを回収して廃棄します。
- 硝子体を取り除きます。
- 網膜の半球を上向きに反転させます。一対の湾曲した鉗子(A)を使用して、解剖顕微鏡で硝子体をできるだけ把握します。
注:硝子体は、視神経または網膜に付着した透明な組織のシートのように見えます。 - 別の湾曲した鉗子(B)を使用して、視神経をつなぐ硝子体の端をつかみます。鉗子Aを鉗子Bから引き離して硝子体を取り除きます。
- 硝子体を捨てます。硝子体の残骸を調べ、この手順を繰り返して、残留物が次のステップを妨げるため、すべての硝子体を取り除きます。
- 網膜の半球を上向きに反転させます。一対の湾曲した鉗子(A)を使用して、解剖顕微鏡で硝子体をできるだけ把握します。
- 残りの神経組織とグリア組織を取り除きます(図2F)。
- 網膜の半球をひっくり返して、再び下向きにします。もう一度、まっすぐなブラシを使用して、網膜を皿の底にそっと押し付けます(髪の毛の先端は使用しないでください)。
- ループブラシを使用して、視神経頭から末梢に向かって血管系を優しくブラッシングし、残りの神経組織20を除去します。
- まっすぐなブラシで網膜をゆっくりと回転させ、ループブラシを使用して、血管網が十分に洗浄されるまで、網膜血管系上の神経組織の小さな塊をすべて除去します(図2G、H)。
4. 単離された網膜血管系を顕微鏡スライドに取り付ける
- 顕微鏡スライドを配置します。
- 清潔な取り付けカセット( 材料表を参照)を解剖顕微鏡の下に置きます。カセットに二重蒸留水を入れます。
- 解剖顕微鏡の下で黒い背景を使用してコントラストを生成し、照らされた透明な血管系を確認します。
- 鉗子を使用して、清潔でラベルの付いた顕微鏡スライドを取り付けカセットの底部に配置します。
- 網膜血管系を移します。
- ガラストランスファーピペットの広い方の端をYLトリプシン溶液に浸します。
- 洗浄した網膜血管系を移し、血管系をマウントカセット内および顕微鏡スライドの上の二重蒸留水に静かに取り除きます。
- 網膜血管系をマウントします。
注:血管系が顕微鏡スライドの上に浮いている間、孤立した血管系は通常のボウル形状になります。- ループブラシを使用して網膜の半球を上向きに反転させ、血管系をスライドガラスにそっと押し下げてから、髪の毛を使用して開いた血管系をスライドの中央に貼り付けます。血管系は、スライドが触れるときにスライドにくっつく必要があります。
- お椀型の網膜血管を視神経から末梢にブラッシングして血管系を平らに取り付けます。
- 血管系がスライドに完全にくっつくまで、あらゆる方向にブラッシングを繰り返します。
- 網膜血管系を風乾します。
- 網膜血管系全体がスライドに付着したら、片方の端をそっと持ち上げるか、カセットの角でゆっくりと水を抜いて電流を最小限に抑え、スライドを水から取り出します(図2I)。
注:血管系は、風乾するとすぐに見えるようになります(図2J)。 - スライドの裏側にある網膜血管系の周囲にマーカーペンで印を付けます。
- 一時停止せずにサンプルの染色に進みます。
- 網膜血管系全体がスライドに付着したら、片方の端をそっと持ち上げるか、カセットの角でゆっくりと水を抜いて電流を最小限に抑え、スライドを水から取り出します(図2I)。
5. TUNEL染色による死亡検出
注:この手順の詳細については、Zheng et al.21を参照してください。孤立した網膜血管における虚血+/-oxストレス誘発アポトーシス体の代表的な画像を 図3に示します。
- 単離された血管系をPBSで再水和します。PBSで3回すすぎ、PBS中の1% Triton X-100と氷上で2分間インキュベートし、単離された血管系を透過させます。
- スライドをPBSで2回すすぎ、残留したTriton X-100を取り除きます。サンプルの周囲を乾燥させます。
- 50 μLのTUNEL反応混合物( 材料表を参照)をサンプルに加えます。スライドを加湿雰囲気中で、暗所で37°Cで60分間インキュベートします。
- スライドをPBSで3回すすぎ、TUNEL反応混合物を除去します。サンプルの周囲を乾燥させます。
- DAPI封入剤を一滴加えて核をDAPIで染色し、カバーガラスでサンプルをマウントします。暗所で4°Cで保管してください。
注:プロトコルは、画像をキャプチャする前に最大1週間一時停止できます。 - 得られた血管系を共焦点蛍光顕微鏡で撮影します( 材料表を参照)。視神経を取り巻く遠末梢にある6〜8個のランダムに選択されたフィールドをキャプチャします(図4)。
注:単離された網膜血管内のサイトカイン誘導アポトーシス体の代表的な画像を 図5に示します。 - 結果を分析します。
- ex vivoでTBH処理したサンプルの場合は、次の手順を実行します。
- 画像Jを用いて、各視野のアポトーシス小体(TUNEL/DAPI二重陽性種)の数を数えます( 材料表参照)。単一サンプルのすべてのフィールドにおけるアポトーシス体の平均を集計します。
- 無作為に選択された非DMサンプルとDMサンプルのペア間のアポトーシス小体数の倍数変化を計算します。
- 両側スチューデントのt検定18を使用して、統計的に有意な差があるかどうかを判断します。
注:コントロールサンプルと実験サンプル(非DMおよびDM)は、同じ方法で行った場合でも、TUNEL染色の程度が異なる可能性があるため、同じ機会に染色してください。経験豊富なユーザーは、1日あたり最大10個の網膜を洗浄して取り付けることができるため、このプロトコルを開始する前に、同数の対照網膜と実験網膜を処理することを計画してください。
- in vivoで、サイトカインカクテル処理したサンプルについては、以下のステップを行う。
- 網膜血管系全体のアポトーシス小体(TUNEL / DAPI二重陽性種)の数を手動でカウントします。
- 無作為に選択された非DMサンプルとDMサンプルのペア間のアポトーシス小体数の倍数変化を計算します。
- 両側スチューデントのt検定を使用して、統計的に有意な差があるかどうかを判断します。
- ex vivoでTBH処理したサンプルの場合は、次の手順を実行します。
結果
網膜血管系の単離に成功すると、マウス網膜血管系のネットワーク全体がフラットマウントされ、構造的完全性は損なわれません(図2J)。過ヨウ素酸シッフヘマトキシリン(PASH)で染色すると、内皮細胞(EC)と周皮細胞(PC)の2種類の血管細胞を区別することができます(図6)。内皮細胞核は細長く、軽く染色されており、完全に血管壁内に存在します。周皮細胞核は円形で、濃く染色されており、毛細血管壁から突き出ています。PASHで染色されたサンプルは、核を欠いた無細胞毛細血管も明らかにします。
死を誘発するアプローチは、次の理論的根拠によって導かれました。保護は限定的であり、非常に強い死を誘発する侮辱に圧倒される可能性があると推測されました。その結果、侮辱(虚血/酸化ストレスとサイトカインの両方18)は、容易に検出可能な増加を誘発するように最適化されたが、死亡の最大限以下の程度であった(図3 および 図5)。
TUNEL陽性核の存在は、細胞死を引き起こすために用いられた特定の種類の侮辱に左右されることを強調することが重要です。虚血/酸化ストレスの侮辱は、 図3に示すように、細胞のアポトーシスのトラムトラックパターンをもたらしましたが、サイトカインの侮辱は、 図5に示すように、明確で明確に定義されたパターンをもたらしました。両方のパターンはDR患者の網膜血管で観察され22、両方のタイプの薬剤がヒトの細胞死を誘導することを示唆している。さらに、観察された形態学的区別は、病理学が酸化ストレスまたはサイトカインによって引き起こされたかどうかを評価する手段を提供します。
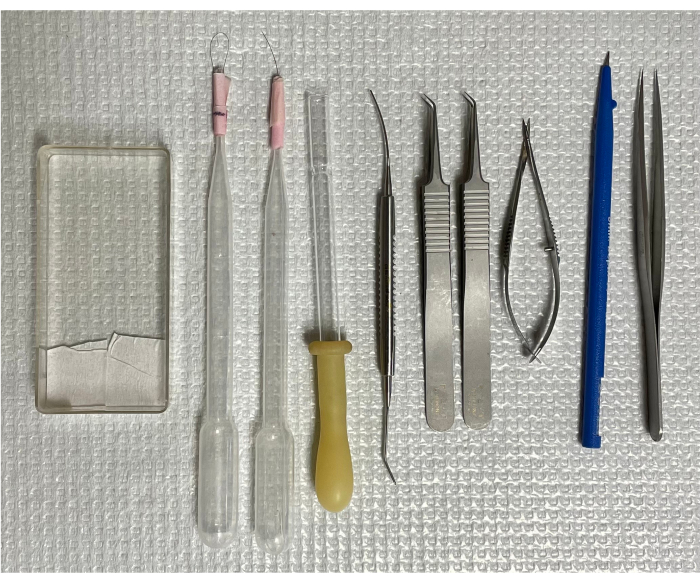
図1:マウス網膜血管系を分離するためのツール。 左から右へ:取り付けカセット、シングルヘアブラシ2本、倒立トランスファーピペット、マイクロスパチュラ、湾曲鉗子2本、スプリングシザース、マイクロナイフ、先端がまっすぐな鉗子。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:死を誘発する侮辱を与え、マウスの眼から網膜血管系を分離する重要なステップを示す概略図。 (A)虚血/酸化傷害の誘発、 ex vivo。摘出後、眼球はTBHの存在下で虚血を受ける。(B)サイトカインの in vivo 投与(硝子体内注射)。(C)眼球を2つに切る。(D)網膜酵素消化:強膜を除去し、網膜を二重蒸留水で一晩洗浄します。YLトリプシン溶液中で37°Cで4時間15分間、24ウェルプレートのウェルでインキュベートします。(E)視細胞を除去する。(F)残りの神経組織およびグリア組織を除去する。(G)上向きの洗浄されたお椀型の維管束ネットワーク。(H)解剖顕微鏡のステージ上の黒い背景の35mmディッシュ内の単離された血管ネットワーク。(I)スライド上のフラットマウント網膜血管系。(J)スライド上の風乾網膜血管系。この図はLi et al.18から修正されたものである。 この図の拡大版をご覧になるには、ここをクリックしてください。
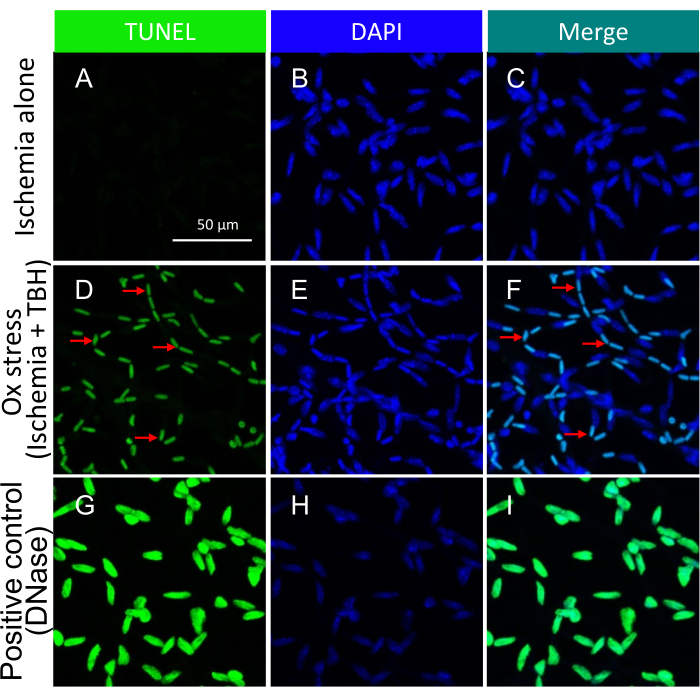
図3:虚血+/- TBHでex vivoで治療されたマウス網膜血管内のアポトーシス小体の検出。孤立した網膜血管における虚血+/-oxストレス誘発アポトーシス体の代表的な画像。各列の見出しは染色を示します。(A-C)1時間の虚血のみを受けた眼球から単離された網膜血管。(D-F)(A-C)と同じですが、1時間の侮辱が虚血と酸化ストレス(5 mM TBH)の組み合わせであったことを除いて。赤い矢印は代表的なTUNEL/DAPI二重陽性種を指しています。(ジーアイ)DNaseで処理したポジティブコントロール。スケールバー = 50 μm。この図はLi et al.18から修正されたものである。この図の拡大版をご覧になるには、ここをクリックしてください。

図4:結果を定量化するためのフィールド選択の図。 TUNELとDAPI信号のマージによる網膜血管系の5 x 5タイルスキャン。視神経を取り囲む遠周縁の6〜8つのフィールドの選択は、赤い四角で示されています。倍率、200倍。スケールバー = 100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
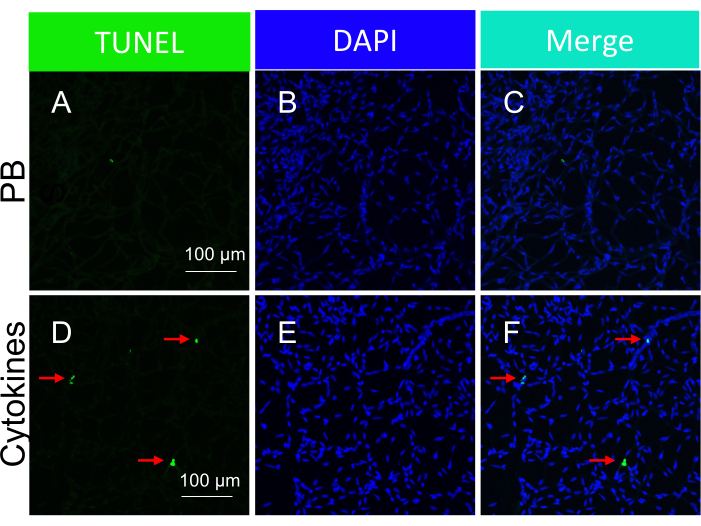
図5:サイトカインの硝子体内注射(in vivo投与)に応答したマウス網膜血管内のアポトーシス体の検出。 単離された網膜血管におけるサイトカイン誘導アポトーシス体の代表的な画像。各列の見出しは染色を示します。(A-C)PBSを硝子体内注射したマウスから単離した網膜血管の画像。(D-F)(A-C)と同じですが、サイトカインカクテルをPBSと一緒に注射した点が異なります。赤い矢印は代表的なTUNEL陽性種です。スケールバー = 100 μm。この図はLi et al.18から修正されたものである。この図の拡大版をご覧になるには、ここをクリックしてください。
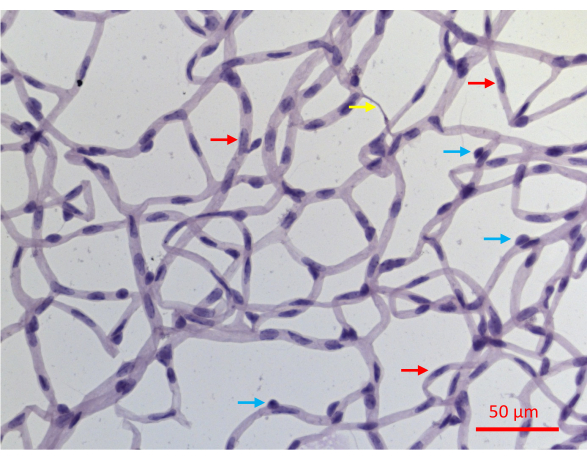
図6:PASHで染色した網膜血管の代表的な画像。 20週間のSTZ誘発性DMを経験したマウスの網膜血管を 図2に示すように単離し、PASHで染色し、可視光で照らしながら画像化しました。毛細血管の周皮細胞核はより円形で濃く染色される傾向があり(青い矢印)、細長くて密度の低い染色された核は内皮細胞の診断になります(赤い矢印)。黄色の矢印は無細胞毛細血管を指しています。スケールバー = 50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
この研究では、虚血/酸化ストレスやサイトカインなどのDM / DR関連の傷害によって引き起こされる死に対する網膜血管系の抵抗性/脆弱性を検出するためのアッセイが確立されました。この原稿は、いくつかの公開されたプロトコル19、20、21の修正であるこのアッセイの詳細な説明を提供します。
プロトコルには、いくつかの重要な段階があります。まず、網膜を細心の注意を払って解剖し、血管網の保存を確保し、実質的な裂傷を防ぐことが不可欠です。これは、網膜がオラセラタにしっかりと付着しているため、辺縁部の後方2〜3mmを切開することで達成でき、それを分離することは困難です。次に、血管に接触するすべての器具(シングルヘアブラシ、トランスファーピペット、鉗子など)を、手順全体を通してこれらの器具をYLトリプシン溶液に浸すことにより、トリプシンでコーティングします。これにより、血管系がこのプロトコルで使用される器具に付着するのを防ぎます。第三に、微小血管系は通常の光の下ではほとんど見えないため、デブリの吸引中や顕微鏡スライドへの移動時には、偶発的な損失を防ぐために警戒を強める必要があります。
網膜のさまざまな層の適切な程度の酵素消化は非常に重要です。消化が不十分な場合、神経組織が血管ネットワークから分離するのを防ぎ、過度の消化は血管神経叢を溶解します。1時間19 分から 一晩23 日までのさまざまな消化時間が報告されています。.観察結果によると、分解時間は 4 時間および 15 分で、2 時間、3 時間、4 時間と比較して最も好ましい結果が得られます。この時点を超えて消化を長引かせることは、プロセスを強化する可能性は低く、代わりに血管系の完全性を損なう可能性があります。
消化された網膜が単毛ブラシに付着している場合は、YLトリプシン溶液に髪を複数回浸します。これにより、ブラシの粘着性のある領域が減少します。ヘアブラシがまだ血管組織に付着している場合は、硝子体の破片が残っていないか検査し、鉗子で取り除きます。
硝子体を完全に除去するのに最適な時期は、視細胞を排除した後、残りの神経組織とグリア組織を除去する前です。網膜は、視細胞が取り除かれるまで硬直性を維持します。この段階で硝子体を摘出すると、網膜/血管系が裂ける可能性があります。残存する神経組織とグリア組織の繊細な層は、血管構造の湾曲した形を維持する上で極めて重要な役割を果たします。それらは、硝子体が視神経から剥離するときに網膜がその中心で裂けるのを防ぎます。
単離された血管系が顕微鏡スライドにまったく接着しない場合は、接着が発生すると予想されるスライドの部分が汚れていることを示しています。スライドの表面を横切って容器を動かして粘着性のある場所を見つけるか、別のスライドに切り替えるか、スライドを細心の注意を払って清掃してから再試行してください。血管がボウルのような形に広がる前にスライドにくっついている場合は、血管系をスライドから持ち上げて、再び水中に自由に浮かぶようにします。このステップは、YLトリプシン溶液に繰り返し浸した鉗子で行います。
血管系を単離するためのいくつかの代替技術が報告されているが、これらは本明細書に記載の保護アッセイには適さないであろう。例えば、浸透圧溶解は、固定されていない網膜サンプルから血管系を分離するために採用されており、組織の生化学的調査を容易にしています24,25。ただし、この手順では、血管系の解剖学的構造と、この記事で採用されているアプローチが保持されない場合があります。同様に、微小血管系の大きなセグメントを単離する組織プリント法は、血管系の電張構造の分析を可能にするが26、血管床全体は典型的には回復しない。
このアッセイは、毛細血管の変性をモニターする既存のアプローチでは保護の問題に対処していないために開発されました。毛細血管変性症は、DMが長引いた後に発生し、DRが発症したかどうかを示します。このアウトカムは、DRの診断に加えて、薬剤/治療法がDRを予防するかどうかを評価するのに役立ちます。しかし、既存の毛細血管変性アッセイは、薬剤の根本的な作用機序を語っていません。このような薬剤は、酸化ストレスやサイトカインの増加など、DRを駆動する病理学的事象を予防する可能性がある。あるいは、薬剤は、酸化ストレスおよびサイトカインに対する回復力を高めることにより、および/または損傷の修復を促進することによって、保護を強化してもよい。この新しい保護アッセイは、特定の治療の有益な効果が、DM関連死から保護する内因性システムの強化を含むかどうかを判断するために使用できます。
この保護アッセイの欠点は、網膜血管内の2つの細胞タイプ、内皮細胞(EC)と周皮細胞(PC)を区別しないことです。PASH染色切片における核の出現は細胞タイプ特異的ですが(図6)、すべての核が診断的特徴を示すわけではありません。核の約30%は、PASH染色試料から得られた2次元画像が血管神経叢の3次元構造を不完全に分解しているため、少なくとも部分的にはECまたはPCとして明確に定義することはできません。この障害は、細胞タイプ特異的マーカーによる免疫蛍光染色などの追加分析によって克服できます。2つの細胞タイプを区別するこのような画像は、TUNELで共染色して、各タイプの血管細胞の耐性/脆弱性を決定できます。
この血管に焦点を当てたアッセイは、神経網膜に関する情報を提供しません。このような情報を提供するために、追加のアッセイを開発することができます。例えば、網膜血管系を単離する代わりに、網膜全体の単一細胞懸濁液を生成し、耐性/脆弱性について(蛍光活性化細胞選別によって)分析することができます。細胞死を示す指標とともに、細胞型特異的なマーカー(神経系と血管系の両方)を含めることで、DM/DRを介した死から保護する能力を持つ網膜細胞型のより完全な全体像が得られます。
結論として、本明細書に記載の保護アッセイは、マウスにおけるDMの発症とDRの発現との間の遅延の原因となるメカニズムを調査するための強力なアプローチを提供する。
開示事項
著者には、報告すべき利益相反はありません。
謝辞
この研究は、イリノイ州失明予防協会、国立衛生研究所(EY031350およびEY001792)からの助成金、および失明防止研究財団からの無制限の助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
参考文献
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved