Method Article
Un test pour détecter la protection du système vasculaire rétinien contre les décès liés au diabète chez la souris
Dans cet article
Résumé
Un test de protection a été mis au point pour surveiller la résilience du système vasculaire rétinien à la mort due à des agressions liées au diabète et à la rétinopathie diabétique telles que le stress oxydatif et les cytokines.
Résumé
La rétinopathie diabétique (RD) est une maladie oculaire complexe et évolutive caractérisée par deux phases distinctes de sa pathogenèse. La première phase implique la perte de protection contre les dommages causés par le diabète à la rétine, tandis que la deuxième phase est centrée sur l’accumulation de ces dommages. Les tests traditionnels se concentrent principalement sur l’évaluation de la dégénérescence capillaire, qui est indicative de la gravité des dommages, s’adressant essentiellement à la deuxième phase de la RD. Cependant, ils ne fournissent qu’indirectement des informations sur la question de savoir si les mécanismes de protection du système vasculaire rétinien ont été compromis. Pour remédier à cette limitation, une nouvelle approche a été développée pour évaluer directement les mécanismes de protection de la rétine, en particulier sa résilience contre les agressions induites par le diabète comme le stress oxydatif et les cytokines. Ce test de protection, bien qu’initialement conçu pour la rétinopathie diabétique, a le potentiel d’applications plus larges dans des contextes physiologiques et pathologiques. En résumé, comprendre la pathogenèse de la rétinopathie diabétique implique de reconnaître les deux phases de perte de protection et d’accumulation des dommages, ce test de protection innovant offrant un outil précieux pour la recherche et potentiellement étendu à d’autres conditions médicales.
Introduction
La rétinopathie diabétique (RD) est l’une des complications microvasculaires du diabète sucré (DM) et la principale cause de cécité chez les personnes en âge de travailler dans les pays développés1. Les principaux facteurs de risque de rétinopathie diabétique sont la durée et le degré d’hyperglycémie 2,3,4. Alors que la DM provoque un dysfonctionnement des composants vasculaires et neuronaux de la rétine5, le diagnostic de RD repose sur les caractéristiques morphologiques de la vascularisation rétinienne6.
Le stress oxydatif induit par l’hyperglycémie est l’un des moteurs de la pathogenèse de la RD7. L’augmentation du stress oxydatif provoque des dommages étendus, ce qui compromet la fonctionnalité des mitochondries et augmente ainsi encore le niveau d’espèces réactives de l’oxygène. Ces événements s’accompagnent d’une fuite des vaisseaux rétiniens, d’une augmentation du niveau de cytokines inflammatoires et de la mort des types de cellules neurales et vasculaires dans la rétine. La perte de cellules vasculaires, et donc de la fonctionnalité du vaste réseau capillaire de la rétine, entraîne une hypoxie, un puissant stimulus pour une variété de réponses5. Ces réponses comprennent l’expression accrue du facteur de croissance de l’endothélium vasculaire (VEGF) qui entraîne à la fois la perméabilité et l’angiogenèse, les caractéristiques cardinales des stades avancés et menaçant la vue de la RD - œdème maculaire diabétique et rétinopathie diabétique proliférative6.
Certaines caractéristiques de la RD suggèrent qu’un organisme (à la fois les patients et les animaux de laboratoire) a une capacité intrinsèque à résister à cette indication. Les patients subissent plusieurs décennies de DM avant de développer un DR 8,9,10,11,12,13 menaçant la vue. Alors que les modèles de DM chez les rongeurs ne développent pas les stades avancés et menaçant la vue de DR14, la forme initiale/légère de DR qui se manifeste ne le fait qu’après une période de semaines ou de mois de DM15,16. De plus, tant chez les patients que chez les animaux de laboratoire, la RD est progressive et les dysfonctionnements/lésions rétiniennes augmentent à mesure que la durée de la DM se prolonge. Enfin, certains patients atteints de DM ne développent jamais de RD. Dans certains cas, cela est dû au fait que ces personnes ne souffrent pas de diabète assez longtemps pour que la RD se développe. Dans d’autres cas, c’est parce qu’ils font preuve d’une résistance extraordinaire à la RD ; comme c’est le cas des participants à l’étude Medalist, qui ne développent pas de RD après 50 ans ou plus de DM17. En dépit d’un tel soutien convaincant à l’existence d’une protection contre la RD et de son énorme pertinence translationnelle, le mécanisme sous-jacent à la protection n’a pas fait l’objet d’une enquête approfondie.
Le test de protection décrit ici a été développé pour faciliter l’étude des raisons pour lesquelles la RD est retardée à partir de l’apparition de la DM chez les souris diabétiques. Les étapes clés de ce test, appliqué à des souris DM et non-DM, comprennent (1) l’administration d’une insulte sous-maximale induisant la mort à l’œil (ex vivo ou in vivo), (2) l’isolement du système vasculaire rétinien, (3) la coloration du système vasculaire avec TUNEL et DAPI, (4) la photographie des images résultantes et la quantification du pourcentage d’espèces doublement positives TUNEL/DAPI.
Protocole
Toutes les études sur les animaux ont été approuvées par le Bureau des soins aux animaux et de la biosécurité institutionnelle de l’Université de l’Illinois à Chicago. Des souris mâles C57/BL6/J âgées de sept semaines ont été logées dans des cages de groupe dans un environnement exempt d’agents pathogènes selon un cycle lumière/obscurité de 12 h et ont bénéficié d’un accès gratuit à la nourriture et à l’eau. Les souris ont été euthanasiées par asphyxie au CO2 , et les yeux ont été énucléés et traités immédiatement18. Les animaux ont été obtenus auprès d’une source commerciale (voir le tableau des matériaux). Les outils essentiels nécessaires à l’étude sont illustrés à la figure 1.
1. Prononcé de l’insulte mortelle
- Effectuer un stress oxydatif avec TBH (ex vivo).
- Euthanasier les souris en suivant des protocoles approuvés par l’établissement et énucléer leurs yeux18 (Figure 2A).
- Placez les globes oculaires directement dans les puits individuels d’une plaque à 24 puits contenant du DMEM + 1 % de BSA, avec ou sans 5 mM d’hydroperoxyde de tert-butyle (TBH) (voir le tableau des matériaux) ; incuber pendant 1 h à 37 °C. Un échantillon témoin positif est traité avec de la DNase (50 U/100 μL) pendant 10 min pour fragmenter l’ADN.
NOTE : La dose de TBH (l’agent qui induit le stress oxydatif) a été choisie pour induire un niveau de mort cellulaire facilement détectable et sous-maximal dans les vaisseaux rétiniens isolés18. - Fixer les yeux dans du formol tamponné à 10% pendant la nuit (16 h minimum).
- Utiliser un cocktail de cytokines pour induire une inflammation (in vivo).
- Anesthésier les souris avec une injection intrapéritonéale de 100 mg/kg de kétamine et de 5 mg/kg de xylazine.
- Utiliser une aiguille personnalisée de 33 G (voir le tableau des matériaux) pour injecter 1 μL/œil du cocktail de cytokines dans le vitré ; le site d’injection se trouve à 2-3 mm du limbe (Figure 2B).
REMARQUE : Le cocktail de cytokines contient un rapport 1 :1 :1 de 1 μg/mL de TNF-α, 1 μg/mL d’IL-1β et 1500 U/μL d’IFN-γ18 (voir le tableau des matériaux). - 24 h après l’injection, euthanasier les souris (selon les protocoles approuvés par l’établissement), énucléer leurs yeux et fixer avec du formol tamponné à 10 % pendant la nuit.
REMARQUE : L’expérience peut être mise en pause après la fixation pendant 1 semaine maximum, puis redémarrée plus tard.
2. Isolation de la rétine
- Ouvrez le globe oculaire.
- Utilisez une pince droite pour saisir doucement le nerf optique (Figure 2C). Tenez un micro-couteau de l’autre main pour faire une incision de 2-3 mm postérieurement au limbe.
- Passez du micro-couteau au micro-ciseaux pour couper parallèlement au limbe tout en faisant pivoter le globe oculaire avec le nerf optique jusqu’à ce que le globe oculaire ait été coupé en deux moitiés.
- Jetez la moitié antérieure de l’œil, y compris le cristallin (Figure 2C).
- Retirez la sclère.
- Utilisez une pince droite pour soulever doucement la sclérotique de 1 à 3 mm de la rétine.
- Utilisez des micro-ciseaux pour faire deux coupes radiales dans la sclère, une partie du chemin vers le nerf optique. Évitez de couper la rétine sous-jacente.
- Utilisez une paire de pinces incurvées pour saisir le lambeau scléral et l’arracher de la rétine. La couche RPE se détachera avec la sclérotique.
- Lavez la rétine.
- À l’aide d’une micro-spatule, transférer la rétine isolée dans un puits à l’intérieur d’une boîte de 24 puits remplie d’eau doublement distillée.
- Secouez doucement le plat à vitesse moyenne-modérée à température ambiante. Changez l’eau toutes les 30 min à 1 h, au moins 4-5 fois, puis laissez reposer toute la nuit.
3. Isolation vasculaire rétinienne
- Digestion : Remplacer l’eau doublement distillée par 800 μL de solution de trypsine YL (3 % de trypsine dans un tampon Tris à 0,1 M (pH 7,8)). Incuber à 37 °C en agitant doucement ou pas du tout pendant 4 h 15 min19 (Figure 2D).
REMARQUE : Évitez les secousses rapides car cela peut endommager le système vasculaire. - Transfert : Tremper l’extrémité large d’une pipette de transfert en verre avec une solution de trypsine YL pour transférer la rétine dans une boîte de Pétri de 35 mm contenant de l’eau non pelucheuse à double distillation.
- Retirez la couche nucléaire externe (photorécepteurs) (Figure 2E).
- Retournez la demi-sphère de la rétine vers le bas. Utilisez la brosse droite à un poil pour presser doucement la rétine au fond de la boîte.
- Utilisez la brosse à boucle pour brosser doucement les photorécepteurs de la rétine. Les coups de pinceau sont appliqués dans une direction allant du nerf optique vers la périphérie de la rétine. Les photorécepteurs peuvent se détacher en grandes feuilles car ils ne sont pas ancrés au reste de la rétine par des vaisseaux sanguins.
- À l’aide d’une pipette de 200 μL, prélever et jeter les feuillets de tissu neural.
- Retirez le vitré.
- Retournez la demi-sphère de la rétine de manière à ce qu’elle soit tournée vers le haut. Utilisez une paire de pinces courbées (A) pour saisir le vitré autant que possible sous un microscope de dissection.
REMARQUE : Le vitré ressemble à une feuille de tissu transparent attachée au nerf optique ou à la rétine. - Utilisez une autre pince incurvée (B) pour saisir l’extrémité du vitré à l’endroit où elle relie le nerf optique. Retirez le vitré en retirant la pince A de la pince B.
- Jeter le vitré. Examinez le reste du vitré et répétez cette étape pour enlever tout le vitré car le résidu entravera les étapes suivantes.
- Retournez la demi-sphère de la rétine de manière à ce qu’elle soit tournée vers le haut. Utilisez une paire de pinces courbées (A) pour saisir le vitré autant que possible sous un microscope de dissection.
- Retirez le reste du tissu neural et glial (Figure 2F).
- Retournez la demi-sphère de la rétine de manière à ce qu’elle soit à nouveau orientée vers le bas. Encore une fois, utilisez la brosse droite pour presser doucement la rétine au fond du plat (n’utilisez pas la pointe des cheveux).
- Utilisez la brosse à boucle pour brosser doucement le système vasculaire de la tête du nerf optique vers la périphérie afin d’enlever le tissu neural restant20.
- Faites tourner la rétine lentement avec la brosse droite et utilisez la brosse à boucle pour enlever tous les petits morceaux de tissu neural sur le système vasculaire rétinien, jusqu’à ce que le réseau vasculaire soit bien nettoyé (Figure 2G,H).
4. Montage du système vasculaire rétinien isolé sur une lame de microscope
- Placez une lame de microscope.
- Placez une cassette de montage propre (voir le tableau des matériaux) sous un microscope à dissection. Remplissez la cassette avec de l’eau doublement distillée.
- Utilisez un arrière-plan noir sous le microscope à dissection pour aider à générer un contraste afin de voir le système vasculaire transparent éclairé.
- À l’aide d’une pince, placez une lame de microscope propre et étiquetée au bas de la cassette de montage.
- Transférez le système vasculaire rétinien.
- Trempez l’extrémité large d’une pipette de transfert en verre avec une solution de trypsine YL.
- Transférez le système vasculaire rétinien nettoyé et délogez-le doucement dans l’eau doublement distillée à l’intérieur de la cassette de montage et au-dessus de la lame de microscope.
- Montez le système vasculaire rétinien.
REMARQUE : Pendant que le système vasculaire flotte au-dessus de la lame de microscope, le système vasculaire isolé acquiert sa forme normale de bol.- Utilisez la brosse à boucle pour retourner la demi-sphère de la rétine vers le haut et poussez doucement le système vasculaire vers le bas sur la lame de verre, puis utilisez les cheveux pour fixer le système vasculaire ouvert au centre de la lame. Le système vasculaire doit adhérer à la lame lorsqu’elle se touche.
- Montez le système vasculaire à plat en brossant le vaisseau rétinien en forme de bol du nerf optique à la périphérie.
- Répétez le brossage dans toutes les directions jusqu’à ce que le système vasculaire adhère complètement à la lame.
- Séchez à l’air libre le système vasculaire rétinien.
- Une fois que l’ensemble du système vasculaire rétinien est fixé à la lame, sortez la lame de l’eau soit en soulevant doucement un bord, soit en drainant lentement l’eau au coin de la cassette pour minimiser les courants, puis en la tirant vers l’extérieur (Figure 2I).
REMARQUE : Le système vasculaire deviendra facilement visible une fois qu’il aura séché à l’air libre (Figure 2J). - Marquez la circonférence du système vasculaire rétinien à l’arrière de la lame avec un marqueur.
- Procédez à la coloration de l’échantillon sans pause.
- Une fois que l’ensemble du système vasculaire rétinien est fixé à la lame, sortez la lame de l’eau soit en soulevant doucement un bord, soit en drainant lentement l’eau au coin de la cassette pour minimiser les courants, puis en la tirant vers l’extérieur (Figure 2I).
5. Détection de décès avec coloration TUNEL
REMARQUE : Pour plus de détails sur cette procédure, reportez-vous à Zheng et al.21. Des images représentatives de corps apoptotiques induits par le stress de l’ischémie +/- ox dans des vaisseaux rétiniens isolés sont représentées à la figure 3.
- Réhydrater le système vasculaire isolé avec du PBS. Rincez-le 3 fois dans du PBS, puis incubez avec 1% de Triton X-100 dans du PBS pendant 2 min sur de la glace pour perméabiliser le système vasculaire isolé.
- Rincez les lames deux fois avec du PBS pour éliminer le Triton X-100 résiduel. Séchez la zone autour de l’échantillon.
- Ajouter 50 μL de mélange réactionnel TUNEL (voir le tableau des matériaux) sur l’échantillon. Incuber la lame dans une atmosphère humidifiée pendant 60 min à 37 °C dans l’obscurité.
- Rincez la lame 3 fois avec du PBS pour éliminer le mélange réactionnel TUNEL. Séchez la zone autour de l’échantillon.
- Ajoutez une goutte de support de montage DAPI pour colorer les noyaux avec DAPI et montez l’échantillon avec une vitre de protection. Conserver à 4 °C à l’obscurité.
REMARQUE : Le protocole peut être mis en pause jusqu’à 1 semaine avant de capturer des images. - Photographier le système vasculaire obtenu à l’aide d’un microscope confocal à fluorescence (voir le tableau des matériaux). Capturez six à huit champs choisis au hasard dans la périphérie éloignée entourant le nerf optique (Figure 4).
NOTE : Des images représentatives de corps apoptotiques induits par les cytokines dans des vaisseaux rétiniens isolés sont illustrées à la figure 5. - Analysez les résultats.
- Pour les échantillons ex vivo traités au TBH, effectuez les étapes suivantes.
- Compter le nombre de corps apoptotiques (espèces doublement positives TUNEL/DAPI) dans chaque champ à l’aide de l’image J (voir le tableau des matériaux). Calculez la moyenne des corps apoptotiques dans tous les champs d’un même échantillon.
- Calculez le changement de pli du nombre de corps apoptotiques entre une paire sélectionnée au hasard d’échantillons non-DM et DM.
- Déterminez s’il existe une différence statistiquement significative à l’aide du test t bilatéral de Student18.
REMARQUE : Colorer les échantillons témoins et expérimentaux (non-DM et DM) à la même occasion, car l’étendue de la coloration TUNEL peut varier, même lorsqu’elle est effectuée de la même manière. Étant donné que jusqu’à 10 rétines peuvent être nettoyées et montées par jour par un utilisateur expérimenté, prévoyez de traiter un nombre égal de rétines de contrôle et expérimentales avant de commencer ce protocole.
- Pour les échantillons traités in vivo, les échantillons traités par cocktail de cytokines, effectuez les étapes suivantes.
- Compter manuellement le nombre de corps apoptotiques (espèces doublement positives TUNEL/DAPI) dans l’ensemble du système vasculaire rétinien.
- Calculez le changement de pli du nombre de corps apoptotiques entre une paire sélectionnée au hasard d’échantillons non-DM et DM.
- Déterminez s’il y a une différence statistiquement significative à l’aide du test t bilatéral de l’étudiant.
- Pour les échantillons ex vivo traités au TBH, effectuez les étapes suivantes.
Résultats
L’isolement réussi de la vascularisation rétinienne permet d’obtenir un montage plat de l’ensemble du réseau vasculaire rétinien de la souris, avec l’intégrité architecturale intacte (Figure 2J). Lors de la coloration avec de l’hématoxyline acide-schiff périodique (PASH), il est possible de distinguer les deux types de cellules vasculaires : les cellules endothéliales (CE) et les péricytes (PC) (Figure 6). Les noyaux des cellules endothéliales sont allongés, légèrement colorés et résident entièrement à l’intérieur des parois des vaisseaux. Les noyaux péricytaires sont circulaires, densément colorés et dépassent des parois capillaires. Les échantillons colorés par PASH révèlent également des capillaires acellulaires, dépourvus de noyaux.
L’approche pour induire la mort a été guidée par le raisonnement suivant. On a émis l’hypothèse que la protection était limitée, c’est-à-dire qu’elle pouvait être submergée par une insulte mortelle très forte. Par conséquent, les agressions (à la fois l’ischémie/stress oxydatif et les cytokines18) ont été optimisées de manière à induire une augmentation facilement détectable mais une étendue sous-maximale de la mortalité (Figure 3 et Figure 5).
Il est important de souligner que la présence de noyaux TUNEL-positifs dépendait du type spécifique d’insulte employée pour déclencher la mort cellulaire. L’agression de l’ischémie/stress oxydatif a conduit à un modèle d’apoptose cellulaire en forme de voie de tramway, comme illustré à la figure 3, tandis que l’insulte de cytokine a entraîné un modèle distinct et bien défini, comme le montre la figure 5. Les deux schémas peuvent être observés dans les vaisseaux rétiniens des patients atteints de RD22, ce qui suggère que les deux types d’agents induisent la mort cellulaire chez l’homme. De plus, les distinctions morphologiques observées permettent d’évaluer si la pathologie est due au stress oxydatif ou aux cytokines.
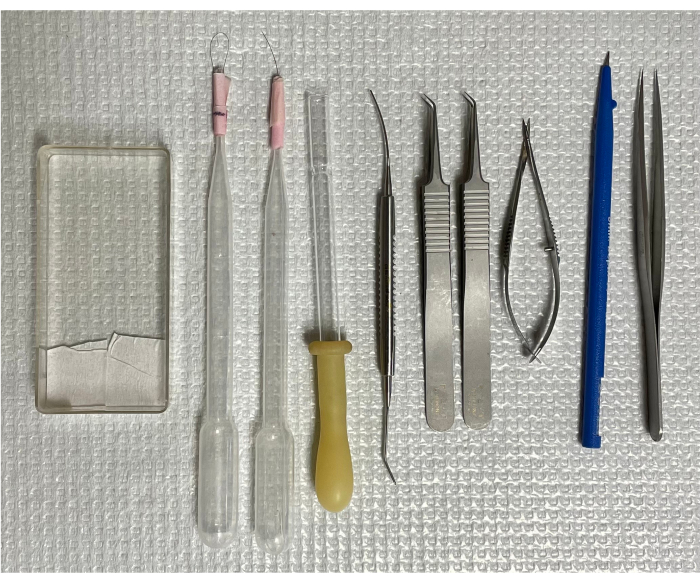
Figure 1 : Outils d’isolement du système vasculaire rétinien de souris. De gauche à droite : la cassette de montage, deux brosses à un seul poil, une pipette de transfert inversée, une micro-spatule, deux pinces courbées, des ciseaux à ressort, un micro-couteau et une pince à pointes droites. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Schéma montrant les étapes clés de l’administration d’une insulte mortelle, puis de l’isolement du système vasculaire rétinien de l’œil d’une souris. (A) Induction d’une ischémie/lésion oxydative, ex vivo. Après énucléation, le globe oculaire est soumis à une ischémie en présence de TBH. (B) Administration in vivo (injection intravitréenne) de cytokines. (C) Couper le globe oculaire en deux moitiés. (D) Digestion enzymatique rétinienne : enlever la sclérotique et laver la rétine dans de l’eau doublement distillée pendant la nuit. Incubation dans une solution de trypsine d’YL à 37 °C pendant 4 h 15 min dans un puits d’une plaque de 24 puits. (E) Élimination des photorécepteurs. (F) Enlever le tissu neural et glial restant. (G) Réseau vasculaire en forme de cuvette nettoyé vers le haut. (H) Réseau vasculaire isolé dans une boîte de 35 mm à fond noir sur la platine d’un microscope à dissection. (I) Vascularisation rétinienne montée à plat sur une lame. (J) Vascularisation rétinienne séchée à l’air sur une lame. Ce chiffre a été modifié à partir de Li et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
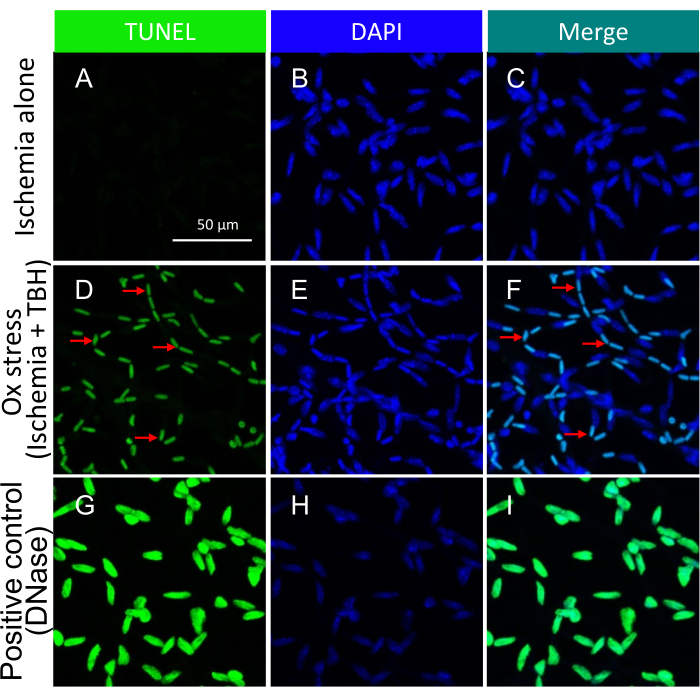
Figure 3 : Détection de corps apoptotiques au sein de vaisseaux rétiniens de souris traités ex vivo avec ischémie +/- TBH. Images représentatives de corps apoptotiques induits par le stress de l’ischémie +/- ox dans des vaisseaux rétiniens isolés. L’en-tête de chaque colonne indique la coloration. (A-C) Vaisseaux rétiniens isolés des globes oculaires qui ont subi 1 h d’ischémie seule. (D-F) Identique à (A-C), sauf que l’insulte de 1 h était une combinaison d’ischémie et de stress oxydatif (5 mM TBH). Les flèches rouges pointent vers des espèces représentatives doublement positives TUNEL/DAPI. (G-I) Contrôle positif traité avec DNase. Barre d’échelle = 50 μm. Ce chiffre a été modifié à partir de Li et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Illustration de la sélection des champs pour la quantification des résultats. Un scan de tuiles 5 x 5 du système vasculaire rétinien avec la fusion des signaux TUNEL et DAPI. La sélection de six à huit champs dans la périphérie la plus éloignée entourant le nerf optique est représentée par des carrés rouges. Grossissement, 200x. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
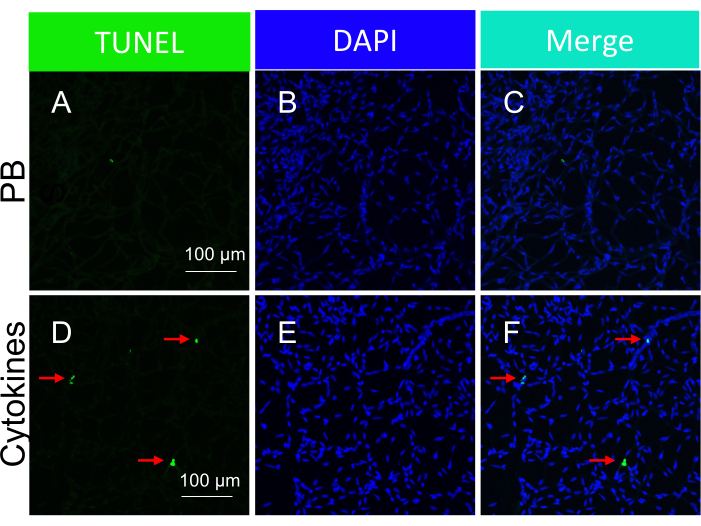
Figure 5 : Détection des corps apoptotiques dans les vaisseaux rétiniens de souris en réponse à l’injection intravitréenne de cytokines (administration in vivo). Images représentatives de corps apoptotiques induits par les cytokines dans des vaisseaux rétiniens isolés. L’en-tête de chaque colonne indique la coloration. (A-C) Images des vaisseaux rétiniens isolés de souris injectées par voie intravitrée avec du PBS. (D-F) Identique à (A-C), sauf qu’un cocktail de cytokines a été injecté avec du PBS. Les flèches rouges pointent vers des espèces représentatives de TUNEL-positives. Barres d’échelle = 100 μm. Ce chiffre a été modifié à partir de Li et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
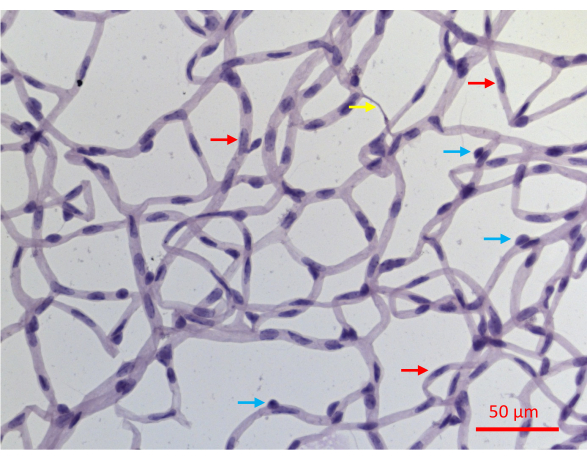
Figure 6 : Image représentative d’un vaisseau rétinien coloré par PASH. Les vaisseaux rétiniens d’une souris qui a subi 20 semaines de DM induite par STZ ont été isolés comme décrit dans la figure 2, colorés avec PASH et imagés alors qu’ils étaient éclairés par la lumière visible. Les noyaux péricytaires dans les capillaires ont tendance à être plus circulaires et densément colorés (flèches bleues), tandis que les noyaux allongés et moins densément colorés diagnostiquent les cellules endothéliales (flèches rouges). La flèche jaune pointe vers un capillaire acellulaire. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cette étude, un test a été établi pour détecter la résistance/vulnérabilité du système vasculaire rétinien à la mort induite par des agressions liées au DM/DR telles que l’ischémie/stress oxydatif et les cytokines. Ce manuscrit fournit une description détaillée de ce test, qui est une modification de plusieurs protocoles publiés 19,20,21.
Le protocole comprend plusieurs étapes cruciales. Tout d’abord, il est impératif de disséquer méticuleusement la rétine, en veillant à la préservation du réseau vasculaire et en évitant les déchirures importantes. Cela peut être accompli en faisant une incision de 2 à 3 mm en arrière du limbe, car la rétine adhère étroitement à l’ora serrata et il est difficile de la séparer. Deuxièmement, enduisez de trypsine tous les instruments qui entrent en contact avec les vaisseaux (par exemple, les brosses à poil unique, les pipettes de transfert et les pinces) en trempant ces outils dans la solution de trypsine YL tout au long de la procédure. Cela empêche le système vasculaire d’adhérer aux instruments utilisés dans ce protocole. Troisièmement, étant donné que la microvascularisation est presque invisible dans des conditions normales de lumière, une vigilance accrue est requise lors de l’aspiration des débris et de leur transfert sur la lame de microscope afin d’éviter toute perte accidentelle.
Un degré approprié de digestion enzymatique des différentes couches de la rétine est crucial ; Une digestion insuffisante empêche la séparation du tissu neuronal du réseau vasculaire, tandis qu’une digestion excessive dissout le plexus vasculaire. Différents temps de digestion allant de 1 h19 à 23 pendant la nuit ont été rapportés. Sur la base des observations, un temps de digestion de 4 h et 15 min donne les résultats les plus favorables par rapport à des durées de 2 h, 3 h et 4 h. Il est peu probable que la prolongation de la digestion au-delà de ce point améliore le processus et pourrait plutôt compromettre l’intégrité du système vasculaire.
Dans les cas où la rétine digérée adhère à la brosse à un seul poil, trempez les cheveux dans une solution de trypsine de Yl plusieurs fois. Cela réduit les zones collantes de la brosse. Si la brosse à cheveux adhère toujours au tissu vasculaire, inspectez-la à la recherche de fragments résiduels de vitré et retirez-les avec une pince.
Le moment optimal pour l’ablation complète du vitré est après l’élimination des photorécepteurs, mais avant l’ablation des tissus neuraux et gliaux restants. La rétine maintient sa rigidité jusqu’à ce que les photorécepteurs soient retirés. L’extraction du vitré à ce stade pourrait potentiellement déchirer la rétine/le système vasculaire. Les couches délicates de tissu neural et glial résiduel jouent un rôle central dans la préservation de la forme incurvée de la structure vasculaire. Ils empêchent la rétine de se déchirer en son centre lorsque le vitré est détaché du nerf optique.
Si le système vasculaire isolé n’adhère pas du tout à la lame de microscope, cela indique que la section de la lame où l’on s’attend à ce que l’adhérence se produise est sale. Essayez de déplacer les récipients sur la surface de la diapositive pour localiser un endroit collant, de passer à une autre diapositive ou de nettoyer méticuleusement la diapositive et de réessayer. Si les récipients collent à la glissière avant de se déployer dans leur forme de bol, soulevez le système vasculaire de la glissière afin de lui permettre de flotter librement dans l’eau une fois de plus. Faites cette étape avec des forceps qui ont été trempés à plusieurs reprises dans la solution de trypsine YL.
Plusieurs techniques alternatives d’isolement du système vasculaire ont été rapportées, qui ne conviendraient pas à l’essai de protection décrit dans le présent document. Par exemple, la lyse osmotique a été utilisée pour isoler le système vasculaire à partir d’échantillons de rétine non fixés, ce qui facilite les investigations biochimiques des tissus24,25. Cependant, cette procédure peut ne pas préserver l’anatomie du système vasculaire ainsi que l’approche employée dans cet article. De même, alors que la méthode d’empreinte tissulaire permettant d’isoler de grands segments de microvascularisation permet d’analyser l’architecture électrotonique du système vasculaire26, l’ensemble du lit vasculaire n’est généralement pas récupéré.
Ce test a été mis au point parce que les approches existantes pour surveiller la dégénérescence capillaire ne répondent pas à la question de la protection. La dégénérescence capillaire, qui survient après une DM prolongée, indique si la RD s’est développée. En plus de diagnostiquer la RD, ce résultat est utile pour évaluer si un agent ou un traitement prévient la RD. Cependant, les tests de dégénérescence capillaire existants ne parlent pas du mécanisme d’action sous-jacent de l’agent. Un tel agent peut prévenir les événements pathologiques qui entraînent la RD, tels qu’une augmentation du stress oxydatif ou des cytokines. Alternativement, l’agent peut renforcer la protection en améliorant la résilience au stress oxydatif et aux cytokines et / ou favoriser la réparation des dommages. Ce nouveau test de protection peut être utilisé pour déterminer si l’effet bénéfique d’un traitement donné implique le renforcement du système endogène qui protège contre la mort liée à la DM.
L’inconvénient de ce test de protection est qu’il ne distingue pas les deux types de cellules au sein des vaisseaux rétiniens : les cellules endothéliales (CE) et les péricytes (PC). Bien que l’apparence de leurs noyaux dans les coupes colorées par TACHs soit spécifique au type de cellule (Figure 6), tous les noyaux ne présentent pas de caractéristiques diagnostiques. Environ 30 % des noyaux ne peuvent pas être définis sans ambiguïté comme EC ou PC, du moins en partie, parce que les images bidimensionnelles obtenues à partir d’échantillons colorés par TACH, résolvent incomplètement la structure tridimensionnelle du plexus vasculaire. Cet obstacle pourrait être surmonté par des analyses supplémentaires telles que la coloration immunofluorescente avec des marqueurs spécifiques au type de cellule. De telles images, qui distinguent les deux types de cellules, pourraient être co-colorées avec TUNEL pour déterminer la résistance/vulnérabilité de chacun des types de cellules vasculaires.
Ce test vasculaire ne fournit aucune information concernant la rétine neurale. D’autres tests pourraient être mis au point pour fournir de telles informations. Par exemple, au lieu d’isoler le système vasculaire rétinien, une suspension cellulaire unique de l’ensemble de la rétine pourrait être générée, puis analysée (par tri cellulaire activé par fluorescence) pour détecter la résistance et la vulnérabilité. L’inclusion de marqueurs spécifiques au type cellulaire (à la fois neural et vasculaire) ainsi que d’indicateurs de mort cellulaire fournirait une image plus complète des types de cellules rétiniennes qui ont la capacité de protéger contre la mort médiée par le DM/DR.
En conclusion, le test de protection décrit ici fournit une approche puissante pour étudier le mécanisme responsable du délai entre l’apparition de la DM et la manifestation de la RD chez la souris.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à signaler.
Remerciements
Ce travail a été soutenu par des subventions de l’Illinois Society to Prevent Blindness, de l’Institut national de la santé (EY031350 et EY001792) et une subvention sans restriction de la Research to Prevent Blindness Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
Références
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon