Method Article
Ein Assay zum Nachweis des Schutzes des Netzhautgefäßsystems vor diabetesbedingtem Tod bei Mäusen
In diesem Artikel
Zusammenfassung
Es wurde ein Schutzassay entwickelt, um die Widerstandsfähigkeit des retinalen Gefäßsystems gegen den Tod durch Diabetes/diabetische Retinopathie-bedingte Beleidigungen wie oxidativen Stress und Zytokine zu überwachen.
Zusammenfassung
Die diabetische Retinopathie (DR) ist eine komplexe und fortschreitende Augenerkrankung, die durch zwei unterschiedliche Phasen in ihrer Pathogenese gekennzeichnet ist. In der ersten Phase geht es um den Verlust des Schutzes vor diabetesbedingten Schäden an der Netzhaut, während sich die zweite Phase auf die Anhäufung dieser Schäden konzentriert. Herkömmliche Assays konzentrieren sich in erster Linie auf die Bewertung der Kapillardegeneration, die auf die Schwere der Schädigung hinweist, und befassen sich im Wesentlichen mit der zweiten Phase der DR. Sie geben jedoch nur indirekt Aufschluss darüber, ob die Schutzmechanismen des retinalen Gefäßsystems beeinträchtigt sind. Um dieser Einschränkung zu begegnen, wurde ein neuartiger Ansatz entwickelt, um die Schutzmechanismen der Netzhaut direkt zu bewerten - insbesondere ihre Widerstandsfähigkeit gegen Diabetes-induzierte Beleidigungen wie oxidativen Stress und Zytokine. Obwohl dieser Schutzassay ursprünglich für die diabetische Retinopathie entwickelt wurde, birgt er das Potenzial für breitere Anwendungen sowohl in physiologischen als auch in pathologischen Kontexten. Zusammenfassend lässt sich sagen, dass das Verständnis der Pathogenese der diabetischen Retinopathie das Erkennen der dualen Phasen des Schutzverlusts und der Schadensakkumulation erfordert, wobei dieser innovative Schutzassay ein wertvolles Werkzeug für die Forschung darstellt und möglicherweise auf andere Erkrankungen ausgeweitet werden kann.
Einleitung
Die diabetische Retinopathie (DR) ist eine der mikrovaskulären Komplikationen des Diabetes mellitus (DM) und die häufigste Ursache für Erblindung bei Personen im erwerbsfähigen Alter in Industrieländern1. Hauptrisikofaktoren für eine diabetische Retinopathie sind die Dauer und der Grad der Hyperglykämie 2,3,4. Während DM eine Dysfunktion sowohl der vaskulären als auch der neuronalen Komponenten der Netzhaut verursacht5, basiert die Diagnose der DR auf morphologischen Merkmalen des retinalen Gefäßsystems6.
Hyperglykämie-induzierter oxidativer Stress ist einer der Treiber der DR-Pathogenese7. Erhöhter oxidativer Stress verursacht weitreichende Schäden, die die Funktionalität der Mitochondrien beeinträchtigen und dadurch den Gehalt an reaktiven Sauerstoffspezies weiter erhöhen. Diese Ereignisse gehen mit einem Austritt von Netzhautgefäßen, einem Anstieg des Spiegels entzündlicher Zytokine und dem Absterben von neuronalen und vaskulären Zelltypen in der Netzhaut einher. Der Verlust von Gefäßzellen und damit die Funktionalität des ausgedehnten Kapillarnetzwerks der Netzhaut führt zu Hypoxie, einem starken Stimulus für eine Vielzahl von Reaktionen5. Zu diesen Reaktionen gehören eine erhöhte Expression des vaskulären endothelialen Wachstumsfaktors (VEGF), der sowohl die Permeabilität als auch die Angiogenese antreibt, Kardinalmerkmale der fortgeschrittenen, das Sehvermögen bedrohenden Stadien des diabetischen Makulaödems und der proliferativen diabetischen Retinopathie6.
Bestimmte Merkmale der DR deuten darauf hin, dass ein Organismus (sowohl Patienten als auch Versuchstiere) eine intrinsische Fähigkeit besitzt, dieser Indikation zu widerstehen. Die Patienten erleben mehrere Jahrzehnte DM, bevor sie eine sehbedrohende DR 8,9,10,11,12,13 entwickeln. Während Nagetiermodelle der DM nicht die fortgeschrittenen, das Sehvermögen bedrohenden Stadien der DR14 entwickeln, manifestiert sich die anfängliche/milde Form der DR erst nach einem Zeitraum von Wochen oder Monaten vonDM 15,16. Darüber hinaus ist die DR sowohl bei Patienten als auch bei Versuchstieren progressiv, und die Dysfunktion/Schädigung der Netzhaut nimmt mit zunehmender Dauer der DM zu. Schließlich entwickeln einige Patienten mit DM nie eine DR. In bestimmten Fällen liegt dies daran, dass solche Personen nicht lange genug an Diabetes leiden, um eine DR zu entwickeln. In anderen Fällen liegt es daran, dass sie eine außergewöhnliche Resistenz gegen DR aufweisen; wie es bei den Teilnehmern der Medalist-Studie der Fall ist, die nach 50 oder mehr Jahren DM17 keine DR entwickeln. Trotz dieser überzeugenden Unterstützung für die Existenz des Schutzes vor DR und seiner enormen translationalen Relevanz wurde der Mechanismus, der dem Schutz zugrunde liegt, nicht offensiv untersucht.
Der hier beschriebene Schutzassay wurde entwickelt, um die Untersuchung zu erleichtern, warum DR ab dem Auftreten von DM bei diabetischen Mäusen verzögert wird. Zu den wichtigsten Schritten dieses Assays, der auf DM- und Nicht-DM-Mäuse angewendet wird, gehören (1) die Verabreichung einer submaximalen, todbringenden Beleidigung des Auges (ex vivo oder in vivo), (2) die Isolierung des retinalen Gefäßsystems, (3) die Färbung des Gefäßsystems mit TUNEL und DAPI, (4) das Fotografieren der resultierenden Bilder und die Quantifizierung des Prozentsatzes der TUNEL/DAPI-Doppel-positiven Spezies.
Protokoll
Alle Tierstudien wurden vom Office of Animal Care and Institutional Biosafety an der University of Illinois in Chicago genehmigt. Sieben Wochen alte männliche C57/BL6/J-Mäuse wurden in Gruppenkäfigen in einer pathogenfreien Umgebung in einem 12-stündigen Hell/Dunkel-Zyklus untergebracht und erhielten freien Zugang zu Futter und Wasser. Die Mäuse wurden durch CO2 -Erstickung euthanasiert, und die Augen wurden sofort enukleiert und verarbeitet18. Die Tiere stammten aus einer kommerziellen Quelle (siehe Materialtabelle). Die wesentlichen Werkzeuge, die für die Studie benötigt werden, sind in Abbildung 1 dargestellt.
1. Zustellung der Todesbeleidigung
- Führen Sie oxidativen Stress mit TBH (ex vivo) durch.
- Euthanasieren Sie die Mäuse nach institutionell anerkannten Protokollen und enukleieren Sie ihre Augen18 (Abbildung 2A).
- Legen Sie die Augäpfel direkt in einzelne Vertiefungen einer 24-Well-Platte, die DMEM + 1% BSA enthält, mit oder ohne 5 mM Tert-Butylhydroperoxid (TBH) (siehe Materialtabelle); 1 Stunde bei 37 °C inkubieren. Eine positive Kontrollprobe wird 10 Minuten lang mit DNase (50 U/100 μL) behandelt, um DNA zu fragmentieren.
ANMERKUNG: Die Dosis von TBH (dem Mittel, das oxidativen Stress induziert) wurde so gewählt, dass ein leicht nachweisbares und submaximales Maß an Zelltod innerhalb der isolierten Netzhautgefäße induziertwird 18. - Fixieren Sie die Augen über Nacht (mindestens 16 Stunden) mit 10% gepuffertem Formalin.
- Verwenden Sie einen Zytokin-Cocktail, um eine Entzündung (in vivo) zu induzieren.
- Betäuben Sie die Mäuse mit einer intraperitonealen Injektion von 100 mg/kg Ketamin und 5 mg/kg Xylazin.
- Verwenden Sie eine angepasste 33-G-Nadel (siehe Materialtabelle), um 1 μl/Auge des Zytokincocktails in den Glaskörper zu injizieren. die Injektionsstelle ist 2-3 mm vom Limbus entfernt (Abbildung 2B).
HINWEIS: Der Zytokin-Cocktail enthält ein Verhältnis von 1:1:1 von 1 μg/ml TNF-α, 1 μg/ml IL-1β und 1500 U/μl IFN-γ18 (siehe Materialtabelle). - 24 Stunden nach der Injektion werden die Mäuse eingeschläfert (gemäß institutionell anerkannten Protokollen), ihre Augen enukleiert und über Nacht mit 10% gepuffertem Formalin fixiert.
HINWEIS: Das Experiment kann nach der Fixierung für maximal 1 Woche pausiert und später neu gestartet werden.
2. Isolierung der Netzhaut
- Schneide den Augapfel auf.
- Verwenden Sie eine gerade Pinzette, um den Sehnerv vorsichtig zu greifen (Abbildung 2C). Halten Sie mit der anderen Hand ein Mikromesser, um einen Schnitt von 2-3 mm hinter dem Limbus zu machen.
- Wechsle vom Mikromesser zur Mikroschere, um parallel zum Limbus zu schneiden, während du den Augapfel zusammen mit dem Sehnerv drehst, bis der Augapfel in zwei Hälften geschnitten ist.
- Verwerfen Sie die vordere Hälfte des Auges, einschließlich der Linse (Abbildung 2C).
- Entferne die Sklera.
- Verwenden Sie eine gerade Pinzette, um die Sklera vorsichtig 1-3 mm von der Netzhaut abzuheben.
- Verwenden Sie eine Mikroschere, um zwei radiale Schnitte in die Sklera zu machen, die auf dem Weg zum Sehnerv liegt. Vermeiden Sie es, die darunter liegende Netzhaut zu durchtrennen.
- Greife mit einer gebogenen Pinzette den Skleralappen und reiße ihn von der Netzhaut ab. Die RPE-Schicht löst sich mit der Sklera.
- Waschen Sie die Netzhaut.
- Verwenden Sie einen Mikrospatel, um die isolierte Netzhaut in eine Vertiefung innerhalb einer 24-Well-Schale zu übertragen, die mit doppelt destilliertem Wasser gefüllt wurde.
- Schütteln Sie das Gericht vorsichtig bei mittlerer bis mittlerer Geschwindigkeit bei Raumtemperatur. Wechseln Sie das Wasser alle 30 Minuten bis 1 Stunde, mindestens 4-5 Mal, und lassen Sie es dann über Nacht stehen.
3. Isolierung der retinalen Gefäße
- Aufschluss: Ersetzen Sie das doppelt destillierte Wasser durch 800 μl YL-Trypsinlösung (3% Trypsin in 0,1 M Tris-Puffer (pH 7,8)). Bei 37 °C mit leichtem bis keinem Schütteln für 4 h 15 min19 inkubieren (Abbildung 2D).
HINWEIS: Vermeiden Sie schnelles Schütteln, da dies das Gefäßsystem schädigen kann. - Transfer: Tauchen Sie das breite Ende einer Glastransferpipette in YL-Trypsinlösung, um die Netzhaut in eine 35-mm-Petrischale mit fusselfreiem, doppelt destilliertem Wasser zu übertragen.
- Entfernen Sie die äußere Kernschicht (Photorezeptoren) (Abbildung 2E).
- Drehen Sie die Netzhaut-Halbkugel nach unten. Verwenden Sie die glatte Einhaarbürste, um die Netzhaut vorsichtig auf den Boden der Schale zu drücken.
- Verwenden Sie die Schlingenbürste, um die Photorezeptoren der Netzhaut vorsichtig wegzubürsten. Die Pinselstriche werden in einer Richtung vom Sehnerv in Richtung der Peripherie der Netzhaut aufgetragen. Die Photorezeptoren können sich in großen Schichten ablösen, da sie nicht durch Blutgefäße mit dem Rest der Netzhaut verankert sind.
- Verwendung einer 200-μl-Pipette zum Sammeln und Entsorgen der neuralen Gewebeschichten.
- Entfernen Sie den Glaskörper.
- Drehen Sie die Netzhaut-Halbkugel so, dass sie nach oben zeigt. Verwenden Sie eine gebogene Pinzette (A), um den Glaskörper unter einem Präpariermikroskop so weit wie möglich zu erfassen.
HINWEIS: Der Glaskörper sieht aus wie eine Schicht aus transparentem Gewebe, die mit dem Sehnerv oder der Netzhaut verbunden ist. - Verwenden Sie eine weitere gekrümmte Zange (B), um das Ende des Glaskörpers zu greifen, wo er den Sehnerv verbindet. Entfernen Sie den Glaskörper, indem Sie die Zange A von der Zange B wegziehen.
- Verwerfen Sie den Glaskörper. Untersuchen Sie den Rest des Glaskörpers und wiederholen Sie diesen Schritt, um den gesamten Glaskörper zu entfernen, da der Rest die nächsten Schritte behindert.
- Drehen Sie die Netzhaut-Halbkugel so, dass sie nach oben zeigt. Verwenden Sie eine gebogene Pinzette (A), um den Glaskörper unter einem Präpariermikroskop so weit wie möglich zu erfassen.
- Entfernen Sie das verbleibende Nerven- und Gliagewebe (Abbildung 2F).
- Drehen Sie die Netzhaut-Halbkugel um, so dass sie wieder nach unten zeigt. Verwenden Sie erneut die gerade Bürste, um die Netzhaut sanft auf den Boden der Schale zu drücken (verwenden Sie nicht die Haarspitze).
- Verwenden Sie die Schlingenbürste, um vorsichtig über das Gefäßsystem vom Sehnervenkopf in Richtung Peripherie zu streichen, um das verbleibende Nervengewebezu entfernen 20.
- Drehen Sie die Netzhaut langsam mit der geraden Bürste und entfernen Sie mit der Schlingenbürste alle kleinen Stücke des Nervengewebes auf dem retinalen Gefäßsystem, bis das Gefäßnetz gut gereinigt ist (Abbildung 2G,H).
4. Montieren des isolierten retinalen Gefäßsystems auf einem Objektträger
- Legen Sie einen Objektträger auf.
- Legen Sie eine saubere Montagekassette (siehe Materialtabelle) unter ein Präpariermikroskop. Füllen Sie die Kassette mit doppelt destilliertem Wasser.
- Verwenden Sie einen schwarzen Hintergrund unter dem Präpariermikroskop, um den Kontrast zu erzeugen und das beleuchtete transparente Gefäßsystem zu sehen.
- Verwenden Sie eine Pinzette, um einen sauberen, beschrifteten Objektträger in den Boden der Montagekassette zu legen.
- Übertragen Sie das retinale Gefäßsystem.
- Tauchen Sie das breite Ende einer Glastransferpipette in YL-Trypsinlösung.
- Übertragen Sie das gereinigte Netzhautgefäßsystem und lösen Sie das Gefäßsystem vorsichtig in das doppelt destillierte Wasser innerhalb der Montagekassette und über dem Objektträger.
- Montieren Sie das Netzhautgefäßsystem.
HINWEIS: Während das Gefäßsystem über dem Objektträger schwebt, nimmt das isolierte Gefäßsystem seine normale Schalenform an.- Verwenden Sie die Schlaufenbürste, um die Netzhaut-Halbkugel nach oben zu drehen, und drücken Sie das Gefäßsystem vorsichtig nach unten auf den Objektträger, und verwenden Sie dann das Haar, um das geöffnete Gefäßsystem auf die Mitte des Objektträgers zu heften. Das Gefäßsystem sollte beim Berühren am Objektträger kleben.
- Montieren Sie das Gefäßsystem flach, indem Sie das schüsselförmige Netzhautgefäß vom Sehnerv zur Peripherie bürsten.
- Wiederholen Sie das Zähneputzen in alle Richtungen, bis das Gefäßsystem vollständig am Objektträger klebt.
- Trocknen Sie das Netzhautgefäßsystem an der Luft.
- Sobald das gesamte Netzhautgefäßsystem am Objektträger befestigt ist, nehmen Sie den Objektträger aus dem Wasser, indem Sie entweder eine Kante vorsichtig anheben oder das Wasser langsam an der Ecke der Kassette ablassen, um Strömungen zu minimieren, und ihn dann herausziehen (Abbildung 2I).
HINWEIS: Das Gefäßsystem wird gut sichtbar, sobald es an der Luft getrocknet ist (Abbildung 2J). - Markieren Sie den Umfang des Netzhautgefäßsystems auf der Rückseite des Objektträgers mit einem Filzstift.
- Fahren Sie mit der Färbung der Probe ohne Pause fort.
- Sobald das gesamte Netzhautgefäßsystem am Objektträger befestigt ist, nehmen Sie den Objektträger aus dem Wasser, indem Sie entweder eine Kante vorsichtig anheben oder das Wasser langsam an der Ecke der Kassette ablassen, um Strömungen zu minimieren, und ihn dann herausziehen (Abbildung 2I).
5. Todeserkennung mit TUNEL-Färbung
HINWEIS: Einzelheiten zu diesem Verfahren finden Sie bei Zheng et al.21. Repräsentative Bilder von Ischämie +/- ox-Stress-induzierten apoptotischen Körpern in isolierten Netzhautgefäßen sind in Abbildung 3 dargestellt.
- Rehydrieren Sie das isolierte Gefäßsystem mit PBS. Spülen Sie es 3 Mal in PBS und inkubieren Sie dann mit 1% Triton X-100 in PBS für 2 Minuten auf Eis, um das isolierte Gefäßsystem zu permeabilisieren.
- Spülen Sie die Objektträger zweimal mit PBS ab, um die Reste von Triton X-100 zu entfernen. Trocknen Sie den Bereich um die Probe herum.
- 50 μl TUNEL-Reaktionsmischung (siehe Materialtabelle) auf die Probe geben. Inkubieren Sie den Objektträger in einer befeuchteten Atmosphäre für 60 min bei 37 °C im Dunkeln.
- Spülen Sie den Objektträger 3 Mal mit PBS, um die TUNEL-Reaktionsmischung zu entfernen. Trocknen Sie den Bereich um die Probe herum.
- Fügen Sie einen Tropfen DAPI-Eindeckmedium hinzu, um die Kerne mit DAPI zu färben, und montieren Sie die Probe mit einem Deckglas. Bei 4 °C im Dunkeln lagern.
HINWEIS: Das Protokoll kann bis zu 1 Woche lang pausiert werden, bevor Bilder aufgenommen werden. - Fotografieren Sie das resultierende Gefäßsystem mit einem konfokalen Fluoreszenzmikroskop (siehe Materialtabelle). Erfassen Sie sechs bis acht zufällig ausgewählte Felder in der äußersten Peripherie, die den Sehnerv umgibt (Abbildung 4).
HINWEIS: Repräsentative Bilder von Zytokin-induzierten apoptotischen Körpern in isolierten Netzhautgefäßen sind in Abbildung 5 dargestellt. - Analysieren Sie die Ergebnisse.
- Für ex vivo, TBH-behandelte Proben führen Sie die folgenden Schritte durch.
- Zählen Sie die Anzahl der apoptotischen Körper (TUNEL/DAPI-Doppel-positive Spezies) in jedem Feld mit Bild J (siehe Materialtabelle). Zähle den Mittelwert der apoptotischen Körper in allen Feldern einer einzelnen Stichprobe.
- Berechnen Sie die Faltungsänderung der Anzahl der apoptotischen Körper zwischen einem zufällig ausgewählten Paar von Nicht-DM- und DM-Proben.
- Ermitteln Sie, ob es einen statistisch signifikanten Unterschied gibt, indem Sie den zweiseitigen Schüler-t-Test18 verwenden.
HINWEIS: Färben Sie die Kontroll- und Versuchsproben (Nicht-DM und DM) bei der gleichen Gelegenheit, da das Ausmaß der TUNEL-Färbung variieren kann, selbst wenn sie auf die gleiche Weise durchgeführt wird. Da bis zu 10 Netzhäute pro Tag von einem erfahrenen Benutzer gereinigt und montiert werden können, sollten Sie die gleiche Anzahl von Kontroll- und experimentellen Netzhäuten verarbeiten, bevor Sie mit diesem Protokoll beginnen.
- Für in vivo mit Zytokin-Cocktails behandelte Proben führen Sie die folgenden Schritte aus.
- Zählen Sie manuell die Anzahl der apoptotischen Körper (TUNEL/DAPI-Doppel-positive Spezies) im gesamten retinalen Gefäßsystem.
- Berechnen Sie die Faltungsänderung der Anzahl der apoptotischen Körper zwischen einem zufällig ausgewählten Paar von Nicht-DM- und DM-Proben.
- Ermitteln Sie, ob es einen statistisch signifikanten Unterschied gibt, indem Sie den zweiseitigen Schüler-t-Test verwenden.
- Für ex vivo, TBH-behandelte Proben führen Sie die folgenden Schritte durch.
Ergebnisse
Die erfolgreiche Isolierung des retinalen Gefäßsystems führt zu einer flachen Aufnahme des gesamten Netzwerks des retinalen Gefäßsystems der Maus, wobei die architektonische Integrität intakt bleibt (Abbildung 2J). Bei der Färbung mit Periodsäure-Schiff-Hämatoxylin (PASH) lassen sich die beiden Gefäßzelltypen unterscheiden: Endothelzellen (ECs) und Perizyten (PCs) (Abbildung 6). Die Endothelzellkerne sind länglich, leicht gefärbt und befinden sich vollständig innerhalb der Gefäßwände. Perizytenkerne sind kreisförmig, dicht gefärbt und ragen aus den Kapillarwänden heraus. Die PASH-gefärbten Proben zeigen auch azelluläre Kapillaren, denen Zellkerne fehlen.
Der Ansatz, den Tod herbeizuführen, wurde von der folgenden Logik geleitet. Es wurde spekuliert, dass der Schutz begrenzt sei, d.h. von einer sehr starken, todbringenden Beleidigung überwältigt werden könnte. Folglich wurden die Insulte (sowohl Ischämie/oxidativer Stress als auch Zytokine18) so optimiert, dass sie einen leicht nachweisbaren, aber dennoch submaximalen Anstieg der Todesfälle induzieren (Abbildung 3 und Abbildung 5).
Es ist wichtig hervorzuheben, dass das Vorhandensein von TUNEL-positiven Kernen von der spezifischen Art der Insult abhing, die verwendet wurde, um den Zelltod auszulösen. Der Ischämie-/oxidative Stress-Insult führte zu einem Tram-Track-Muster der Zellapoptose, wie in Abbildung 3 dargestellt, während der Zytokin-Insult zu einem deutlichen und gut definierten Muster führte, wie in Abbildung 5 dargestellt. Beide Muster können in retinalen Gefäßen von DR-Patienten beobachtetwerden 22, was darauf hindeutet, dass beide Arten von Wirkstoffen beim Menschen den Zelltod induzieren. Darüber hinaus bieten die beobachteten morphologischen Unterschiede eine Möglichkeit, um zu beurteilen, ob die Pathologie durch oxidativen Stress oder Zytokine ausgelöst wurde.
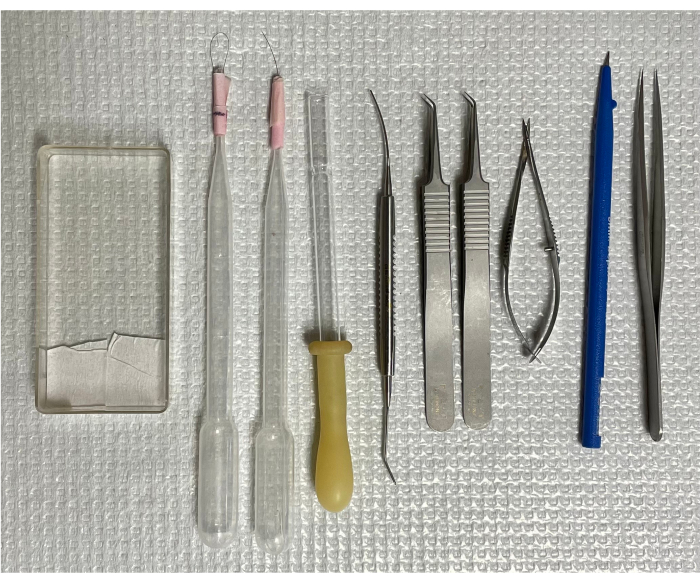
Abbildung 1: Werkzeuge zur Isolierung des retinalen Gefäßsystems der Maus. Von links nach rechts: die Montagekassette, zwei Einhaarbürsten, eine invertierte Transferpipette, ein Mikrospatel, zwei gebogene Pinzetten, eine Federschere, ein Mikromesser und eine Pinzette mit geraden Spitzen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schematische Darstellung der wichtigsten Schritte der Verabreichung einer todesbringenden Beleidigung und der anschließenden Isolierung des Netzhautgefäßsystems von einem Mausauge. (A) Induktion von Ischämie/oxidativer Schädigung, ex vivo. Nach der Enukleation wird der Augapfel in Gegenwart von TBH einer Ischämie ausgesetzt. (B) In-vivo-Verabreichung (intravitreale Injektion) von Zytokinen. (C) Schneiden des Augapfels in zwei Hälften. (D) Enzymverdauung der Netzhaut: Entfernung der Sklera und Waschen der Netzhaut in doppelt destilliertem Wasser über Nacht. Inkubation in YL-Trypsinlösung bei 37 °C für 4 h 15 min in einer Vertiefung einer 24-Well-Platte. (E) Entfernen der Photorezeptoren. (F) Entfernung des verbleibenden Neural- und Gliagewebes. (G) Gereinigtes schalenförmiges Gefäßnetz mit Blick nach oben. (H) Isoliertes Gefäßnetz in einer 35-mm-Schale mit schwarzem Hintergrund auf dem Tisch eines Präpariermikroskops. (I) Flach montiertes Netzhautgefäßsystem auf einem Objektträger. (J) Luftgetrocknetes Netzhautgefäßsystem auf einem Objektträger. Diese Abbildung wurde von Li et al.18 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
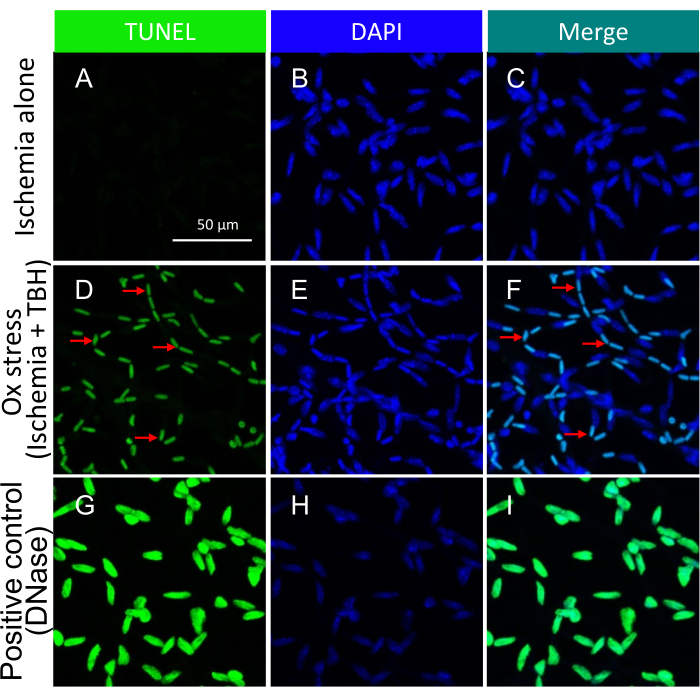
Abbildung 3: Nachweis von apoptotischen Körpern in retinalen Gefäßen der Maus, die ex vivo mit Ischämie +/- TBH behandelt wurden. Repräsentative Bilder von Ischämie +/- ox-Stress-induzierten apoptotischen Körpern in isolierten retinalen Gefäßen. Die Überschrift jeder Spalte gibt die Färbung an. (A-C) Netzhautgefäße, die aus Augäpfeln isoliert wurden, die nur 1 Stunde Ischämie durchgemacht haben. (D-F) Identisch mit (A-C), mit dem Unterschied, dass der 1-stündige Insult eine Kombination aus Ischämie und oxidativem Stress (5 mM TBH) war. Die roten Pfeile zeigen auf repräsentative TUNEL/DAPI-Doppel-positive Spezies. (G-I) Die Positivkontrolle wurde mit DNase behandelt. Maßstabsbalken = 50 μm. Diese Abbildung wurde von Li et al.18 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Illustration der Feldauswahl zur Quantifizierung der Ergebnisse. Ein 5 x 5 Kachelscan des retinalen Gefäßsystems mit der Verschmelzung von TUNEL- und DAPI-Signal. Die Auswahl von sechs bis acht Feldern in der äußersten Peripherie, die den Sehnerv umgibt, ist mit roten Quadraten dargestellt. Vergrößerung, 200x. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
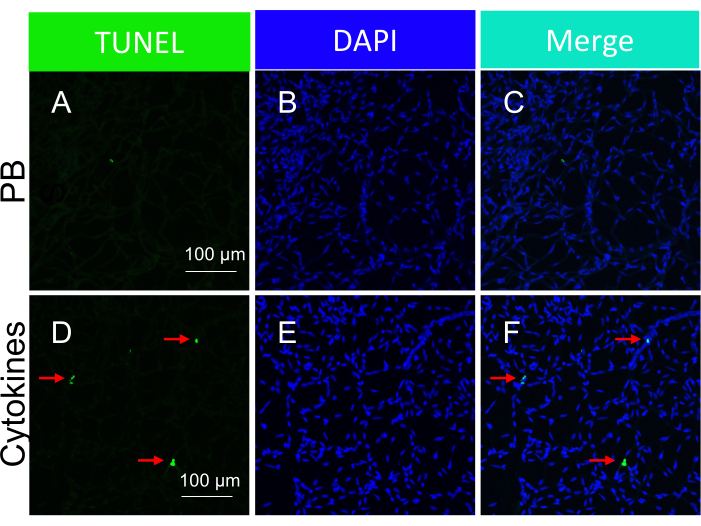
Abbildung 5: Nachweis der apoptotischen Körper in den Netzhautgefäßen der Maus als Reaktion auf die intravitreale Injektion von Zytokinen (in vivo Verabreichung). Repräsentative Bilder von Zytokin-induzierten apoptotischen Körpern in isolierten Netzhautgefäßen. Die Überschrift jeder Spalte gibt die Färbung an. (A-C) Bilder der Netzhautgefäße, die von Mäusen isoliert wurden, denen PBS intravitreal injiziert wurde. (D-F) Identisch mit (A-C), mit der Ausnahme, dass ein Zytokincocktail zusammen mit PBS injiziert wurde. Die roten Pfeile zeigen auf repräsentative TUNEL-positive Arten. Maßstabsbalken = 100 μm. Diese Abbildung wurde von Li et al.18 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
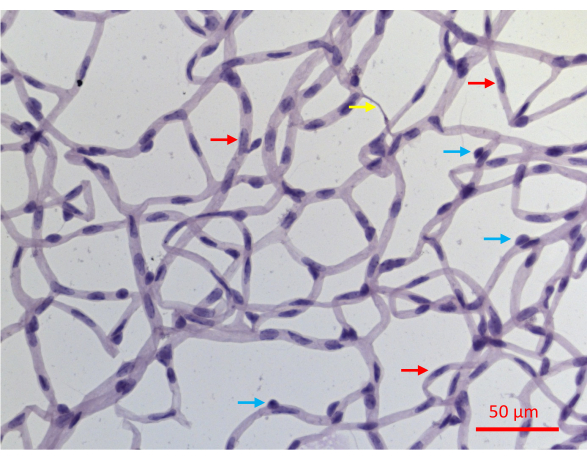
Abbildung 6: Repräsentatives Bild eines PASH-gefärbten Netzhautgefäßes. Die Netzhautgefäße einer Maus, die 20 Wochen lang STZ-induzierte DM erlitten hatte, wurden wie in Abbildung 2 beschrieben isoliert, mit PASH gefärbt und bei Beleuchtung mit sichtbarem Licht abgebildet. Perizytenkerne in Kapillaren sind tendenziell kreisförmiger und dichter gefärbt (blaue Pfeile), während längliche und weniger dicht gefärbte Kerne diagnostisch für Endothelzellen sind (rote Pfeile). Der gelbe Pfeil zeigt auf eine azelluläre Kapillare. Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Studie wurde ein Assay etabliert, um die Resistenz/Anfälligkeit des retinalen Gefäßsystems für den Tod zu erkennen, die durch DM/DR-bezogene Insulte wie Ischämie/oxidativen Stress und Zytokine induziert werden. Dieses Manuskript enthält eine detaillierte Beschreibung dieses Assays, der eine Modifikation mehrerer veröffentlichter Protokolledarstellt 19,20,21.
Das Protokoll umfasst mehrere entscheidende Phasen. Zunächst ist es unerlässlich, die Netzhaut sorgfältig zu präparieren, um den Erhalt des Gefäßnetzes zu gewährleisten und erhebliche Risse zu vermeiden. Dies kann erreicht werden, indem ein Schnitt 2-3 mm hinter dem Limbus gemacht wird, da die Netzhaut fest an der Ora serrata haftet und es schwierig ist, sie zu trennen. Zweitens beschichten Sie alle Instrumente, die mit den Gefäßen in Berührung kommen (z. B. Einzelhaarbürsten, Transferpipette und Pinzette), mit Trypsin, indem Sie diese Werkzeuge während des gesamten Eingriffs in die YL-Trypsinlösung tauchen. Dadurch wird verhindert, dass das Gefäßsystem an den Instrumenten haftet, die in diesem Protokoll verwendet werden. Drittens, da das Mikrogefäßsystem unter normalem Licht nahezu unsichtbar ist, ist bei der Absaugung von Trümmern und der Übertragung auf den Objektträger erhöhte Wachsamkeit erforderlich, um einen versehentlichen Verlust zu verhindern.
Ein angemessenes Maß an enzymatischer Verdauung der verschiedenen Schichten der Netzhaut ist entscheidend; Eine unzureichende Verdauung verhindert die Trennung von neuronalem Gewebe vom Gefäßnetzwerk, während eine übermäßige Verdauung den Gefäßplexus auflöst. Es wurden verschiedene Verdauungszeiten von 1 h19 bis 23 über Nacht berichtet. Basierend auf Beobachtungen liefert eine Aufschlusszeit von 4 h und 15 min die günstigsten Ergebnisse im Vergleich zu Dauern von 2 h, 3 h und 4 h. Es ist unwahrscheinlich, dass eine Verlängerung der Verdauung über diesen Punkt hinaus den Prozess verbessert und stattdessen die Integrität des Gefäßsystems beeinträchtigen könnte.
In Fällen, in denen die verdaute Netzhaut an der Einzelhaarbürste haftet, tauchen Sie das Haar mehrmals in YL-Trypsinlösung. Dadurch werden die klebrigen Stellen der Bürste reduziert. Wenn die Haarbürste noch am Gefäßgewebe haftet, untersuchen Sie sie auf Glaskörperreste und entfernen Sie diese mit einer Pinzette.
Der optimale Zeitpunkt für eine vollständige Glaskörperentfernung ist nach der Beseitigung der Photorezeptoren, aber vor der Entfernung des verbleibenden Neural- und Gliagewebes. Die Netzhaut behält die Steifigkeit bei, bis die Photorezeptoren entfernt werden. Die Entnahme des Glaskörpers in diesem Stadium könnte möglicherweise die Netzhaut/das Gefäßsystem reißen. Die empfindlichen Schichten des verbliebenen Nerven- und Gliagewebes spielen eine entscheidende Rolle bei der Erhaltung der gekrümmten Form der Gefäßstruktur. Sie verhindern, dass die Netzhaut in ihrer Mitte reißt, wenn sich der Glaskörper vom Sehnerv löst.
Wenn das isolierte Gefäßsystem überhaupt nicht am Objektträger haftet, weist dies darauf hin, dass der Abschnitt des Objektträgers, in dem eine Adhäsion erwartet wird, verschmutzt ist. Versuchen Sie, die Gefäße über die Oberfläche der Folie zu bewegen, um eine klebrige Stelle zu finden, wechseln Sie zu einer anderen Folie oder reinigen Sie die Folie sorgfältig und versuchen Sie es erneut. Wenn die Gefäße an der Rutsche kleben, bevor sie sich in ihre schüsselartige Form entfalten, heben Sie das Gefäßsystem von der Rutsche an, um es wieder frei im Wasser schwimmen zu lassen. Führen Sie diesen Schritt mit einer Pinzette durch, die wiederholt in die YL-Trypsin-Lösung getaucht wurde.
Es wurde über mehrere alternative Techniken zur Isolierung des Gefäßsystems berichtet, die für den hierin beschriebenen Schutzassay nicht geeignet wären. Zum Beispiel wurde die osmotische Lyse eingesetzt, um das Gefäßsystem aus nicht fixierten Netzhautproben zu isolieren, was biochemische Untersuchungen des Gewebes erleichtert 24,25. Es kann jedoch sein, dass dieses Verfahren die Anatomie des Gefäßsystems nicht so gut bewahrt wie der in diesem Artikel verwendete Ansatz. In ähnlicher Weise ermöglicht das Gewebedruckverfahren zur Isolierung großer Segmente von Mikrogefäßen zwar eine Analyse der elektrotonischen Architektur des Gefäßsystems26, aber das gesamte Gefäßbett wird typischerweise nicht wiederhergestellt.
Dieser Assay wurde entwickelt, weil bestehende Ansätze zur Überwachung der Kapillardegeneration das Problem des Schutzes nicht berücksichtigen. Die Kapillardegeneration, die nach längerer DM auftritt, zeigt an, ob sich eine DR entwickelt hat. Neben der Diagnose einer DR ist dieses Ergebnis nützlich, um zu beurteilen, ob ein Wirkstoff/eine Therapie eine DR verhindert. Bestehende Kapillardegenerations-Assays sagen jedoch nichts über den zugrundeliegenden Wirkmechanismus des Wirkstoffs aus. Ein solches Mittel kann pathologische Ereignisse verhindern, die DR antreiben, wie z. B. erhöhter oxidativer Stress oder Zytokine. Alternativ kann das Mittel den Schutz erzwingen, indem es die Widerstandsfähigkeit gegenüber oxidativem Stress und Zytokinen erhöht und/oder die Reparatur von Schäden fördert. Dieser neue Schutzassay kann verwendet werden, um festzustellen, ob die positive Wirkung einer bestimmten Therapie darin besteht, das endogene System zu verstärken, das vor DM-bedingtem Tod schützt.
Ein Nachteil dieses Schutzassays besteht darin, dass er die beiden Zelltypen innerhalb der Netzhautgefäße nicht unterscheidet: Endothelzellen (ECs) und Perizyten (PCs). Während das Erscheinungsbild ihrer Zellkerne in PASH-gefärbten Schnitten zelltypspezifisch ist (Abbildung 6), weist nicht jeder Zellkern diagnostische Merkmale auf. Etwa 30% der Zellkerne können nicht eindeutig als EC oder PC definiert werden, zumindest teilweise, da die zweidimensionalen Bilder aus PASH-gefärbten Proben die dreidimensionale Struktur des Gefäßgeflechts nur unvollständig auflösen. Dieses Hindernis konnte durch zusätzliche Analysen wie die Immunfluoreszenzfärbung mit zelltypspezifischen Markern überwunden werden. Solche Bilder, die die beiden Zelltypen unterscheiden, könnten mit TUNEL kogefärbt werden, um die Resistenz/Vulnerabilität jedes der vaskulären Zelltypen zu bestimmen.
Dieser gefäßfokussierte Assay liefert keine Informationen über die neurale Netzhaut. Zusätzliche Assays könnten entwickelt werden, um solche Informationen zu liefern. Anstatt beispielsweise das retinale Gefäßsystem zu isolieren, könnte eine einzelne Zellsuspension der gesamten Netzhaut erzeugt und dann (durch fluoreszierende aktivierte Zellsortierung) auf Resistenz/Vulnerabilität analysiert werden. Die Einbeziehung von zelltypspezifischen Markern (sowohl neuronal als auch vaskulär) zusammen mit Indikatoren für den Zelltod würde ein vollständigeres Bild der Netzhautzelltypen liefern, die die Fähigkeit haben, vor DM/DR-vermitteltem Tod zu schützen.
Zusammenfassend lässt sich sagen, dass der hier beschriebene Schutzassay einen leistungsstarken Ansatz zur Untersuchung des Mechanismus bietet, der für die Verzögerung zwischen dem Auftreten von DM und der Manifestation von DR bei Mäusen verantwortlich ist.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu melden.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der Illinois Society to Prevent Blindness, des National Institute of Health (EY031350 and EY001792) und eines uneingeschränkten Zuschusses der Research to Prevent Blindness Foundation unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
Referenzen
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten