需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
呼吸肌表面肌电图的采集和半自动分析
摘要
在这里,我们描述了一种记录和分析呼吸肌电图 (EMG) 信号的协议。它包括将 EMG 电极放置在几根呼吸肌上、去除 EMG 信号中的心电图噪声以及获取 EMG 均方根 (RMS) 和活动开始时间的解剖参考。
摘要
由于当前方法(如功能磁共振成像 (fMRI))的突兀性和不切实际性,评估呼吸驱动带来了挑战。肌电图 (EMG) 提供了肌肉呼吸驱动的替代测量方法,可以确定肌肉激活的幅度和时间。幅度反映了肌肉激活的水平,而时间表示肌肉活动相对于特定事件(例如吸气流动和其他肌肉的激活)的开始和偏移。这些指标对于理解呼吸协调和控制至关重要,尤其是在不同负荷或存在呼吸病理生理学的情况下。本研究概述了一种获取和分析健康成人和呼吸健康状况患者的呼吸肌 EMG 信号的方案。这些研究获得了伦理批准,包括参与者准备、电极放置、信号采集、预处理和后处理。关键步骤包括清洁皮肤、通过触诊和超声定位肌肉,以及使用电极以尽量减少心电图 (ECG) 污染。以高采样率和增益采集数据,并同步心电图和呼吸血流记录。预处理包括过滤和转换 EMG 信号,而后处理涉及计算相对于吸气流的起始和偏移差异。来自执行增量吸气阈值负荷 (ITL) 的健康男性参与者的代表性数据说明了该方案的应用。结果显示,在较高负荷下,膈外肌的激活较早且持续时间延长,与 EMG 幅度增加相关。该协议有助于对呼吸肌激活进行详细评估,提供对正常和病理生理运动控制策略的见解。
引言
由于功能性磁共振成像 (fMRI) 等评估方法的突兀性,通常不切实际,因此呼吸驱动 (即呼吸中枢向呼吸肌的输出) 很难评估。此外,位于脑干的呼吸中枢体积小,难以定位,并且对生理噪声的改变敏感 1,2。呼吸驱动的测量很重要,因为它们与重要的临床结局有关,例如呼吸困难,呼吸窘迫的迹象。肌电图 (EMG) 是呼吸肌呼吸驱动的替代物3。呼吸肌 EMG 允许通过 EMG 信号的均方根 (RMS) 来确定肌肉活动及其强度。此外,可以通过识别肌肉活动的开始和偏移量(分别为 EMG、起始和 EMG、偏移量)来评估肌肉激活的时间1,2,3,4,5,6,7,8,9,10,11。
肌电信号的幅度是指肌肉细胞收缩时产生的电位,表明它们的肌肉激活水平12。肌电信号的强度可能因肌肉收缩的强度、募集的运动单位数量、电极位置、肌肉和皮下组织的运动以及被测肌肉的具体特征等因素而异12。
肌电图信号的时间是指电活动相对于特定事件或动作(例如,相对于呼吸的吸气流)发生的时间13。开始时间表示肌肉激活何时开始,而偏移时间表示肌肉活动何时减少、停止或处于放松阶段13。几个呼吸肌激活的时间将有助于理解呼吸过程中的协调和控制机制。评估时间模式随时间或个体的一致性或可变性有助于确定与急性或慢性通气衰竭相关的生理和病理生理运动控制策略。
呼吸肌 EMG 的大小和时间都与重要的临床结果相关 12,13,14。隔膜在休息时产生大部分通气15。当呼吸需求增加时,例如在运动期间或与肺部疾病(例如,慢性阻塞性肺病、间质性肺病或急性呼吸窘迫综合征)相关的吸气负荷增加时,膈外呼吸肌会促进通气,这可以增加或抵消膈肌收缩需求15.因此,除了膈肌肌电图的幅度增加外,膈肌肌电图的幅度也会增加。
激活膈外呼吸肌可以保护膈肌免于疲劳16。然而,早期激活(发作)和延长激活与急性和慢性通气衰竭有关 14,17,18。这里的目的是描述一种协议,用于获取和分析健康成人和疑似或确诊呼吸病理生理学患者的呼吸肌 EMG 信号的时间和幅度。该协议包括先前验证的数据采集步骤,以量化 EMG 活动的时间和幅度13,19。
研究方案
采用该技术的研究已获得多伦多大学和位于加拿大多伦多的圣迈克尔医院以及比利时鲁汶的 Gasthuisberg 大学医院的伦理批准。此处描述了一种特定的协议。已经提出了关于呼吸肌的几种替代表面肌电图 (sEMG) 方法的一般讨论,并在其他地方报道12。
1. 参与者准备和放置 sEMG 电极
- 为确保足够的可视化,请男性不要穿衬衫,要求女性穿运动文胸或背心。使用前襟开口的病号服,以提供足够的通道并保持端庄。
- 如果参与者有长发,请将其扎在后面并固定在原位,以便评估斜角肌和胸锁乳突肌。
- 将参与者置于坐姿或半躺姿。
- 如果发现胸毛或颈毛过多,请剃掉用于 sEMG 电极放置的区域。
- 为了降低皮肤阻抗,清洁皮肤上的油脂和死皮。
- 方法是用酒精湿巾擦拭,并在使用电极之前让酒精蒸发(即风干)。
- 如果皮肤较浅,它可能会显得轻微发红,但更重要的是,确保在放置电极的地方没有明显的污垢、油脂或干燥的皮肤。但是,请避免过度摩擦,以防止皮肤损伤。避免将电极应用于破损的皮肤或其他皮肤损伤区域。
- 通过地标、触诊和/或超声波定位感兴趣的肌肉。
注意:超声可能有助于标记肋隔膜20。 图 1 显示了可以放置电极用于呼吸肌 sEMG 的位置示例。 - 将 sEMG 电极放置在胸部右侧,远离心脏,以降低 ECG 信号的振幅并最大限度地减少其污染。
- 沿肌肉纤维的纵向排列在肌肉腹部中心以 2 cm 的电极间距离应用成对的 EMG 电极。
- 对于肋隔膜/肋间肌,将腋前线和锁骨中线标记,并将成对的电极垂直放置在这两条线之间的第七或第八肋间隙的水平。
- 对于斜角肌,将颈部的后三角形标记出来,并将成对的电极沿肌肉的纵轴放置在环状突水平。
- 对于胸骨旁肋间肌,将第二肋间隙标记在胸骨右侧外侧 1-2 cm 处,并将成对的电极沿肌肉的纵轴放置。
- 对于胸锁乳突肌,标志是胸骨上切迹和乳突。通过将作者的手放在参与者下巴的左侧并要求参与者对着手轻轻进行等长左旋转,突出右胸锁乳突肌腹部。将成对的电极沿其纵轴放置在肌肉腹部的中点。
- 一些 EMG 系统可能需要地面传感器。如果需要,将地面传感器放置在靠近呼吸肌的骨骼结构上(例如,锁骨、C7 颈椎棘突)。
- 将 EMG 传感器夹连接到 EMG 电极上。确保来自两块不同肌肉的 EMG 传感器的电线(即使是无线的)不会重叠和污染或在两块肌肉之间提供串扰。
注意: 来自同一传感器的电线可以重叠,但来自两个不同传感器的电线不应重叠。 - 通过使用将传感器的下侧固定在皮肤上的双面胶带,进一步固定 EMG 电极和传感器。
- 在传感器顶部贴上医用级低过敏性胶带,以进一步将每个传感器固定在皮肤上。避免施加过大的压力,如上所述,确保来自不同传感器的电线不会重叠。
2. 信号采集
- 在数据采集软件上选择预设模板,然后按 可选 。该模板将具有以下预设参数:EMG 信号中的高通滤波器 (0.5-20 Hz),以减少低频伪影,促进实时可视化。
- 将 EMG 信号的采样率设置为至少 1 kHz。
- 将 EMG 信号的增益设置为 1000。
- 设置模板以获取 ECG 和呼吸流量的同步记录。
- 根据协议获取 sEMG 和 ECG 数据,例如,在机械通气患者的自主呼吸试验期间。
- 协议完成后,停止记录并保存数据文件。
注意: 图 2 显示了显示已应用过滤的软件屏幕截图。
3. 数据采集后的预处理
- 打开软件并确认用于分析 EMG 信号的参数(5 Hz 的双向高通滤波器、用于去除 ECG 污染的最小均方 (LMS) 自适应滤波器、移动窗口为 0.02 秒的均方根变换)并按 继续。
- 选择要分析的文件,然后按 OK。
- 定义要分析的时间间隔(如果要分析文件的总持续时间,它将从 0 秒到最大时间),按 Select the Range and Continue,然后按 Conditioning。
- 按下 Analyze(分析 )按钮以应用预先选择的参数(请参阅步骤 3.1)。可视化分析的 EMG 信号。在 1 按钮上按 Rescaled 显示 EMG 信号,在记录期间按其最大值进行归一化。
- 按 Continue to Calculate On Off 按钮。根据 EMG 信号的导数函数,它将检测 EMG 活动的开始时间。按 On 和 Off 按钮。
- 从需要可视化的肌肉中选择 EMG 信号。可视化可以在肌肉之间交替进行,以便目视检查所有记录的 EMG 信号。按 STOP Looking and Go To Saving 按钮。按 Saving (保存)。
- 选择要保存的数据。可以在保存之前减少信号(例如,从 1000Hz 到 100Hz)。按 Save Processed Data,选择要保存文件的计算机文件夹,并为其命名。按 Save 再次确认。
4. 后处理
- 使用提供计算功能的软件(例如 Excel、R、Phyton、Matlab)打开保存的文件。通过流量信号的开和关时间确定每次呼吸,并计算每次呼吸的 EMG 峰值 RMS 和 EMG 平均 RMS。
- 对于 EMG 起始,计算 EMG 起始和吸气流起始(INSP,起始)之间的绝对差异(以毫秒为单位):
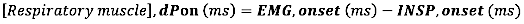
- 对于 EMG 偏移,计算 EMG 偏移与吸气流量结束 (INSP,offset) 之间的绝对差(以毫秒为单位)
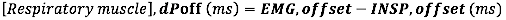
- 对于相对于吸气持续时间的 EMG 发作,计算 EMG 发作和 INSP,onset 之间的相对差异(相对于 Ti 的持续时间):

- 对于相对于吸气时间持续时间的 EMG 偏移,计算 EMG 偏移和 INSP,offset 之间的相对差异(相对于 Ti 的持续时间):

其中 dP 是 EMG,起始和吸气流量起点 (INSP,onset) 或 EMG,偏移和吸气流量偏移 (INSP,offset) 之间的时间差。
结果
数据为一名男性参与者(22 岁;体重:100 公斤;身高:185 厘米;BMI:29 kg/m2) 肺活量测定和吸气肌力量正常(FEV1:4.89 L/s [预测值的 97%];最大吸气压:151 cmH2O [预测值的 136%)]。他使用前面描述的方案 21,22,23 执行增量吸气阈值负荷 (ITL) 直至任务失败。图 1...
讨论
由于 EMG 信号的带宽谱重叠,从 EMG 信号中去除心脏活动伪影很复杂。大部分 EMG 频谱在 20 到 250 Hz 之间,而 ECG 频谱在 0 Hz 到 100 Hz 之间。对于某些分析(即时间),必须在没有 ECG 污染的情况下获得 EMG 信号,以实现 EMG 幅度和时间的准确性和可解释性。利用频率的最小均方 (LMS) 自适应滤波器是一种识别模式的算法。在这种情况下,该算法从组合的 ECG-EMG 信号中删除 EC...
披露声明
作者声明他们没有需要披露的利益冲突。
致谢
AR 得到了加拿大卫生研究院 (CIHR) 奖学金 (#187900) 的支持,UM 由 Mitacs (IT178-9 -FR101644) 资助。
材料
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
参考文献
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963 (2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483 (2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. a. T., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239 (2013).
- Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Neural offset time evaluation in surface respiratory signals during controlled respiration. 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2 (2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598 (2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522 (2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827 (2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885 (2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。