JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
호흡기 근육 표면 근전도의 수집 및 반자동 분석
요약
여기에서는 호흡기 근전도(EMG) 신호를 기록하고 분석하는 프로토콜에 대해 설명합니다. 여기에는 여러 호흡기 근육에 EMG 전극을 배치하고, EMG 신호에서 심전도 잡음을 제거하고, EMG RMS(Root Mean Square) 및 활동 시작 타이밍을 획득하기 위한 해부학적 참조가 포함됩니다.
초록
호흡 구동을 평가하는 것은 기능적 자기 공명 영상(fMRI)과 같은 현재 방법의 눈에 거슬리고 비현실성으로 인해 어려움을 겪습니다. 근전도(EMG)는 근육에 대한 호흡 구동의 대리 측정을 제공하여 근육 활성화의 크기와 시기를 모두 결정할 수 있습니다. 크기는 근육 활성화 수준을 반영하는 반면, 타이밍은 흡기 흐름 및 다른 근육의 활성화와 같은 특정 이벤트와 관련된 근육 활동의 시작과 오프셋을 나타냅니다. 이러한 지표는 특히 다양한 부하에서 또는 호흡기 병태생리학이 있는 경우 호흡 조정 및 조절을 이해하는 데 중요합니다. 이 연구는 건강한 성인과 호흡기 질환이 있는 환자의 호흡기 근육 EMG 신호를 획득하고 분석하기 위한 프로토콜을 설명합니다. 참가자 준비, 전극 배치, 신호 획득, 전처리 및 후처리를 포함하는 연구에 대한 윤리적 승인을 획득했습니다. 주요 단계에는 피부 세척, 촉진 및 초음파를 통한 근육 위치 파악, 심전도(ECG) 오염을 최소화하기 위한 전극 적용이 포함됩니다. 데이터는 동기화된 ECG 및 호흡량 기록과 함께 높은 샘플링 속도와 게인으로 획득됩니다. 전처리에는 EMG 신호 필터링 및 변환이 포함되며, 후처리에는 흡기 흐름에 대한 시작 및 오프셋 차이를 계산하는 작업이 포함됩니다. 증분 흡기 임계값 부하(ITL)를 수행하는 건강한 남성 참가자의 대표 데이터는 프로토콜의 적용을 보여줍니다. 결과는 더 높은 부하에서 횡격막 외 근육의 조기 활성화와 연장된 지속 시간을 보여주었으며, 이는 EMG 크기 증가와 상관관계가 있습니다. 이 프로토콜은 호흡 근육 활성화에 대한 자세한 평가를 용이하게 하여 정상 및 병태생리학적 운동 제어 전략에 대한 통찰력을 제공합니다.
서문
호흡 드라이브(즉, 호흡 중추에서 호흡 근육으로 출력되는 것)는 기능적 자기 공명 영상(fMRI)과 같은 평가 방법의 눈에 거슬리고 종종 비실용적이기 때문에 평가하기 어렵습니다. 더욱이, 뇌간에 위치한 호흡 중추의 크기가 작기 때문에 위치를 파악하기 어렵고 생리적 소음에 의한 변화에 민감합니다 1,2. 호흡 구동의 측정은 호흡 곤란의 징후인 호흡곤란과 같은 중요한 임상 결과와 관련이 있기 때문에 중요합니다. 근전도검사(EMG)는 호흡 근육에 대한 호흡 욕구를 대신하는 것입니다3. 호흡기 근육 EMG를 사용하면 EMG 신호의 RMS(Root Mean Square)를 통해 근육 활동과 강도를 결정할 수 있습니다. 또한, 근육 활성화의 타이밍은 근육 활동의 시작과 상쇄(각각 EMG, 발병 및 EMG, 상쇄)를 식별하여 평가할 수 있습니다1,2,3,4,5,6,7,8,9,10,11.
근전도 신호의 크기는 근육 세포가 수축할 때 생성되는 전위를 말하며, 근육 활성화 수준을 나타냅니다12. 근전도 신호의 크기는 근육 수축의 강도, 동원된 운동 단위의 수, 전극 배치, 근육 및 피하 조직의 움직임, 측정되는 근육의 특정 특성과 같은 요인에 따라 달라질 수 있습니다12.
근전도 신호의 타이밍은 특정 이벤트 또는 동작과 관련하여 전기적 활동이 발생하는 시점을 나타냅니다(예: 호흡을 위한 흡기 흐름과 관련하여)13. 시작 타이밍은 근육 활성화가 시작되는 시점을 나타내고, 오프셋 타이밍은 근육 활동이 감소하거나 중단되거나 이완 단계13에 있을 때를 나타냅니다. 여러 호흡 근육의 활성화 중 타이밍은 호흡 중 조정 및 제어 메커니즘에 대한 이해를 용이하게 합니다. 시간이 지남에 따라 또는 개인에서 타이밍 패턴의 일관성 또는 변동성을 평가하면 급성 또는 만성 인공호흡 장애와 관련된 생리학적 및 병태생리학적 운동 제어 전략을 식별하는 데 도움이 될 수 있습니다.
호흡기 근육 근전도의 크기와 시기는 모두 중요한 임상 결과와 관련이 있습니다 12,13,14. 다이어프램은 휴식 시 대부분의 환기를 생성합니다(15). 운동 중 또는 폐 질환(예: 만성 폐쇄성 폐질환, 간질성 폐질환 또는 급성 호흡곤란 증후군)과 관련된 흡기 부하 증가와 같이 호흡 수요가 증가할 때, 횡격막외 호흡 근육은 환기를 촉진하여 횡격막 수축 요구 사항을 증가시키거나 상쇄할 수 있다15. 따라서 횡격막 EMG의 크기가 증가하는 것 외에도 횡격막 외 근육 EMG의 크기도 증가할 것입니다.
횡격막 외 호흡 근육의 활성화는 횡격막의 피로 발달을 방지할 수 있다16. 그러나 조기 활성화(발병) 및 장기간의 활성화는 급성 및 만성 환기 장애와 관련이 있었다 14,17,18. 여기서의 목적은 건강한 성인과 호흡기 병태생리가 의심되거나 확인된 환자 모두에서 호흡기 근육 EMG 신호의 타이밍과 크기를 모두 획득하고 분석하기 위한 프로토콜을 설명하는 것입니다. 이 프로토콜에는 EMG 활동의 타이밍과 크기를 정량화하기 위해 데이터 수집에서 이전에 검증된 단계가 포함되어 있습니다13,19.
프로토콜
이 기술을 사용하는 연구는 토론토 대학과 캐나다 토론토에 위치한 성 미카엘 병원, 벨기에 루벤의 가스트하위스베르크 대학병원에서 윤리적 승인을 받았습니다. 여기에는 하나의 특정 프로토콜이 설명되어 있습니다. 호흡기 근육에 대한 몇 가지 대안적인 표면 근전도(sEMG) 접근법에 대한 일반적인 논의가 제안되었으며 다른 곳에서도 보고되었습니다12.
1. 참가자의 sEMG 전극 준비 및 배치
- 적절한 시각화를 위해 남성은 셔츠를 입지 말고, 여성은 스포츠 브라 또는 싱글릿을 입도록 요청합니다. 앞면이 열리는 병원 가운을 사용하여 적절한 접근을 제공하고 단정함을 유지하십시오.
- 참가자가 긴 머리를 가지고 있는 경우 뒤로 묶고 제자리에서 핀으로 고정하여 비늘과 흉쇄유돌을 평가할 수 있습니다.
- 참가자를 앉거나 반쯤 누운 자세로 배치합니다.
- 가슴이나 목에 여분의 털이 발견되면 sEMG를 위한 전극 배치 부위를 면도합니다.
- 피부 임피던스를 줄이려면 피부의 유분과 각질을 청소하십시오.
- 알코올 천으로 문지르고 전극을 적용하기 전에 알코올이 증발(즉, 공기 건조)되도록 하여 이 작업을 수행합니다.
- 피부가 밝으면 약간 붉게 보일 수 있지만 더 중요한 것은 전극이 배치될 위치에 눈에 띄는 먼지, 기름 또는 건조한 피부가 보이지 않도록 하는 것입니다. 그러나 피부 손상을 방지하기 위해 과도하게 문지르는 것은 피하십시오. 갈라진 피부나 다른 피부 병변 부위에 전극을 붙이지 마십시오.
- 랜드마크, 촉진 및/또는 초음파를 통해 관심 있는 근육을 찾습니다.
알림: 초음파는 늑골 횡격막20을 landmarking하는 데 유용할 수 있습니다. 그림 1 은 호흡 근육의 sEMG를 위해 전극을 배치할 수 있는 위치의 예를 보여줍니다. - sEMG 전극을 심장에서 더 멀리 떨어진 흉부 오른쪽에 배치하여 ECG 신호의 진폭을 줄이고 오염을 최소화합니다.
- 근육 섬유의 세로 정렬을 따라 근육 배 중앙에 2cm 전극 간 거리를 두고 쌍을 이루는 EMG 전극을 적용합니다.
- 늑골 횡격막/늑간선의 경우, 앞쪽 겨드랑이 라인과 중간 쇄골 라인을 랜드마크로 표시하고 7번째 또는 8번째 늑간 공간 수준에서 이 두 라인 사이에 쌍을 이루는 전극을 수직으로 배치합니다.
- scalene의 경우, 목의 후방 삼각형을 랜드마크로 표시하고 cricoid process 수준에서 근육의 세로 축을 따라 쌍을 이루는 전극을 배치합니다.
- 흉골 주위 늑간(parasternal intercostals)의 경우, 흉골 오른쪽 옆으로 1-2cm 떨어진 두 번째 늑간 공간을 landmark하고 근육의 세로축을 따라 쌍을 이룬 전극을 배치합니다.
- sternocleidomastoid의 경우, suprasternal notch 및 mastoid process를 landmark합니다. 작업자의 손을 참가자의 턱 왼쪽에 놓고 참가자에게 손에 대해 등척성 왼쪽 회전을 부드럽게 수행하도록 요청하여 오른쪽 흉쇄유돌근 배를 강조합니다. 한 쌍의 전극을 세로축을 따라 근육 배의 중간 지점에 놓습니다.
- 일부 EMG 시스템에는 접지 센서가 필요할 수 있습니다. 필요한 경우 지면 센서를 호흡 근육에 가까운 뼈 구조(예: 쇄골, C7 경추돌기)에 놓습니다.
- EMG 전극에 EMG 센서 클립을 부착합니다. 두 개의 서로 다른 근육(무선일지라도)의 EMG 센서의 전선이 겹치거나 두 근육 사이에 혼선을 일으키거나 오염되지 않도록 하십시오.
알림: 동일한 센서의 전선은 겹칠 수 있지만 두 개의 다른 센서의 전선은 겹칠 수 없습니다. - 센서 밑면을 피부에 고정하는 양면 테이프를 사용하여 EMG 전극과 센서를 추가로 고정합니다.
- 센서 상단에 의료용 저자극성 테이프를 붙여 각 센서를 피부에 더욱 단단히 고정합니다. 과도한 압력을 가하지 말고 위에서 언급했듯이 다른 센서의 전선이 겹치지 않도록 하십시오.
2. 신호 수집
- 데이터 수집 소프트웨어에서 사전 설정된 템플릿을 선택하고 Open을 누릅니다. 템플릿에는 다음과 같은 사전 설정된 매개변수가 있습니다: EMG 신호의 고역 통과 필터(0.5-20Hz)는 저주파 아티팩트를 줄여 실시간 시각화를 용이하게 합니다.
- 최소 1kHz의 EMG 신호의 샘플링 속도를 설정합니다.
- EMG 신호의 게인을 1000으로 설정합니다.
- ECG 및 호흡 흐름의 동기화된 기록을 획득하도록 템플릿을 설정합니다.
- 프로토콜에 따라(예: 기계 환기 환자의 자발적 호흡 시험 중) sEMG 및 ECG 데이터를 수집합니다.
- 프로토콜이 완료되면 녹음을 중지하고 데이터 파일을 저장합니다.
참고: 그림 2 는 적용된 필터링을 보여주는 소프트웨어의 스크린샷을 보여줍니다.
3. 데이터 수집 후 전처리
- 소프트웨어를 열고 근전도 신호 분석에 사용할 매개변수(5Hz의 양방향 고역 통과 필터, ECG 오염을 제거하기 위한 LMS(Least Mean Square) 적응형 필터, 0.02초 동안 이동 창으로 평균 제곱근 변환)을 확인하고 Continue를 누릅니다.
- 분석할 파일을 선택하고 확인을 누릅니다.
- 분석할 시간 간격을 정의하고(파일의 총 지속 시간이 분석되는 경우 0초에서 최대 시간까지) Select the Range(범위 선택) 및 Continue(계속)를 누른 다음 Conditioning(컨디셔닝)을 누릅니다.
- 분석 버튼을 눌러 미리 선택된 매개변수를 적용합니다(3.1단계 참조). 분석된 근전도 신호를 시각화합니다. Rescaled on 1 버튼을 누르면 기록된 기간 동안 최대값으로 정규화된 EMG 신호가 표시됩니다.
- Continue to Calculate On Off 버튼을 누릅니다. EMG 신호의 미분 함수를 기반으로 EMG 활동의 시작 타이밍을 감지합니다. 켜기 및 끄기 버튼을 누릅니다.
- 시각화해야 하는 근육에서 EMG 신호를 선택합니다. 시각화는 기록된 모든 EMG 신호의 육안 검사를 허용하기 위해 근육 간에 번갈아 가며 수행할 수 있습니다. STOP Looking and Go To Saving 버튼을 누릅니다. 저장을 누릅니다.
- 저장할 데이터를 선택합니다. 저장하기 전에 신호를 줄일 수 있습니다(예: 1000Hz에서 100Hz로). Save Processed Data를 누르고, 파일을 저장할 컴퓨터 폴더를 선택하고, 이름을 지정합니다. 저장을 다시 눌러 확인합니다.
4. 후처리
- 계산을 계산하는 기능을 제공하는 소프트웨어(예: Excel, R, Phyton, Matlab)를 사용하여 저장된 파일을 엽니다. 흐름 신호의 켜짐 및 꺼짐 시간으로 각 호흡을 결정하고 각 호흡에 대한 EMG 피크 RMS와 EMG 평균 RMS를 계산합니다.
- EMG 시작의 경우 EMG 시작과 흡기 흐름 시작(INSP, 시작) 사이의 절대 차이(밀리초)를 계산합니다.
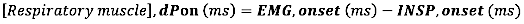
- EMG 오프셋의 경우 EMG 오프셋과 흡기 흐름 끝(INSP,offset) 사이의 절대 차이(밀리초)를 계산합니다.
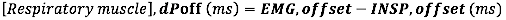
- 흡기 시간 지속 시간과 관련된 EMG 발병의 경우 EMG 발병과 INSP,발병 사이의 상대적 차이(Ti 지속 시간)를 계산합니다.

- 흡기 시간 지속 시간에 상대적인 EMG 오프셋의 경우 EMG 오프셋과 INSP,offset 사이의 상대적 차이(Ti 지속 시간)를 계산합니다.

여기서 dP는 EMG, 시작 및 흡기 흐름 시작(INSP, 시작) 또는 EMG, 오프셋과 흡기 흐름 오프셋(INSP, 오프셋) 사이의 시간 차이입니다.)
결과
데이터는 남성 참가자(22세, 체중: 100kg, 신장: 185cm; BMI: 29 kg/m2) 정상 폐활량 측정 및 흡기 근력 (FEV1: 4.89 L/s [예측의 97%]; 최대 흡기압: 151 cmH2O [예측의 136%]). 그는 앞서 설명한 프로토콜 21,22,23을 사용하여 작업 실패까지 증분 흡기 임계값 로딩(ITL)을 수행했습니다. 데이터 수집 시...
토론
EMG 신호에서 심장 활동 아티팩트를 제거하는 것은 대역폭 스펙트럼이 겹치기 때문에 복잡합니다. EMG 주파수 스펙트럼의 대부분은 20Hz에서 250Hz 사이이고 ECG 주파수 스펙트럼은 0Hz에서 100Hz 사이입니다. 일부 분석(즉, 타이밍)의 경우 EMG 크기 및 타이밍의 정확성과 해석 가능성을 달성하기 위해 ECG 오염 없이 EMG 신호를 도출하는 것이 필수적입니다. 주파수를 활용한 LMS(Least ...
공개
저자는 공개할 이해 상충이 없다고 선언합니다.
감사의 말
AR은 CIHR(Canadian Institutes of Health Research) Fellowship(#187900)의 지원을 받았으며 UM은 Mitacs(IT178-9 -FR101644)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
참고문헌
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963 (2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483 (2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. a. T., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239 (2013).
- Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Neural offset time evaluation in surface respiratory signals during controlled respiration. 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2 (2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598 (2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522 (2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827 (2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885 (2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유