Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Erfassung und halbautomatische Analyse der Oberflächen-Elektromyographie der Atemmuskulatur
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll zur Aufzeichnung und Analyse von Signalen der respiratorischen Elektromyographie (EMG). Es enthält die anatomischen Referenzen für die Platzierung der EMG-Elektroden über mehreren Atemmuskeln, die Entfernung von elektrokardiographischem Rauschen aus den EMG-Signalen und die Erfassung des EMG-Mittelquadrats (RMS) und des Zeitpunkts des Beginns der Aktivität.
Zusammenfassung
Die Bewertung des Atemantriebs stellt aufgrund der Aufdringlichkeit und Unpraktikabilität aktueller Methoden wie der funktionellen Magnetresonanztomographie (fMRT) eine Herausforderung dar. Die Elektromyographie (EMG) bietet ein Surrogatmaß für den Atemantrieb der Muskeln, das es ermöglicht, sowohl das Ausmaß als auch den Zeitpunkt der Muskelaktivierung zu bestimmen. Die Größenordnung spiegelt den Grad der Muskelaktivierung wider, während der Zeitpunkt den Beginn und die Verschiebung der Muskelaktivität in Bezug auf bestimmte Ereignisse wie den Inspirationsfluss und die Aktivierung anderer Muskeln angibt. Diese Metriken sind entscheidend für das Verständnis der Atemkoordination und -kontrolle, insbesondere bei unterschiedlichen Belastungen oder bei Vorhandensein einer respiratorischen Pathophysiologie. Diese Studie skizziert ein Protokoll zur Erfassung und Analyse von EMG-Signalen der Atemmuskulatur bei gesunden Erwachsenen und Patienten mit Atemwegserkrankungen. Die Studien, die die Vorbereitung der Teilnehmer, die Platzierung der Elektroden, die Signalerfassung, die Vor- und Nachbearbeitung umfassten, wurden ethisch genehmigt. Zu den wichtigsten Schritten gehören die Reinigung der Haut, die Lokalisierung der Muskeln durch Palpation und Ultraschall sowie das Anbringen von Elektroden, um die Kontamination der Elektrokardiographie (EKG) zu minimieren. Die Datenerfassung erfolgt mit einer hohen Abtastrate und Verstärkung mit synchronisierten EKG- und Atemflussaufzeichnungen. Die Vorverarbeitung umfasst das Filtern und Transformieren des EMG-Signals, während die Nachbearbeitung die Berechnung von Onset- und Offset-Unterschieden relativ zum Inspirationsfluss umfasst. Repräsentative Daten eines gesunden männlichen Teilnehmers, der eine inkrementelle inspiratorische Schwellenbelastung (ITL) durchführte, veranschaulichen die Anwendung des Protokolls. Die Ergebnisse zeigten eine frühere Aktivierung und eine verlängerte Dauer der extradiaphragmatischen Muskeln bei höheren Belastungen, was mit einer erhöhten EMG-Größe korrelierte. Dieses Protokoll ermöglicht eine detaillierte Beurteilung der Aktivierung der Atemmuskulatur und bietet Einblicke in normale und pathophysiologische motorische Kontrollstrategien.
Einleitung
Der Atemantrieb (d. h. die Ausgabe von Atemzentren an die Atemmuskulatur) ist aufgrund der aufdringlichen, oft unpraktischen Natur von Bewertungsmethoden wie der funktionellen Magnetresonanztomographie (fMRT) schwierig zu bewerten. Darüber hinaus ist die geringe Größe der Atmungszentren im Hirnstamm schwer zu lokalisieren und empfindlich gegenüber Veränderungen durch physiologisches Rauschen 1,2. Messungen des Atemantriebs sind wichtig, da sie mit wichtigen klinischen Ergebnissen wie Dyspnoe, einem Hinweis auf Atemnot, in Verbindung stehen. Die Elektromyographie (EMG) ist ein Surrogat des Atemantriebs für die Atemmuskulatur3. Das EMG der Atemmuskulatur ermöglicht die Bestimmung der Muskelaktivität und ihrer Intensität über das mittlere Quadrat (RMS) des EMG-Signals. Darüber hinaus kann der Zeitpunkt der Muskelaktivierung durch die Identifizierung des Beginns und des Versatzes ihrer Aktivität (EMG, Beginn bzw. EMG, Versatz) beurteilt werden1,2,3,4,5,6,7,8,9,10,11.
Die Größe des EMG-Signals bezieht sich auf das elektrische Potential, das von Muskelzellen erzeugt wird, wenn sie sich zusammenziehen, und gibt den Grad ihrer Muskelaktivierung an12. Die Größe des EMG-Signals kann in Abhängigkeit von Faktoren wie der Intensität der Muskelkontraktion, der Anzahl der rekrutierten motorischen Einheiten, der Elektrodenplatzierung, der Bewegung von Muskel- und Unterhautgewebe und den spezifischen Eigenschaften des zu messenden Muskels variieren12.
Der Zeitpunkt des EMG-Signals bezieht sich darauf, wann die elektrische Aktivität relativ zu einem bestimmten Ereignis oder einer bestimmten Handlung auftritt (z. B. relativ zum Inspirationsfluss für die Atmung)13. Der Zeitpunkt des Beginns zeigt an, wann die Muskelaktivierung beginnt, während der Offset-Zeitpunkt angibt, wann die Muskelaktivität abnimmt, aufhört oder sich in der Entspannungsphasebefindet 13. Das Timing zwischen der Aktivierung mehrerer Atemmuskulaturn wird das Verständnis der Koordinations- und Kontrollmechanismen während der Atmung erleichtern. Die Beurteilung der Konsistenz oder Variabilität von Zeitmustern im Laufe der Zeit oder bei Einzelpersonen kann helfen, physiologische und pathophysiologische motorische Kontrollstrategien zu identifizieren, die mit akutem oder chronischem Beatmungsversagen verbunden sind.
Sowohl das Ausmaß als auch der Zeitpunkt des Atemmuskel-EMG wurden mit wichtigen klinischen Ergebnissen in Verbindung gebracht 12,13,14. Die Membran erzeugt den Großteil der Ventilation in Ruhe15. Wenn der Atmungsbedarf steigt, z. B. während des Trainings oder einer erhöhten inspiratorischen Belastung im Zusammenhang mit Lungenerkrankungen (z. B. chronisch obstruktive Lungenerkrankung, interstitielle Lungenerkrankung oder akutes Atemnotsyndrom), verstärken die extradiaphragmatischen Atemmuskulatur die Beatmung, was den kontraktilen Zwerchfellbedarf erhöhen oder ausgleichen kann15. So nimmt neben der zunehmenden Größe des Zwerchfell-EMG auch die Größe der extradiaphragmatischen Muskel-EMG zu.
Die Aktivierung der extrazwerchfellartigen Atemmuskulatur kann das Zwerchfell vor Ermüdung schützen16. Eine frühe Aktivierung (Beginn) und eine verlängerte Aktivierung wurden jedoch mit akutem und chronischem Beatmungsversagen in Verbindung gebracht 14,17,18. Ziel ist es, ein Protokoll zu beschreiben, um sowohl den Zeitpunkt als auch das Ausmaß der Atemmuskel-EMG-Signale sowohl bei gesunden Erwachsenen als auch bei Patienten mit Verdacht auf oder bestätigte respiratorische Pathophysiologie zu erfassen und zu analysieren. Dieses Protokoll umfasst zuvor validierte Schritte von der Datenerfassung zur Quantifizierung des Zeitpunkts und des Ausmaßes der EMG-Aktivität13,19.
Protokoll
Studien, die diese Technik anwenden, wurden von der University of Toronto und dem St. Michael's Hospital in Toronto, Kanada, und dem Universitätskrankenhaus Gasthuisberg, Leuven, Belgien, ethisch genehmigt. Ein spezifisches Protokoll wird hier beschrieben. Für die Atemmuskulatur wurden allgemeine Diskussionen über mehrere alternative Oberflächen-EMG-Ansätze (sEMG) vorgeschlagen, über die an anderer Stelle berichtetwird 12.
1. Vorbereitung und Platzierung der sEMG-Elektroden durch die Teilnehmer
- Um eine angemessene Visualisierung zu gewährleisten, bitten Sie Männer, kein Hemd zu tragen, und Frauen, einen Sport-BH oder ein Unterhemd zu tragen. Verwenden Sie einen Krankenhauskittel mit einer Öffnung vorne, um einen angemessenen Zugang zu ermöglichen und Bescheidenheit zu wahren.
- Wenn der Teilnehmer lange Haare hat, lassen Sie sie zurückbinden und feststecken, damit die Schuppe und das Sternocleidomastoid beurteilt werden können.
- Positionieren Sie den Teilnehmer in sitzender oder halbliegender Position.
- Wenn überschüssige Brust- oder Nackenhaare festgestellt werden, rasieren Sie den Bereich für die Elektrodenplatzierung für das sEMG.
- Um die Hautimpedanz zu reduzieren, reinigen Sie die Haut von Öl und abgestorbenen Hautschüppchen.
- Reiben Sie dazu mit einem Alkoholtupfer ab und lassen Sie den Alkohol verdampfen (d. h. an der Luft trocknen), bevor die Elektrode angelegt wird.
- Wenn die Haut heller ist, kann sie leicht gerötet erscheinen, aber noch wichtiger ist, dass kein offensichtlicher Schmutz, Öl oder trockene Haut an den Stellen, an denen Elektroden platziert werden, sichtbar ist. Vermeiden Sie jedoch übermäßiges Reiben, um Hautschäden zu vermeiden. Vermeiden Sie das Anlegen von Elektroden an Bereichen mit verletzter Haut oder anderen Hautläsionen.
- Lokalisieren Sie die interessierenden Muskeln durch Landmarkierung, Palpation und/oder Ultraschall.
HINWEIS: Ultraschall kann nützlich sein, um die Rippenblende20 zu markieren. Abbildung 1 zeigt Beispiele für Stellen, an denen Elektroden für das sEMG der Atemmuskulatur platziert werden können. - Platzieren Sie sEMG-Elektroden auf der rechten Seite des Brustkorbs, weiter vom Herzen entfernt, um die Amplitude des EKG-Signals zu verringern und seine Kontamination zu minimieren.
- Bringen Sie gepaarte EMG-Elektroden mit einem Elektrodenabstand von 2 cm in der Mitte des Muskelbauchs entlang der Längsausrichtung der Muskelfasern an.
- Für das Rippenzwerchfell/die Interkostalen markieren Sie die vordere Achsellinie und die mittlere Schlüsselbeinlinie und platzieren Sie die paarigen Elektroden vertikal zwischen diesen beiden Linien auf Höhe des siebten oder achten Interkostalraums.
- Für die Skalena markieren Sie das hintere Dreieck des Halses und platzieren die paarigen Elektroden entlang der Längsachse des Muskels auf Höhe des Zirikoidfortsatzes.
- Bei den parasternalen Interkostalen markieren Sie den zweiten Interkostalraum 1-2 cm lateral auf der rechten Seite des Brustbeins und platzieren Sie die paarigen Elektroden entlang der Längsachse des Muskels.
- Für den Sternocleidomastoid markieren Sie die suprasternale Kerbe und den Warzenfortsatz. Betonen Sie den rechten Bauch des Sternocleidomastoideus, indem Sie die Hand des Bedieners auf die linke Seite des Kinns des Teilnehmers legen und den Teilnehmer bitten, sanft eine isometrische Linksdrehung gegen die Hand durchzuführen. Platzieren Sie die paarigen Elektroden in der Mitte des Muskelbauchs entlang seiner Längsachse.
- Einige EMG-Systeme benötigen möglicherweise einen Erdungssensor. Platzieren Sie den Bodensensor bei Bedarf auf einer knöchernen Struktur in der Nähe der Atemmuskulatur (z. B. Schlüsselbein, C7 zervikaler Dornfortsatz).
- Befestigen Sie EMG-Sensorclips an EMG-Elektroden. Stellen Sie sicher, dass sich die Drähte von EMG-Sensoren von zwei verschiedenen Muskeln (auch wenn sie drahtlos sind) nicht überlappen und verunreinigen oder ein Übersprechen zwischen den beiden Muskeln ermöglichen.
HINWEIS: Drähte vom selben Sensor können sich überlappen, Drähte von zwei verschiedenen Sensoren jedoch nicht. - Bringen Sie eine weitere Fixierung von EMG-Elektroden und Sensoren an, indem Sie doppelseitige Klebebänder verwenden, die die Unterseite des Sensors auf der Haut befestigen.
- Bringen Sie medizinisches hypoallergenes Klebeband über die Oberseite der Sensoren an, um jeden Sensor weiter auf der Haut zu befestigen. Vermeiden Sie übermäßigen Druck und stellen Sie wie oben erwähnt sicher, dass sich die Drähte der verschiedenen Sensoren nicht überlappen.
2. Signalerfassung
- Wählen Sie die voreingestellte Vorlage in der Datenerfassungssoftware aus und drücken Sie Öffnen. Die Vorlage verfügt über die folgenden voreingestellten Parameter: Ein Hochpassfilter (0,5-20 Hz) im EMG-Signal, um niederfrequente Artefakte zu reduzieren und die Echtzeitvisualisierung zu erleichtern.
- Stellen Sie die Abtastrate des EMG-Signals von mindestens 1 kHz ein.
- Stellen Sie die Verstärkung des EMG-Signals auf 1000 ein.
- Legen Sie die Vorlage so fest, dass eine synchronisierte Aufzeichnung des EKGs und des Atemflusses erfasst wird.
- Erfassen Sie sEMG- und EKG-Daten gemäß Protokoll, z. B. während eines Spontanatmungsversuchs bei einem mechanisch beatmeten Patienten.
- Nachdem das Protokoll abgeschlossen ist, beenden Sie die Aufzeichnung und speichern Sie die Datendatei.
HINWEIS: Abbildung 2 zeigt Screenshots der Software, auf die die angewendete Filterung angewendet wird.
3. Vorverarbeitung nach der Datenerfassung
- Öffnen Sie die Software und bestätigen Sie die Parameter, die für die Analyse des EMG-Signals verwendet werden sollen (ein bidirektionaler Hochpassfilter von 5 Hz, der Least Mean Square (LMS) Adaptive Filter zum Entfernen von EKG-Kontaminationen, Root Mean Square Transformation mit einem beweglichen Fenster für 0,02 s) und drücken Sie Weiter.
- Wählen Sie die zu analysierende Datei aus und drücken Sie OK.
- Definieren Sie das zu analysierende Zeitintervall (wenn die Gesamtdauer der Datei analysiert werden soll, reicht sie von 0 s bis zur maximalen Zeit), drücken Sie Bereich auswählen und fortfahren und drücken Sie dann Konditionierung.
- Drücken Sie die Schaltfläche Analysieren , um die vorgewählten Parameter anzuwenden (siehe Schritt 3.1). Visualisieren Sie das analysierte EMG-Signal. Drücken Sie die Taste Rescaled on 1 , um das EMG-Signal anzuzeigen, das während des Aufnahmezeitraums um seinen Maximalwert normalisiert ist.
- Drücken Sie die Schaltfläche Weiter zum Berechnen Ein Aus . Basierend auf der Ableitungsfunktion des EMG-Signals wird der Zeitpunkt des Beginns der EMG-Aktivität erkannt. Drücken Sie die Ein- und Aus-Taste .
- Wählen Sie das EMG-Signal aus dem Muskel aus, das visualisiert werden soll. Die Visualisierung kann zwischen den Muskeln gewechselt werden, um die visuelle Inspektion aller aufgezeichneten EMG-Signale zu ermöglichen. Drücken Sie die Taste STOP Looking and Go To Saving . Drücken Sie auf Speichern.
- Wählen Sie die Daten aus, die gespeichert werden sollen. Es ist möglich, die Signale vor dem Speichern zu reduzieren (z. B. von 1000 Hz auf 100 Hz). Drücken Sie auf Verarbeitete Daten speichern, wählen Sie den Computerordner aus, in dem die Datei gespeichert werden soll, und geben Sie ihr einen Namen. Drücken Sie zur Bestätigung erneut auf Speichern .
4. Nachbearbeitung
- Öffnen Sie die gespeicherte Datei mit einer Software, die die Möglichkeit bietet, Berechnungen zu berechnen (z. B. Excel, R, Phyton, Matlab). Bestimmen Sie jeden Atemzug entweder durch die Ein- und Ausschaltzeit des Flusssignals und berechnen Sie den EMG-Spitzeneffektivwert und den EMG-Mittelwert für jeden Atemzug.
- Berechnen Sie für den EMG-Beginn die absolute Differenz (in Millisekunden) zwischen dem EMG-Beginn und dem Beginn des inspiratorischen Flusses (INSP, Beginn):
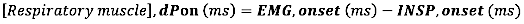
- Berechnen Sie für den EMG-Offset die absolute Differenz (in Millisekunden) zwischen dem EMG-Offset und dem Ende des Inspirationsflusses (INSP, Offset)
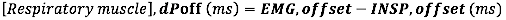
- Berechnen Sie für den EMG-Beginn im Verhältnis zur Dauer der Inspirationszeit die relative Differenz (zur Dauer von Ti) zwischen dem EMG-Beginn und dem INSP-Beginn:

- Berechnen Sie für den EMG-Offset relativ zur Dauer der Inspirationszeit die relative Differenz (zur Dauer von Ti) zwischen EMG-Offset und INSP,Offset:

Dabei ist dP die Zeitdifferenz zwischen dem EMG,-Beginn und dem Beginn des inspiratorischen Flusses (INSP,onset) oder zwischen dem EMG,-Offset und dem inspiratorischen Flow-Offset (INSP,Offset).)
Ergebnisse
Die Daten beziehen sich auf einen männlichen Teilnehmer (22 Jahre; Gewicht: 100 kg; Größe: 185 cm; BMI: 29 kg/m2) bei normaler Spirometrie und inspiratorischer Muskelkraft (FEV1: 4,89 L/s [97% der Prognosen]; maximaler Inspirationsdruck: 151 cmH2O [136% der Prognosen]). Er führte eine inkrementelle inspiratorische Schwellenbelastung (ITL) bis zum Versagen der Aufgabe unter Verwendung eines zuvor beschriebenen Protokolls du...
Diskussion
Die Entfernung von Herzaktivitätsartefakten aus dem EMG-Signal ist aufgrund ihrer überlappenden Bandbreitenspektren komplex. Der Großteil des EMG-Frequenzspektrums liegt zwischen 20 und 250 Hz, während das EKG-Frequenzspektrum zwischen 0 Hz und 100 Hz liegt. Für einige Analysen (d. h. das Timing) ist es wichtig, das EMG-Signal ohne EKG-Kontamination abzuleiten, um die Genauigkeit und Interpretierbarkeit der EMG-Größe und des Timings zu erreichen. Der adaptive Filter für das klein...
Offenlegungen
Die Autoren erklären, dass sie keinen Interessenkonflikt offenlegen müssen.
Danksagungen
AR wird durch ein Stipendium der Canadian Institutes of Health Research (CIHR) unterstützt (#187900) und UM wurde von Mitacs (IT178-9 -FR101644) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
Referenzen
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963 (2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483 (2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. a. T., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239 (2013).
- Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Neural offset time evaluation in surface respiratory signals during controlled respiration. 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2 (2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598 (2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522 (2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827 (2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885 (2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten