É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aquisição e Análise Semiautomatizada de Eletromiografia de Superfície Muscular Respiratória
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para registrar e analisar sinais de eletromiografia respiratória (EMG). Inclui as referências anatômicas para colocar os eletrodos EMG sobre vários músculos respiratórios, remover o ruído eletrocardiográfico dos sinais EMG e adquirir a raiz quadrada média (RMS) EMG e o tempo de início da atividade.
Resumo
A avaliação do drive respiratório apresenta desafios devido à intrusão e impraticabilidade dos métodos atuais, como a ressonância magnética funcional (fMRI). A eletromiografia (EMG) oferece uma medida substituta do impulso respiratório para os músculos, permitindo a determinação da magnitude e do tempo de ativação muscular. A magnitude reflete o nível de ativação muscular, enquanto o tempo indica o início e o deslocamento da atividade muscular em relação a eventos específicos, como fluxo inspiratório e ativação de outros músculos. Essas métricas são críticas para entender a coordenação e o controle respiratório, especialmente sob cargas variáveis ou na presença de fisiopatologia respiratória. Este estudo descreve um protocolo para aquisição e análise de sinais EMG dos músculos respiratórios em adultos saudáveis e pacientes com problemas de saúde respiratória. A aprovação ética foi obtida para os estudos, que incluíram preparação dos participantes, colocação dos eletrodos, aquisição de sinais, pré-processamento e pós-processamento. As principais etapas envolvem a limpeza da pele, a localização dos músculos por meio de palpação e ultrassom e a aplicação de eletrodos para minimizar a contaminação por eletrocardiografia (ECG). Os dados são adquiridos a uma alta taxa de amostragem e ganho, com ECG sincronizado e registros de fluxo respiratório. O pré-processamento inclui filtrar e transformar o sinal EMG, enquanto o pós-processamento envolve o cálculo das diferenças de início e deslocamento em relação ao fluxo inspiratório. Dados representativos de um participante saudável do sexo masculino realizando carga de limiar inspiratório incremental (ITL) ilustram a aplicação do protocolo. Os resultados mostraram ativação mais precoce e duração prolongada dos músculos extradiafragmáticos sob cargas mais altas, correlacionando-se com o aumento da magnitude EMG. Este protocolo facilita uma avaliação detalhada da ativação da musculatura respiratória, fornecendo informações sobre as estratégias de controle motor normal e fisiopatológico.
Introdução
O impulso respiratório (ou seja, a saída dos centros respiratórios para os músculos respiratórios) é difícil de avaliar devido à natureza intrusiva e muitas vezes impraticável dos métodos avaliativos, como a ressonância magnética funcional (fMRI). Além disso, o pequeno tamanho dos centros respiratórios localizados no tronco encefálico é difícil de localizar e sensível a alterações por ruído fisiológico 1,2. As medidas do estímulo respiratório são importantes devido à sua associação com desfechos clínicos importantes, como dispneia, uma indicação de desconforto respiratório. A eletromiografia (EMG) é um substituto do impulso respiratório para os músculos respiratórios3. A EMG do músculo respiratório permite a determinação da atividade muscular e sua intensidade por meio da raiz quadrada média (RMS) do sinal EMG. Além disso, o momento da ativação muscular pode ser avaliado identificando o início e o deslocamento de sua atividade (EMG, onset e EMG, offset, respectivamente)1,2,3,4,5,6,7,8,9,10,11.
A magnitude do sinal EMG refere-se ao potencial elétrico gerado pelas células musculares quando elas se contraem, indicando seu nível de ativação muscular12. A magnitude do sinal EMG pode variar dependendo de fatores como a intensidade da contração muscular, o número de unidades motoras recrutadas, a colocação do eletrodo, o movimento dos tecidos muscular e subcutâneo e as características específicas do músculo que está sendo medido12.
O tempo do sinal EMG refere-se a quando a atividade elétrica ocorre em relação a um evento ou ação específica (por exemplo, em relação ao fluxo inspiratório para a respiração)13. O tempo de início indica quando a ativação muscular começa, enquanto o tempo de deslocamento indica quando a atividade muscular diminui, cessa ou está na fase de relaxamento13. O tempo entre a ativação de vários músculos respiratórios facilitará a compreensão dos mecanismos de coordenação e controle durante a respiração. Avaliar a consistência ou variabilidade dos padrões de tempo ao longo do tempo ou em indivíduos pode ajudar a identificar estratégias fisiológicas e fisiopatológicas de controle motor associadas à insuficiência ventilatória aguda ou crônica.
Tanto a magnitude quanto o momento da EMG do músculo respiratório têm sido associados a importantes desfechos clínicos 12,13,14. O diafragma gera a maior parte da ventilação em repouso15. Quando a demanda respiratória aumenta, como durante o exercício ou aumento da carga inspiratória associada a doenças pulmonares (por exemplo, doença pulmonar obstrutiva crônica, doença pulmonar intersticial ou síndrome do desconforto respiratório agudo), os músculos respiratórios extradiafragmáticos aumentam a ventilação, o que pode aumentar ou compensar as necessidades contráteis do diafragma15. Assim, além do aumento da magnitude da EMG do diafragma, a magnitude da EMG do músculo extradiafragmático também aumentará.
A ativação dos músculos respiratórios extradiafragmáticos pode proteger o diafragma do desenvolvimento de fadiga16. No entanto, a ativação precoce (onset) e a ativação prolongada têm sido associadas à insuficiência ventilatória aguda e crônica 14,17,18. O objetivo aqui é descrever um protocolo para adquirir e analisar o tempo e a magnitude dos sinais EMG dos músculos respiratórios em adultos saudáveis e pacientes com fisiopatologia respiratória suspeita ou confirmada. Este protocolo inclui etapas previamente validadas desde a aquisição de dados para quantificar o tempo e a magnitude da atividade EMG13,19.
Protocolo
Os estudos que empregam essa técnica receberam aprovação ética da Universidade de Toronto e do Hospital St. Michael, localizado em Toronto, Canadá, e do Hospital Universitário Gasthuisberg, Leuven, Bélgica. Um protocolo específico é descrito aqui. A discussão geral sobre várias abordagens alternativas de EMG de superfície (sEMG) foi proposta para os músculos respiratórios e é relatada em outros lugares12.
1. Preparação dos participantes e colocação dos eletrodos EMGs
- Para garantir uma visualização adequada, peça aos homens que não usem camisa e às mulheres que usem sutiã esportivo ou camiseta. Use uma bata hospitalar com abertura frontal para fornecer acesso adequado e manter a modéstia.
- Se o participante tiver cabelo comprido, amarre-o para trás e prenda-o fora do lugar para que o escaleno e o esternocleidomastóideo possam ser avaliados.
- Posicione o participante na posição sentada ou semi-deitada.
- Se for encontrado excesso de pelos no peito ou pescoço, raspe a área para colocação do eletrodo para sEMG.
- Para reduzir a impedância da pele, limpe a pele de óleo e pele morta.
- Faça isso esfregando com um pano embebido em álcool e permitindo que o álcool evapore (ou seja, seque ao ar) antes de aplicar o eletrodo.
- Se a pele for mais clara, pode parecer ligeiramente vermelha, mas o mais importante, certifique-se de que nenhuma sujeira, óleo ou pele seca óbvia seja aparente onde os eletrodos serão colocados. No entanto, evite esfregar excessivamente para evitar danos à pele. Evite a aplicação de eletrodos em áreas de pele quebrada ou outras lesões cutâneas.
- Localize os músculos de interesse por meio de marcos, palpação e/ou ultrassom.
NOTA: O ultrassom pode ser útil na marcação do diafragma costal20. A Figura 1 mostra exemplos de locais onde os eletrodos podem ser colocados para EMGs dos músculos respiratórios. - Coloque eletrodos de EMG no lado direito do tórax, mais longe do coração, para diminuir a amplitude do sinal de ECG e minimizar sua contaminação.
- Aplique eletrodos EMG emparelhados com uma distância entre eletrodos de 2 cm no centro da barriga muscular ao longo do alinhamento longitudinal das fibras musculares.
- Para o diafragma costal/intercostais, marque a linha axilar anterior e a linha hemiclavicular e coloque os eletrodos emparelhados verticalmente entre essas duas linhas no nível do sétimo ou oitavo espaço intercostal.
- Para o escaleno, marque o triângulo posterior do pescoço e coloque os eletrodos emparelhados ao longo do eixo longitudinal do músculo no nível do processo cricóide.
- Para os intercostais paraesternais, marque o segundo espaço intercostal 1-2 cm lateral ao lado direito do esterno e coloque os eletrodos emparelhados ao longo do eixo longitudinal do músculo.
- Para o esternocleidomastóideo, marque a incisura supraesternal e o processo mastóideo. Acentue o ventre do músculo esternocleidomastóideo direito colocando a mão do operador no lado esquerdo do queixo do participante e pedindo ao participante que execute suavemente a rotação isométrica à esquerda contra a mão. Coloque os eletrodos emparelhados no ponto médio da barriga muscular ao longo de seu eixo longitudinal.
- Alguns sistemas EMG podem exigir um sensor de aterramento. Se necessário, coloque o sensor de solo em uma estrutura óssea próxima aos músculos respiratórios (por exemplo, clavícula, processo espinhoso cervical C7).
- Prenda os clipes do sensor EMG aos eletrodos EMG. Certifique-se de que os fios dos sensores EMG de dois músculos diferentes (mesmo que sem fio) não se sobreponham e contaminem ou forneçam diafonia entre os dois músculos.
NOTA: Os fios do mesmo sensor podem se sobrepor, mas os fios de dois sensores diferentes não devem. - Aplique fixação adicional de eletrodos e sensores EMG usando fitas dupla-face que prendem a parte inferior do sensor à pele.
- Aplique fita hipoalergênica de grau médico por cima dos sensores para prender ainda mais cada sensor à pele. Evite aplicar pressão excessiva e, conforme mencionado acima, certifique-se de que os fios de diferentes sensores não se sobreponham.
2. Aquisição de sinal
- Selecione o modelo predefinido no software de aquisição de dados e pressione Abrir. O modelo terá os seguintes parâmetros predefinidos: Um filtro passa-alta (0,5-20 Hz) no sinal EMG para reduzir artefatos de baixa frequência para facilitar a visualização em tempo real.
- Defina a taxa de amostragem do sinal EMG de pelo menos 1 kHz.
- Defina o ganho do sinal EMG para 1000.
- Defina o modelo para adquirir um registro sincronizado do ECG e do fluxo respiratório.
- Adquira dados de sEMG e ECG de acordo com o protocolo, por exemplo, durante um teste de respiração espontânea em um paciente de ventilação mecânica.
- Após a conclusão do protocolo, pare a gravação e salve o arquivo de dados.
NOTA: A Figura 2 mostra capturas de tela do software mostrando a filtragem aplicada.
3. Pré-processamento após a aquisição de dados
- Abra o software e confirme os parâmetros a serem usados para análise do sinal EMG (um filtro passa-alta bidirecional de 5 Hz, o filtro adaptativo Least Mean Square (LMS) para remover a contaminação do ECG, transformação quadrada média com uma janela móvel por 0.02 s) e pressione Continuar.
- Selecione o arquivo a ser analisado e pressione OK.
- Defina o intervalo de tempo a ser analisado (se a duração total do arquivo for analisado, será de 0 s ao tempo máximo), pressione Selecionar o intervalo e continuar e, em seguida, pressione Condicionamento.
- Pressione o botão Analisar para aplicar os parâmetros pré-selecionados (consulte a etapa 3.1). Visualize o sinal EMG analisado. Pressione o botão Redimensionado em 1 para mostrar o sinal EMG normalizado por seu valor máximo durante o período gravado.
- Pressione o botão Continuar para calcular On Off . Com base na função derivada do sinal EMG, ele detectará o tempo de início da atividade EMG. Pressione o botão On e Off .
- Selecione o sinal EMG do músculo que precisa ser visualizado. A visualização pode ser alternada entre os músculos para permitir a inspeção visual de todos os sinais EMG registrados. Pressione o botão PARAR de procurar e ir para salvar . Pressione Salvando.
- Selecione os dados a serem salvos. É possível reduzir os sinais antes de salvar (por exemplo, de 1000Hz para 100Hz). Pressione Salvar dados processados, selecione a pasta do computador na qual o arquivo deve ser salvo e dê um nome a ele. Pressione Salvar novamente para confirmar.
4. Pós-processamento
- Abra o arquivo salvo usando um software que fornece a capacidade de calcular cálculos (por exemplo, Excel, R, Phyton, Matlab). Determine cada respiração pelo tempo ligado e desligado do sinal de fluxo e calcule o pico EMG RMS e o EMG RMS médio para cada respiração.
- Para o início da EMG, calcule a diferença absoluta (em milissegundos) entre o início da EMG e o início do fluxo inspiratório (INSP, onset):
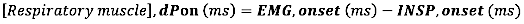
- Para deslocamento EMG, calcule a diferença absoluta (em milissegundos) entre o deslocamento EMG e o final do fluxo inspiratório (INSP, offset)
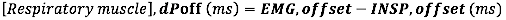
- Para o início da EMG em relação à duração do tempo inspiratório, calcule a diferença relativa (para a duração do Ti) entre o início da EMG e o início da INSP:

- Para o deslocamento EMG em relação à duração do tempo inspiratório, calcule a diferença relativa (para a duração do Ti) entre o deslocamento EMG e o INSP, deslocamento:

onde dP é a diferença de tempo entre o EMG, início e início do fluxo inspiratório (INSP,onset) ou entre EMG,offset e deslocamento do fluxo inspiratório (INSP,offset).)
Resultados
Os dados são fornecidos para um participante do sexo masculino (22 anos; peso: 100 kg; altura: 185 cm; IMC: 29 kg/m2) com espirometria e força muscular inspiratória normais (VEF1: 4,89 L/s [97% do previsto]; pressão inspiratória máxima: 151 cmH2O [136% do previsto]). Ele realizou uma carga de limiar inspiratório incremental (ITL) até a falha da tarefa usando um protocolo descrito anteriormente 21,22,23.
Discussão
A remoção de artefatos de atividade cardíaca do sinal EMG é complexa devido à sobreposição de seus espectros de largura de banda. A maior parte do espectro de frequência EMG está entre 20 e 250 Hz, enquanto o espectro de frequência ECG está entre 0 Hz e 100 Hz. Para algumas análises (ou seja, temporização), é essencial derivar o sinal EMG sem contaminação por ECG para obter precisão e interpretabilidade da magnitude e tempo EMG. O filtro adaptativo do mínimo quadrado m...
Divulgações
Os autores declaram não ter conflito de interesses a divulgar.
Agradecimentos
A AR é apoiada por uma bolsa de estudos do Canadian Institutes of Health Research (CIHR) (# 187900) e a UM foi financiada pela Mitacs (IT178-9 -FR101644).
Materiais
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
Referências
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963 (2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483 (2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. a. T., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239 (2013).
- Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Neural offset time evaluation in surface respiratory signals during controlled respiration. 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2 (2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598 (2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522 (2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827 (2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885 (2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados