È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Acquisizione e analisi semi-automatizzata dell'elettromiografia della superficie del muscolo respiratorio
In questo articolo
Riepilogo
Qui, descriviamo un protocollo per registrare e analizzare i segnali dell'elettromiografia respiratoria (EMG). Include i riferimenti anatomici per posizionare gli elettrodi EMG su diversi muscoli respiratori, rimuovere il rumore elettrocardiografico dai segnali EMG e acquisire il valore quadratico medio (RMS) dell'EMG e i tempi di inizio dell'attività.
Abstract
La valutazione dell'unità respiratoria presenta sfide a causa dell'invadenza e dell'impraticabilità dei metodi attuali come la risonanza magnetica funzionale (fMRI). L'elettromiografia (EMG) offre una misura surrogata dell'impulso respiratorio ai muscoli, consentendo di determinare sia l'entità che la tempistica dell'attivazione muscolare. L'entità riflette il livello di attivazione muscolare, mentre la tempistica indica l'inizio e l'offset dell'attività muscolare rispetto a eventi specifici, come il flusso inspiratorio e l'attivazione di altri muscoli. Queste metriche sono fondamentali per comprendere la coordinazione e il controllo respiratorio, soprattutto in presenza di carichi variabili o in presenza di fisiopatologia respiratoria. Questo studio delinea un protocollo per l'acquisizione e l'analisi dei segnali EMG dei muscoli respiratori in adulti sani e pazienti con condizioni di salute respiratoria. È stata ottenuta l'approvazione etica per gli studi, che includevano la preparazione dei partecipanti, il posizionamento degli elettrodi, l'acquisizione del segnale, la pre-elaborazione e la post-elaborazione. I passaggi chiave riguardano la pulizia della pelle, la localizzazione dei muscoli tramite palpazione ed ultrasuoni e l'applicazione di elettrodi per ridurre al minimo la contaminazione dell'elettrocardiogramma (ECG). I dati vengono acquisiti con un'elevata frequenza di campionamento e guadagno, con registrazioni sincronizzate dell'ECG e del flusso respiratorio. La pre-elaborazione include il filtraggio e la trasformazione del segnale EMG, mentre la post-elaborazione comporta il calcolo delle differenze di insorgenza e offset rispetto al flusso inspiratorio. I dati rappresentativi di un partecipante maschio sano che ha eseguito il carico incrementale della soglia inspiratoria (ITL) illustrano l'applicazione del protocollo. I risultati hanno mostrato un'attivazione precoce e una durata prolungata dei muscoli extradiaframmatici sotto carichi più elevati, correlata con un aumento dell'entità dell'EMG. Questo protocollo facilita una valutazione dettagliata dell'attivazione dei muscoli respiratori, fornendo informazioni sulle strategie di controllo motorio sia normali che fisiopatologiche.
Introduzione
L'impulso respiratorio (cioè l'output dei centri respiratori ai muscoli respiratori) è difficile da valutare a causa della natura invadente e spesso impraticabile dei metodi valutativi come la risonanza magnetica funzionale (fMRI). Inoltre, le piccole dimensioni dei centri respiratori situati nel tronco encefalico sono difficili da localizzare ed è sensibile alle alterazioni dovute al rumore fisiologico 1,2. Le misurazioni dell'impulso respiratorio sono importanti a causa della loro associazione con importanti esiti clinici come la dispnea, un'indicazione di distress respiratorio. L'elettromiografia (EMG) è un surrogato dell'impulso respiratorio ai muscoli respiratori3. L'EMG dei muscoli respiratori consente di determinare l'attività muscolare e la sua intensità attraverso la radice quadrata media (RMS) del segnale EMG. Inoltre, la tempistica dell'attivazione muscolare può essere valutata identificando l'insorgenza e l'offset della loro attività (EMG, insorgenza ed EMG, offset, rispettivamente)1,2,3,4,5,6,7,8,9,10,11.
L'entità del segnale EMG si riferisce al potenziale elettrico generato dalle cellule muscolari quando si contraggono, indicando il loro livello di attivazione muscolare12. L'entità del segnale EMG può variare a seconda di fattori quali l'intensità della contrazione muscolare, il numero di unità motorie reclutate, il posizionamento degli elettrodi, il movimento del muscolo e dei tessuti sottocutanei e le caratteristiche specifiche del muscolo misurato12.
La temporizzazione del segnale EMG si riferisce a quando l'attività elettrica si verifica in relazione a un evento o un'azione specifica (ad esempio, in relazione al flusso inspiratorio per la respirazione)13. Il tempo di insorgenza indica quando inizia l'attivazione muscolare, mentre il tempo di offset indica quando l'attività muscolare diminuisce, cessa o è nella fase di rilassamento13. La tempistica tra l'attivazione di diversi muscoli respiratori faciliterà la comprensione dei meccanismi di coordinazione e controllo durante la respirazione. La valutazione della coerenza o della variabilità dei modelli temporali nel tempo o negli individui può aiutare a identificare le strategie di controllo motorio fisiologiche e fisiopatologiche associate all'insufficienza ventilatoria acuta o cronica.
Sia l'entità che la tempistica dell'EMG del muscolo respiratorio sono state associate a importanti esiti clinici 12,13,14. Il diaframma genera la maggior parte della ventilazione a riposo15. Quando la domanda respiratoria aumenta, ad esempio durante l'esercizio fisico o l'aumento del carico inspiratorio associato a malattie polmonari (ad esempio, broncopneumopatia cronica ostruttiva, malattia polmonare interstiziale o sindrome da distress respiratorio acuto), i muscoli respiratori extradiaframmatici aumentano la ventilazione, che può aumentare o compensare i requisiti contrattili del diaframma15. Pertanto, oltre all'aumento dell'entità dell'EMG del diaframma, aumenterà anche l'entità dell'EMG del muscolo extradiaframmatico.
L'attivazione dei muscoli respiratori extradiaframmatici può proteggere il diaframma dallo sviluppo di affaticamento16. Tuttavia, l'attivazione precoce (esordio) e l'attivazione prolungata sono state associate a insufficienza ventilatoria acuta e cronica 14,17,18. L'obiettivo qui è quello di descrivere un protocollo per acquisire e analizzare sia la tempistica che l'entità dei segnali EMG dei muscoli respiratori sia in adulti sani che in pazienti con fisiopatologia respiratoria sospetta o confermata. Questo protocollo include passaggi precedentemente convalidati dall'acquisizione dei dati per quantificare la tempistica e l'entità dell'attività EMG13,19.
Protocollo
Gli studi che impiegano questa tecnica hanno ricevuto l'approvazione etica dall'Università di Toronto e dal St. Michael's Hospital di Toronto, in Canada, e dall'University Hospital Gasthuisberg, Leuven, in Belgio. Qui viene descritto un protocollo specifico. Discussioni generali su diversi approcci alternativi all'EMG di superficie (sEMG) sono state proposte per i muscoli respiratori e sono riportate altrove12.
1. Preparazione e posizionamento degli elettrodi sEMG da parte dei partecipanti
- Per garantire un'adeguata visualizzazione, chiedi ai maschi di non indossare una maglietta e alle femmine di indossare un reggiseno sportivo o una canottiera. Utilizzare un camice da ospedale con un'apertura frontale per fornire un accesso adeguato e mantenere la modestia.
- Se il partecipante ha i capelli lunghi, falli legare all'indietro e appuntarli fuori posto in modo che lo scaleno e lo sternocleidomastoideo possano essere valutati.
- Posizionare il partecipante in posizione seduta o semisdraiata.
- Se si riscontrano peli eccessivi sul torace o sul collo, radere l'area per il posizionamento degli elettrodi per la sEMG.
- Per ridurre l'impedenza cutanea, pulire la pelle dall'olio e dalla pelle morta.
- Fallo strofinando con una salvietta imbevuta di alcol e lasciando evaporare l'alcol (cioè asciugarlo all'aria) prima di applicare l'elettrodo.
- Se la pelle è più chiara, può apparire leggermente rossa, ma soprattutto, assicurati che non siano evidenti sporco, olio o pelle secca dove verranno posizionati gli elettrodi. Tuttavia, evitare uno sfregamento eccessivo per evitare danni alla pelle. Evitare l'applicazione di elettrodi su aree di pelle rotta o altre lesioni cutanee.
- Localizzare i muscoli di interesse mediante landmarking, palpazione e/o ecografia.
NOTA: Gli ultrasuoni possono essere utili per contrassegnare il diaframma costale20. La Figura 1 mostra esempi di posizioni in cui è possibile posizionare gli elettrodi per la sEMG dei muscoli respiratori. - Posizionare gli elettrodi sEMG sul lato destro del torace, più lontano dal cuore, per ridurre l'ampiezza del segnale ECG e minimizzarne la contaminazione.
- Applicare elettrodi EMG accoppiati con una distanza tra gli elettrodi di 2 cm al centro del ventre muscolare lungo l'allineamento longitudinale delle fibre muscolari.
- Per il diaframma costale/intercostali, marcare la linea ascellare anteriore e la linea medioclavicolare e posizionare gli elettrodi accoppiati verticalmente tra queste due linee a livello del settimo o ottavo spazio intercostale.
- Per lo scaleno, segnare il triangolo posteriore del collo e posizionare gli elettrodi accoppiati lungo l'asse longitudinale del muscolo a livello del processo cricoideo.
- Per gli intercostali parasternali, posizionare il secondo spazio intercostale a 1-2 cm lateralmente al lato destro dello sterno e posizionare gli elettrodi accoppiati lungo l'asse longitudinale del muscolo.
- Per lo sternocleidomastoideo, evidenziare l'incisura soprasternale e il processo mastoideo. Accentuare il ventre del muscolo sternocleidomastoideo destro posizionando la mano dell'operatore sul lato sinistro del mento del partecipante e chiedendo al partecipante di eseguire delicatamente la rotazione isometrica sinistra contro la mano. Posizionare gli elettrodi accoppiati nel punto medio del ventre muscolare lungo il suo asse longitudinale.
- Alcuni sistemi EMG possono richiedere un sensore di terra. Se necessario, posizionare il sensore a terra su una struttura ossea vicino ai muscoli respiratori (ad es. clavicola, processo spinoso cervicale C7).
- Collegare le clip del sensore EMG agli elettrodi EMG. Assicurarsi che i cavi dei sensori EMG di due muscoli diversi (anche se wireless) non si sovrappongano e non contaminino o forniscano diafonia tra i due muscoli.
NOTA: I fili dello stesso sensore possono sovrapporsi, ma i cavi di due sensori diversi non dovrebbero. - Applicare un'ulteriore fissazione di elettrodi e sensori EMG utilizzando nastri biadesivi che fissano la parte inferiore del sensore alla pelle.
- Applicare del nastro ipoallergenico di grado medico sulla parte superiore dei sensori per fissare ulteriormente ciascun sensore alla pelle. Evitare di applicare una pressione eccessiva e, come accennato in precedenza, assicurarsi che i fili di sensori diversi non si sovrappongano.
2. Acquisizione del segnale
- Selezionare il modello preimpostato sul software di acquisizione dati e premere Apri. Il modello avrà i seguenti parametri preimpostati: Un filtro passa-alto (0,5-20 Hz) nel segnale EMG per ridurre gli artefatti a bassa frequenza e facilitare la visualizzazione in tempo reale.
- Impostare la frequenza di campionamento del segnale EMG di almeno 1 kHz.
- Impostare il guadagno del segnale EMG su 1000.
- Impostare il modello per acquisire una registrazione sincronizzata dell'ECG e del flusso respiratorio.
- Acquisire dati sEMG ed ECG secondo il protocollo, ad esempio durante una prova di respirazione spontanea in un paziente con ventilazione meccanica.
- Al termine del protocollo, interrompere la registrazione e salvare il file di dati.
NOTA: La Figura 2 mostra le schermate del software che mostrano il filtro applicato.
3. Pre-elaborazione dopo l'acquisizione dei dati
- Aprire il software e confermare i parametri da utilizzare per l'analisi del segnale EMG (un filtro passa-alto bidirezionale di 5 Hz, il filtro adattivo LMS (Least Mean Square) per rimuovere la contaminazione ECG, la trasformata quadratica media con una finestra mobile per 0,02 s) e premere Continua.
- Selezionare il file da analizzare e premere OK.
- Definire l'intervallo di tempo da analizzare (se la durata totale del file deve essere analizzata, sarà da 0 s al tempo massimo), premere Seleziona l'intervallo e continua, quindi premere Condizionamento.
- Premere il pulsante Analizza per applicare i parametri preselezionati (vedere il passaggio 3.1). Visualizza il segnale EMG analizzato. Premere il pulsante Riscalato su 1 per visualizzare il segnale EMG normalizzato del suo valore massimo durante il periodo registrato.
- Premere il pulsante Continua a calcolare On Off . In base alla funzione derivata del segnale EMG, rileverà la tempistica di insorgenza dell'attività EMG. Premere i pulsanti On e Off .
- Selezionare il segnale EMG dal muscolo che deve essere visualizzato. La visualizzazione può essere alternata tra i muscoli per consentire l'ispezione visiva di tutti i segnali EMG registrati. Premere il pulsante INTERROMPI ricerca e Vai al salvataggio . Premere Salvataggio.
- Selezionare i dati da salvare. È possibile ridurre i segnali prima di salvarli (ad esempio, da 1000Hz a 100Hz). Premere Salva dati elaborati, selezionare la cartella del computer in cui salvare il file e assegnargli un nome. Premere nuovamente Salva per confermare.
4. Post-elaborazione
- Apri il file salvato utilizzando un software che offre la possibilità di calcolare i calcoli (ad esempio, Excel, R, Phyton, Matlab). Determinare ogni respiro in base al tempo di accensione e spegnimento del segnale di flusso e calcolare l'RMS di picco EMG e l'RMS medio EMG per ogni respiro.
- Per l'insorgenza dell'EMG, calcolare la differenza assoluta (in millisecondi) tra l'insorgenza dell'EMG e l'insorgenza del flusso inspiratorio (INSP, insorgenza):
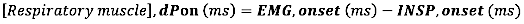
- Per l'offset EMG, calcolare la differenza assoluta (in millisecondi) tra l'offset EMG e la fine del flusso inspiratorio (INSP,offset)
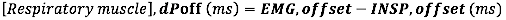
- Per l'insorgenza dell'EMG rispetto alla durata del tempo inspiratorio, calcolare la differenza relativa (rispetto alla durata del Ti) tra l'insorgenza dell'EMG e l'insp, esordio:

- Per l'offset EMG relativo alla durata del tempo inspiratorio, calcolare la differenza relativa (rispetto alla durata di Ti) tra l'offset EMG e l'INSP, offset:

dove dP è la differenza di tempo tra l'EMG, l'insorgenza e l'insorgenza del flusso inspiratorio (INSP, insorgenza) o tra l'EMG, l'offset e l'offset del flusso inspiratorio (INSP, offset).
Risultati
I dati sono forniti per un partecipante di sesso maschile (22 anni; peso: 100 kg; altezza: 185 cm; BMI: 29 kg/m2) con spirometria e forza muscolare inspiratoria normali (FEV1: 4,89 L/s [97% del previsto]; pressione inspiratoria massima: 151 cmH2O [136% del previsto]). Ha eseguito un carico incrementale della soglia inspiratoria (ITL) fino al fallimento del compito utilizzando un protocollo precedentemente descritto 21,22,23.
Discussione
La rimozione degli artefatti dell'attività cardiaca dal segnale EMG è complessa a causa dei loro spettri di larghezza di banda sovrapposti. La maggior parte dello spettro di frequenza EMG è compresa tra 20 e 250 Hz, mentre lo spettro di frequenza ECG è compreso tra 0 Hz e 100 Hz. Per alcune analisi (ad esempio, la temporizzazione), è essenziale derivare il segnale EMG senza contaminazione ECG per ottenere l'accuratezza e l'interpretabilità dell'entità e della tempistica dell'EMG. ...
Divulgazioni
Gli autori dichiarano di non avere alcun conflitto di interessi da divulgare.
Riconoscimenti
AR è supportato da una borsa di studio del Canadian Institutes of Health Research (CIHR) (#187900) e UM è stato finanziato da Mitacs (IT178-9 -FR101644).
Materiali
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
Riferimenti
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963 (2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483 (2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. a. T., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239 (2013).
- Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Neural offset time evaluation in surface respiratory signals during controlled respiration. 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2 (2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598 (2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522 (2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827 (2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885 (2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon