Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Acquisition et analyse semi-automatisée de l’électromyographie de surface des muscles respiratoires
Dans cet article
Résumé
Nous décrivons ici un protocole permettant d’enregistrer et d’analyser les signaux d’électromyographie respiratoire (EMG). Il comprend les références anatomiques permettant de placer les électrodes EMG sur plusieurs muscles respiratoires, d’éliminer le bruit électrocardiographique des signaux EMG et d’acquérir la racine carrée moyenne (RMS) de l’EMG et le moment du début de l’activité.
Résumé
L’évaluation de l’entraînement respiratoire présente des défis en raison de l’intrusivité et de l’impraticabilité des méthodes actuelles telles que l’imagerie par résonance magnétique fonctionnelle (IRMf). L’électromyographie (EMG) offre une mesure de substitution de l’entraînement respiratoire aux muscles, permettant de déterminer à la fois l’amplitude et le moment de l’activation musculaire. L’amplitude reflète le niveau d’activation musculaire, tandis que le moment indique le début et le décalage de l’activité musculaire par rapport à des événements spécifiques, tels que le flux inspiratoire et l’activation d’autres muscles. Ces paramètres sont essentiels pour comprendre la coordination et le contrôle respiratoires, en particulier sous des charges variables ou en présence d’une physiopathologie respiratoire. Cette étude décrit un protocole pour l’acquisition et l’analyse des signaux EMG des muscles respiratoires chez les adultes en bonne santé et les patients souffrant de problèmes respiratoires. L’approbation éthique a été obtenue pour les études, qui comprenaient la préparation des participants, le placement des électrodes, l’acquisition du signal, le prétraitement et le post-traitement. Les étapes clés consistent à nettoyer la peau, à localiser les muscles par palpation et échographie et à appliquer des électrodes pour minimiser la contamination par électrocardiographie (ECG). Les données sont acquises à un taux d’échantillonnage et à un gain élevés, avec des enregistrements synchronisés de l’ECG et du débit respiratoire. Le prétraitement comprend le filtrage et la transformation du signal EMG, tandis que le post-traitement consiste à calculer les différences de début et de décalage par rapport au débit inspiratoire. Des données représentatives provenant d’un participant masculin en bonne santé effectuant une charge incrémentielle de seuil inspiratoire (ITL) illustrent l’application du protocole. Les résultats ont montré une activation plus précoce et une durée prolongée des muscles extradiaphragmatiques sous des charges plus élevées, corrélées à une augmentation de l’amplitude de l’EMG. Ce protocole facilite une évaluation détaillée de l’activation des muscles respiratoires, fournissant des informations sur les stratégies de contrôle moteur normales et physiopathologiques.
Introduction
L’entraînement respiratoire (c’est-à-dire la sortie des centres respiratoires vers les muscles respiratoires) est difficile à évaluer en raison de la nature intrusive et souvent peu pratique des méthodes d’évaluation telles que l’imagerie par résonance magnétique fonctionnelle (IRMf). De plus, la petite taille des centres respiratoires situés dans le tronc cérébral est difficile à localiser et est sensible aux altérations par le bruitphysiologique1,2. Les mesures de la pulsion respiratoire sont importantes en raison de leur association avec des résultats cliniques importants tels que la dyspnée, une indication de détresse respiratoire. L’électromyographie (EMG) est un substitut de l’entraînement respiratoire aux muscles respiratoires3. L’EMG des muscles respiratoires permet de déterminer l’activité musculaire et son intensité au moyen de la racine carrée moyenne (RMS) du signal EMG. De plus, le moment de l’activation musculaire peut être évalué en identifiant le début et le décalage de leur activité (EMG, début et EMG, décalage, respectivement)1,2,3,4,5,6,7,8,9,10,11.
L’amplitude du signal EMG fait référence au potentiel électrique généré par les cellules musculaires lorsqu’elles se contractent, indiquant leur niveau d’activation musculaire12. L’amplitude du signal EMG peut varier en fonction de facteurs tels que l’intensité de la contraction musculaire, le nombre d’unités motrices recrutées, le placement des électrodes, le mouvement des tissus musculaires et sous-cutanés et les caractéristiques spécifiques du muscle mesuré12.
La synchronisation du signal EMG fait référence au moment où l’activité électrique se produit par rapport à un événement ou une action spécifique (par exemple, par rapport au flux inspiratoire pour la respiration)13. Le moment du début indique quand l’activation musculaire commence, tandis que le moment du décalage indique quand l’activité musculaire diminue, cesse ou est dans la phase de relaxation13. Le timing parmi l’activation de plusieurs muscles respiratoires facilitera la compréhension des mécanismes de coordination et de contrôle pendant la respiration. L’évaluation de la cohérence ou de la variabilité des modèles temporels au fil du temps ou chez les individus peut aider à identifier les stratégies de contrôle moteur physiologiques et physiopathologiques associées à l’insuffisance ventilatoire aiguë ou chronique.
L’ampleur et le moment de l’EMG du muscle respiratoire ont été associés à des résultats cliniques importants 12,13,14. Le diaphragme génère la majorité de la ventilation au repos15. Lorsque la demande respiratoire augmente, par exemple pendant l’exercice ou l’augmentation de la charge inspiratoire associée à des maladies pulmonaires (par exemple, la bronchopneumopathie chronique obstructive, la maladie pulmonaire interstitielle ou le syndrome de détresse respiratoire aiguë), les muscles respiratoires extradiaphragmatiques stimulent la ventilation, ce qui peut augmenter ou compenser les besoins contractiles du diaphragme15. Ainsi, en plus de l’amplitude croissante de l’EMG du diaphragme, l’amplitude de l’EMG du muscle extradiaphragmatique augmentera également.
L’activation des muscles respiratoires extradiaphragmatiques peut protéger le diaphragme contre le développement de la fatigue16. Cependant, une activation précoce (début) et une activation prolongée ont été associées à une insuffisance ventilatoire aiguë et chronique 14,17,18. L’objectif ici est de décrire un protocole permettant d’acquérir et d’analyser à la fois le moment et l’amplitude des signaux EMG des muscles respiratoires chez les adultes en bonne santé et les patients présentant une pathophysiologie respiratoire suspectée ou confirmée. Ce protocole comprend des étapes précédemment validées de l’acquisition des données pour quantifier le moment et l’ampleur de l’activité EMG13,19.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les études utilisant cette technique ont reçu l’approbation éthique de l’Université de Toronto et de l’hôpital St. Michael’s situé à Toronto, au Canada, ainsi que de l’hôpital universitaire Gasthuisberg, à Louvain, en Belgique. Un protocole spécifique est décrit ici. Des discussions générales sur plusieurs approches EMG de surface alternatives (sEMG) ont été proposées pour les muscles respiratoires et sont rapportées ailleurs12.
1. Préparation et placement des électrodes sEMG par le participant
- Pour assurer une visualisation adéquate, demandez aux hommes de ne pas porter de chemise et aux femmes de porter un soutien-gorge ou un maillot de sport. Utilisez une chemise d’hôpital avec une ouverture sur le devant pour permettre un accès adéquat et maintenir la modestie.
- Si le participant a les cheveux longs, faites-les attacher et épingler à l’endroit afin que le scalène et le sternocléidomastoïdien puissent être évalués.
- Positionnez le participant en position assise ou semi-allongée.
- Si vous constatez un excès de poils sur la poitrine ou le cou, rasez la zone pour le placement des électrodes pour le sEMG.
- Pour réduire l’impédance de la peau, nettoyez la peau de l’huile et des peaux mortes.
- Pour ce faire, frottez avec une lingette imbibée d’alcool et laissez l’alcool s’évaporer (c’est-à-dire sécher à l’air) avant d’appliquer l’électrode.
- Si la peau est plus claire, elle peut apparaître légèrement rouge, mais plus important encore, assurez-vous qu’aucune saleté, huile ou peau sèche évidente n’est apparente à l’endroit où les électrodes seront placées. Cependant, évitez de frotter excessivement pour éviter d’endommager la peau. Évitez d’appliquer des électrodes sur des zones de peau éraflée ou d’autres lésions cutanées.
- Localiser les muscles d’intérêt par repère, palpation et/ou échographie.
REMARQUE : L’échographie peut être utile pour marquer le diaphragme costal20. La figure 1 montre des exemples d’endroits où des électrodes peuvent être placées pour le sEMG des muscles respiratoires. - Placez les électrodes sEMG sur le côté droit du thorax, plus loin du cœur, pour diminuer l’amplitude du signal ECG et minimiser sa contamination.
- Appliquez des électrodes EMG appariées avec une distance de 2 cm entre les électrodes au centre du ventre musculaire le long de l’alignement longitudinal des fibres musculaires.
- Pour le diaphragme costal/intercostal, marquez la ligne axillaire antérieure et la ligne médio-claviculaire et placez les électrodes appariées verticalement entre ces deux lignes au niveau du septième ou huitième espace intercostal.
- Pour le scalène, marquez le triangle postérieur du cou et placez les électrodes appariées le long de l’axe longitudinal du muscle au niveau de l’apophyse cricoïde.
- Pour les intercostaux parasternaux, marquez le deuxième espace intercostal de 1 à 2 cm sur le côté droit du sternum et placez les électrodes appariées le long de l’axe longitudinal du muscle.
- Pour le sterno-cléidomastoïdien, repère l’encoche suprasternale et l’apophyse mastoïdienne. Accentuez le ventre du muscle sterno-cléido-mastoïdien droit en plaçant la main de l’opérateur sur le côté gauche du menton du participant et en demandant au participant d’effectuer doucement une rotation isométrique gauche contre la main. Placez les électrodes appariées au milieu du ventre musculaire le long de son axe longitudinal.
- Certains systèmes EMG peuvent nécessiter un capteur au sol. Si nécessaire, placez le capteur de sol sur une structure osseuse proche des muscles respiratoires (par exemple, clavicule, apophyse épineuse cervicale C7).
- Fixez les clips du capteur EMG aux électrodes EMG. Assurez-vous que les fils des capteurs EMG de deux muscles différents (même s’ils sont sans fil) ne se chevauchent pas et ne contaminent pas ou ne fournissent pas de diaphonie entre les deux muscles.
REMARQUE : Les fils du même capteur peuvent se chevaucher, mais pas les fils de deux capteurs différents. - Appliquez une fixation supplémentaire des électrodes et des capteurs EMG à l’aide de rubans adhésifs double face qui fixent le dessous du capteur à la peau.
- Appliquez du ruban adhésif hypoallergénique de qualité médicale sur le dessus des capteurs pour fixer davantage chaque capteur à la peau. Évitez d’appliquer une pression excessive et, comme mentionné ci-dessus, assurez-vous que les fils des différents capteurs ne se chevauchent pas.
2. Acquisition du signal
- Sélectionnez le modèle prédéfini sur le logiciel d’acquisition de données et appuyez sur Ouvrir. Le modèle aura les paramètres prédéfinis suivants : Un filtre passe-haut (0,5-20 Hz) dans le signal EMG pour réduire les artefacts à basse fréquence afin de faciliter la visualisation en temps réel.
- Réglez la fréquence d’échantillonnage du signal EMG d’au moins 1 kHz.
- Réglez le gain du signal EMG sur 1000.
- Réglez le modèle pour obtenir un enregistrement synchronisé de l’ECG et du débit respiratoire.
- Acquérir des données sEMG et ECG selon le protocole, par exemple lors d’un essai de respiration spontanée chez un patient sous ventilation mécanique.
- Une fois le protocole terminé, arrêtez l’enregistrement et sauvegardez le fichier de données.
REMARQUE : la figure 2 montre des captures d’écran du logiciel montrant le filtrage appliqué.
3. Prétraitement après l’acquisition des données
- Ouvrez le logiciel et confirmez les paramètres à utiliser pour l’analyse du signal EMG (un filtre passe-haut bidirectionnel de 5 Hz, le filtre adaptatif LMS (Least Mean Square) pour éliminer la contamination de l’ECG, la transformation quadratique moyenne avec une fenêtre mobile pendant 0,02 s) et appuyez sur Continuer.
- Sélectionnez le fichier à analyser et appuyez sur OK.
- Définissez l’intervalle de temps à analyser (si la durée totale du fichier est à analyser, elle sera de 0 s à temps maximum), appuyez sur Sélectionner la plage et Continuer, puis appuyez sur Conditionnement.
- Appuyez sur le bouton Analyser pour appliquer les paramètres présélectionnés (voir étape 3.1). Visualisez le signal EMG analysé. Appuyez sur le bouton Rescaled sur 1 pour afficher le signal EMG normalisé par sa valeur maximale pendant la période enregistrée.
- Appuyez sur le bouton Continuer à calculer sur Arrêt . Sur la base de la fonction dérivée du signal EMG, il détectera le moment du début de l’activité EMG. Appuyez sur les boutons On et Off .
- Sélectionnez le signal EMG du muscle qui doit être visualisé. La visualisation peut être alternée entre les muscles pour permettre l’inspection visuelle de tous les signaux EMG enregistrés. Appuyez sur le bouton STOP Looking and Go To Saving (Arrêter de regarder et aller à l’enregistrement ). Appuyez sur Enregistrer.
- Sélectionnez les données à sauvegarder. Il est possible de réduire les signaux avant de les enregistrer (par exemple, de 1000 Hz à 100 Hz). Appuyez sur Enregistrer les données traitées, sélectionnez le dossier de l’ordinateur dans lequel le fichier doit être enregistré et donnez-lui un nom. Appuyez à nouveau sur Enregistrer pour confirmer.
4. Post-traitement
- Ouvrez le fichier enregistré à l’aide d’un logiciel qui offre la possibilité de calculer des calculs (par exemple, Excel, R, Phyton, Matlab). Déterminez chaque respiration soit par le temps d’activation et d’arrêt du signal de débit et calculez le pic RMS EMG et la RMS moyenne EMG pour chaque respiration.
- Pour l’apparition de l’EMG, calculez la différence absolue (en millisecondes) entre l’apparition de l’EMG et l’apparition du flux inspiratoire (INSP, début) :
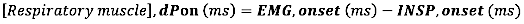
- Pour le décalage EMG, calculez la différence absolue (en millisecondes) entre le décalage EMG et la fin du débit inspiratoire (INSP, offset)
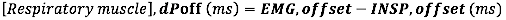
- Pour l’apparition de l’EMG par rapport à la durée du temps inspiratoire, calculer la différence relative (par rapport à la durée de Ti) entre l’apparition de l’EMG et l’apparition de l’INSP, procédez comme suit :

- Pour le décalage EMG par rapport à la durée du temps inspiratoire, calculez la différence relative (à la durée de Ti) entre le décalage EMG et INSP,offset :

où dP est la différence de temps entre l’EMG, début et l’apparition du flux inspiratoire (INSP, début) ou entre l’EMG, décalage et décalage du flux inspiratoire (INSP, décalage).)
Access restricted. Please log in or start a trial to view this content.
Résultats
Les données sont fournies pour un participant masculin (22 ans ; poids : 100 kg ; taille : 185 cm ; IMC : 29 kg/m2) avec spirométrie et force musculaire inspiratoire normales (VEMS1 : 4,89 L/s [97 % de la prévision] ; pression inspiratoire maximale : 151 cmH2O [136 % de la prévision]). Il a effectué une charge incrémentielle de seuil inspiratoire (ITL) jusqu’à l’échec de la tâche en utilisant un protocole précédemment décrit 21,22,23.
Access restricted. Please log in or start a trial to view this content.
Discussion
La suppression des artefacts d’activité cardiaque du signal EMG est complexe en raison de leurs spectres de bande passante qui se chevauchent. La majorité du spectre de fréquences EMG se situe entre 20 et 250 Hz, tandis que le spectre de fréquences ECG se situe entre 0 Hz et 100 Hz. Pour certaines analyses (c’est-à-dire le timing), il est essentiel de dériver le signal EMG sans contamination ECG pour obtenir la précision et l’intelligibilité de l’amplitude et du timing EM...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts à divulguer.
Remerciements
La RA est financée par une bourse des Instituts de recherche en santé du Canada (IRSC) (#187900) et l’UM a été financée par Mitacs (IT178-9 -FR101644).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
Références
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963(2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483(2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. aT., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239(2013).
- Neural offset time evaluation in surface respiratory signals during controlled respiration. Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Annu Int Conf IEEE Eng Med Biol Soc, 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2(2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598(2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199(2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431(2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522(2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827(2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885(2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861(2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon