Method Article
用大面积成像测量水下环境的结构、组成和变化
摘要
该协议涵盖了一个四步大面积成像调查方法,用于提取珊瑚礁群落的结构复杂性、群落组成和种群人口统计的指标。在协议的每个步骤中,都会优先考虑采集的影像质量和对源影像的集成访问。
摘要
数字成像和处理技术已经发展到促进大面积成像调查的扩展,这提高了我们研究生活在潮下带栖息地的生物的状态、趋势和动态的能力。通过创建用于 异地 分析的照片级真实数字孪生,这些方法使小型现场团队能够收集比以前更多的数据。在这里,我们提出了一个四步大面积成像调查管道和分析方法,包括图像收集、模型构建、生态分析和数据管理,这些方法都是通过过去十年的实验开发和完善的。所描述的每个步骤都始终关注原始源影像的唯一价值。虽然从大面积影像调查中提取的数据类型非常广泛,但我们在这里包含了提取结构复杂性、群落组成和人口统计分析的生态数据的工作流程,这些数据对监测和假设驱动的工作很有价值。我们还包括元数据标准的建议,这些标准补充了大面积成像数据的收集并支持存档工作,从而促进了研究小组之间的透明度和协作。
引言
在陆地环境中,研究人员利用了生态群落的标准化大面积采样,特别是在长期研究地点的背景下,包括巴罗科罗拉多岛1、哈伯德布鲁克实验森林2 等3。通过收集空间明确和分类学分辨的分布数据,这种采样已被用于探索基本的生态动力学,例如分散和补充模式 3,4,5、栖息地偏好和可用性、扩散内核、资源限制 3,5,6,7,8 和空间利用 9,10.然而,迄今为止,大多数海洋群落的空间研究都依赖于相对覆盖度的指标,报告为分类群或类群11、12、13、14、15 占据的覆盖百分比。然而,对相对覆盖率的汇总估计不足以解决人口水平人口统计和社区水平动态的细节。对底栖生物群落进行详细分析的研究依赖于费力的水下监测方案 16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,但由于水中方法的作需要,这些研究的规模(包括分类学、空间学和时间学规模)明显受到限制。
大面积成像 (LAI) 是一种通过计算密集型工作流程将来自大量图像的信息组合在一起的方法,以比组成图像大得多的比例创建照片般逼真的环境表示33。LAI 工作流程特别适合水下栖息地的应用,因为水中由于光的吸收和散射而导致能见度有限。由于能见度有限,必须在拍摄对象附近获取捕捉底栖生物精细细节的图像;因此,为了捕捉大片底栖栖息地的景观(或海景)视图,同时保留单个底栖主题的精细细节,需要合成成像。此外,在结构复杂的环境中,在重建复合成像时必须考虑三维 (3D) 结构,以忠实地表示底栖生物的位置和相对接近度。运动结构 (SfM) 摄影测量方法已应用于底栖生物相对固定的环境,包括珊瑚礁34、35、36、南极底栖生态系统37、冷水珊瑚礁38、冷泉39 和海草栖息地40,生成无立体影像的复合成像,用于重建景观场景,并带有后续正射图生成和点云估计。
在珊瑚礁科学中,LAI 提供了在越来越大的空间尺度上可视化珊瑚礁景观并在数字媒体上共享这些可视化的潜力。LAI 可用于估计珊瑚礁生物的覆盖率、珊瑚群落的密度和分布,以及单个生物的形状和状况41、42、43、44、45、46、47。此外,当在不同时间点从同一位置收集 LAI 产品时,可以记录单个生物体的大小和状况的变化 48,49,50,51。鉴于大多数硬化珊瑚群落每年的径向生长速度为毫米到厘米,多年来收集的时间序列 LAI 可以为报告这些物种的生物学和生态学提供宝贵的数据流52。重复和共同注册的 LAI 数据为以可共享、存档和用作全球合作基础的格式研究珊瑚礁提供了独特的见解。
随着珊瑚礁生态学家53 广泛使用 LAI,相机系统和调查方法的多样性也随之扩大52。所选的 LAI 协议应以所需生态指标的分辨率和范围为目标,同时保持在可用资源范围内。任何摄影测量重建的质量最终都取决于源影像的分辨率和调查区域的空间覆盖范围。图像质量由相机参数(包括传感器分辨率和焦距)以及收集程序(主要是与底栖动物54 的距离)的影响决定,所有这些都有助于特定图像集的有效地面采样距离 (GSD)。此外,快速快门速度、小光圈和低 ISO 值将分别产生清晰、聚焦和低电子噪声的图像。在光照水平较低的水下环境中,将这些设置中的每一个都保持在可产生足够质量影像的阈值可能是一项挑战。较大的传感器,如数码单镜头反光 (DSLR) 风格和无反光镜相机上的传感器,与运动相机55 等更小、更便携的解决方案相比,可以产生更好的图像质量,进而提供更准确的重建。在考虑合适的照相机型号时,不应忽视的其他功能包括内置间隔计以及足够的存储和电池容量,以支持现场长时间的图像采集工作。
调查设计应由生态假设驱动,候选指标确定必要的分辨率和空间覆盖范围。在珊瑚礁生态学中,LAI 已被用于表征结构复杂性 35,36,56,57,58,59、群落组成和组合60、61、62、空间分布 45、63、64、65、66 和群落轨迹 48,49,50,67,68,69。图像质量的分辨率应适合生态数据需求,在亚毫米细节上具有更精细的分辨率,以支持沿群落边界的珊瑚虫尺度观察70 或小型幼珊瑚的调查66,71。相比之下,提取大尺度栖息地和结构指标用于沿海测绘 72,73,74 需要更大的空间范围,同时减少对 cm-m 尺度分辨率的需求。对分辨率的需求必须与获得足够的采样所需的空间范围以及完成 LAI 调查所需的时间作限制相平衡33。
这里描述的是进行 LAI 调查的端到端协议,其重点是最大限度地提高源图像的质量、效用和价值,将协议分为四个主要步骤:图像收集、模型构建、生态分析和数据管理33。在过去十年中,收集了 2,000 多个独特珊瑚礁地点的大约 3,500 次 LAI 图像调查,这有助于完善此处介绍的每个步骤的方法 (https://doi.org/10.6075/J0T43RN1)。由此产生的协议是一种稳健的数据收集和准确和精确的模型重建的方法,能够在广泛的应用中收集详细的生态数据,包括结构复杂性、群落组成和人口统计(例如,密度和大小结构)。我们还包括用于存档 LAI 数据的元数据标准,该标准的建立对于确保这些数字孪生的保存、透明度和协作潜力至关重要。
研究方案
1. 图像收集
注:以下大面积影像采集程序概述了一种测量大约 100 m2 区域的方法,尽管它可以很容易地适应 10 m2 到 2,500 m2 的区域。下面描述的调查方法旨在部署在各种工作条件下,生成高质量的影像,并提供强大的数据,这些数据可用于许多生态应用,只需由两人伙伴团队进行一小时的潜水即可。
- 齿轮准备
- 通过使用 1 1/2 英寸长的飞利浦平头螺钉将外框架面板连接到相机安装面板和立柱来组装相机框架(图 1)。
- 准备两台数码单反相机,一台带有固定广角镜头,另一台配备变焦镜头。有关相机的详细设置,请参阅 表 1 。
注意:虽然第二个变焦镜头相机是可选的,但强烈建议捕捉更高的图像分辨率,以确定分类学75,76 的细节,寻找和识别小型幼珊瑚66,71(直径 1-5 厘米),并在未来的生态分析中区分珊瑚群落边界 45,48,50。 - 通过连接圆顶端口组装水下摄像机外壳,并使用随附的圆顶翼形螺钉固定。使用 1/2 英寸长的十字头螺钉连接手柄,使用 1 1/8 英寸长的内六角螺钉连接相机安装板。将相机插入外壳,并使用真空泵将外壳压力设置为 5 英寸。Hg,检查 O 形圈密封件的完整性。
- 将相机安装板滑到安装框架面板上,将外壳安装在相机框架上,并使用翼形螺钉固定到位。
- 绘图设置
- 使用六块带有印刷编码标记的方形不锈钢瓷砖(边长 10 厘米)建立地块的边界。沿目标等深线放置两个相距 10 m 的中央瓦片,在中心瓦片的近海和近海 5 m 处添加四个角瓦片,以形成 10 m x 10 m 的方形地块区域(图 2)。记录 6 个图块中每个图块的深度,以提供本地垂直方向,并简化后续的模型构建步骤。
- 添加参考浮子,将 ~1.5 m 的线附加到 0.45 kg (1 lb) 的砝码上,该砝码位于四个角图块中每个图块外约 1 m 处。
注意:这些参考浮子可作为摄影师的指南,以表示绘图的边界和底栖生物上方的高度,他们应该在底栖生物中游泳。将它们放置在 10 m x 10 m 的绘图边界之外会创建影像的缓冲区,有助于确保完全重建核心成像区域。 - 在地块的每个象限中放置一个 0.5 m 长的比例尺,该比例尺由两个固定在聚氯乙烯 (PVC) 或铝条上的编码目标图块组成,总共部署四个比例尺。
注意:比例尺和深度切片在整个图像收集过程中保持稳定非常重要。比例尺和深度图块也可以用作摄像机作员的视觉地标,以跟踪他们的游泳模式进度。 - 要建立永久地块,请安装 0.46 米(18 英寸)不锈钢桩(0.95 厘米或 3/8 英寸螺纹杆),用两部分船用环氧树脂固定,使用木槌固定在每个中心瓷砖附近,以标记地块的中心线。在陆上观察时,左侧的木桩包括一个锁紧螺母,以协助在未来的调查工作中定位。在调查结束时,使用存储在贴在潜水浮标上的防水箱内的 GPS 装置记录左中桩位置正上方的全球定位系统 (GPS) 坐标。
注意:在允许的情况下,建议安装永久性桩,以减少后续调查的搜索时间,并确认对同一珊瑚礁区域的重新调查。使用打印的二维 (2D) 正射影像或调查地点的“路线图”(补充文件 1)来定位不变特征并帮助确定同一绘图区域的位置以进行成像。这些路线图还可用于在允许不允许安装永久木桩或木桩已移位或移除的情况下重新定位精确的测量地块。
- 图像捕获
- 在绘图的目标深度处使用灰卡设置每个相机的自定义白平衡。
- 在设置为以 1 s-1 间隔拍摄的间隔计上启动每台摄像机。
- 以网格模式在底栖生物上方约 1.5 m 处游泳相机系统,然后以大约 1 m s-1 的慢速游泳,每次通过之间大约 1 m 的垂直网格状通道(图 3)。确保刀路至少超出绘图边界的边缘 2 m,以确保在目标绘图区域内有足够的重叠。
注意:遵循这种游泳模式和速度会导致在 1,700 分钟的成像期间从每台相机至少收集大约 28 张图像。然而,考虑到通过之间的周转时间和过度采样方面的错误,以防止重叠不足导致数据不理想,我们建议潜水员在大约 40 分钟的成像期间从每台相机收集 2,500 张图像。 - 将相机系统大致垂直于海洋表面,以确保足够的自上而下的覆盖范围;但是,对于地形复杂的勘测地点,请在第二次扫描时调整照相机方向,使其垂直于底栖生物,并减少 3D 重建中的遮挡。调整照相机角度时要小心,以尽量减少影像中捕获的蓝色海水。
注意:在海洋条件不理想的情况下,例如强流或陡峭的斜坡,两个通道都可以在相同的沿岸方向进行。在强流中,可能需要仅使用单个广角镜头相机,以减少潜水员保持前进所需的阻力和努力。理想情况下,第二组刀路应相对于第一组略有旋转。如果沿相同的沿岸方向完成两次走刀,则应至少添加一条或两条垂直或对角线的“连接线”,以穿过初始走刀集,以提高重建质量。
2. 模型构建
注意:模型构建步骤的重点是保持对高分辨率源图像的访问并生成派生的密集点云。密集点云的引用发生在集中式可视化和分析软件中(参见 材料表)77,允许用户动态输入和修改。这样,当出现新信息时,就无需重新处理和重新导出数据集的数据产品,尤其是在跨时间进行额外调查时。2D 正射地图(此处称为正射投影)是使用密集点云的正射校正投影视图生成的,其中投影角度与重力方向正交。
- 相机对齐和 3D 密集点云构建
- 使用高性能计算机,通过选择“工作流”|”添加文件夹。加载文件后,选择数据布局作为 单个相机, 添加所有图像 到一个块.从项目中删除场景中蓝色水过多的图像。
注意:在添加到项目中之前,应将每个摄像机中的图像组织到单独的文件夹中,这些文件夹会将数据块中的图像文件作为不同的摄像机组分开。 - 通过选择 “工作流程”|”对齐照片。有关对齐的处理设置,请参阅 表 2 。
- 对齐完成后,根据对齐的摄像机百分比验证图像集是否已成功对齐,并检查生成的稀疏点云是否存在覆盖间隙或未对齐。在继续之前,请确保边界框包含整个稀疏点云。如有必要,请使用 Resize (调整大小 ) 或 Rotate Region (旋转区域 ) 选项对其进行修改。
注意:可以让 100% 的图像对齐,但模型的某些部分仍然存在间隙,相反,80-90% 的图像对齐,但具有目标调查区域的完整模型。因此,应使用对齐百分比和区域覆盖率来做出明智的决策,以确定生成的数据集的部分或全部可用性,或者是否需要在提高图像采集质量或调整对齐处理设置方面做出额外的努力。 - 禁用 包含变焦镜头图像的摄像机组。通过选择 Workflow |构建 Dense Cloud。请参阅 表 2 了解 Build Dense Cloud 的处理设置。
注意:虽然在生态分析期间,应使用来自两台相机的图像进行对齐,以便于查询所有高分辨率图像,但在创建密集点云时不应使用变焦镜头图像,因为两台相机之间白平衡和曝光的细微差异会给密集点云增加视觉噪声。 - 通过选择 工具 |运行脚本 |Extract_meta.py脚本 (补充文件 2)。通过选择 File (文件) |导出 |导出点。有关导出的设置,请参阅 表 2 。
- 将导出的密集点云文件拖放到位于可视化软件程序文件中的 vc5prep-confidence.bat 文件上。
- 将导出的数据文件(包括摄像机姿势文件(*.cams.xml 和 *.meta.json)以及生成的程序文件(*.vml 和包含 *ptdata、*.xml、*.kdm 文件的文件夹)编译到一个目录中,以便在可视化软件中使用。
- 使用高性能计算机,通过选择“工作流”|”添加文件夹。加载文件后,选择数据布局作为 单个相机, 添加所有图像 到一个块.从项目中删除场景中蓝色水过多的图像。
- 缩放和方向
- 在可视化软件中, 使用 缩放器工具 将标记对放置在比例尺目标上,并输入已知距离。
注意:有关缩放器工具的更多详细信息,请参阅补充文件 3 的第 4.2 节。 - 在每个深度平铺上放置标记,并使用 定向工具 调整每个平铺的深度值,以定义与局部垂直线的最佳拟合平面。
注意:有关定向工具的更多详细信息,请参阅补充文件 3 的第 4.4 节。
注意:验证深度光线是否指向上方,以估计的水面结束。如果光线向下,请检查深度图块中是否有移动的证据,这些证据会导致深度值相对于其最终重建位置或深度元数据错误。
- 在可视化软件中, 使用 缩放器工具 将标记对放置在比例尺目标上,并输入已知距离。
- 时间共同注册
- 按照补充文件 3 的第 10.0 节,在软件中为数据集合创建一个组织项目文件。在单个组织项目中包括多个站点和随时间变化的调查。
- 将密集的点云文件作为图层添加到组织工程中,并根据需要修改站点级别的组织结构,以跨时间连接给定站点的密集点云。
注意:使用一致的文件命名方案 [Region]_[Date]_[Site] 来自动化图层组织。 - 为站点选择一个时间点,以用作时间序列比例和方向的参考图层。
注意:可以使用多个图层来设置比例;但是,必须选择一个时间点图层作为方向参考,因为潮汐偏移和较大的涌浪高度会导致深度测量的精度和一致性随时间变化的误差。 - 使用 辅助套准工具 跨时间对齐图层。
注意:更多详细信息可在补充文件 3 的第 11.0 节中找到。如果由于高增长或大膨胀事件而导致较大的结构变化,则最好使用使用候选不变量特征的手动联合配准工作流。对于较长的时间序列,或者当时间发生重大变化时,通常建议将给定模型共同注册到下一个较早的时间点。
- 2D 正射校正
- 使用软件中的 方框工具 ,从表面角度 (g: 0°) 设置视图,边界包含焦点分析区域 (10 m x 10 m) 以及从每个边缘延伸的最小 2 m 缓冲区(最小 w:14 m,最小 h:14 m)。
注意:有关使用方框工具的详细信息,请参阅补充文件 3 的第 6.0 节。 - 在 框工具中,打开 地图导出 以创建正射投影图像文件。将 导出分辨率 设置为 1 毫米 px-1 ,然后选择 捕捉 以生成预览。滚动到包含密集点云完整部分的预览图块,并增加 pt-size 值以填充点之间的间隙。
- 选择 capture 以将正射投影导出为 ppm 文件。捕获完成后,通过将生成的 .ppm 文件拖放到程序文件中的 convert-to-tif-flip.cmd 文件上,将导出的文件转换为 tif。
- 对于时间序列的共配准密集点云,请对站点重复步骤 2.4.2 到 2.4.3,在使用相同的框时更改时间图层。
- 使用软件中的 方框工具 ,从表面角度 (g: 0°) 设置视图,边界包含焦点分析区域 (10 m x 10 m) 以及从每个边缘延伸的最小 2 m 缓冲区(最小 w:14 m,最小 h:14 m)。
3. 生态分析
注意:生态数据提取有无数种选择,我们在这里介绍其中的一些选择。这些核心工作流程侧重于长期监测的既定指标78,79,但可以使用和调整来生成足以进行基于观察的科学调查的数据。用户应根据其个人数据需求和分析目标选择和调整工作流程。下面描述的工作流旨在集成对源影像的直接访问,以帮助对生物数据进行注记,使用 3D 密集点云或 2D 正射投影等衍生产品作为组织框架。
- 结构复杂性
- 使用 rugo 工具,在密集的点云上制作一个 10 m x 10 m 的方框,设置最大尺寸为 10 m(rugo-dim:10.0 m),纵横比为 1.0(四纵横比:1.000),以指定 100 m2 的目标区域进行数据提取。
注意:有关使用 rugo 工具的更多详细信息,请参阅补充文件 3 的第 7.0 节。 - 根据所需的样品间距,设置要采样的样带线数(线)和沿每个样带(样品)的点数。选择 准备 以导出包含每个采样点的 x、y 和 z 坐标的 csv 文件,该文件可用于各种结构复杂性分析。
- 运行 补充文件 4 中的脚本,以生成用于结构复杂性分析的函数。然后,根据所需的指标,按照 补充文件 5 中的脚本来量化结构复杂性。
注意:建议选择用户可能针对的最高分辨率(推荐 1 cm 间距 )的间距刻度,以解决他们感兴趣的刻度,从中可以类似地通过下采样来评估各种刻度,例如此处介绍的刻度(0.5 m 线间距 和 10 cm 点间距)56。
- 使用 rugo 工具,在密集的点云上制作一个 10 m x 10 m 的方框,设置最大尺寸为 10 m(rugo-dim:10.0 m),纵横比为 1.0(四纵横比:1.000),以指定 100 m2 的目标区域进行数据提取。
- 社区构成
- 使用 虚拟点截距 (VPI) 工具, 在密集点云上制作一个 10 m x 10 m 的方框,设置最大尺寸为 10 m (四边形尺寸:10.0 m), 纵横比为 1( 四边形宽高比:1.000), 以指定目标 100 m2 区域进行数据提取。
注意:有关使用虚拟点截距工具的详细信息,请参阅补充文件 3 的第 5.0 节。 - 设置要从分层随机分布的密集点云中采样的点,其中点的数量以所选密度为目标。选择 Prepare (准备 ) 以开始采样点。
注:对于分类学水平的分析,建议使用 25 m-2 (2,500 个点)的采样密度。这里介绍的结果使用了较低的采样密度 (10 m-2) 进行更广泛的群落组成比较调查,重点是功能水平。 - 使用 凸轮工具 将源图像链接到密集的点云,并允许对模型上的点进行空间查询的多图像视图。
注意:有关 cams 工具的更多详细信息,请参阅补充文件 3 的第 4.5 节。 - 使用 VPI 浏览器 Web 小程序,直接使用源影像的多个视图,使用最高分辨率的分类名称主要标注每个点。为每个点添加两组可选的二级标签,珊瑚标签的示例包括漂白应力75 和形态。
注意:可以通过编辑位于 *.pq 文件夹中的 qclasses.json 文件来修改主要和次要标签集。 - 使用 Web 小程序将每个标签的覆盖率百分比摘要导出为 .csv 文件。
- 使用 虚拟点截距 (VPI) 工具, 在密集点云上制作一个 10 m x 10 m 的方框,设置最大尺寸为 10 m (四边形尺寸:10.0 m), 纵横比为 1( 四边形宽高比:1.000), 以指定目标 100 m2 区域进行数据提取。
- 密度调查
- 确保已按照步骤 3.2.3 在软件中链接图像。通过将透视视图的焦距更改为 100 mm,然后缩小到模型的自上而下的完整视图,来设置密集点云的伪地图视图。使用补充文件 6 中的样方采样文件,通过单击单元格 c1 的 eval 来使用 Web 小程序捕获视图,然后选择抓取按钮。
注意:更多详细信息可在补充文件 3 的第 8.0 节中找到。 - 打开摄像头,然后通过单击样方采样脚本中单元格 c2 和 c3 的 eval 在样方采样工作流程中链接图像。
- 确保已按照步骤 3.1.1 制作了一个 rugo box,以指定目标 100 m2 数据提取区域。在 Web 小程序中,评估 c4 制备细胞切片以采样 100 个 1 m2 样方。
- 在 Quadrat Sampling web address中,使用源影像搜索样方并标记目标生物体。双击某个位置可重新定位采样位置。单击分类按钮,将目标点指定为样本。要删除标记的点,请双击该点,然后选择 NOTHING。
注:样方以预先确定的随机顺序显示,允许对样方的子集进行随机采样以进行密度调查。 - 将位于 *aux/recruits/test1 下的所有采样文件编译到一个目录中,重命名每个文件以包含站点名称。将按钮查找文件 (Supplemental File 7) 添加到与采样文件相同的目录中。按照内嵌说明运行 补充文件 8 中的脚本,按位点和分类组将样品数据聚合到密度中。
注意:在这里,我们对无柄无脊椎动物进行采样,但相同的工具可用于调查各种生物,包括幼年和成年珊瑚的密度。
- 确保已按照步骤 3.2.3 在软件中链接图像。通过将透视视图的焦距更改为 100 mm,然后缩小到模型的自上而下的完整视图,来设置密集点云的伪地图视图。使用补充文件 6 中的样方采样文件,通过单击单元格 c1 的 eval 来使用 Web 小程序捕获视图,然后选择抓取按钮。
- 人口学
- 在分割分析软件中加载用于菌落分割的正射投影文件(参见 材料表)80。将多个时间点的共配正射投影文件加载为同一工程文件中 的新地图 ,以分割和追踪菌落随时间的变化大小。
- 通过补充文件 3 第 17.1 节中找到的 iView 的 Web 小程序使用源图像,同时分割菌落作为分类和边界鉴定的参考。确保已按照步骤 3.2.3 在可视化软件中链接图像。在焦点聚落的密集点云上放置一个标记,并滚动浏览不同透视图的标记位置的源图像。
- 使用 正/负单击注记工具 对单个珊瑚群落进行分割。使用基于单击或手动边界调整来修改边界。
4. 数据管理
注意:存档工作应优先保留源图像,因为所有后续衍生产品都是可复制的。虽然给定用户可用的存储库会有所不同,但应努力标准化源图像数据集中包含的相关调查元数据,以便在向更广泛的社区提供时最大限度地发挥其效用。
- 数据存储库
- 生成一个方法描述文件,其中包括测量详细信息,例如覆盖的区域、照相机系统、地面控制标记和采集模式。有关此协议的示例说明,请参阅 补充文件 9 。
- 生成特定于影像数据集的调查元数据文件,包括站点名称、采集日期、GPS 坐标、绘图方位角、地面控制深度和比例数据等字段,以及用于给定调查的采集模式和照相机系统。
注意:强烈建议在调查期间添加包含更广泛的地理背景和条件的其他字段。可以在 补充文件 10 中找到包含推荐字段的示例元数据文件。 - 将描述文件、元数据文件和图像文件合并到一个 zip 存档中,以摄取到选定的数据存储库中。
注意:图像数据集合已在 https://doi.org/10.6075/J0DV1HDR 上提供。
结果
在野外成功收集大面积图像应导致创建密集的点云重建,并完全覆盖调查区域,而覆盖不足的冗余可能会导致点云出现间隙或完全退化(图 4)。对于 2016 年在夏威夷群岛进行的 43 次大面积图像调查,每个数据集平均对齐了 99.6% 的图像,其中 66% 的图像集成功对齐了 100% 的图像。从广角镜头相机采集的图像的平均 GSD 为 0.52 mm px-1 ,而来自变焦镜头相机的图像的平均 GSD 为 0.18 mm px-1。这些调查生成了平均大小为 5.577 亿个点 (15 GB) 的密集点云。
此处描述的生态工作流程旨在生成与现有珊瑚礁监测方法相当的数据78。从夏威夷各地的 LAI 调查中提取的生态数据显示,除了一些异常值外,结构复杂性工作流程产生的线性粗糙度测量与跨地点复杂性的原位测量相比,这些测量与相对值非常吻合81(图 5A、B)。与传统的光样方调查相比,来自 LAI 的额外群落组成分析用于衡量主要底栖功能群的覆盖率显示出相似的对齐82(图 5C,D)。这里的样方采样用于测量无柄无脊椎动物的密度,最常见的是海胆,它们被总结为相对丰度的分类测量。相对于原位方法,LAI 方法经常记录更高水平的丰度81(图 5E,F),这可能是由于与快速目视普查相比,能够全面搜索和调查给定区域内的所有个体。使用 2D 正射投影分割珊瑚群落还揭示了与原位方法83 相似的常见珊瑚分类群的大小分布(图 5G,H)。
LAI 调查的一个主要优势是能够通过对密集点云进行联合配准来存档和跟踪珊瑚礁区域随时间的变化。珊瑚礁是有生命的基质,对于 LAI 勘测来说,这意味着识别可用于可靠地共记录来自不同时间点的密集点云的天然或固定表面可能具有挑战性。千年环礁的例子(图 6)显示了一个同时具有高生长和结构损失的例子,其中辅助协同配准工作流程用于密集的点云协同配准,尽管珊瑚礁表面在时间上几乎没有稳定性。
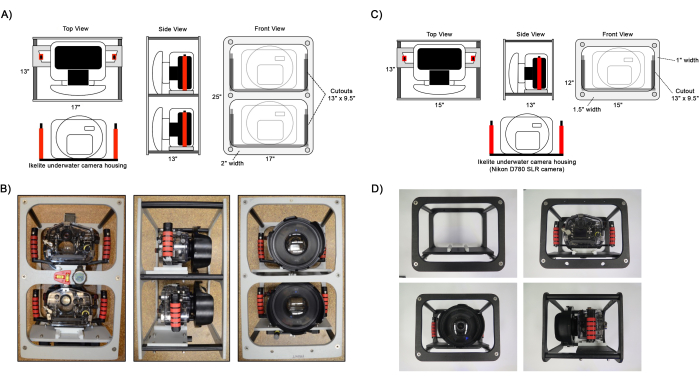
图 1:组装的相机框架图。 (A,B) 双相机和 (C,D) 单相机帧设置的示例视图。Ikelite 相机外壳使用连接到外壳手柄的滑块板连接到相机安装面板上的框架上。如 B所示,可以将辅助导航的可选仪器(如水平仪、指南针和潜水电脑)连接到框架上。 请单击此处查看此图的较大版本。

图 2:设置 100 m2 大面积图像图的示意图。 完全设置的大面积图像图示意图,面积为 100 m2 。临时绘图标记包括 6 个边界切片标记、4 个比例尺和 4 个参考浮点数。当向岸上看时,永久性地块标记包括两个不锈钢桩和左侧桩,包括一个锁紧螺母。该图的 GPS 参考应位于左中图块或木桩上方。 请单击此处查看此图的较大版本。
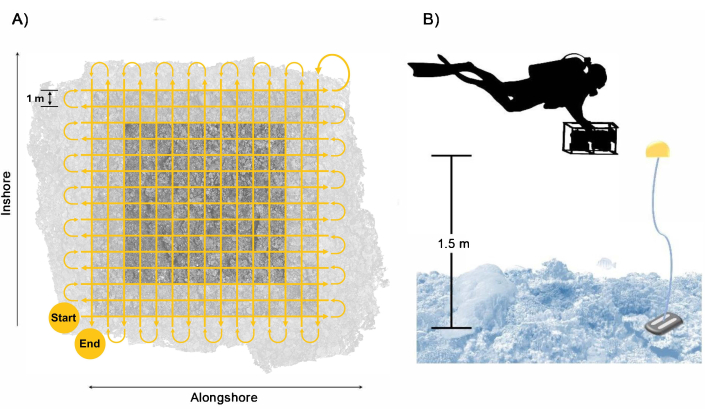
图 3:潜水员收集模式。 (A) 潜水员的游泳路径,以确保有足够的覆盖范围和绘图区域的重叠,包括缓冲区,以及 (B) 潜水员与摄像系统的布置,参考浮子为游泳高度提供指导。 请单击此处查看此图的较大版本。

图 4:减少图像重叠。 通过随机采样,可以减少密集点云随着重叠图像数量的增加而退化。每个面板显示由 (A) 所有图像、(B) 1/2、(C) 1/3、(D) 1/5 和 (E) 原始图像的 1/10 生成的密集点云。 请单击此处查看此图的较大版本。

图 5:生态数据提取。 显示了从每个生态工作流程的大面积成像中提取的候选数据与已建立的原位数据收集方法的比较。这包括 (A,B) 结构复杂性、(C,D) 群落组成(误差线表示标准误差)、(E,F) 无脊椎动物密度和 (G,H) 大小结构人口统计学。缩写:LAI = 大面积成像。 请单击此处查看此图的较大版本。

图 6:密集的点云协同配准。 两个时间上共配的密集点云的示例视觉比较。结构损失区域(可能由涌浪损坏)在视觉上以红色编码,如洋红色箭头所示。结构添加区域,通常归因于珊瑚群落的生长,在视觉上以蓝色编码,如黄色箭头所示。此处描述的联合配准工作流仍可用于动态的珊瑚礁区域,如图所示,其中永久安装的地面控制点 (GCP) 由于过度生长或移位而不可靠。 请单击此处查看此图的较大版本。
| 相机功能 | 推荐设置 |
| 重点 | 自动 |
| 拍摄模式 | P (程序自动) 用于广角镜头 |
| A(光圈优先自动),对于微距镜头,设为 F8 光圈 | |
| 发布模式 | S(快门优先自动) |
| 自动对焦设置 | 自动对焦中央 (AF-C)、单个中央焦点 (S) |
| 自动 ISO 感光度控制 | 上 |
| 最大 ISO 感光度 | 3200 |
| 最小快门速度 | 1/320 |
| 图像质量 | RAW + JPEG |
| 间隔计时器 | 1 秒 |
| 白平衡 | 习惯 |
表 1:推荐的相机设置。 以下是用于优化图像质量的关键相机设置列表。这些设置优先捕获移动作员在水下照明条件下捕获的聚焦图像。
| 对齐照片 | |
| 准确性 | 高 |
| 通用预选 | 不 |
| 关键点限制 | 5000 |
| 连接点限制 | 0 |
| 引导图像匹配 | 不 |
| 自适应相机模型拟合 | 是的 |
| 构建密集云 | |
| 质量 | 高 |
| 深度过滤 | 轻微 |
| 计算点颜色 | 是的 |
| 计算点置信度 | 是的 |
| 导出点 | |
| 文件类型 | 斯坦福 PLY |
| 坐标系统 | 本地坐标 (m) |
| 源数据 | 密集云 |
| 保存点颜色 | 是的 |
| 保存点法线 | 是的 |
| 保存点置信度 | 是的 |
| 保存点类 | 不 |
| 将颜色转换为 8 位 RGB | 是的 |
| 二进制编码 | 是的 |
表 2:3D 密集点云构建设置。 Agisoft Metashape 中用于创建和导出高质量密集点云重建的设置列表。
补充文件 1:路线图。 标有绘图要素和深度的正射镶嵌图像示例,以帮助查找要重新测量的绘图区域。 请点击此处下载此文件。
补充文件 2:Extract_meta.py。 在 Agisoft Metashape 中运行脚本,以导出相机姿态和文件目录信息,以便在 Viscore 中使用以查询原始图像。 请点击此处下载此文件。
补充文件 3:Viscore 指南。 Viscore 软件指南,包括模型可视化、协同配准和生态分析的工作流程。请点击此处下载此文件。
补充文件 4:Rugosity_Functions.rmd. R 中使用的脚本包含处理从 Viscore 中提取的 rugosity 数据的函数。 请单击此处下载此文件。
补充文件 5:Rugosity_Analysis.rmd. R 中用于计算 rugosity 指标的脚本。 请点击此处下载此文件。
补充文件 6:Quadrat_sampling.rpl.json。 Viscore 中用于样方密度分析工作流程的脚本。请点击此处下载此文件。
补充文件 7:Density_taxo_lookup.json。 用于运行样方采样脚本以按分类组聚合样方采样数据的按钮查找文件。 请点击此处下载此文件。
补充文件 8:Density_Analysis.R R 中用于聚合样方采样数据的脚本,这些数据在调查级别按分类组计算密度。 请点击此处下载此文件。
补充文件 9:README.txt 要包含在原始图像中的示例文本文件,用于描述图像捕获方法的数据存档。 请点击此处下载此文件。
补充文件 10:METADATA_KAH_2016-07_03.txt 原始图像中包含的示例文本文件,用于数据存档,其中包含 LAI 调查的元数据字段。这包括用于参考的调查比例和深度数据的字段,以及用于地理环境的整体站点元数据。缩写:LAI = 大面积成像。 请点击此处下载此文件。
讨论
大面积成像是一种工具,使领域科学家能够以比收集的单个图像更大的比例对环境特征进行数字可视化和分析。通过从多个角度捕获环境的多个图像,LAI 协议有助于创建相对广阔的景观(相对于单个图像的空间覆盖范围)的表示,同时保持从原始图像中收集的细节。LAI 的独特价值在于能够跨比例浏览环境数据,从最大比例(由调查的面积范围定义)到最精细比例(由原始影像的已实现分辨率定义)。然而,为了利用这种跨尺度的优势,确保定期和流畅地访问所捕获的所有级别的数据至关重要,特别是在确保轻松访问原始图像和派生的 3D 模型方面。在此处介绍的协议的每个步骤中,我们通过始终确保原始图像与派生的 LAI 模型一起可访问、可用和安全存档,突出了 LAI 的这一独特优势。
LAI 方法将交付直接链接到所收集的原始图像的商品。通过改变图像采集的细节,用户可以生成不同质量和覆盖范围的数据产品。在调查结构复杂的珊瑚礁环境时,水下调查时间有限(或可供捕获的图像数量恒定)的用户可能会优先增加调查区域的区域覆盖范围或增加采样区域每个部分的细节级别。必然会有一个权衡,即大型区域模型每单位面积的细节较少(可能有更多的遮挡),而详细模型覆盖的总面积较少(可能具有较少的遮挡)。在此协议中,我们包括使用两个相机,每个相机都有不同的镜头,这使用户能够对更大的区域进行采样(与广角镜头充分重叠以满足 SfM 要求),同时收集更详细的原始图像(来自变焦镜头的更高细节,照片到照片重叠较少)。通过包括来自两台相机的图像的姿态估计,下游可视化和分析协议包括来自大部分采样区域的更高分辨率视图。尽管该协议旨在扩大调查可行性的范围,但用户可能会发现衍生产品缺乏足够的区域覆盖或原始图像的足够细节来完成首选的分析程序。鼓励用户查看原始图像和派生模型,以确保环境调查协议满足计划需求,并修改水中调查方法(例如,改变地面采样距离、更改调查持续时间或收集的图像数量)以达到区域覆盖率和每单位面积分辨率的首选平衡。
LAI 方法通过捕获信息丰富、覆盖范围广的底栖环境“快照”为水下科学提供价值,这些快照可以节省时间,并且需要有限的特定领域专业知识进行收集。这些数据产品的价值可以参考现有数据流以及新颖和加速的特定领域应用程序来考虑。考虑到与现有数据流的比较,LAI 的分析产品可以提供与水下观察者原地收集的数据直接可比的生态数据 84,85,86,87。我们在这里提供了对来自每个经典原位监测活动和 LAI 产品的标准化分析的生态数据输出的定量分析,遵循此协议。通过关注珊瑚礁监测工作中的四个常见指标(结构复杂性、底栖生物群落组成、移动无脊椎动物的密度和珊瑚大小结构;图 5),我们证明了数据输出具有很强的定量一致性。值得注意的是,对于需要精细观测的数据流(例如,分类学鉴定、生物边界的精确定义),包括定期和可靠地访问原始图像的 LAI 工作流程提供了独特的优势,可以与历史上仅限于沉浸式原位采样的观测机会相媲美。Viscore 提供并在本协议中描述的数据处理和可视化的进步在确保 LAI 衍生的生态数据和原位监测产品的可比性方面具有独特的价值,允许通过结合 LAI 的数字增强工作流程来公正地维护长期数据流。
对于水下科学家来说,LAI 提供了在数据采集和探索中利用新颖和加速的工作流程的机会。LAI 作为一种高分辨率制图工具具有独特的优势,它不仅包含描述底栖环境相对组成的信息,还包含空间特征的信息。LAI 产品明确表示从 SfM 工作流程创建 3D 模型,它包含有关结构复杂性的信息,这些信息可以在多个尺度上探索56。作为捕捉更大面积海景的工具,LAI 产品可以提供考虑底栖生物的空间分布模式和邻域特征的机会45,66。此外,通过能够在更大尺度上可视化底栖景观,可以检测到由于水下远距离能见度的限制而在水下栖息地不易看到的特征,例如太平洋珊瑚礁上常见大型藻类的大规模 (3-4 m) 多边形图案64。
虽然 LAI 为大规模分析提供了机会,但人们已经对与高效水下采集和图像后处理相关的挑战表示担忧。扩大水下图像采集的空间范围将需要技术进步,从潜水员部署的成像到辅助测绘系统88 的使用,并最终使用 ROV38 和 AUV67,89。关于采集模式和相机系统的稳健调查方法将确保在这些不同平台上生成的数据的平稳过渡和一致性。鉴于 LAI 产品的计算需求和大数据格式,一些海洋科学家对工作流程的技术可访问性90 和与生态数据提取相关的大量时间需求表示担忧84,86。然而,越来越多的工具正在出现,它们利用创造性的解决方案来解决数据提取的技术障碍 80,91,92,93。重要的是,使用 AI 增强的 LAI 分析工作流程会受到所提供输入信号质量的限制。因此,无论数据提取是由人类观察者、训练有素的 AI 算法还是(理想情况下)由 AI 加速的人机协同工作流程进行,在保持 LAI 协议中图像采集和数据管理的标准和质量仍然存在一贯的需求。如此处所述,通过始终如一地关注 LAI 协议中原始图像的首要重要性,出现了稳健、透明和一致地探索水下栖息地的独特机会。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了斯克里普斯海洋学研究所 100 岛挑战赛 (100 Island Challenge) 的努力支持。我们感谢 Schmidt Marine Technology Partners、Ed 和 Christy Scripps 以及 Moore Family Foundation 对相关研究和大面积成像培训工作的财政支持,这有助于改进该方法。此外,我们还要感谢科考船 Hi'ialiki、 Hanse Explorer 和 Plan B 的船员,他们为实地工作提供了支持。我们特别感谢 NOAA 太平洋岛屿渔业科学中心生态系统科学部的团队,他们协助实地收集了此处提供的数据。
材料
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
参考文献
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548(2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985(2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535(2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993(2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077(2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197(2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262(2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593(2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979(2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740(2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737(2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276(2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050(2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440(2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957(2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011(2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113(2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077(2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438(2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213(2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594(2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282(2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943(2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569(2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304(2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548(2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145(2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674(2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317(2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。