Method Article
Messung der Struktur, Zusammensetzung und Veränderung von Unterwasserumgebungen mit großflächiger Bildgebung
In diesem Artikel
Zusammenfassung
Dieses Protokoll umfasst eine vierstufige großflächige bildgebende Erhebungsmethode, die zur Extraktion von Metriken der strukturellen Komplexität, der Zusammensetzung der Gemeinschaft und der Populationsdemografie für Korallenriffgemeinschaften verwendet wird. Die Qualität der erfassten Bilder und der integrierte Zugriff auf die Quellbilder werden in jedem Schritt des Protokolls priorisiert.
Zusammenfassung
Die digitale Bildgebungs- und Verarbeitungstechnologie hat sich weiterentwickelt, um die Ausweitung großflächiger bildgebender Erhebungen zu erleichtern, die unsere Fähigkeit erhöhen, den Status, die Trends und die Dynamik von Organismen zu untersuchen, die in subtidalen Lebensräumen leben. Durch die Erstellung fotorealistischer digitaler Zwillinge für Ex-situ-Analysen ermöglichen diese Ansätze kleinen Feldteams, wesentlich mehr Daten zu sammeln, als dies bisher möglich war. Hier stellen wir eine vierstufige, großflächige bildgebende Erhebungspipeline und Analysemethodik vor, die in den letzten zehn Jahren durch Experimente entwickelt und verfeinert wurde, einschließlich Bilderfassung, Modellkonstruktion, ökologischer Analyse und Datenkuration. Bei jedem beschriebenen Schritt liegt der Schwerpunkt konsequent auf dem einzigartigen Wert der ursprünglichen Quellbilder. Während die Arten von Daten, die aus großflächigen Bilderhebungen extrahiert werden, umfangreich sind, beziehen wir hier Arbeitsabläufe ein, um ökologische Daten für strukturelle Komplexität, Gemeinschaftszusammensetzung und demografische Analysen zu extrahieren, die für das Monitoring und hypothesengetriebene Bemühungen wertvoll sind. Darüber hinaus geben wir Empfehlungen für Metadatenstandards, die die Erfassung großflächiger Bilddaten ergänzen und die Archivierung unterstützen, um Transparenz und Zusammenarbeit zwischen Forschungsgruppen zu erleichtern.
Einleitung
In allen terrestrischen Umgebungen haben Forscher die Vorteile standardisierter großflächiger Probenahmen von ökologischen Gemeinschaften genutzt, insbesondere im Zusammenhang mit Langzeitstudienstandorten, darunter Barro Colorado Island1, der Hubbard Brook Experimental Forest2 und andere3. Durch die Sammlung von räumlich expliziten und taxonomisch aufgelösten Verteilungsdaten wurden solche Stichproben verwendet, um grundlegende ökologische Dynamiken zu untersuchen, wie z. B. Ausbreitungs- und Rekrutierungsmuster 3,4,5, Habitatpräferenz und -verfügbarkeit, Ausbreitungskerne, Ressourcenbegrenzung 3,5,6,7,8 und Weltraumnutzung 9,10. Bisher haben sich die meisten räumlichen Studien von marinen Lebensgemeinschaften jedoch auf Metriken der relativen Bedeckung gestützt, die als prozentuale Bedeckung des Taxons oder der Gruppe 11,12,13,14,15 angegeben wird. Aggregierte Schätzungen der relativen Bedeckung reichen jedoch nicht aus, um Details der Demografie auf Bevölkerungsebene sowie der Dynamik auf Gemeindeebene zu klären. Studien, die detaillierte Analysen der benthischen Lebensgemeinschaften lieferten, stützten sich auf mühsame Überwachungsprotokolle im Wasser 16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32, aber der Umfang (einschließlich taxonomischer, räumlicher und chronologischer Skalen) dieser Studien ist aufgrund der betrieblichen Anforderungen der In-Water-Methodik deutlich begrenzt.
Large-Area Imaging (LAI) ist ein Ansatz, bei dem Informationen aus zahlreichen Bildern durch rechenintensive Arbeitsabläufe kombiniert werden, um fotorealistische Darstellungen von Umgebungen in Maßstäben zu erstellen, die viel größer sind als die der konstituierenden Bilder33. Der LAI-Workflow eignet sich besonders gut für Anwendungen in Unterwasserlebensräumen, da die Sicht aufgrund von Lichtabsorption und -streuung im Wasser eingeschränkt ist. Aufgrund der eingeschränkten Sichtbarkeit müssen Bilder, die feine Details des Benthos erfassen, in der Nähe des Motivs aufgenommen werden. Um eine Landschaftsansicht (oder Meereslandschaft) eines breiten Streifens benthischen Lebensraums aufzunehmen und gleichzeitig feine Details einzelner benthischer Motive beizubehalten, ist daher eine zusammengesetzte Bildgebung erforderlich. Darüber hinaus ist es in strukturell komplexen Umgebungen unerlässlich, die dreidimensionale (3D) Struktur bei der Rekonstruktion der zusammengesetzten Bildgebung zu berücksichtigen, um getreue Darstellungen der Position und relativen Nähe benthischer Organismen zu erzeugen. Die photogrammetrische Methode Structure-from-Motion (SfM) wurde auf Umgebungen mit relativ unbeweglichen benthischen Organismen angewendet, darunter Korallenriffe34,35,36, antarktische benthische Ökosysteme37, Kaltwasserkorallenriffe38, kalte Quellen39 und Seegrashabitate40, um eine zusammengesetzte Bildgebung ohne Stereoskopie zu erzeugen, die zur Rekonstruktion einer Landschaftsszene mit anschließender Orthokartengenerierung und Punktwolkenschätzung verwendet wird.
In der Korallenriffforschung hat das LAI das Potenzial geboten, Rifflandschaften auf immer größeren räumlichen Skalen zu visualisieren und diese Visualisierungen über digitale Medien zu teilen. LAI kann verwendet werden, um die Bedeckung von Rifforganismen, die Dichte und Verteilung von Korallenkolonien sowie die Form und den Zustand einzelner Organismen abzuschätzen 41,42,43,44,45,46,47. Wenn LAI-Produkte zu verschiedenen Zeitpunkten am selben Ort gesammelt werden, ist es ferner möglich, Veränderungen in der Größe und dem Zustand einzelner Organismen aufzuzeichnen 48,49,50,51. Angesichts der Tatsache, dass die meisten Skleraktinischen Korallenkolonien radial in der Größenordnung von Millimetern bis Zentimetern pro Jahr wachsen, können Zeitreihen-LAI, die über Jahre hinweg gesammelt wurden, einen unschätzbaren Datenstrom für die Berichterstattung über die Biologie und Ökologie dieser Arten liefern52. Wiederholte und mitregistrierte LAI-Daten bieten einzigartige Einblicke, mit denen Korallenriffe in einem Format untersucht werden können, das geteilt, archiviert und als Grundlage für die weltweite Zusammenarbeit verwendet werden kann.
Mit der zunehmenden Verwendung von LAI unter Korallenriffökologen53 hat sich auch die Vielfalt der Kamerasysteme und Erhebungsmethodenerweitert 52. Ein ausgewähltes LAI-Protokoll sollte auf die Auflösung und den Umfang der gewünschten ökologischen Metriken abzielen und gleichzeitig im Rahmen der verfügbaren Ressourcen bleiben. Die Qualität jeder photogrammetrischen Rekonstruktion hängt letztlich von der Auflösung der Quellbilder und der räumlichen Abdeckung des Erhebungsgebiets ab. Die Bildqualität wird durch den Einfluss von Kameraparametern wie der Sensorauflösung und der Brennweite sowie dem Erfassungsverfahren, hauptsächlich dem Abstand vom Benthos54, bestimmt, die alle zur effektiven Bodenabtastentfernung (GSD) eines bestimmten Bildsatzes beitragen. Darüber hinaus führen kurze Verschlusszeiten, kleine Blendenöffnungen und niedrige ISO-Werte zu Bildern, die scharf und scharf sind und ein geringes elektronisches Rauschen aufweisen. Jede dieser Einstellungen auf Schwellenwerten zu halten, die eine ausreichende Bildqualität erzeugen, kann in Unterwasserumgebungen mit geringen Lichtverhältnissen eine Herausforderung sein. Größere Sensoren, wie sie bei digitalen Spiegelreflexkameras (DSLR) und spiegellosen Kameras zu finden sind, erzeugen eine bessere Bildqualität und damit genauere Rekonstruktionen im Vergleich zu kleineren, mobileren Lösungen wie Action-Kameras55. Zu den weiteren Merkmalen, die bei der Auswahl eines geeigneten Kameramodells nicht außer Acht gelassen werden sollten, gehören ein eingebautes Intervallometer und eine ausreichende Speicher- und Akkukapazität, um die Langzeiterfassung von Bildern vor Ort zu unterstützen.
Das Survey-Design sollte von der ökologischen Hypothese geleitet werden, wobei die Kandidatenmetriken die erforderliche Auflösung und räumliche Abdeckung bestimmen. In der Ökologie der Korallenriffe wurde LAI verwendet, um die strukturelle Komplexität 35,36,56,57,58,59, die Zusammensetzung und Assemblage der Gemeinschaften 60,61,62, die räumliche Verteilung 45,63,64,65,66 und die Verläufe der Gemeinschaft zu charakterisieren 48,49,50,67,68,69. Die Auflösung der Bildqualität sollte dem ökologischen Datenbedarf angemessen sein, mit einer feineren Skalenauflösung im Sub-mm-Detailbereich, die erforderlich ist, um Beobachtungen der Konkurrenz auf Polypenschuppen entlang der Koloniegrenzen70 oder Erhebungen kleiner Jungkorallen 66,71 zu unterstützen. Im Gegensatz dazu erfordert die Extraktion großräumiger Lebensraum- und Strukturmetriken für die Küstenkartierung 72,73,74 eine größere räumliche Ausdehnung mit einem geringeren Auflösungsbedarf auf der cm-m-Skala. Der Bedarf an Auflösung muss mit der räumlichen Ausdehnung abgewogen werden, die erforderlich ist, um eine ausreichende Probenahme zu erhalten, und mit den operationellen Grenzen der Zeit, die für die Durchführung einer LAI-Erhebung benötigt wird33.
Hier wird ein End-to-End-Protokoll für die Durchführung einer LAI-Umfrage beschrieben, das sich auf die Maximierung der Qualität, des Nutzens und des Wertes der Quellbilder konzentriert und das Protokoll in vier Hauptschritte unterteilt: Bilderfassung, Modellkonstruktion, ökologische Analysen und Datenpflege33. Die Sammlung von etwa 3.500 LAI-Bildaufnahmen von über 2.000 einzigartigen Riffstandorten in den letzten zehn Jahren hat zur Verfeinerung der Methodik für jeden hier vorgestellten Schritt beigetragen (https://doi.org/10.6075/J0T43RN1). Das resultierende Protokoll ist eine Methode für eine robuste Datenerfassung und genaue und präzise Modellrekonstruktionen, die die Sammlung detaillierter ökologischer Daten über ein breites Anwendungsspektrum hinweg ermöglichen, einschließlich struktureller Komplexität, Zusammensetzung von Gemeinschaften und demografischer Populationsdaten (z. B. Dichte- und Größenstruktur). Darüber hinaus integrieren wir Metadatenstandards für die Archivierung von LAI-Daten, deren Etablierung unerlässlich ist, um die Bewahrung, Transparenz und das kollaborative Potenzial dieser digitalen Zwillinge zu gewährleisten.
Protokoll
1. Bildersammlung
HINWEIS: Das folgende Verfahren zur großflächigen Bilderfassung beschreibt eine Methode zur Vermessung eines Bereichs von ca. 100 m2, kann jedoch leicht für Bereiche von 10 m2 bis 2.500 m2 angepasst werden. Die unten beschriebene Vermessungsmethode ist so konzipiert, dass sie unter einer Vielzahl von Arbeitsbedingungen eingesetzt werden kann, qualitativ hochwertige Bilder erzeugt und robuste Daten liefert, die für viele ökologische Anwendungen mit dem Aufwand eines einzigen einstündigen Tauchgangs durch ein zweiköpfiges Buddy-Team verwendet werden können.
- Vorbereitung der Ausrüstung
- Montieren Sie den Kamerarahmen, indem Sie die äußeren Rahmenverkleidungen mit 1 1/2" langen Kreuzschlitzschrauben an den Kameramontageplatten und -säulen befestigen (Abbildung 1).
- Bereiten Sie zwei DSLR-Kameras vor, eine mit einem festen Weitwinkelobjektiv und eine zweite Kamera mit einem Zoomobjektiv. In Tabelle 1 finden Sie detaillierte Kameraeinstellungen.
HINWEIS: Obwohl die Kamera mit dem zweiten Zoomobjektiv optional ist, wird dringend empfohlen, eine höhere Bildauflösung zu erfassen, um Details der Taxonomie75,76 zu bestimmen, kleine junge Korallen66,71 (1-5 cm Durchmesser) zu finden und zu identifizieren und die Grenzen der Korallenkolonie 45,48,50 bei zukünftigen ökologischen Analysen zu unterscheiden. - Montieren Sie Unterwasserkameragehäuse, indem Sie den Kuppelanschluss anbringen und mit den mitgelieferten Kuppel-Rändelschrauben befestigen. Befestigen Sie die Griffe mit 1/2" langen Kreuzschlitzschrauben und die Kameramontageplatte mit einer 1 1/8" langen Innensechskantschraube. Setzen Sie die Kameras in das Gehäuse ein und stellen Sie mit der Vakuumpumpe den Gehäusedruck auf 5 Zoll ein. Hg, um die Unversehrtheit der O-Ring-Dichtung zu überprüfen.
- Montieren Sie die Gehäuse am Kamerarahmen, indem Sie die Kameramontageplatte auf die Montagerahmenplatten schieben und mit Rändelschrauben befestigen.
- Aufbau der Handlung
- Legen Sie die Grenzen des Grundstücks mit sechs quadratischen Edelstahlfliesen (10 cm Seitenlänge) mit aufgedruckten codierten Markierungen fest. Platzieren Sie zwei zentrale Kacheln im Abstand von 10 m entlang der Zielisobath, wobei vier Eckplättchen 5 m vor der Küste und vor der Küste der mittleren Kacheln hinzugefügt werden, um eine 10 m x 10 m große quadratische Grundstücksfläche zu schaffen (Abbildung 2). Notieren Sie die Tiefe an jeder der sechs Kacheln, um eine Orientierung zur lokalen Vertikalen zu ermöglichen und nachfolgende Schritte der Modellerstellung zu erleichtern.
- Fügen Sie Referenzschwimmer mit ~1,5 m Leine hinzu, die an 0,45 kg (1 lb) Gewichten etwa 1 m außerhalb jeder der vier Eckkacheln befestigt sind.
HINWEIS: Diese Referenzschwimmer dienen dem Kameramann als Orientierungshilfe, um die Grenzen des Diagramms und die Höhe über dem Benthos zu markieren, in der die Kamera schwimmen soll. Wenn Sie sie außerhalb der Grundstücksgrenzen von 10 m x 10 m platzieren, wird eine Pufferzone der Bilddaten erstellt, die dazu beiträgt, dass der abgebildete Kernbereich vollständig rekonstruiert wird. - Platzieren Sie in jedem Quadranten des Grundstücks einen 0,5 m langen Maßstabsbalken, der aus zwei codierten Zielplättchen besteht, die auf Polyvinylchlorid (PVC) oder Aluminiumbalken befestigt sind, für insgesamt vier ausgehängte Maßstabsleisten.
HINWEIS: Es ist wichtig, dass Maßstabsleisten und Tiefenkacheln während des gesamten Bilderfassungsprozesses stabil bleiben. Maßstabsbalken und Tiefenkacheln können auch als visuelle Orientierungspunkte für den Kameramann verwendet werden, um den Fortschritt des Schwimmmusters zu verfolgen. - Um dauerhafte Parzellen zu errichten, installieren Sie 0,46 m (18 Zoll) Edelstahlpfähle (0,95 cm oder 3/8 Zoll Gewindestange), die mit zweiteiligem Marine-Epoxidharz gesichert sind, indem Sie einen Hammer neben jeder Mittelplatte verwenden, um die Mittellinie des Grundstücks zu markieren. Wenn Sie an Land blicken, enthält der linke Pfahl eine Kontermutter, um die Orientierung bei zukünftigen Vermessungsbemühungen zu erleichtern. Zeichnen Sie am Ende der Untersuchung die GPS-Koordinate (Global Positioning System) direkt über der Position des linken Mittelpfahls mit einem GPS-Gerät auf, das in einem wasserdichten Gehäuse aufbewahrt wird, das an einem Tauchschwimmer befestigt ist.
HINWEIS: Die Installation von permanenten Pfählen wird empfohlen, wenn dies durch Genehmigung zulässig ist, um die Suchzeit bei nachfolgenden Untersuchungen zu verkürzen und die erneute Vermessung desselben Riffbereichs zu bestätigen. Verwenden Sie ein gedrucktes 2D-Orthobild (2D) oder eine "Roadmap" (Ergänzende Datei 1) des Vermessungsstandorts, um unveränderliche Features zu lokalisieren und die Position desselben Plotbereichs für die Bildgebung zu identifizieren. Diese Fahrkarten können auch verwendet werden, um genaue Vermessungsflächen zu verlegen, wenn die Genehmigung die Installation von dauerhaften Pfählen nicht zulässt oder wenn Pfähle verschoben oder entfernt wurden.
- Bilderfassung
- Legen Sie den benutzerdefinierten Weißabgleich jeder Kamera mit einer grauen Karte auf die Zieltiefe des Diagramms fest.
- Starten Sie jede Kamera auf einem Intervallmesser, das so eingestellt ist, dass es in einem Intervall von 1 s-1 aufnimmt.
- Schwimmen Sie das Kamerasystem etwa 1,5 m über dem Benthos in einem gerasterten Muster, gefolgt von einem zweiten senkrechten Gitterdurchgang mit einem Abstand von ca. 1 m zwischen jedem Durchgang, wobei Sie mit einer langsamen Geschwindigkeit von ca. 0,25 m s-1 schwimmen (Abbildung 3). Stellen Sie sicher, dass die Bahnen mindestens 2 m über die Ränder der Parzellengrenzen hinausragen, um eine ausreichende Überlappung innerhalb des Zielparzellenbereichs zu gewährleisten.
HINWEIS: Das Befolgen dieses Schwimmmusters und dieser Geschwindigkeit führt zu einer minimalen Erfassung von ca. 1.700 Bildern von jeder Kamera während einer 28-minütigen Bildgebung. Um jedoch die Durchlaufzeit zwischen den Durchgängen zu berücksichtigen und sich bei der Überabtastung zu irren, um eine unzureichende Überlappung zu puffern, die zu suboptimalen Daten führt, empfehlen wir, dass Taucher die Sammlung von 2.500 Bildern von jeder Kamera während einer Bildgebungszeit von etwa 40 Minuten anstreben. - Halten Sie das Kamerasystem ungefähr senkrecht zur Meeresoberfläche, um eine ausreichende Abdeckung von oben nach unten zu gewährleisten. Bei Vermessungsstandorten mit komplexer Topografie sollten Sie jedoch die Kameraausrichtung im zweiten Durchgang so anpassen, dass sie senkrecht zum Benthos verläuft und Okklusionen in der 3D-Rekonstruktion reduziert werden. Achten Sie beim Ausrichten der Kamera darauf, das blaue Wasser, das in den Bildern erfasst wird, zu minimieren.
HINWEIS: Bei suboptimalen Meeresbedingungen wie starken Strömungen oder steilen Hängen können beide Pässe in gleicher Küstenrichtung durchgeführt werden. Die Verwendung nur einer Kamera mit einem Weitwinkelobjektiv kann bei starker Strömung erforderlich sein, um das Widerstandsprofil und die Anstrengung des Tauchers zu reduzieren, die erforderlich ist, um vorwärts zu kommen. Der zweite Durchgang sollte idealerweise relativ zum ersten leicht gedreht werden. Wenn zwei Durchgänge in der gleichen Richtung entlang der Küste durchgeführt werden, sollten mindestens ein oder zwei senkrechte oder diagonale "Ankerlinien" hinzugefügt werden, die den ursprünglichen Satz von Durchgängen durchschneiden, um die Rekonstruktionsqualität zu verbessern.
2. Modellbau
HINWEIS: Der Schritt der Modellerstellung konzentriert sich auf die Aufrechterhaltung des Zugriffs auf hochauflösende Quellbilddaten und die Generierung der abgeleiteten Punktwolke mit hoher Dichte. Die Referenzierung der dichten Punktwolke erfolgt innerhalb der zentralisierten Visualisierungs- und Analysesoftware (siehe Materialtabelle)77, so dass der Benutzer im laufenden Betrieb eingeben und ändern kann. Dadurch entfällt die Notwendigkeit, Datenprodukte für einen Datensatz erneut zu verarbeiten und zu exportieren, wenn neue Informationen auftauchen, insbesondere bei zusätzlichen Erhebungen im Laufe der Zeit. 2D-Orthomaps, hier als Orthoprojektionen bezeichnet, werden mit Hilfe einer orthorektifizierten Projektionsansicht der dichten Punktwolke erzeugt, wobei der Projektionswinkel orthogonal zur Schwerkraft verläuft.
- Maßstab und Ausrichtung
- Verwenden Sie in der Visualisierungssoftware das Skalierungswerkzeug, um Markierungspaare auf Maßstabsleistenzielen zu platzieren und den bekannten Abstand einzugeben.
HINWEIS: Weitere Informationen zum Skalierungstool finden Sie in Abschnitt 4.2 der Zusatzdatei 3. - Platzieren Sie Markierungen auf jeder Tiefenkachel und verwenden Sie das Ausrichten-Werkzeug , um die Tiefenwerte für jede Kachel anzupassen und die am besten an die lokale Vertikale angepasste Ebene zu definieren.
HINWEIS: Weitere Einzelheiten zum Ausrichtungswerkzeug finden Sie in Abschnitt 4.4 der Zusatzdatei 3.
HINWEIS: Vergewissern Sie sich, dass die Tiefenstrahlen nach oben zeigen und an der geschätzten Wasseroberfläche enden. Im Falle von nach unten gerichteten Strahlen prüfen Sie, ob die Tiefenkacheln auf Anzeichen von Bewegungen hinweisen, die zu Fehlern im Tiefenwert relativ zur endgültigen rekonstruierten Position oder zu Fehlern in den Tiefenmetadaten führen würden.
- Verwenden Sie in der Visualisierungssoftware das Skalierungswerkzeug, um Markierungspaare auf Maßstabsleistenzielen zu platzieren und den bekannten Abstand einzugeben.
- Zeitliche Koregistrierung
- Erstellen Sie in der Software eine Organisationsprojektdatei für eine Datenerfassung gemäß Abschnitt 10.0 der Zusatzdatei 3. Schließen Sie mehrere Sites mit Umfragen im Zeitverlauf in ein einzelnes Organisationsprojekt ein.
- Fügen Sie dem Organisationsprojekt Punktwolkendateien mit hoher Dichte als Layer hinzu, und ändern Sie die Organisationsstruktur auf Site-Ebene nach Bedarf, um dichte Punktwolken einer bestimmten Site im Zeitverlauf zu verbinden.
HINWEIS: Verwenden Sie ein einheitliches Dateibenennungsschema von [Region]_[Datum]_[Standort], um die Layer-Organisation zu automatisieren. - Wählen Sie einen Zeitpunkt für einen Standort aus, der als Referenz-Layer für den Maßstab und die Ausrichtung der Zeitserie dienen soll.
HINWEIS: Zum Festlegen des Maßstabs können mehrere Ebenen verwendet werden. Für die Orientierung muss jedoch ein Zeitpunkt-Layer als Referenz ausgewählt werden, da Gezeitenverschiebungen und große Seegangshöhen zu Fehlern in der Genauigkeit und Konsistenz von Tiefenmessungen über die Zeit führen. - Verwenden Sie das Werkzeug für die unterstützte Koregistrierung , um Layer über die Zeit hinweg auszurichten.
HINWEIS: Weitere Einzelheiten finden Sie in Abschnitt 11.0 der Zusatzdatei 3. In Fällen großer struktureller Veränderungen aufgrund von hohem Wachstum oder großen Wellenereignissen kann es vorzuziehen sein, den manuellen Coregistrierungs-Workflow mit invarianten Kandidatenmerkmalen zu verwenden. Bei längeren Zeitreihen oder bei erheblichen Änderungen im Laufe der Zeit wird im Allgemeinen empfohlen, ein bestimmtes Modell mit dem nächsthöheren früheren Zeitpunkt zu koregistrieren.
3. Ökologische Analyse
HINWEIS: Es gibt unzählige Möglichkeiten zur ökologischen Datenextraktion, von denen wir hier eine Auswahl vorstellen. Diese Kern-Workflows konzentrieren sich auf etablierte Metriken für das Langzeitmonitoring78,79, können aber verwendet und angepasst werden, um Daten zu generieren, die für beobachtungsbasierte wissenschaftliche Untersuchungen ausreichen. Die Nutzer sollten Workflows basierend auf ihren individuellen Datenbedürfnissen und analytischen Zielen auswählen und anpassen. Die unten beschriebenen Workflows sind so konzipiert, dass sie den direkten Zugriff auf die Quellbilddaten integrieren, um die Annotation biologischer Daten zu unterstützen, wobei abgeleitete Produkte wie die 3D-Punktwolke mit hoher Dichte oder die 2D-Orthoprojektion als organisatorischer Rahmen verwendet werden.
- Strukturelle Komplexität
- Erstellen Sie mit dem rugo-Werkzeug einen 10 m x 10 m großen Quader auf der dichten Punktwolke, indem Sie eine maximale Abmessung von 10 m (Rugo-Dim: 10,0 m) und ein Seitenverhältnis von 1,0 (Quad-Aspekt: 1.000) festlegen, um den Zielbereich von 100 m2 für die Datenextraktion zu kennzeichnen.
HINWEIS: Weitere Details zur Verwendung des rugo-Tools finden Sie in Abschnitt 7.0 der Zusatzdatei 3. - Legen Sie die Anzahl der zu erfassenden Transektlinien (Linien) und die Anzahl der Punkte entlang jedes Transekts (Proben) basierend auf dem gewünschten Probenabstand fest. Wählen Sie Vorbereiten aus, um eine CSV-Datei zu exportieren, die die X-, Y- und Z-Koordinaten jedes erfassten Punktes enthält und für eine Vielzahl von strukturellen Komplexitätsanalysen verwendet werden kann.
- Führen Sie das Skript in der Zusatzdatei 4 aus, um Funktionen zu generieren, die für strukturelle Komplexitätsanalysen verwendet werden. Befolgen Sie dann die Skripte in der Zusatzdatei 5 basierend auf den gewünschten Metriken, um die strukturelle Komplexität zu quantifizieren.
HINWEIS: Es wird empfohlen, einen Abstandsmaßstab mit der höchsten Auflösung (1 cm Abstand empfohlen) zu wählen, den Benutzer für ihren interessierenden Maßstab anvisieren können, von dem aus eine Vielzahl von Maßstäben, wie die hier vorgestellten (0,5 m Zeilenabstand und 10 cm Punktabstand), in ähnlicher Weise durch Downsampling56 bewertet werden können.
- Erstellen Sie mit dem rugo-Werkzeug einen 10 m x 10 m großen Quader auf der dichten Punktwolke, indem Sie eine maximale Abmessung von 10 m (Rugo-Dim: 10,0 m) und ein Seitenverhältnis von 1,0 (Quad-Aspekt: 1.000) festlegen, um den Zielbereich von 100 m2 für die Datenextraktion zu kennzeichnen.
- Zusammensetzung der Gemeinschaft
- Erstellen Sie mit dem Werkzeug Virtueller Punktabschnitt (VPI) einen 10 m x 10 m großen Quader in der dichten Punktwolke, indem Sie eine maximale Abmessung von 10 m (Quad-Dim: 10,0 m) und ein Seitenverhältnis von 1 (Quad-Aspekt: 1.000) festlegen, um den Zielbereich von 100 m2 für die Datenextraktion festzulegen.
HINWEIS: Einzelheiten zur Verwendung des Werkzeugs "Virtueller Punktabschnitt" finden Sie in Abschnitt 5.0 der Zusatzdatei 3. - Legen Sie die Punkte, die aus der dichten Punktwolke abgetastet werden sollen, in einer geschichteten Zufallsverteilung fest, wobei die Anzahl der Punkte auf eine ausgewählte Dichte ausgerichtet ist. Wählen Sie Vorbereiten aus, um mit den Probenahmepunkten zu beginnen.
HINWEIS: Für Analysen auf taxonomischer Ebene wird eine Probenahmedichte von 25 m-2 (2.500 Punkte) empfohlen. Die hier vorgestellten Ergebnisse verwendeten eine geringere Stichprobendichte (10 m-2) für eine breitere Vergleichserhebung zur Zusammensetzung der Gemeinschaft, die sich auf eine funktionale Ebene konzentrierte. - Verwenden Sie das Werkzeug cams, um die Quellbilder mit der dichten Punktwolke zu verknüpfen und räumlich abgefragte Mehrfachbildansichten von Punkten auf dem Modell zu ermöglichen.
HINWEIS: Weitere Einzelheiten zum Nocken-Tool finden Sie in Abschnitt 4.5 der Zusatzdatei 3. - Verwenden Sie das VPI-Browser-Web-Applet, um jeden Punkt direkt mit seiner taxonomischen Bezeichnung mit der höchsten Auflösung zu beschriften, indem Sie mehrere Ansichten der Quellbilddaten verwenden. Fügen Sie für jeden Punkt zwei optionale Sätze sekundärer Beschriftungen hinzu, mit Beispielen für Korallenbeschriftungen, einschließlich Bleichstress75 und Morphologie.
HINWEIS: Primäre und sekundäre Beschriftungssätze können geändert werden, indem Sie die qclasses.json Datei im Ordner *.pq bearbeiten. - Exportieren Sie eine Zusammenfassung der prozentualen Abdeckung für jedes Etikett als .csv Datei mit dem Web-Applet.
- Erstellen Sie mit dem Werkzeug Virtueller Punktabschnitt (VPI) einen 10 m x 10 m großen Quader in der dichten Punktwolke, indem Sie eine maximale Abmessung von 10 m (Quad-Dim: 10,0 m) und ein Seitenverhältnis von 1 (Quad-Aspekt: 1.000) festlegen, um den Zielbereich von 100 m2 für die Datenextraktion festzulegen.
- Erhebung der Dichte
- Stellen Sie sicher, dass die Bilder bereits in der Software verknüpft wurden, indem Sie Schritt 3.2.3 ausführen. Legen Sie eine Pseudo-Kartenansicht der dichten Punktwolke fest, indem Sie die Brennweite der perspektivischen Ansicht auf 100 mm ändern und auf eine vollständige Ansicht des Modells von oben nach unten verkleinern. Verwenden Sie die quadratische Sampling-Datei in der Zusatzdatei 6, um die Ansicht mit dem Web-Applet zu erfassen, indem Sie für Zelle c1 auf eval klicken und dann die Schaltfläche "Greifen" auswählen.
HINWEIS: Weitere Einzelheiten finden Sie in Abschnitt 8.0 der Zusatzdatei 3. - Schalten Sie die Kameras ein und verknüpfen Sie dann Bilder innerhalb des Quadrat-Sampling-Workflows, indem Sie für die Zellen c2 und c3 im Quadrat-Sampling-Skript auf eval klicken.
- Stellen Sie sicher, dass nach Schritt 3.1.1 bereits ein Rugo-Feld erstellt wurde, um den angestrebten Datenextraktionsbereich von 100 m2 zu kennzeichnen. Werten Sie im Web-Applet den Abschnitt c4-Vorbereitungszellen aus, um 100 1 m2 Quadrate zu beproben.
- Verwenden Sie in der Webadresse "Quadrat Sampling" die Quellbilder, um ein Quadrat zu durchsuchen und Zielorganismen zu markieren. Doppelklicken Sie mit der linken Maustaste auf eine Position, um die Stichprobenposition neu auszurichten. Klicken Sie auf eine taxonomische Schaltfläche, um den Zielpunkt als Stichprobe festzulegen. Um einen markierten Punkt zu entfernen, doppelklicken Sie mit der linken Maustaste auf diesen Punkt und wählen Sie NICHTS.
HINWEIS: Quadrate werden in einer vorgegebenen Zufallsreihenfolge dargestellt, so dass eine Teilmenge von Quadraten für Dichteerhebungen nach dem Zufallsprinzip ausgewählt werden kann. - Kompilieren Sie alle Sampling-Dateien, die sich unter *aux/recruits/test1 befinden, in ein einzelnes Verzeichnis, und benennen Sie jede Datei so um, dass sie den Site-Namen enthält. Fügen Sie die Nachschlagedatei der Schaltfläche (Supplemental File 7) demselben Verzeichnis wie die Samplingdateien hinzu. Führen Sie das Skript in der Zusatzdatei 8 aus, und befolgen Sie die Inline-Anweisungen, um Beispieldaten nach Standort und taxonomischer Gruppe in Dichte zu aggregieren.
HINWEIS: Hier beproben wir sessile wirbellose Tiere, aber das gleiche Werkzeug kann verwendet werden, um eine Vielzahl von Organismen zu erfassen, einschließlich juveniler und adulter Korallendichten.
- Stellen Sie sicher, dass die Bilder bereits in der Software verknüpft wurden, indem Sie Schritt 3.2.3 ausführen. Legen Sie eine Pseudo-Kartenansicht der dichten Punktwolke fest, indem Sie die Brennweite der perspektivischen Ansicht auf 100 mm ändern und auf eine vollständige Ansicht des Modells von oben nach unten verkleinern. Verwenden Sie die quadratische Sampling-Datei in der Zusatzdatei 6, um die Ansicht mit dem Web-Applet zu erfassen, indem Sie für Zelle c1 auf eval klicken und dann die Schaltfläche "Greifen" auswählen.
- Demographie
- Laden Sie die Orthoprojektionsdatei für die Koloniesegmentierung in die Segmentierungsanalysesoftware (siehe Materialtabelle)80. Laden Sie gemeinsam registrierte Orthoprojektionsdateien für mehrere Zeitpunkte als neue Maps innerhalb derselben Projektdatei, um die Größe von Kolonien im Zeitverlauf zu segmentieren und zu verfolgen.
- Verwenden Sie die Quellbilder über das Web-Applet für iView , das in Abschnitt 17.1 der Zusatzdatei 3 zu finden ist, während Sie Kolonien als Referenz für die taxonomische und Grenzidentifizierung segmentieren. Stellen Sie sicher, dass die Bilder bereits in der Visualisierungssoftware verknüpft wurden, indem Sie Schritt 3.2.3 befolgen. Platzieren Sie eine Markierung auf der dichten Punktwolke für die Fokuskolonie und scrollen Sie durch die Quellbilder, um die Position der Markierung für verschiedene perspektivische Ansichten zu erhalten.
- Verwenden Sie das Anmerkungswerkzeug für positive/negative Klicks , um einzelne Korallenkolonien zu segmentieren. Ändern Sie Berandungen mit klickbasierter oder manueller Berandungsanpassung.
4. Datenpflege
HINWEIS: Bei der Archivierung sollte die Bewahrung der Quellbilder Vorrang haben, da alle nachfolgenden abgeleiteten Produkte reproduzierbar sind. Obwohl die Repositories, die einem bestimmten Benutzer zur Verfügung stehen, variieren können, sollten Anstrengungen unternommen werden, um die zugehörigen Umfragemetadaten, die im Quellbild-Datensatz enthalten sind, zu standardisieren, um ihren Nutzen zu maximieren, wenn sie der breiteren Gemeinschaft zur Verfügung gestellt werden.
- Datenspeicher
- Generieren Sie eine Methodenbeschreibungsdatei, die Vermessungsdetails wie abgedeckte Fläche, Kamerasystem, Bodenkontrollmarkierungen und Erfassungsmuster enthält. Siehe Ergänzende Datei 9 für eine Beispielbeschreibung für dieses Protokoll.
- Generieren Sie eine Vermessungsmetadatendatei, die für das Bilddataset spezifisch ist, einschließlich Feldern wie Standortname, Erfassungsdatum, GPS-Koordinaten, Parzellenpeilung, Bodenkontrolltiefe und Maßstabsdaten sowie dem verwendeten Erfassungsmuster und Kamerasystem für die jeweilige Vermessung.
HINWEIS: Zusätzliche Felder, die einen breiteren geografischen Kontext und die Bedingungen während der Erhebung enthalten, werden dringend empfohlen. Ein Beispiel für eine Metadatendatei mit empfohlenen Feldern finden Sie in der Zusatzdatei 10. - Kombinieren Sie die Beschreibungsdatei, die Metadatendatei und die Bilddateien in einem einzigen ZIP-Archiv, das in das ausgewählte Datenrepository aufgenommen wird.
HINWEIS: Sammlungen von Bilddaten wurden unter https://doi.org/10.6075/J0DV1HDR zur Verfügung gestellt.
Ergebnisse
Eine erfolgreiche großflächige Bilderfassung im Feld sollte zur Erstellung einer dichten Punktwolkenrekonstruktion mit vollständiger Top-Down-Abdeckung des Vermessungsgebiets führen, während eine unzureichende Redundanz in der Abdeckung zu Lücken oder einer vollständigen Verschlechterung der Punktwolke führen kann (Abbildung 4). Bei einer Reihe von 43 großflächigen Bilderhebungen, die im Jahr 2016 auf dem hawaiianischen Archipel durchgeführt wurden, wurden durchschnittlich 99,6 % der Bilder pro Datensatz ausgerichtet, wobei 66 % der Bildsätze 100 % der Bilder erfolgreich ausgerichtet hatten. Bilder, die von der Kamera mit Weitwinkelobjektiv aufgenommen wurden, wiesen eine durchschnittliche GSD von 0,52 mm px-1 auf, während Bilder von der Kamera mit Zoomobjektiv eine durchschnittliche GSD von 0,18 mm px-1 aufwiesen. Diese Durchmusterungen erzeugten dichte Punktwolken mit einer durchschnittlichen Größe von 557,7 Millionen Punkten (15 GB).
Die hier beschriebenen ökologischen Arbeitsabläufe wurden so konzipiert, dass sie Daten generieren, die mit bestehenden Methoden zur Überwachung von Korallenriffen vergleichbar sind78. Ökologische Daten, die aus den LAI-Erhebungen auf Hawaii extrahiert wurden, zeigen, abgesehen von einigen Ausreißern, Messungen der linearen Rauheit, die sich aus dem Arbeitsablauf der strukturellen Komplexität ergeben und gut mit den relativen Werten im Vergleich zu In-situ-Messungen der Komplexität an Standorten übereinstimmen81 (Abbildung 5A,B). Zusätzliche Analysen der Zusammensetzung der Gemeinschaft aus LAI zur Messung der prozentualen Abdeckung der wichtigsten benthischen funktionellen Gruppen zeigen eine ähnliche Übereinstimmung im Vergleich zu herkömmlichen Photoquadrat-Erhebungen82 (Abbildung 5C,D). Die quadratische Stichprobe wurde hier verwendet, um die Dichte von sessilen wirbellosen Tieren zu messen, wobei Seeigel am häufigsten sind, die als kategoriale Maße für die relative Abundanz zusammengefasst wurden. LAI-Methoden verzeichneten im Vergleich zu In-situ-Methoden regelmäßig höhere Abundanzniveaus81 (Abbildung 5E,F), was möglicherweise auf die Fähigkeit zurückzuführen ist, alle Individuen innerhalb eines bestimmten Gebiets im Vergleich zu einer schnellen visuellen Zählung umfassend zu durchsuchen und zu befragen. Die Segmentierung von Korallenkolonien mit Hilfe der 2D-Orthoprojektion ergab auch ähnliche Größenverteilungen der häufigen Korallentaxa wie bei in situ Methoden83 (Abbildung 5G,H).
Ein großer Vorteil von LAI-Vermessungen ist die Möglichkeit, Veränderungen in Riffgebieten im Laufe der Zeit durch die Koregistrierung der dichten Punktwolke zu archivieren und zu verfolgen. Korallenriffe sind lebende Substrate, was für LAI-Erhebungen bedeutet, dass es schwierig sein kann, dauerhafte Oberflächen zu identifizieren, entweder natürliche oder installierte, die zur zuverlässigen Koregistrierung dichter Punktwolken aus verschiedenen Zeitpunkten verwendet werden können. Das Beispiel vom Millennium-Atoll (Abbildung 6) zeigt ein Beispiel mit hohem Wachstum und strukturellem Verlust, bei dem der unterstützte Koregistrierungs-Workflow für die Koregistrierung dichter Punktwolken verwendet wurde, obwohl die Riffoberfläche im Laufe der Zeit wenig bis gar nicht stabil war.
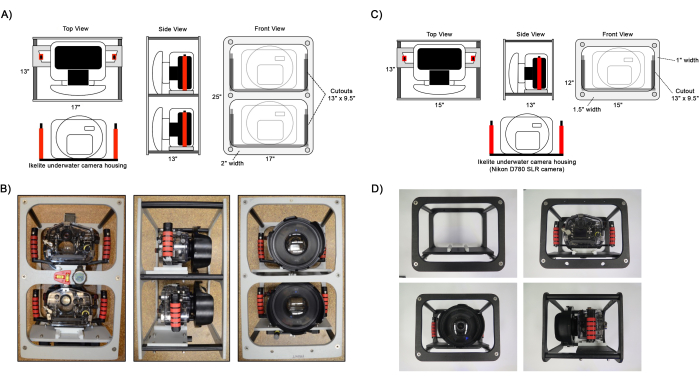
Abbildung 1: Diagramm der zusammengesetzten Kamerarahmen. Beispielansichten der (A,B) Dual- und (C,D) Einzelkamera-Frames. Ikelite Kameragehäuse werden mit einer Schiebeplatte, die an den Gehäusegriffen befestigt ist, am Rahmen an der Kamerahalterung befestigt. Optionale Instrumente zur Unterstützung der Navigation wie Wasserwaage, Kompass und Tauchcomputer können am Rahmen angebracht werden, wie in B gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Diagramm des Aufbaus eines großflächigen Bilddiagramms von 100 m2 . Schematische Darstellung eines vollständig eingerichteten großflächigen Bildplots mit einer Fläche von 100 m2 . Zu den temporären Plot-Markierungen gehören sechs Grenzkachel-Marker, vier Maßstabsleisten und vier Referenz-Gleitkommazahlen. Zu den dauerhaften Grundstücksmarkierungen gehören zwei Edelstahlpfähle mit dem linken Pfahl, wenn man an Land schaut, einschließlich einer Kontermutter. Die GPS-Referenz für das Grundstück sollte über der linken Mittelkachel oder dem Pfahl eingenommen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
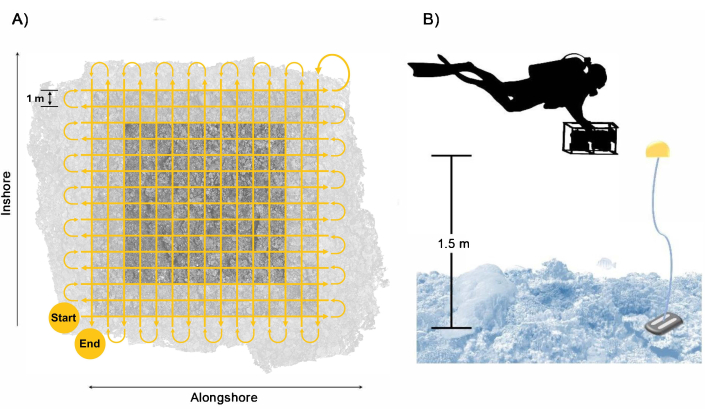
Abbildung 3: Muster der Taucher-Sammlung. Beispiel für (A) den Schwimmweg des Tauchers, um eine ausreichende Abdeckung und Überlappung des Grundstücksbereichs mit einem Puffer zu gewährleisten, und (B) die Anordnung des Tauchers mit dem Kamerasystem mit den Referenzschwimmern, die eine Richtschnur für die Schwimmhöhe bieten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Reduzierung der Bildüberlappung. Die Verschlechterung der dichten Punktwolke mit zunehmender Anzahl überlappender Bilder wird durch Zufallsstichproben reduziert. Jedes Fenster zeigt die dichte Punktwolke, die aus (A) allen Bildern, (B) 1/2, (C) 1/3, (D) 1/5 und (E) 1/10 der Originalbilder generiert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Ökologische Datenextraktion. Kandidatendaten, die für jeden der ökologischen Arbeitsabläufe aus der großflächigen Bildgebung extrahiert wurden, werden im Vergleich zu etablierten in situ Datenerhebungsmethoden gezeigt. Dazu gehören (A,B) strukturelle Komplexität, (C,D) Zusammensetzung der Gemeinschaft (Fehlerbalken zeigen Standardfehler an), (E,F) Dichte von Wirbellosen und (G,H) Demografie der Größenstruktur. Abkürzung: LAI = large-area imaging. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Koregistrierung von dichten Punktwolken. Ein Beispiel für einen visuellen Vergleich zweier zeitlich koregistrierter dichter Punktwolken. Bereiche mit strukturellen Verlusten, die wahrscheinlich durch Seegangsschäden verursacht wurden, sind visuell rot gekennzeichnet, wie durch den magentafarbenen Pfeil angezeigt. Bereiche mit struktureller Ergänzung, die typischerweise auf das Wachstum von Korallenkolonien zurückzuführen sind, sind visuell blau codiert, wie durch den gelben Pfeil angezeigt. Der hier beschriebene Coregistrierungs-Workflow kann auch für so dynamische Riffbereiche wie hier verwendet werden, in denen fest installierte Ground Control Points (GCPs) aufgrund von Überwucherung oder Verschiebung unzuverlässig wären. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Kamera-Funktion | Empfohlene Einstellung |
| Brennpunkt | Auto |
| Aufnahmemodus | P (Programmed Auto) für Weitwinkelobjektiv |
| A (Blendenautomatik), eingestellt auf eine Blende von F8 für Makroobjektiv | |
| Release-Modus | S (Automatik mit Verschlussautomatik) |
| Autofokus-Einstellungen | Autofokus zentral (AF-C), Einzelner zentraler Punkt (S) |
| Automatische ISO-Empfindlichkeitssteuerung | AUF |
| Maximale ISO-Empfindlichkeit | 3200 |
| Minimale Verschlusszeit | 1/320 |
| Bildqualität | RAW + JPEG |
| Intervalltaktgeber | 1 Sek. |
| Weißabgleich | Gewohnheit |
Tabelle 1: Empfohlene Kameraeinstellungen. Im Folgenden finden Sie eine Liste der wichtigsten Kameraeinstellungen, die zur Optimierung der Bildqualität verwendet werden. Diese Einstellungen priorisieren die Aufnahme von scharfen Bildern, die von einem sich bewegenden Bediener unter Unterwasserlichtbedingungen aufgenommen wurden.
| Fotos ausrichten | |
| Genauigkeit | Hoch |
| Generische Vorauswahl | Nein |
| Schlüsselpunkt-Limit | 5000 |
| Begrenzung des Verknüpfungspunkts | 0 |
| Geführter Bildabgleich | Nein |
| Anpassung des adaptiven Kameramodells | Ja |
| Dichte Cloud erstellen | |
| Qualität | Hoch |
| Tiefenfilterung | Leicht |
| Punktfarben berechnen | Ja |
| Punktkonfidenz berechnen | Ja |
| Punkte exportieren | |
| Dateityp | Stanford PLY |
| Koordinatensystem | Lokale Koordinaten (m) |
| Ursprungsdaten | Dichte Wolke |
| Speichern von Punktfarben | Ja |
| Speicherpunkt normal | Ja |
| Vertrauen in Punkte sparen | Ja |
| Speicherpunkt-Klassen | Nein |
| Konvertieren Sie Farben in 8 Bit RGB | Ja |
| Binäre Codierung | Ja |
Tabelle 2: Einstellungen für die Konstruktion von 3D-Punktwolken. Eine Liste von Einstellungen, die in Agisoft Metashape verwendet werden, um eine qualitativ hochwertige Rekonstruktion von Punktwolken zu erstellen und zu exportieren.
Ergänzende Datei 1: Roadmap. Beispiel für ein Orthomosaikbild, das mit Plot-Features und -Tiefen markiert ist, um die Suche nach dem Plotbereich für die erneute Vermessung zu erleichtern. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 2: Extract_meta.py. Skript wird in Agisoft Metashape ausgeführt, um Kameraposen- und Dateiverzeichnisinformationen für die Verwendung in Viscore zu exportieren und die Originalbilder abzufragen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 3: Leitfaden zu Viscore. Software-Leitfaden für Viscore, der Workflows für die Modellvisualisierung, Co-Registrierung und ökologische Analysen enthält. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 4: Rugosity_Functions.RMD. Skript, das in R verwendet wird und Funktionen zur Verarbeitung von Rauheitsdaten enthält, die aus Viscore extrahiert wurden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 5: Rugosity_Analysis.Rmd. Skript, das in R zum Berechnen von Rugosity-Metriken verwendet wird. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 6: Quadrat_sampling.rpl.json. Skript, das in Viscore für den Arbeitsablauf der Quadrat-Dichte-Analyse verwendet wird. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 7: Density_taxo_lookup.json. Schaltfläche Lookup-Datei zum Ausführen eines Quadrat-Sampling-Skripts zum Aggregieren von Quadrat-Sampling-Daten nach taxonomischer Gruppe. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 8: Density_Analysis.R Skript, das in R verwendet wird, um quadratische Stichprobendaten zu aggregieren, das die Dichte nach taxonomischer Gruppe auf Vermessungsebene berechnet. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 9: README.txt Beispiel-Textdatei, die in Originalbilder für die Datenarchivierung eingefügt werden soll und die Bilderfassungsmethode beschreibt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 10: METADATA_KAH_2016-07_03.txt Beispieltextdatei, die in Originalbilder für die Datenarchivierung eingefügt werden soll und Metadatenfelder für die LAI-Vermessung enthält. Dazu gehören Felder für den Maßstab innerhalb der Vermessung und Tiefendaten für die Referenzierung sowie allgemeine Standortmetadaten für den geografischen Kontext. Abkürzung: LAI = large-area imaging. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die großflächige Bildgebung ist ein Werkzeug, das es Wissenschaftlern ermöglicht, Merkmale der Umgebung in größeren Maßstäben als den der einzelnen gesammelten Bilder digital zu visualisieren und zu analysieren. Durch die Aufnahme mehrerer Bilder der Umgebung aus mehreren Perspektiven helfen LAI-Protokolle, Darstellungen relativ breiter Landschaften (im Verhältnis zur räumlichen Abdeckung einzelner Bilder) zu erstellen, während die aus den ursprünglichen Bildern gesammelten Details beibehalten werden. Der einzigartige Wert von LAI liegt in der Fähigkeit, Umweltdaten über verschiedene Skalen hinweg zu untersuchen, von der größten Skala (definiert durch die räumliche Ausdehnung der Vermessung) bis zur feinsten Skala (definiert durch die realisierte Auflösung der Originalbilder). Um jedoch von dieser skalenübergreifenden Stärke zu profitieren, ist es entscheidend, einen regelmäßigen und flüssigen Zugriff auf alle Ebenen der erfassten Daten zu gewährleisten, insbesondere um einen einfachen Zugriff sowohl auf die Originalbilder als auch auf das abgeleitete 3D-Modell zu gewährleisten. In jedem Schritt des hier vorgestellten Protokolls heben wir diese einzigartige Stärke von LAI hervor, indem wir konsequent sicherstellen, dass die Originalbilder zugänglich, nutzbar und sicher zusammen mit den abgeleiteten LAI-Modellen archiviert werden.
Die LAI-Methode liefert Produkte, die direkt mit den gesammelten Originalbildern verknüpft sind. Durch die Verschiebung der Details der Bildaufnahme können Benutzer Datenprodukte von unterschiedlicher Qualität und Abdeckung erstellen. Bei der Vermessung strukturell komplexer Korallenriffumgebungen kann ein Benutzer mit begrenzter Vermessungszeit unter Wasser (oder einer konstanten Anzahl von Bildern, die aufgenommen werden können) der Erhöhung der flächendeckenden Abdeckung des Erhebungsgebiets oder der Erhöhung des Detaillierungsgrads jedes Abschnitts des beprobten Gebiets Vorrang einräumen. Es wird notwendigerweise einen Kompromiss geben, wobei das große Flächenmodell weniger Details (und vielleicht mehr Okklusionen) pro Flächeneinheit aufweist und das detaillierte Modell eine geringere Gesamtfläche abdeckt (mit wahrscheinlich weniger Okklusionen). In diesem Protokoll schließen wir die Verwendung von zwei Kameras mit jeweils unterschiedlichen Objektiven ein, die es dem Benutzer ermöglichen, einen größeren Bereich abzutasten (ausreichende Überlappung mit dem Weitwinkelobjektiv, um die SfM-Anforderungen zu erfüllen) und gleichzeitig detailliertere Originalbilder zu erfassen (höhere Details vom Zoomobjektiv, das weniger Überlappungen von Foto zu Foto aufweist). Durch die Einbeziehung der Posenschätzung von Bildern beider Kameras umfassen die nachgelagerten Visualisierungs- und Analyseprotokolle Ansichten mit höherer Auflösung von einem Großteil des abgetasteten Bereichs. Obwohl das Protokoll darauf abzielt, den Bereich der Durchführbarkeit von Untersuchungen zu erweitern, können Benutzer feststellen, dass die abgeleiteten Produkte keine ausreichende flächendeckende Abdeckung oder keine ausreichende Detailgenauigkeit der Originalbilder aufweisen, um bevorzugte Analyseroutinen zu vervollständigen. Die Benutzer werden aufgefordert, die Originalbilder und die abgeleiteten Modelle zu überprüfen, um sicherzustellen, dass das Umweltvermessungsprotokoll den Programmanforderungen entspricht, und den Ansatz für die Vermessung im Wasser zu modifizieren (z. B. Verschieben der Bodenprobenahmeentfernung, Ändern der Vermessungsdauer oder der Anzahl der gesammelten Bilder), um das bevorzugte Gleichgewicht zwischen Flächenabdeckung und Auflösung pro Flächeneinheit zu erreichen.
LAI-Methoden bieten einen Mehrwert für die Unterwasserwissenschaft, indem sie informationsreiche, weitreichende "Momentaufnahmen" benthischer Umgebungen erfassen, die zeiteffizient sein können und nur begrenztes domänenspezifisches Fachwissen für die Erfassung erfordern. Der Wert dieser Datenprodukte kann sowohl in Bezug auf bestehende Datenströme als auch für neuartige und beschleunigte domänenspezifische Anwendungen betrachtet werden. Unter Berücksichtigung des Vergleichs mit bestehenden Datenströmen können Analyseprodukte von LAI ökologische Daten liefern, die direkt mit den Daten vergleichbar sind, die von Unterwasserbeobachtern in situ erhoben wurden 84,85,86,87. Wir bieten hier eine quantitative Analyse der ökologischen Datenausgaben, die aus jedem klassischen In-situ-Monitoring und aus der standardisierten Analyse von LAI-Produkten abgeleitet wurden, gemäß diesem Protokoll. Durch die Fokussierung auf vier gängige Metriken bei der Überwachung von Korallenriffen (strukturelle Komplexität, Zusammensetzung der benthischen Gemeinschaft, Dichte mobiler Wirbelloser und Struktur der Korallengröße; Abbildung 5) zeigen wir eine starke quantitative Übereinstimmung in den Datenausgaben. Insbesondere für die Datenströme, die feinskalige Beobachtungen erfordern (z. B. taxonomische Identifikationen, genaue Definitionen biologischer Grenzen), bieten LAI-Workflows, die einen regelmäßigen und zuverlässigen Zugang zu Originalbildern beinhalten, eine einzigartige Stärke, um die Beobachtungsmöglichkeiten zu parallelisieren, die in der Vergangenheit nur auf immersive In-situ-Probenahmen beschränkt waren. Die von Viscore bereitgestellten und in diesem Protokoll beschriebenen Fortschritte in der Datenverarbeitung und -visualisierung bieten einen einzigartigen Wert bei der Sicherstellung der Vergleichbarkeit von LAI-abgeleiteten ökologischen Daten und In-situ-Überwachungsprodukten, indem sie eine unvoreingenommene Pflege langfristiger Datenströme unter Einbeziehung digital verbesserter Arbeitsabläufe von LAI ermöglichen.
Für Unterwasserwissenschaftler bietet das LAI die Möglichkeit, neuartige und beschleunigte Arbeitsabläufe bei der Datenerfassung und -exploration zu nutzen. LAI hat einzigartige Stärken als hochauflösendes Kartierungswerkzeug, das nicht nur Informationen zur Beschreibung der relativen Zusammensetzung der benthischen Umgebung, sondern auch räumliche Eigenschaften enthält. Explizit zur Erstellung eines 3D-Modells aus dem SfM-Workflow enthalten LAI-Produkte Informationen über die strukturelle Komplexität, die über mehrere Skalen hinweg untersucht werden können56. Als Werkzeuge zur Erfassung größerer Meereslandschaften können LAI-Produkte die Möglichkeit bieten, Muster der räumlichen Verteilung und Nachbarschaftsmerkmale für benthische Organismen zu berücksichtigen45,66. Darüber hinaus wird es durch die Möglichkeit, benthische Landschaften in größeren Maßstäben zu visualisieren, möglich, Merkmale zu erkennen, die in Unterwasserlebensräumen aufgrund der Einschränkungen der Fernsichtbarkeit unter Wasser nicht ohne weiteres sichtbar sind, z. B. großflächige (3-4 m) polygonale Muster einer gewöhnlichen Makroalge auf einem pazifischen Korallenriff64.
Während LAI Möglichkeiten für groß angelegte Analysen bietet, wurden Bedenken hinsichtlich der Herausforderungen im Zusammenhang mit einer effizienten Sammlung und Nachbearbeitung von Bildern geäußert. Die Erweiterung der räumlichen Ausdehnung der Bildaufnahme unter Wasser wird technologische Fortschritte erfordern, weg von der von Tauchern eingesetzten Bildgebung hin zur Verwendung von assistierten Kartierungssystemen88 und schließlich zur Verwendung von ROVs38 und AUVs67, 89. Robuste Erhebungsmethoden in Bezug auf das Erfassungsmuster und die Kamerasysteme gewährleisten einen reibungslosen Übergang und Konsistenz der über diese verschiedenen Plattformen generierten Daten. Angesichts des Rechenaufwands sowie des großen Datenformats von LAI-Produkten haben einige Meereswissenschaftler Bedenken hinsichtlich der technologischen Zugänglichkeit des Arbeitsablaufs90 und des hohen Zeitaufwands im Zusammenhang mit der ökologischen Datenextraktiongeäußert 84,86. Es wird jedoch eine wachsende Anzahl von Tools vorgestellt, die kreative Lösungen für die technischen Hürden der Datenextraktion nutzen 80,91,92,93. Wichtig ist, dass die Verwendung von KI-gestützten Workflows für die LAI-Analyse durch die Qualität des bereitgestellten Eingangssignals begrenzt ist. Daher besteht nach wie vor ein konstanter Anspruch an die Aufrechterhaltung der Standards und der Qualität der Bildaufnahme und des Datenmanagements in LAI-Protokollen, unabhängig davon, ob die Datenextraktion von einem menschlichen Beobachter, von einem trainierten KI-Algorithmus oder (idealerweise) von einem KI-beschleunigten Human-in-the-Loop-Workflow durchgeführt wird. Durch die konsequente Fokussierung auf die primäre Bedeutung der Originalbilder in den LAI-Protokollen, wie hier beschrieben, ergeben sich einzigartige Möglichkeiten, Unterwasserlebensräume robust, transparent und konsistent zu erforschen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wird durch die Bemühungen der 100 Island Challenge an der Scripps Institution of Oceanography unterstützt. Wir danken Schmidt Marine Technology Partners, Ed und Christy Scripps und der Moore Family Foundation für ihre finanzielle Unterstützung der damit verbundenen Forschungs- und großflächigen Bildgebungsschulungen, die zur Verfeinerung der Methodik beigetragen haben. Darüber hinaus danken wir der Besatzung der Forschungsschiffe Hi'ialiki, Hanse Explorer und Plan B, die die Feldarbeiten unterstützt haben. Wir danken insbesondere dem Team der Ecosystem Sciences Division des Pacific Islands Fisheries Sciences Center der NOAA, das bei der Feldsammlung der hier vorgestellten Daten geholfen hat.
Materialien
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
Referenzen
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548(2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985(2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535(2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993(2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077(2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197(2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262(2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593(2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979(2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740(2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737(2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276(2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050(2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440(2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957(2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011(2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113(2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077(2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438(2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213(2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594(2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282(2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943(2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569(2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304(2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548(2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145(2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674(2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317(2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten