Method Article
Medición de la estructura, composición y cambio de entornos subacuáticos con imágenes de gran área
En este artículo
Resumen
Este protocolo cubre una metodología de estudio de imágenes de área grande de cuatro pasos utilizada para extraer métricas de complejidad estructural, composición de la comunidad y demografía de la población para las comunidades de arrecifes de coral. La calidad de las imágenes recopiladas y el acceso integrado a las imágenes de origen se priorizan en cada paso del protocolo.
Resumen
La tecnología de procesamiento e imágenes digitales ha evolucionado para facilitar la expansión de los estudios de imágenes de grandes áreas, lo que aumenta nuestra capacidad para estudiar el estado, las tendencias y la dinámica de los organismos que viven en hábitats submareales. Mediante la creación de gemelos digitales fotorrealistas para análisis ex situ , estos enfoques permiten a pequeños equipos de campo recopilar muchos más datos de lo que antes era posible. Aquí presentamos una metodología de análisis y proceso de análisis de encuestas de imágenes de área grande de cuatro pasos, que incluye la recopilación de imágenes, la construcción de modelos, el análisis ecológico y la curación de datos, que se ha desarrollado y perfeccionado a través de la experimentación durante la última década. Cada paso descrito tiene un enfoque coherente en el valor único de las imágenes de origen originales. Si bien los tipos de datos extraídos de los estudios de imágenes de grandes áreas son enormes, incluimos aquí flujos de trabajo para extraer datos ecológicos para la complejidad estructural, la composición de la comunidad y los análisis demográficos valiosos para el monitoreo y los esfuerzos basados en hipótesis. Además, incluimos recomendaciones para estándares de metadatos, que complementan la recopilación de datos de imágenes de gran área y apoyan los esfuerzos de archivo que facilitan la transparencia y la colaboración entre los grupos de investigación.
Introducción
En todos los ambientes terrestres, los investigadores han aprovechado el muestreo estandarizado de grandes áreas de comunidades ecológicas, particularmente en el contexto de sitios de estudio a largo plazo, incluida la isla Barro Colorado1, el bosque experimental Hubbard Brook2 y otros3. A través de la recopilación de datos de distribución espacialmente explícitos y taxonómicamente resueltos, dicho muestreo se ha utilizado para explorar la dinámica ecológica fundamental, como los patrones de dispersión y reclutamiento 3,4,5, la preferencia y disponibilidad de hábitat, los núcleos de dispersión, la limitación de recursos 3,5,6,7,8 y el uso del espacio 9,10. Sin embargo, hasta la fecha, la mayoría de los estudios espaciales de las comunidades marinas se han basado en métricas de cobertura relativa, reportadas como porcentaje de cobertura ocupada por taxón o grupo 11,12,13,14,15. Sin embargo, las estimaciones agregadas de la cobertura relativa son insuficientes para resolver los detalles de la demografía a nivel poblacional, así como la dinámica a nivel comunitario. Los estudios que han proporcionado análisis detallados de las comunidades bentónicas se han basado en laboriosos protocolos de monitoreo en el agua 16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32, pero la escala (incluyendo escalas taxonómicas, espaciales y cronológicas) de estos estudios es notablemente limitada debido a las demandas operativas de la metodología en el agua.
La adquisición de imágenes de área grande (LAI) es un enfoque que combina información de numerosas imágenes a través de flujos de trabajo computacionalmente intensivos para crear representaciones fotorrealistas de entornos a escalas mucho mayores que la de las imágenes constituyentes33. El flujo de trabajo LAI es particularmente adecuado para aplicaciones en hábitats submarinos dada la visibilidad limitada debido a la absorción de luz y la dispersión en el agua. Debido a la visibilidad limitada, las imágenes que capturan detalles finos del bentos deben adquirirse cerca del sujeto; Para capturar una vista de paisaje (o paisaje marino) de una amplia franja de hábitat bentónico mientras se conservan detalles finos de sujetos bentónicos individuales, se requieren imágenes compuestas. Además, en entornos estructuralmente complejos, es esencial tener en cuenta la estructura tridimensional (3D) en la reconstrucción de las imágenes compuestas para producir representaciones fieles de la posición y la proximidad relativa de los organismos bentónicos. El método fotogramétrico Structure-from-Motion (SfM) se ha aplicado a entornos con organismos bentónicos relativamente inmóviles, incluidos los arrecifes de coral 34,35,36, los ecosistemas bentónicos antárticos37, los arrecifes de coral de aguas frías 38, las filtraciones frías39 y el hábitat de pastos marinos40, generando imágenes compuestas sin estereoscopía utilizadas para reconstruir una escena de paisaje con generación de ortomapas de seguimiento y estimación de nubes de puntos.
En la ciencia de los arrecifes de coral, LAI ha ofrecido el potencial de visualizar paisajes de arrecifes a escalas espaciales cada vez más grandes y de compartir estas visualizaciones a través de medios digitales. El LAI se puede utilizar para estimar la cobertura de los organismos de los arrecifes, la densidad y distribución de las colonias de coral, así como la forma y la condición de los organismos individuales 41,42,43,44,45,46,47. Además, cuando los productos de LAI se recolectan en el mismo lugar en diferentes puntos en el tiempo, es posible registrar cambios en el tamaño y la condición de los organismos individuales 48,49,50,51. Dado que la mayoría de las colonias de corales escleractinianos crecen del orden de milímetros a centímetros radialmente por año, las series temporales de LAI recopiladas a lo largo de los años pueden proporcionar un flujo de datos invaluable para informar sobre la biología y ecología de estas especies52. Los datos repetidos y co-registrados de LAI ofrecen perspectivas únicas con las que estudiar los arrecifes de coral en un formato que puede compartirse, archivarse y utilizarse como base para la colaboración en todo el mundo.
A medida que el uso de LAI se ha expandido entre los ecologistas de arrecifes de coral53, también lo ha hecho la diversidad de sistemas de cámaras y metodologías de estudio52. Un protocolo LAI elegido debe centrarse en la resolución y el alcance de las métricas ecológicas deseadas, al tiempo que se mantiene dentro de los recursos disponibles. La calidad de cualquier reconstrucción fotogramétrica dependerá, en última instancia, de la resolución de las imágenes de origen y de la cobertura espacial del área de levantamiento. La calidad de la imagen está determinada por la influencia de los parámetros de la cámara, incluida la resolución del sensor y la distancia focal, así como por el procedimiento de recopilación, principalmente la distancia desde el bentos54, todo lo cual contribuye a la distancia efectiva de muestreo del suelo (GSD) de un conjunto particular de imágenes. Además, las velocidades de obturación rápidas, las aperturas pequeñas y los valores ISO bajos producirán imágenes nítidas, enfocadas y con bajo ruido electrónico, respectivamente. Mantener cada uno de estos ajustes en umbrales que produzcan imágenes de suficiente calidad puede ser un desafío en entornos submarinos donde los niveles de luz son bajos. Los sensores más grandes, como los que se encuentran en las cámaras réflex digitales de lente única (DSLR) y sin espejo, generan una mejor calidad de imagen y, a su vez, reconstrucciones más precisas en comparación con soluciones más pequeñas y móviles como las cámaras de acción55. Las características adicionales que no deben pasarse por alto al considerar un modelo de cámara adecuado incluyen un intervalómetro incorporado y suficiente capacidad de almacenamiento y batería para respaldar los esfuerzos de recopilación de imágenes de duración prolongada en el campo.
El diseño de la encuesta debe basarse en la hipótesis ecológica, y las métricas candidatas deben determinar la resolución y la cobertura espacial necesarias. Dentro de la ecología de los arrecifes de coral, el LAI se ha utilizado para caracterizar la complejidad estructural 35,36,56,57,58,59, la composición y ensamblaje de la comunidad 60,61,62, la distribución espacial 45,63,64,65,66 y las trayectorias de la comunidad 48,49,50,67,68,69. La resolución de la calidad de la imagen debe ser apropiada para las necesidades de datos ecológicos, con una resolución a escala más fina en el detalle sub-mm necesario para apoyar las observaciones a escala de pólipos de la competencia a lo largo de los bordes de las colonias70 o los muestreos de pequeños corales juveniles 66,71. Por el contrario, la extracción de métricas estructurales y de hábitat a gran escala para el mapeo costero 72,73,74 requiere una mayor extensión espacial con una menor necesidad de resolución a escala cm-m. La demanda de resolución debe equilibrarse con la extensión espacial requerida para obtener suficiente muestreo y los límites operacionales del tiempo necesario para completar una encuesta LAI33.
Aquí se describe un protocolo de extremo a extremo para llevar a cabo una encuesta LAI, que se centra en maximizar la calidad, la utilidad y el valor de las imágenes de origen, dividiendo el protocolo en cuatro pasos principales: recopilación de imágenes, construcción del modelo, análisis ecológicos y curación de datos33. La colección de aproximadamente 3.500 estudios de imágenes de LAI de más de 2.000 sitios de arrecifes únicos durante la última década ha contribuido al refinamiento de la metodología para cada paso presentado aquí (https://doi.org/10.6075/J0T43RN1). El protocolo resultante es un método para la recopilación de datos robustos y reconstrucciones de modelos exactas y precisas, que permiten la recopilación de datos ecológicos detallados en una amplia gama de aplicaciones, incluida la complejidad estructural, la composición de la comunidad y la demografía de la población (por ejemplo, estructura de densidad y tamaño). Además, incluimos estándares de metadatos para el archivo de datos LAI, cuyo establecimiento es esencial para garantizar la preservación, la transparencia y el potencial colaborativo de estos gemelos digitales.
Protocolo
1. Colección de imágenes
NOTA: El siguiente procedimiento de recolección de imágenes de área grande describe un método para inspeccionar un área de aproximadamente 100 m2, aunque se puede adaptar fácilmente para áreas que van desde 10 m2 hasta 2,500 m2. El método de encuesta que se describe a continuación está diseñado para ser desplegable en una variedad de condiciones de trabajo, generar imágenes de alta calidad y proporcionar datos sólidos que se pueden utilizar para muchas aplicaciones ecológicas a partir del esfuerzo de una sola inmersión de una hora por parte de un equipo de dos personas.
- Preparación de aparejos
- Ensamble el marco de la cámara fijando los paneles exteriores del marco a los paneles y columnas de montaje de la cámara con tornillos de cabeza plana Philips de 1 1/2" de largo (Figura 1).
- Prepare dos cámaras DSLR, una con una lente gran angular fija y una segunda cámara equipada con una lente de zoom. Consulte la Tabla 1 para ver la configuración detallada de la cámara.
NOTA: Si bien la segunda cámara con lente de zoom es opcional, se recomienda encarecidamente capturar una mayor resolución de imagen para determinar los detalles de la taxonomía75,76, encontrar e identificar pequeños corales juveniles66,71 (1-5 cm de diámetro) y distinguir los bordes de las colonias de coral 45,48,50 durante futuros análisis ecológicos. - Ensamble las carcasas de las cámaras subacuáticas colocando el puerto de la cúpula y asegúrelas con los tornillos de mariposa de la cúpula incluidos. Fije las manijas con tornillos de cabeza Phillips de 1/2" de largo y la placa de montaje de la cámara con un tornillo de cabeza hueca de 1 1/8" de largo. Inserte las cámaras en la carcasa y utilice la bomba de vacío para ajustar la presión de la carcasa a 5 pulgadas. Hg, comprobando la integridad de la junta tórica.
- Instale las carcasas en el marco de la cámara deslizando la placa de montaje de la cámara sobre los paneles del marco de montaje y asegúrelas en su lugar con tornillos de mariposa.
- Configuración de la parcela
- Establecer los límites de la parcela utilizando seis baldosas cuadradas de acero inoxidable (10 cm de longitud de lado) con rotuladores codificados impresos. Coloque dos losetas centrales a 10 m de distancia a lo largo de la isóbata objetivo, con cuatro baldosas de esquina agregadas 5 m hacia adentro y mar adentro de las baldosas centrales para crear un área de parcela cuadrada de 10 m por 10 m (Figura 2). Registre la profundidad en cada una de las seis baldosas para proporcionar orientación a la vertical local y facilitar los pasos posteriores de construcción del modelo.
- Agregue flotadores de referencia con ~ 1,5 m de línea unida a pesos de 0,45 kg (1 lb) aproximadamente 1 m fuera de cada una de las cuatro baldosas de esquina.
NOTA: Estos flotadores de referencia sirven de guía para que el operador de cámara denote los límites de la parcela y la altura sobre el bentos a la que debe nadar la cámara. Al colocarlos fuera de los límites de la parcela de 10 m x 10 m, se crea una zona de influencia de las imágenes, lo que ayuda a garantizar que el área central de la imagen se reconstruya por completo. - Coloque una barra de escala de 0,5 m de longitud que consta de dos mosaicos de destino codificados fijados a una barra de cloruro de polivinilo (PVC) o aluminio en cada cuadrante de la parcela para un total de cuatro barras de escala desplegadas.
NOTA: Es importante que las barras de escala y los mosaicos de profundidad permanezcan estables durante todo el proceso de recopilación de imágenes. Las barras de escala y los mosaicos de profundidad también se pueden usar como puntos de referencia visuales para que el operador de cámara realice un seguimiento del progreso de su patrón de natación. - Para establecer parcelas permanentes, instale estacas de acero inoxidable de 0,46 m (18 pulgadas) (0,95 cm o varilla roscada de 3/8 pulgadas) aseguradas con epoxi marino de dos partes utilizando un mazo adyacente a cada baldosa central para marcar la línea central de la parcela. Al mirar hacia tierra, la estaca izquierda incluye una tuerca de seguridad para ayudar con la orientación durante futuros esfuerzos de inspección. Al final de la encuesta, registre la coordenada del Sistema de Posicionamiento Global (GPS) directamente sobre la ubicación de la estaca en el centro izquierdo utilizando una unidad GPS almacenada dentro de un estuche impermeable adherido a un flotador de buceo.
NOTA: Se recomienda la instalación de estacas permanentes cuando se permita a través de los permisos para reducir el tiempo de búsqueda en los estudios posteriores y afirmar la repetición de los estudios en la misma área del arrecife. Utilice una ortoimagen impresa en 2 dimensiones (2D) o un "mapa de ruta" (Archivo Suplementario 1) del sitio de la encuesta para ubicar características invariantes y ayudar a identificar la ubicación de la misma área de parcela para la obtención de imágenes. Estas hojas de ruta también se pueden utilizar para reubicar parcelas topográficas exactas en casos en los que los permisos no permiten la instalación de estacas permanentes o cuando las estacas se han desprendido o eliminado.
- Captura de imágenes
- Establezca el balance de blancos personalizado de cada cámara usando una tarjeta gris a la profundidad objetivo del gráfico.
- Encienda cada cámara en un intervalómetro configurado para capturar en un intervalo de 1 s-1 .
- Nade el sistema de cámaras aproximadamente 1,5 m por encima del bentos en un patrón de cuadrícula, seguido de un segundo paso de cuadrícula perpendicular con aproximadamente 1 m entre cada paso nadando a una velocidad lenta de aproximadamente 0,25 m s-1 (Figura 3). Asegúrese de que las pasadas se extiendan un mínimo de 2 m más allá de los límites de la parcela para garantizar una superposición suficiente dentro del área de parcela objetivo.
NOTA: Seguir este patrón de natación y velocidad da como resultado la recolección mínima de aproximadamente 1,700 imágenes de cada cámara durante 28 minutos de imágenes. Sin embargo, para tener en cuenta el tiempo de respuesta entre pasadas y errar por el lado del sobremuestreo para amortiguar la superposición insuficiente que da como resultado datos subóptimos, recomendamos que los buzos se dirijan a la colección de 2.500 imágenes de cada cámara durante aproximadamente 40 minutos de imágenes. - Sostenga el sistema de cámaras aproximadamente perpendicular a la superficie del océano para garantizar una cobertura suficiente de arriba hacia abajo; sin embargo, para sitios de prospección con topografía compleja, ajuste la orientación de la cámara en la segunda pasada para que siga perpendicular al bentos y reduzca las oclusiones en la reconstrucción 3D. Tenga cuidado al inclinar la cámara para minimizar el agua azul que se captura en las imágenes.
NOTA: En casos de condiciones oceánicas subóptimas, como fuertes corrientes o pendientes pronunciadas, ambos pasos se pueden realizar en la misma dirección a lo largo de la costa. El uso de una sola cámara de lente gran angular puede ser necesario en una corriente fuerte para reducir el perfil de resistencia y el esfuerzo del buzo necesario para mantener el progreso hacia adelante. Lo ideal es que el segundo conjunto de pasadas se gire ligeramente en relación con el primero. Si se realizan dos pasadas en la misma dirección a lo largo de la costa, se deben agregar al menos una o dos "líneas de amarre" perpendiculares o diagonales que atraviesen el conjunto inicial de pasadas para mejorar la calidad de la reconstrucción.
2. Construcción del modelo
NOTA: El paso de construcción del modelo se centra en mantener el acceso a las imágenes de origen de alta resolución y generar la nube de puntos densa derivada. La referenciación de la nube de puntos densa se produce dentro del software de visualización y análisis centralizado (ver Tabla de Materiales)77, lo que permite al usuario ingresar y modificar sobre la marcha. Esto elimina la necesidad de reprocesar y volver a exportar productos de datos para un conjunto de datos cuando surge nueva información, particularmente con encuestas adicionales a lo largo del tiempo. Los ortomapas 2D, denominados aquí ortoproyecciones, se generan utilizando una vista de proyección ortorrectificada de la densa nube de puntos, con el ángulo de proyección ortogonal a la dirección de la gravedad.
- Alineación de la cámara y construcción de nubes de puntos densas en 3D
- Con una computadora de alto rendimiento, cargue todas las imágenes, incluidas las de las cámaras de lente gran angular y macro, en un proyecto de Agisoft Metashape seleccionando Flujo de trabajo | Agregar carpeta. Una vez que se hayan cargado los archivos, seleccione el diseño de datos como Cámaras individuales, Agregar todas las imágenes aun trozo. Elimine del proyecto las imágenes con exceso de agua azul en la escena.
NOTA: Antes de agregarlas al proyecto, las imágenes de cada cámara deben organizarse en carpetas separadas, lo que separará los archivos de imagen dentro del fragmento como grupos de cámaras distintos. - Alinee todas las imágenes seleccionando Flujo de trabajo | Alinear fotos. Consulte la Tabla 2 para ver la configuración de procesamiento de la alineación.
- Una vez completada la alineación, verifique que el conjunto de imágenes se haya alineado correctamente en función del porcentaje de cámaras alineadas y la inspección de la nube de puntos dispersa generada para detectar brechas en la cobertura o desalineaciones. Asegúrese de que el cuadro delimitador abarque toda la nube de puntos dispersa antes de continuar. Si es necesario, modifíquelo con las opciones Cambiar tamaño o Rotar región .
NOTA: Es posible que el 100% de las imágenes estén alineadas y aún tengan espacios en partes del modelo y, por el contrario, que el 80-90% de las imágenes estén alineadas pero que tengan un modelo completo del área de levantamiento objetivo. Por lo tanto, tanto el porcentaje de alineación como la cobertura de área deben utilizarse para tomar una decisión informada sobre la usabilidad, en parte o en su totalidad, del conjunto de datos generado o si se necesitan esfuerzos adicionales para aumentar la calidad de adquisición de imágenes o ajustes en la configuración de procesamiento de alineación. - Deshabilite el grupo de cámaras que contiene las imágenes del objetivo zoom. Construya la nube de puntos densa seleccionando Flujo de trabajo | Construya una nube densa. Consulte la Tabla 2 para conocer la configuración de procesamiento de Build Dense Cloud.
NOTA: Si bien las imágenes de ambas cámaras deben usarse para la alineación para facilitar la consulta de todas las imágenes de alta resolución durante los análisis ecológicos, las imágenes con lentes de zoom no deben usarse durante la creación de la nube de puntos densa, ya que las sutiles diferencias en el balance de blancos y la exposición entre las dos cámaras agregarán ruido visual a la nube de puntos densa. - Exporte las estimaciones de la posición de la cámara seleccionando Herramientas | Ejecutar script | Extract_meta.py script (Legajo Suplementario 2). Exporte la nube de puntos densa seleccionando Archivo | Exportación | Puntos de exportación. Consulte la Tabla 2 para conocer la configuración de la exportación.
- Arrastre y suelte el archivo de nube de puntos densa exportado en el archivo de vc5prep-confidence.bat ubicado dentro de los archivos de programa del software de visualización.
- Compile los archivos de datos exportados, incluidos los archivos de pose de la cámara (*.cams.xml y *.meta.json) junto con los archivos de programa generados (*.vml y la carpeta que contiene los archivos *ptdata, *.xml, *.kdm) en un único directorio para su uso en el software de visualización.
- Con una computadora de alto rendimiento, cargue todas las imágenes, incluidas las de las cámaras de lente gran angular y macro, en un proyecto de Agisoft Metashape seleccionando Flujo de trabajo | Agregar carpeta. Una vez que se hayan cargado los archivos, seleccione el diseño de datos como Cámaras individuales, Agregar todas las imágenes aun trozo. Elimine del proyecto las imágenes con exceso de agua azul en la escena.
- Escala y orientación
- En el software de visualización, utilice la herramienta de escalado para colocar pares de marcadores en los objetivos de la barra de escala e introduzca la distancia conocida.
NOTA: Puede encontrar más detalles sobre la herramienta de escalado en la sección 4.2 del Archivo complementario 3. - Coloque marcadores en cada mosaico de profundidad y utilice la herramienta de orientación para ajustar los valores de profundidad de cada mosaico para definir el plano de mejor ajuste a la vertical local.
NOTA: Se pueden encontrar más detalles sobre la herramienta de orientación en la sección 4.4 del Archivo Suplementario 3.
NOTA: Verifique que los rayos de profundidad apunten hacia arriba, terminando en la superficie del agua estimada. En el caso de rayos orientados hacia abajo, compruebe si hay evidencia de movimiento en las baldosas de profundidad que provocarían errores en el valor de profundidad en relación con su ubicación final reconstruida o errores en los metadatos de profundidad.
- En el software de visualización, utilice la herramienta de escalado para colocar pares de marcadores en los objetivos de la barra de escala e introduzca la distancia conocida.
- Corregistro temporal
- Cree un archivo de proyecto de organización en el software para una recopilación de datos siguiendo la sección 10.0 del Archivo complementario 3. Incluya varios sitios con encuestas a lo largo del tiempo en un solo proyecto de organización.
- Agregue archivos de nubes de puntos densas al proyecto de organización como capas y modifique la estructura organizativa a nivel de sitio según sea necesario para conectar nubes de puntos densas de un sitio determinado a lo largo del tiempo.
NOTA: Utilice un esquema de nomenclatura de archivos coherente de [Región]_[Fecha]_[Sitio] para automatizar la organización de capas. - Seleccione un punto de tiempo para un sitio que sirva como capa de referencia para la escala y la orientación de la serie temporal.
NOTA: Se pueden utilizar varias capas para establecer la escala; Sin embargo, se debe seleccionar una capa de punto de tiempo como referencia para la orientación, ya que los cambios de marea y la gran altura del oleaje conducen a errores en la precisión y consistencia de las mediciones de profundidad a lo largo del tiempo. - Utilice la herramienta de corregistro asistido para alinear capas a lo largo del tiempo.
NOTA: Se pueden encontrar más detalles en la sección 11.0 del Archivo Complementario 3. En casos de grandes cambios estructurales debidos a un alto crecimiento o a grandes eventos de oleaje, puede ser preferible utilizar el flujo de trabajo de corregistro manual utilizando características invariantes de candidatos. Para series temporales más largas, o cuando hay cambios sustanciales a lo largo del tiempo, generalmente se recomienda registrar un modelo determinado en el siguiente punto temporal anterior.
- Ortorrectificación 2D
- Con la herramienta de cajas del software, defina una vista desde un ángulo de superficie (g: 0°) con límites que abarquen el área de análisis focal (10 m x 10 m) junto con un búfer mínimo de 2 m ( mínimo w: 14 m, mínimo h: 14 m) que se extienda desde cada borde.
NOTA: Los detalles para usar la herramienta de cajas se pueden encontrar en la sección 6.0 del Archivo Suplementario 3. - Dentro de la herramienta cuadros, active la exportación de mapas para crear un archivo de imagen de ortoproyección. Establezca la resolución de exportación en 1 mm px-1 y seleccione capturar para generar una vista previa. Desplácese hasta un mosaico de vista previa que contenga una sección completa de la densa nube de puntos y aumente el valor de pt-size para rellenar los espacios entre puntos.
- Seleccione capturar para exportar la ortoproyección como un archivo ppm. Una vez completada la captura, convierta el archivo exportado en un tif arrastrando y soltando el archivo .ppm generado en el archivo convert-to-tif-flip.cmd ubicado dentro de los archivos del programa.
- Para las nubes de puntos densas corregistradas de una serie temporal, repita los pasos 2.4.2 a 2.4.3 para el sitio, cambiando la capa de tiempo mientras utiliza el mismo cuadro.
- Con la herramienta de cajas del software, defina una vista desde un ángulo de superficie (g: 0°) con límites que abarquen el área de análisis focal (10 m x 10 m) junto con un búfer mínimo de 2 m ( mínimo w: 14 m, mínimo h: 14 m) que se extienda desde cada borde.
3. Análisis ecológico
NOTA: Existen innumerables opciones para la extracción de datos ecológicos, una selección de las cuales presentamos aquí. Estos flujos de trabajo principales se centran en métricas establecidas para el seguimiento a largo plazo78,79, pero pueden utilizarse y adaptarse para generar datos suficientes para la investigación científica basada en la observación. Los usuarios deben seleccionar y adaptar los flujos de trabajo en función de sus necesidades individuales de datos y objetivos analíticos. Los flujos de trabajo que se describen a continuación están diseñados para integrar el acceso directo a las imágenes de origen para ayudar en la anotación de datos biológicos, utilizando productos derivados como la nube de puntos densa en 3D o la ortoproyección en 2D como marco organizativo.
- Complejidad estructural
- Con la herramienta rugo, cree una caja de 10 m x 10 m en la densa nube de puntos, estableciendo una dimensión máxima de 10 m (rugo-dim: 10,0 m) y una relación de aspecto de 1,0 (aspecto cuádruple: 1.000) para designar el área objetivo de 100m2 para la extracción de datos.
NOTA: Se pueden encontrar más detalles sobre el uso de la herramienta rugo en la sección 7.0 del Archivo Suplementario 3. - Establezca el número de líneas de transecto para muestrear (líneas) y el número de puntos a lo largo de cada transecto (muestras) en función del espaciado de muestra deseado. Seleccione preparar para exportar un archivo csv que contenga las coordenadas x, y y z de cada punto muestreado, que se puede utilizar para una variedad de análisis de complejidad estructural.
- Ejecute el script que se encuentra en el archivo complementario 4 para generar funciones utilizadas para análisis de complejidad estructural. A continuación, siga los scripts que se encuentran en el Archivo complementario 5 en función de las métricas deseadas para cuantificar la complejidad estructural.
NOTA: Se sugiere seleccionar una escala de espaciado con la resolución más alta (se recomienda un espaciado de 1 cm ) a la que los usuarios puedan dirigirse para abordar su escala de interés, a partir de la cual se pueden evaluar de manera similar una variedad de escalas, como las que se presentan aquí (espaciado entre líneas de 0,5 m y espaciado entre puntos de 10 cm), mediante un muestreo descendente56.
- Con la herramienta rugo, cree una caja de 10 m x 10 m en la densa nube de puntos, estableciendo una dimensión máxima de 10 m (rugo-dim: 10,0 m) y una relación de aspecto de 1,0 (aspecto cuádruple: 1.000) para designar el área objetivo de 100m2 para la extracción de datos.
- Composición de la comunidad
- Con la herramienta Intercepción de punto virtual (VPI), cree una caja de 10 m x 10 m en la nube de puntos densa, estableciendo una dimensión máxima de 10 m (cuádruple: 10,0 m) y una relación de aspecto de 1 (cuádruple aspecto: 1.000) para designar el área objetivo de 100m2 para la extracción de datos.
NOTA: Los detalles sobre el uso de la herramienta de intercepción de punto virtual se pueden encontrar en la sección 5.0 del Archivo Suplementario 3. - Establezca los puntos que se van a muestrear de la nube de puntos densa en una distribución aleatoria estratificada, con el número de puntos apuntando a una densidad elegida. Seleccione preparar para comenzar los puntos de muestreo.
NOTA: Se recomienda una densidad de muestreo de 25 m-2 (2.500 puntos) para los análisis a nivel taxonómico. Los resultados presentados aquí utilizaron una densidad de muestreo más baja (10 m-2) para una encuesta comparativa de composición comunitaria más amplia centrada en un nivel funcional. - Utilice la herramienta de levas para vincular las imágenes de origen a la densa nube de puntos y permitir vistas de varias imágenes consultadas espacialmente de puntos en el modelo.
NOTA: Puede encontrar más detalles sobre la herramienta de levas en la sección 4.5 del Archivo Suplementario 3. - Utilice el applet web del navegador VPI para etiquetar principalmente cada punto con su designación taxonómica de mayor resolución directamente utilizando varias vistas de las imágenes de origen. Agregue dos conjuntos opcionales de etiquetas secundarias para cada punto, con ejemplos para etiquetas de coral, incluido el estrés de blanqueamiento75 y la morfología.
NOTA: Los conjuntos de etiquetas primarios y secundarios se pueden modificar editando el archivo qclasses.json ubicado en la carpeta *.pq. - Exporte un resumen de la cobertura porcentual de cada etiqueta como un archivo .csv mediante el applet web.
- Con la herramienta Intercepción de punto virtual (VPI), cree una caja de 10 m x 10 m en la nube de puntos densa, estableciendo una dimensión máxima de 10 m (cuádruple: 10,0 m) y una relación de aspecto de 1 (cuádruple aspecto: 1.000) para designar el área objetivo de 100m2 para la extracción de datos.
- Estudio de densidad
- Asegúrese de que las imágenes ya se hayan vinculado en el software siguiendo el paso 3.2.3. Establezca una vista de pseudomapa de la densa nube de puntos cambiando la distancia focal de la vista en perspectiva a 100 mm y alejando el zoom para obtener una vista completa del modelo de arriba hacia abajo. Utilice el archivo de muestreo de cuadrante en el Archivo complementario 6 para capturar la vista utilizando el applet web haciendo clic en evaluar para la celda c1 y, a continuación, seleccione el botón de captura.
NOTA: Se pueden encontrar más detalles en la sección 8.0 del Archivo Complementario 3. - Activa las cámaras y, a continuación, vincula imágenes dentro del flujo de trabajo de muestreo de cuadrantes haciendo clic en Evaluar para las celdas c2 y c3 en el script de muestreo de cuadrantes.
- Asegúrese de que ya se haya hecho una caja rugo siguiendo el paso 3.1.1 para designar el área de extracción de datos objetivo de 100m2 . En el applet web, evalúe la sección de celdas de preparación c4 para muestrear 100 cuadrantes de 1 m2 .
- En la dirección web de muestreo por cuadrantes, utilice las imágenes de origen para buscar en un cuadrante y etiquetar los organismos objetivo. Haga doble clic con el botón izquierdo en una ubicación para reorientar la ubicación de muestreo. Haga clic en un botón taxonómico para designar el punto de destino como muestra. Para eliminar un punto marcado, haga doble clic con el botón izquierdo en ese punto y seleccione NADA.
NOTA: Los cuadrantes se presentan en un orden aleatorio predeterminado, lo que permite muestrear aleatoriamente un subconjunto de cuadrantes para estudios de densidad. - Compile todos los archivos de muestreo ubicados en *aux/recruits/test1 en un solo directorio, cambiando el nombre de cada archivo para incluir el nombre del sitio. Agregue el archivo de búsqueda del botón (Archivo complementario 7) al mismo directorio que los archivos de muestreo. Ejecute el script en el archivo complementario 8, siguiendo las instrucciones en línea para agregar datos de muestra en densidad por sitio y grupo taxonómico.
NOTA: Aquí, tomamos muestras de invertebrados sésiles, pero la misma herramienta se puede usar para estudiar una variedad de organismos, incluidas las densidades de corales juveniles y adultos.
- Asegúrese de que las imágenes ya se hayan vinculado en el software siguiendo el paso 3.2.3. Establezca una vista de pseudomapa de la densa nube de puntos cambiando la distancia focal de la vista en perspectiva a 100 mm y alejando el zoom para obtener una vista completa del modelo de arriba hacia abajo. Utilice el archivo de muestreo de cuadrante en el Archivo complementario 6 para capturar la vista utilizando el applet web haciendo clic en evaluar para la celda c1 y, a continuación, seleccione el botón de captura.
- Demografía
- Cargue el archivo de ortoproyección para la segmentación de colonias en el software de análisis de segmentación (ver Tabla de Materiales)80. Cargue archivos de ortoproyección registrados conjuntamente para varios puntos de tiempo como nuevos mapas dentro del mismo archivo de proyecto para segmentar y rastrear el tamaño de las colonias a lo largo del tiempo.
- Utilice las imágenes de origen a través del applet web para iView que se encuentra en la sección 17.1 del Archivo Suplementario 3 mientras segmenta las colonias como referencia para la identificación taxonómica y de límites. Asegúrese de que las imágenes ya se hayan vinculado en el software de visualización siguiendo el paso 3.2.3. Coloque un marcador en la densa nube de puntos para la colonia focal y desplácese por las imágenes de origen para la ubicación del marcador para diferentes vistas en perspectiva.
- Utilice la herramienta de anotación de clics positivos/negativos para segmentar colonias de coral individuales. Modifique los límites mediante el ajuste de límites manual o basado en clics.
4. Curación de datos
NOTA: Los esfuerzos de archivo deben priorizar la preservación de las imágenes de origen, ya que todos los productos derivados posteriores son reproducibles. Si bien los repositorios disponibles para un usuario determinado variarán, se deben hacer esfuerzos para estandarizar los metadatos de encuestas asociados incluidos en el conjunto de datos de imágenes de origen para maximizar su utilidad cuando estén disponibles para la comunidad en general.
- Repositorio de datos
- Genere un archivo de descripción de métodos que incluya detalles topográficos como el área cubierta, el sistema de cámaras, los marcadores de control del terreno y el patrón de recolección. Consulte el Archivo complementario 9 para obtener una descripción de ejemplo de este protocolo.
- Genere un archivo de metadatos de levantamiento específico para el conjunto de datos de imágenes, incluidos campos como el nombre del sitio, la fecha de recolección, las coordenadas GPS, los rumbos de la parcela, la profundidad y la escala del control del terreno, y el patrón de recolección y el sistema de cámara utilizados para la encuesta dada.
NOTA: Se recomiendan encarecidamente campos adicionales que incluyan un contexto geográfico más amplio y condiciones durante la encuesta. Un ejemplo de archivo de metadatos con campos recomendados se puede encontrar en el Archivo complementario 10. - Combine el archivo de descripción, el archivo de metadatos y los archivos de imagen en un único archivo zip para ingerirlo en el repositorio de datos elegido.
NOTA: Las colecciones de datos de imágenes se han puesto a disposición en https://doi.org/10.6075/J0DV1HDR.
Resultados
El éxito de la recopilación de imágenes de grandes áreas sobre el terreno debería dar lugar a la creación de una reconstrucción densa de nubes de puntos con una cobertura completa de arriba hacia abajo del área de levantamiento, mientras que una redundancia inadecuada en la cobertura puede dar lugar a lagunas o a la degradación completa de la nube de puntos (Figura 4). Para un conjunto de 43 encuestas de imágenes de área grande realizadas en todo el archipiélago de Hawái en 2016, un promedio del 99,6% de las imágenes se alinearon por conjunto de datos, y el 66% de los conjuntos de imágenes tenían el 100% de las imágenes alineadas correctamente. Las imágenes recopiladas de la cámara con lente gran angular tenían un GSD promedio de 0.52 mm px-1 , mientras que las imágenes de la cámara con lente de zoom tenían un GSD promedio de 0.18 mm px-1. Estas encuestas generaron densas nubes de puntos con un tamaño medio de 557,7 millones de puntos (15 GB).
Los flujos de trabajo ecológicos descritos aquí fueron diseñados para generar datos comparables a las metodologías existentes para el monitoreo de arrecifes de coral78. Los datos ecológicos extraídos de los estudios de LAI en Hawái muestran, aparte de algunos valores atípicos, medidas de rugosidad lineal resultantes del flujo de trabajo de complejidad estructural que se alinean bien con los valores relativos en comparación con las medidas in situ de complejidad en todos los sitios81 (Figura 5A, B). Los análisis adicionales de la composición de la comunidad de LAI para medir la cobertura porcentual de los principales grupos funcionales bentónicos muestran una alineación similar en comparación con los estudios fotocuadráticos tradicionales82 (Figura 5C, D). Se utilizó un muestreo cuadrilátero para medir la densidad de invertebrados sésiles, siendo los más comunes los erizos de mar, que se resumieron como medidas categóricas de abundancia relativa. Los métodos LAI registraron regularmente niveles más altos de abundancia en relación con los métodos in situ 81 (Figura 5E, F), lo que puede deberse a la capacidad de buscar y encuestar exhaustivamente a todos los individuos dentro de un área dada en comparación con un censo visual rápido. La segmentación de las colonias de coral utilizando la ortoproyección 2D también reveló distribuciones de tamaño similares a las de los taxones de coral comunes a los métodos in situ 83 (Figura 5G, H).
Una de las principales ventajas de los estudios LAI es la capacidad de archivar y rastrear los cambios en las áreas de arrecifes a lo largo del tiempo a través del corregistro de la densa nube de puntos. Los arrecifes de coral son sustratos vivos, lo que para los estudios de LAI significa que puede ser un desafío identificar superficies permanentes, ya sean naturales o instaladas, que se puedan usar para corregistrar de manera confiable densas nubes de puntos de diferentes puntos de tiempo. El ejemplo del atolón del Milenio (Figura 6) muestra un ejemplo con alto crecimiento y pérdida estructural en el que se utilizó el flujo de trabajo de corregistro asistido para el corregistro de nubes de puntos densas a pesar de la poca o ninguna estabilidad de la superficie del arrecife a lo largo del tiempo.
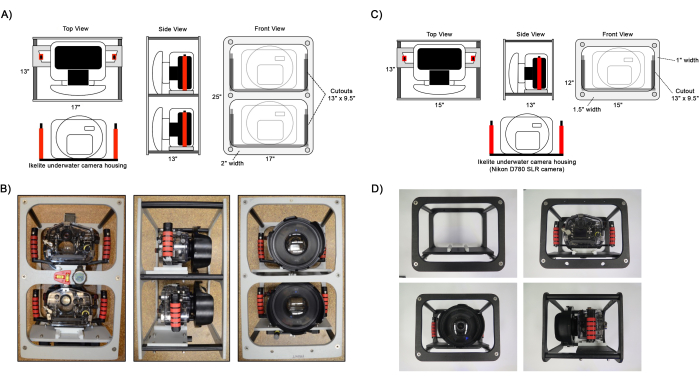
Figura 1: Diagrama de los fotogramas de la cámara ensamblados. Vistas de ejemplo de las configuraciones de fotogramas de cámara doble (A,B) y (C,D) de una sola cámara. Las carcasas de las cámaras Ikelite se fijan al marco del panel de montaje de la cámara mediante una placa deslizante fijada a las asas de la carcasa. Los instrumentos opcionales para ayudar en la navegación, como un nivel, una brújula y una computadora de buceo, se pueden conectar al marco como se muestra en B. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagrama de la configuración de 100m2 de imagen de área grande. Esquema de una parcela de imagen de gran área completamente configurada de 100 m2 de área. Los marcadores de trazado temporales incluyen seis marcadores de mosaico de límite, cuatro barras de escala y cuatro flotantes de referencia. Los marcadores permanentes de la parcela incluyen dos estacas de acero inoxidable con la estaca izquierda, cuando se mira hacia la costa, incluida una tuerca de seguridad. La referencia GPS para la parcela debe tomarse por encima de la baldosa o estaca central izquierda. Haga clic aquí para ver una versión más grande de esta figura.
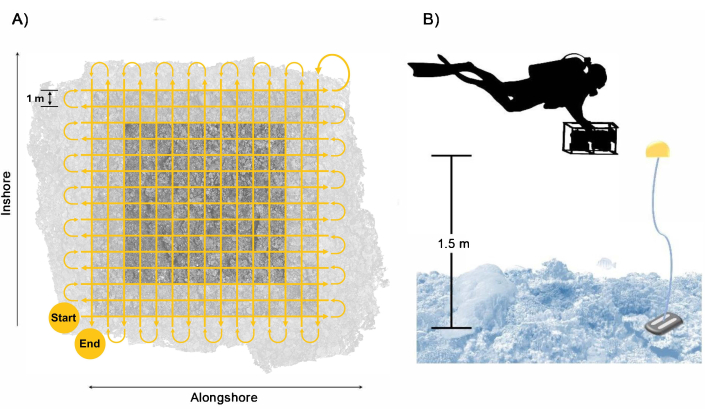
Figura 3: Patrón de recolección de buzos. Ejemplo de (A) ruta de nado del buceador para asegurar una cobertura suficiente y superposición del área de la parcela con un amortiguador incluido y (B) disposición del buceador con el sistema de cámaras con los flotadores de referencia que proporcionan una guía para la altura de nado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Reducción de la superposición de imágenes. La degradación de la densa nube de puntos a medida que el número de imágenes superpuestas se reduce mediante muestreo aleatorio. Cada panel muestra la densa nube de puntos generada a partir de (A) todas las imágenes, (B) 1/2, (C) 1/3, (D) 1/5 y (E) 1/10 de las imágenes originales. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Extracción de datos ecológicos. Los datos candidatos extraídos de imágenes de gran área para cada uno de los flujos de trabajo ecológicos se muestran en comparación con los métodos de recopilación de datos in situ establecidos. Esto incluye (A,B) la complejidad estructural, (C,D) la composición de la comunidad (las barras de error indican error estándar), (E,F) la densidad de invertebrados y la demografía de la estructura de tamaño (G,H). Abreviatura: LAI = imágenes de área grande. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Corregistro de nubes de puntos densas. Un ejemplo de comparación visual de dos nubes de puntos densas corregistradas temporalmente. Las áreas de pérdida estructural, probablemente por daño por oleaje, se codifican visualmente en rojo, como lo indica la flecha magenta. Las áreas de adición estructural, generalmente atribuidas al crecimiento de colonias de coral, se codifican visualmente en azul, como lo indica la flecha amarilla. El flujo de trabajo de corregistro descrito aquí aún se puede usar para áreas de arrecifes tan dinámicas como las que se ven aquí, donde los puntos de control terrestre (GCP) instalados permanentemente no serían confiables debido al crecimiento excesivo o al desplazamiento. Haga clic aquí para ver una versión más grande de esta figura.
| Función de la cámara | Ajuste recomendado |
| Centro de atención | Automático |
| Modo de disparo | P (Automático programado) para lente gran angular |
| A (prioridad a la apertura automática), ajustada a una apertura de F8 para el objetivo macro | |
| Modo de liberación | S (Automático con prioridad al obturador) |
| Ajustes de enfoque automático | Enfoque automático central (AF-C), punto central único (S) |
| Control automático de la sensibilidad ISO | EN |
| Sensibilidad ISO máxima | 3200 |
| Velocidad de obturación mínima | 1/320 |
| Calidad de imagen | RAW + JPEG |
| Temporizador de intervalos | 1 s |
| Balance de blancos | Costumbre |
Tabla 1: Ajustes recomendados de la cámara. A continuación se muestra una lista de los ajustes clave de la cámara que se utilizan para optimizar la calidad de la imagen. Estos ajustes priorizan la captura de imágenes enfocadas capturadas por un operador en movimiento en condiciones de iluminación subacuática.
| Alinear fotos | |
| Exactitud | Alto |
| Preselección genérica | No |
| Límite de puntos clave | 5000 |
| Límite de puntos de enlace | 0 |
| Coincidencia de imágenes guiada | No |
| Adaptación del modelo de cámara | Sí |
| Construya una nube densa | |
| Calidad | Alto |
| Filtrado de profundidad | Leve |
| Calcular colores de puntos | Sí |
| Calcular la confianza de puntos | Sí |
| Puntos de exportación | |
| Tipo de archivo | CAPA DE Stanford |
| Sistema de coordenadas | Coordenadas locales (m) |
| Datos de origen | Nube densa |
| Guardar colores de puntos | Sí |
| Guardar punto normal | Sí |
| Ahorre confianza en los puntos | Sí |
| Guardar clases de puntos | No |
| Convertir colores a RGB de 8 bits | Sí |
| Codificación binaria | Sí |
Tabla 2: Configuración de construcción de nubes de puntos densas 3D. Una lista de configuraciones utilizadas en Agisoft Metashape para crear y exportar una reconstrucción de nube de puntos densa de alta calidad.
Archivo Complementario 1: Hoja de ruta. Ejemplo de imagen de ortomosaico marcada con características y profundidades de la parcela para ayudar a encontrar el área de la parcela para la relevización. Haga clic aquí para descargar este archivo.
Legajo Complementario 2: Extract_meta.py. Script ejecutado en Agisoft Metashape para exportar la pose de la cámara y la información del directorio de archivos para su uso en Viscore para consultar las imágenes originales. Haga clic aquí para descargar este archivo.
Legajo Suplementario 3: Guía de Viscore. Guía de software para Viscore, que incluye flujos de trabajo para la visualización de modelos, corregistro y análisis ecológicos. Haga clic aquí para descargar este archivo.
Legajo Complementario 4: Rugosity_Functions.Rmd. Script utilizado en R que contiene funciones para procesar datos de rugosidad extraídos de Viscore. Por favor, haga clic aquí para descargar este archivo.
Legajo Suplementario 5: Rugosity_Analysis.Rmd. Script utilizado en R para calcular métricas de rugosidad. Haga clic aquí para descargar este archivo.
Legajo Complementario 6: Quadrat_sampling.rpl.json. Script utilizado en Viscore para el flujo de trabajo de análisis de densidad de cuadrantes. Haga clic aquí para descargar este archivo.
Legajo Complementario 7: Density_taxo_lookup.json. Archivo de búsqueda de botón para ejecutar un script de muestreo de cuadrantes para agregar datos de muestreo de cuadrantes por grupo taxonómico. Haga clic aquí para descargar este archivo.
Legajo Suplementario 8: Density_Analysis.R Script utilizado en R para agregar datos de muestreo de cuadrantes que calculan la densidad por grupo taxonómico a nivel de encuesta. Haga clic aquí para descargar este archivo.
Legajo Complementario 9: README.txt Ejemplo de archivo de texto que se incluirá con las imágenes originales para el archivo de datos que describe la metodología de captura de imágenes. Haga clic aquí para descargar este archivo.
Legajo Complementario 10: METADATA_KAH_2016-07_03.txt Ejemplo de archivo de texto que se incluirá con las imágenes originales para el archivo de datos que contienen campos de metadatos para la encuesta LAI. Esto incluye campos para dentro de la encuesta, escala y datos de profundidad para referenciar, así como metadatos generales del sitio para el contexto geográfico. Abreviatura: LAI = imágenes de área grande. Haga clic aquí para descargar este archivo.
Discusión
Las imágenes de área grande son una herramienta que permite a los científicos visualizar y analizar digitalmente las características del entorno a escalas mayores que la de las imágenes individuales recopiladas. Al capturar múltiples imágenes del entorno desde múltiples perspectivas, los protocolos LAI ayudan a crear representaciones de paisajes relativamente amplios (en relación con la cobertura espacial de las imágenes individuales) mientras mantienen los detalles recopilados de las imágenes originales. El valor único de LAI radica en la capacidad de explorar datos ambientales a través de escalas, desde la escala más grande (definida por la extensión de área de la encuesta) hasta la escala más fina (definida por la resolución realizada de las imágenes originales). Sin embargo, para capitalizar esta fortaleza a escala cruzada, es fundamental garantizar un acceso regular y fluido a todos los niveles de los datos capturados, específicamente para garantizar un acceso fácil tanto a las imágenes originales como al modelo 3D derivado. En cada paso del protocolo presentado aquí, destacamos esta fortaleza única de LAI al garantizar constantemente que las imágenes originales sean accesibles, utilizables y archivadas de forma segura junto con los modelos de LAI derivados.
El método LAI entregará productos que estén vinculados directamente a las imágenes originales recopiladas. Al cambiar los detalles de la adquisición de imágenes, los usuarios pueden producir productos de datos de diferente calidad y cobertura. Al inspeccionar entornos de arrecifes de coral estructuralmente complejos, un usuario con un tiempo de estudio limitado bajo el agua (o con un número constante de imágenes disponibles para capturar) puede priorizar el aumento de la cobertura de área del área de estudio o el aumento del nivel de detalle de cada sección del área muestreada. Necesariamente habrá una compensación, ya que el modelo de área grande tendrá menos detalles (y quizás más oclusiones) por unidad de área y el modelo detallado cubrirá menos área total (probablemente menos oclusiones). En este protocolo, incluimos el uso de dos cámaras, cada una con diferentes lentes, lo que permite al usuario muestrear un área más grande (suficiente superposición con la lente gran angular para cumplir con los requisitos de SfM) mientras que simultáneamente recopila imágenes originales más detalladas (mayor detalle de la lente de zoom que tiene menos superposición de foto a foto). Al incluir la estimación de la pose de las imágenes de ambas cámaras, los protocolos de visualización y análisis posteriores incluyen vistas de mayor resolución de gran parte del área muestreada. Aunque el protocolo tiene como objetivo ampliar el rango de viabilidad de la encuesta, los usuarios pueden encontrar que los productos derivados carecen de suficiente cobertura de área o de suficientes detalles de las imágenes originales para completar las rutinas analíticas preferidas. Se alienta a los usuarios a revisar las imágenes originales y los modelos derivados para asegurarse de que el protocolo de prospección ambiental cumple con las necesidades del programa y a modificar el enfoque de la prospección en el agua (por ejemplo, cambiando la distancia de muestreo del suelo, alterando la duración de la encuesta o el número de imágenes recolectadas) para llegar al equilibrio preferido de cobertura de área y resolución por unidad de área.
Los métodos LAI aportan valor a la ciencia subacuática al capturar "instantáneas" ricas en información y de amplia cobertura de entornos bentónicos que pueden ser eficientes en el tiempo y requieren una experiencia limitada en un dominio específico para su recopilación. El valor de estos productos de datos se puede considerar con referencia a los flujos de datos existentes, así como para aplicaciones novedosas y aceleradas específicas de dominio. Teniendo en cuenta la comparación con los flujos de datos existentes, los productos de análisis de LAI pueden proporcionar datos ecológicos que son directamente comparables con los datos recopilados in situ por observadores submarinos 84,85,86,87. Proporcionamos aquí un análisis cuantitativo de los datos ecológicos derivados de cada una de las actividades clásicas de monitoreo in situ y del análisis estandarizado de los productos de LAI, siguiendo este protocolo. Al centrarse en cuatro métricas comunes en los esfuerzos de monitoreo de los arrecifes de coral (complejidad estructural, composición de la comunidad bentónica, densidad de invertebrados móviles y estructura del tamaño del coral; Figura 5), demostramos una fuerte concordancia cuantitativa en los resultados de los datos. En particular, para los flujos de datos que requieren observaciones a gran escala (por ejemplo, identificaciones taxonómicas, definiciones precisas de fronteras biológicas), los flujos de trabajo de LAI que incluyen acceso regular y confiable a imágenes originales brindan una fuerza única para paralelo con las oportunidades de observación que históricamente se han limitado solo al muestreo inmersivo in situ. Los avances en el manejo y visualización de datos proporcionados por Viscore y descritos en este protocolo ofrecen un valor único para garantizar la comparabilidad de los datos ecológicos derivados de LAI y los productos de monitoreo in situ, lo que permite un mantenimiento imparcial de los flujos de datos a largo plazo con la incorporación de flujos de trabajo mejorados digitalmente de LAI.
Para los científicos submarinos, LAI ofrece la oportunidad de aprovechar flujos de trabajo novedosos y acelerados en la adquisición y exploración de datos. LAI tiene fortalezas únicas como una herramienta de mapeo de alta resolución que contiene información no solo que describe la composición relativa del entorno bentónico, sino también las características espaciales. Explícito para la creación de un modelo 3D a partir del flujo de trabajo de SfM, los productos LAI contienen información sobre la complejidad estructural que puede ser explorada a través de múltiples escalas56. Como herramientas que capturan paisajes marinos de áreas más grandes, los productos LAI pueden brindar la oportunidad de considerar los patrones de distribución espacial y las características de vecindad para los organismos bentónicos45,66. Además, al ser capaz de visualizar paisajes bentónicos a escalas más grandes, se hace posible detectar características que no son fácilmente visibles en los hábitats submarinos debido a las limitaciones de la visibilidad a larga distancia bajo el agua, por ejemplo, el patrón poligonal a gran escala (3-4 m) de una macroalga común en un arrecife de coral del Pacífico64.
Si bien el LAI ofrece oportunidades para el análisis a gran escala, se han manifestado preocupaciones con respecto a los desafíos relacionados con la recolección eficiente en el agua y el posprocesamiento de imágenes. La expansión de la extensión espacial de la adquisición de imágenes bajo el agua exigirá avances tecnológicos que se alejen de las imágenes desplegadas por buzos, hacia la utilización de sistemas de mapeo asistido88 y, en última instancia, el uso de ROV38 y AUV67,89. Las metodologías de encuesta sólidas con respecto al patrón de adquisición y los sistemas de cámaras garantizarán una transición fluida y la coherencia de los datos generados en estas diferentes plataformas. Dadas las demandas computacionales, así como el gran formato de datos de los productos LAI, algunos científicos marinos han expresado su preocupación por la accesibilidad tecnológica del flujo de trabajo90 y las grandes demandas de tiempo relacionadas con la extracción de datos ecológicos84,86. Sin embargo, se presenta un número creciente de herramientas que aprovechan las soluciones creativas a los obstáculos técnicos de la extracción de datos 80,91,92,93. Es importante destacar que el uso de flujos de trabajo mejorados por IA para el análisis de LAI está limitado por la calidad de la señal de entrada proporcionada. Como tal, sigue existiendo una demanda constante para mantener los estándares y la calidad de la adquisición de imágenes y la gestión de datos en los protocolos LAI, independientemente de si la extracción de datos la realiza un observador humano, un algoritmo de IA entrenado o (idealmente) un flujo de trabajo humano acelerado por IA. Al mantener un enfoque constante en la importancia primordial de las imágenes originales en los protocolos LAI, como se describe aquí, surgen oportunidades únicas para explorar hábitats submarinos de manera sólida, transparente y consistente.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo está respaldado por los esfuerzos del Desafío de las 100 Islas en el Instituto Scripps de Oceanografía. Agradecemos a Schmidt Marine Technology Partners, Ed y Christy Scripps, y a la Moore Family Foundation por su apoyo financiero a la investigación asociada y a los esfuerzos de capacitación en imágenes de gran área que han ayudado a refinar la metodología. Además, agradecemos a la tripulación de los buques de investigación Hi'ialiki, Hanse Explorer y Plan B, que brindaron apoyo a los esfuerzos de campo. Agradecemos especialmente al equipo de la División de Ciencias del Ecosistema del Centro de Ciencias Pesqueras de las Islas del Pacífico de la NOAA que ayudó con la recopilación de campo de los datos presentados aquí.
Materiales
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
Referencias
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548(2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985(2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535(2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993(2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077(2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197(2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262(2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593(2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979(2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740(2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737(2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276(2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050(2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440(2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957(2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011(2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113(2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077(2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438(2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213(2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594(2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282(2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943(2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569(2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304(2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548(2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145(2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674(2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317(2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados