Method Article
Mesure de la structure, de la composition et de l’évolution des environnements sous-marins à l’aide de l’imagerie de grande surface
Dans cet article
Résumé
Ce protocole couvre une méthodologie d’imagerie à grande surface en quatre étapes utilisée pour extraire des mesures de la complexité structurelle, de la composition des communautés et de la démographie de la population des communautés de récifs coralliens. La qualité des images collectées et l’accès intégré à l’imagerie source sont priorisés à chaque étape du protocole.
Résumé
La technologie d’imagerie et de traitement numériques a évolué pour faciliter l’expansion des relevés d’imagerie à grande échelle, ce qui augmente notre capacité à étudier l’état, les tendances et la dynamique des organismes vivant dans les habitats subtidaux. En créant des jumeaux numériques photoréalistes pour les analyses ex situ , ces approches permettent à de petites équipes de terrain de collecter beaucoup plus de données qu’auparavant. Nous présentons ici un pipeline d’études d’imagerie à grande échelle en quatre étapes et une méthodologie d’analyse, y compris la collecte d’images, la construction de modèles, l’analyse écologique et la conservation des données, qui a été développée et affinée par l’expérimentation au cours de la dernière décennie. Chaque étape décrite met l’accent sur la valeur unique de l’imagerie source d’origine. Bien que les types de données extraites des relevés d’images à grande échelle soient vastes, nous incluons ici des flux de travail pour extraire des données écologiques sur la complexité structurelle, la composition des communautés et les analyses démographiques précieuses pour la surveillance et les efforts fondés sur des hypothèses. Nous incluons également des recommandations pour les normes de métadonnées, qui complètent la collecte de données d’imagerie de grande surface et soutiennent les efforts d’archivage facilitant la transparence et la collaboration entre les groupes de recherche.
Introduction
Dans l’ensemble des environnements terrestres, les chercheurs ont tiré parti de l’échantillonnage normalisé de grandes zones de communautés écologiques, en particulier dans le contexte de sites d’étude à long terme, notamment l’île Barro Colorado1, la forêt expérimentale Hubbard Brook2 et d’autres3. Grâce à la collecte de données de répartition spatialement explicites et taxonomiquement résolues, cet échantillonnage a été utilisé pour explorer la dynamique écologique fondamentale, comme les modèles de dispersion et de recrutement 3,4,5, la préférence et la disponibilité de l’habitat, les noyaux de dispersion, la limitation des ressources 3,5,6,7,8 et l’utilisation de l’espace 9,10. Cependant, à ce jour, la plupart des études spatiales des communautés marines se sont appuyées sur des mesures de couverture relative, rapportées en pourcentage de couverture occupée par le taxon ou le groupe 11,12,13,14,15. Cependant, les estimations agrégées de la couverture relative sont insuffisantes pour résoudre les détails de la démographie au niveau de la population ainsi que de la dynamique au niveau de la communauté. Les études qui ont fourni des analyses détaillées des communautés benthiques se sont appuyées sur des protocoles de surveillance laborieux dans l’eau 16,17,18,19,20,21,22,23,24,25,26,27,28,29 ,30,31,32, mais l’échelle (y compris les échelles taxonomiques, spatiales et chronologiques) de ces études est considérablement limitée en raison des exigences opérationnelles de la méthodologie dans l’eau.
L’imagerie de grande surface (LAI) est une approche qui combine des informations provenant de nombreuses images par le biais de flux de travail intensifs en calcul pour créer des représentations photoréalistes d’environnements à des échelles beaucoup plus grandes que celles des images constitutives33. Le flux de travail LAI est particulièrement bien adapté aux applications dans les habitats sous-marins, compte tenu de la visibilité limitée due à l’absorption et à la diffusion de la lumière dans l’eau. En raison de la visibilité limitée, les images qui capturent les détails fins du benthos doivent être acquises près du sujet ; Pour capturer une vue du paysage (ou du paysage marin) d’une large bande d’habitat benthique tout en conservant les détails fins des sujets benthiques individuels, il faut donc une imagerie composite. De plus, dans des environnements structurellement complexes, il est essentiel de tenir compte de la structure tridimensionnelle (3D) dans la reconstruction de l’imagerie composite afin de produire des représentations fidèles de la position et de la proximité relative des organismes benthiques. La méthode photogrammétrique Structure-from-Motion (SfM) a été appliquée à des environnements avec des organismes benthiques relativement immobiles, y compris les récifs coralliens 34,35,36, les écosystèmes benthiques de l’Antarctique37, les récifs coralliens d’eau froide 38, les suintements froids39 et l’habitat d’herbiers marins40, générant une imagerie composite sans stéréoscopie utilisée pour reconstruire une scène de paysage avec génération d’ortho-carte et estimation de nuages de points.
Dans la science des récifs coralliens, LAI a offert la possibilité de visualiser des paysages récifaux à des échelles spatiales de plus en plus grandes et de partager ces visualisations à travers les médias numériques. L’IAL peut être utilisée pour estimer la couverture des organismes récifaux, la densité et la distribution des colonies de coraux, ainsi que la forme et l’état des organismes individuels 41,42,43,44,45,46,47. De plus, lorsque les produits LAI sont collectés au même endroit à différents moments dans le temps, il est possible d’enregistrer les changements dans la taille et l’état des organismesindividuels 48,49,50,51. Étant donné que la plupart des colonies de coraux scléractiniaires croissent de l’ordre du millimètre au centimètre radial par an, les séries chronologiques d’IAL collectées au fil des années peuvent fournir un flux de données inestimable pour rendre compte de la biologie et de l’écologie de ces espèces52. Les données LAI répétées et co-enregistrées offrent des informations uniques permettant d’étudier les récifs coralliens dans un format qui peut être partagé, archivé et utilisé comme base de collaboration dans le monde entier.
À mesure que l’utilisation de l’indice de liaison élévatrice s’est développée parmi les écologistes des récifs coralliens53, la diversité des systèmes de caméras et des méthodologies d’enquête52 s’est également développée. Un protocole LAI choisi doit cibler la résolution et la portée des paramètres écologiques souhaités tout en restant limité aux ressources disponibles. La qualité de toute reconstruction photogrammétrique dépendra en fin de compte de la résolution de l’imagerie source et de la couverture spatiale de la zone de relevé. La qualité de l’image est déterminée par l’influence des paramètres de la caméra, y compris la résolution du capteur et la distance focale, ainsi que par la procédure de collecte, principalement la distance par rapport au benthos54, qui contribuent toutes à la distance d’échantillonnage au sol (GSD) effective d’un ensemble particulier d’images. De plus, des vitesses d’obturation rapides, de petites ouvertures et de faibles valeurs ISO produiront des images nettes, nettes et à faible bruit électronique, respectivement. Maintenir chacun de ces paramètres à des seuils permettant d’obtenir des images de qualité suffisante peut être un défi dans les environnements sous-marins où les niveaux de lumière sont faibles. Les capteurs plus grands, comme ceux que l’on trouve sur les appareils photo reflex numériques et les appareils photo hybrides, génèrent une meilleure qualité d’image et, par conséquent, des reconstitutions plus précises par rapport aux solutions plus petites et plus mobiles comme les caméras d’action55. Parmi les autres caractéristiques à ne pas négliger lors de l’achat d’un modèle d’appareil photo approprié, citons un intervallomètre intégré et une capacité de stockage et de batterie suffisante pour prendre en charge les efforts de collecte d’images de longue durée sur le terrain.
La conception de l’enquête doit être guidée par l’hypothèse écologique, les paramètres candidats déterminant la résolution et la couverture spatiale nécessaires. Dans l’écologie des récifs coralliens, l’IAL a été utilisé pour caractériser la complexité structurale 35,36,56,57,58,59, la composition et l’assemblage des communautés60,61,62, la distribution spatiale45,63,64,65,66 et les trajectoires des communautés 48,49,50,67,68,69. La résolution de la qualité de l’image doit être adaptée aux besoins en données écologiques, avec une résolution à l’échelle plus fine sur les détails sub-mm nécessaires pour soutenir les observations à l’échelle des polypes de la compétition le long des frontières des colonies70 ou les relevés de petits coraux juvéniles66,71. En revanche, l’extraction de paramètres d’habitat et de structure à grande échelle pour la cartographie côtière 72,73,74 nécessite une plus grande étendue spatiale avec un besoin réduit de résolution à l’échelle cm-m. La demande de résolution doit être équilibrée avec l’étendue spatiale requise pour obtenir un échantillonnage suffisant et les limites opérationnelles du temps nécessaire pour réaliser un levé LAI33.
Le présent document décrit un protocole de bout en bout pour la réalisation d’une enquête LAI, qui se concentre sur l’optimisation de la qualité, de l’utilité et de la valeur de l’imagerie source, en décomposant le protocole en quatre étapes principales : la collecte d’images, la construction du modèle, les analyses écologiques et la conservation des données33. La collecte d’environ 3 500 relevés d’images LAI de plus de 2 000 sites récifaux uniques au cours de la dernière décennie a contribué à affiner la méthodologie pour chaque étape présentée ici (https://doi.org/10.6075/J0T43RN1). Le protocole qui en résulte est une méthode de collecte de données robustes et de reconstructions de modèles exactes et précises, qui permettent la collecte de données écologiques détaillées dans un large éventail d’applications, y compris la complexité structurelle, la composition des communautés et les données démographiques de la population (p. ex., la densité et la structure de la taille). Nous incluons en outre des normes de métadonnées pour l’archivage des données LAI, dont l’établissement est essentiel pour assurer la préservation, la transparence et le potentiel collaboratif de ces jumeaux numériques.
Protocole
1. Collecte d’images
REMARQUE : La procédure de collecte d’images de grande surface suivante décrit une méthode pour effectuer le levé d’une zone d’environ 100 m2, bien qu’elle puisse facilement être adaptée à des zones allant de 10 m2 à 2 500 m2. La méthode d’enquête décrite ci-dessous est conçue pour être déployable dans une variété de conditions de travail, générer des images de haute qualité et fournir des données robustes qui peuvent être utilisées pour de nombreuses applications écologiques à partir de l’effort d’une seule plongée d’une heure par une équipe de binômes de deux personnes.
- Préparation de l’engrenage
- Assemblez le cadre de l’appareil photo en fixant les panneaux extérieurs du cadre aux panneaux et aux colonnes de montage de l’appareil photo à l’aide de vis à tête plate Philips de 1 1/2 po de long (Figure 1).
- Préparez deux appareils photo reflex numériques, l’un avec un objectif grand angle fixe et l’autre équipé d’un zoom. Voir le Tableau 1 pour les paramètres détaillés de l’appareil photo.
REMARQUE : Bien que le deuxième appareil photo à objectif zoom soit facultatif, il est fortement recommandé de capturer une plus grande résolution d’image pour déterminer les détails de la taxonomie75,76, trouver et identifier les petits coraux juvéniles66,71 (1-5 cm de diamètre) et distinguer les limites des colonies de coraux 45,48,50 lors des futures analyses écologiques. - Assemblez les boîtiers de caméra sous-marine en fixant le port du dôme et fixez-les à l’aide des vis à oreilles du dôme incluses. Fixez les poignées à l’aide de vis à tête cruciforme de 1/2 » de long et la plaque de montage de l’appareil photo à l’aide d’une vis à tête creuse de 1 1/8 » de long. Insérez les caméras dans le boîtier et utilisez la pompe à vide pour régler la pression du boîtier à 5 po. Hg, en vérifiant l’intégrité du joint torique.
- Installez les boîtiers sur le cadre de l’appareil photo en faisant glisser la plaque de montage de l’appareil photo sur les panneaux du cadre de montage et fixez-les en place à l’aide de vis moletées.
- Configuration de l’intrigue
- Établissez les limites de la parcelle à l’aide de six carreaux carrés en acier inoxydable (10 cm de côté) avec des marqueurs codés imprimés. Placez deux tuiles centrales à 10 m l’une de l’autre le long de l’isobathe cible, avec quatre tuiles d’angle ajoutées à 5 m à l’intérieur et au large des tuiles centrales pour créer une zone de parcelle carrée de 10 m sur 10 m (figure 2). Enregistrez la profondeur à chacune des six tuiles pour fournir une orientation par rapport à la verticale locale et faciliter les étapes ultérieures de construction du modèle.
- Ajoutez des flotteurs de référence avec ~1,5 m de ligne attachée à des poids de 0,45 kg (1 lb) à environ 1 m à l’extérieur de chacun des quatre carreaux d’angle.
REMARQUE : Ces flotteurs de référence servent de guide à l’opérateur de la caméra pour indiquer les limites de la parcelle et la hauteur au-dessus du benthos à laquelle ils doivent nager avec la caméra. En les plaçant à l’extérieur des limites de la parcelle de 10 m x 10 m, vous créez une zone tampon de l’imagerie, ce qui permet de s’assurer que la zone imagée centrale est entièrement reconstruite. - Placez une barre d’échelle de 0,5 m de longueur composée de deux tuiles cibles codées fixées à des barres de polychlorure de vinyle (PVC) ou d’aluminium dans chaque quadrant de la placette, pour un total de quatre barres d’échelle déployées.
REMARQUE : Il est important que les barres d’échelle et les tuiles de profondeur restent stables tout au long du processus de collecte d’images. Les barres d’échelle et les tuiles de profondeur peuvent également être utilisées comme repères visuels pour que le caméraman puisse suivre la progression de son schéma de nage. - Pour établir des parcelles permanentes, installez des piquets en acier inoxydable de 0,46 m (18 po) (tige filetée de 0,95 cm ou 3/8 po) fixés avec de l’époxy marin en deux parties à l’aide d’un maillet adjacent à chaque tuile centrale pour marquer la ligne médiane de la parcelle. Lorsque l’on regarde vers la rive, le piquet gauche comprend un contre-écrou pour faciliter l’orientation lors des futurs efforts de relevé. À la fin de l’enquête, enregistrez les coordonnées du système de positionnement global (GPS) directement au-dessus de l’emplacement du piquet central gauche à l’aide d’un appareil GPS stocké dans un boîtier étanche fixé à un flotteur de plongée.
REMARQUE : L’installation de piquets permanents est recommandée lorsqu’elle est autorisée par le permis afin de réduire le temps de recherche lors des relevés ultérieurs et d’affirmer qu’il est nécessaire de refaire les relevés de la même zone de récif. Utilisez une ortho-image bidimensionnelle (2D) imprimée ou une « feuille de route » (fichier supplémentaire 1) du site d’étude pour localiser les caractéristiques invariantes et aider à identifier l’emplacement de la même zone de parcelle pour l’imagerie. Ces feuilles de route peuvent également être utilisées pour déplacer des parcelles d’arpentage exactes dans les cas où l’autorisation ne permet pas l’installation de piquets permanents ou lorsque des piquets ont été délogés ou enlevés.
- Capture d’image
- Réglez la balance des blancs personnalisée de chaque caméra à l’aide d’une carte grise à la profondeur ciblée du tracé.
- Démarrez chaque caméra sur un intervallomètre réglé pour capturer sur un intervalle de 1 s-1 .
- Nager le système de caméra à environ 1,5 m au-dessus du benthos selon un quadrillage, suivi d’un deuxième passage perpendiculaire avec environ 1 m entre chaque passage en nageant à une vitesse lente d’environ 0,25 m s-1 (figure 3). Assurez-vous que les passes s’étendent sur au moins 2 m au-delà des bords des limites de la parcelle pour assurer un chevauchement suffisant dans la zone cible de la parcelle.
REMARQUE : En suivant ce schéma de nage et cette vitesse, il suffit de collecter au moins 1 700 images de chaque caméra pendant 28 minutes d’imagerie. Cependant, pour tenir compte du temps d’exécution entre les passages et du fait de pécher par excès de suréchantillonnage pour éviter un chevauchement insuffisant qui entraîne des données sous-optimales, nous recommandons aux plongeurs de cibler la collecte de 2 500 images de chaque caméra pendant environ 40 minutes d’imagerie. - Tenez le système de caméra à peu près perpendiculairement à la surface de l’océan pour assurer une couverture descendante suffisante ; cependant, pour les sites d’arpentage à topographie complexe, ajustez l’orientation de la caméra lors du deuxième passage pour suivre perpendiculairement au benthos et réduire les occlusions dans la reconstruction 3D. Lorsque vous orientez l’appareil photo, veillez à minimiser l’eau bleue capturée dans les images.
REMARQUE : Dans les cas de conditions océaniques sous-optimales telles que de forts courants ou des pentes abruptes, les deux passes peuvent être effectuées dans la même direction le long du rivage. L’utilisation d’un seul appareil photo à objectif grand angle peut être nécessaire en cas de fort courant pour réduire le profil de traînée et l’effort du plongeur nécessaire pour maintenir sa progression vers l’avant. Idéalement, la deuxième série de passes doit être légèrement tournée par rapport à la première. Si deux passages sont effectués dans la même direction le long du rivage, au moins une ou deux « lignes de liaison » perpendiculaires ou diagonales coupant l’ensemble initial de passes doivent être ajoutées pour améliorer la qualité de la reconstitution.
2. Construction du modèle
REMARQUE : L’étape de construction du modèle se concentre sur le maintien de l’accès à l’imagerie source haute résolution et la génération du nuage de points dense dérivé. Le référencement du nuage de points dense se fait dans le logiciel centralisé de visualisation et d’analyse (voir la Table des matériaux)77, ce qui permet à l’utilisateur de saisir et de modifier à la volée. Il n’est donc plus nécessaire de retraiter et d’exporter à nouveau les produits de données d’un ensemble de données lorsque de nouvelles informations apparaissent, en particulier dans le cas d’enquêtes supplémentaires au fil du temps. Les orthocartes 2D, appelées ici orthoprojections, sont générées à l’aide d’une vue de projection orthorectifiée du nuage de points dense, avec l’angle de projection orthogonal à la direction de la gravité.
- Alignement de la caméra et construction de nuages de points denses en 3D
- À l’aide d’un ordinateur hautes performances, chargez toutes les images, y compris celles des appareils photo grand angle et macro, dans un projet Agisoft Metashape en sélectionnant Flux de travail | Ajouter un dossier. Une fois les fichiers chargés, sélectionnez la disposition des données comme Caméras uniques, ajoutez toutes les images à un seul morceau. Supprimez du projet les images contenant trop d’eau bleue dans la scène.
REMARQUE : Avant d’être ajoutées au projet, les images de chaque appareil photo doivent être organisées dans des dossiers distincts, qui sépareront les fichiers d’image du bloc en groupes de caméras distincts. - Alignez toutes les images en sélectionnant Flux de travail | Alignez les photos. Voir le tableau 2 pour les paramètres de traitement de l’alignement.
- Une fois l’alignement terminé, vérifiez que le jeu d’images a été correctement aligné en fonction du pourcentage de caméras alignées et de l’inspection du nuage de points clairsemé généré pour détecter les lacunes de couverture ou les désalignements. Assurez-vous que la boîte englobante englobe l’intégralité du nuage de points clairsemé avant de continuer. Si nécessaire, modifiez-le à l’aide des options Redimensionner ou Rotation de la région .
REMARQUE : Il est possible d’aligner 100 % des images et d’avoir encore des espaces dans certaines parties du modèle et, à l’inverse, d’aligner 80 à 90 % des images mais d’avoir un modèle complet de la zone d’enquête cible. Par conséquent, le pourcentage d’alignement et la couverture surfacique doivent être utilisés pour prendre une décision éclairée sur la facilité d’utilisation, en partie ou en totalité, de l’ensemble des données générées ou sur la nécessité d’efforts supplémentaires pour améliorer la qualité d’acquisition d’images ou d’ajuster les paramètres de traitement de l’alignement. - Désactivez le groupe de caméras contenant les images de l’objectif zoom. Construisez le nuage de points dense en sélectionnant Flux de travail | Créez un cloud dense. Reportez-vous au Tableau 2 pour connaître les paramètres de traitement de Build Dense Cloud.
REMARQUE : Bien que les images des deux caméras doivent être utilisées pour l’alignement afin de faciliter l’interrogation de toutes les images haute résolution lors des analyses écologiques, les images de l’objectif zoom ne doivent pas être utilisées lors de la création du nuage de points dense, car les différences subtiles de balance des blancs et d’exposition entre les deux caméras ajouteront du bruit visuel au nuage de points dense. - Exportez les estimations de pose de la caméra en sélectionnant Outils | Exécuter le script | Extract_meta.py script (Fichier supplémentaire 2). Exportez le nuage de points dense en sélectionnant Fichier | Exporter | Exporter des points. Voir le Tableau 2 pour les paramètres d’exportation.
- Faites glisser et déposez le fichier de nuage de points dense exporté sur le fichier vc5prep-confidence.bat situé dans les fichiers programme du logiciel de visualisation.
- Compilez les fichiers de données exportés, y compris les fichiers de pose de caméra (*.cams.xml et *.meta.json) ainsi que les fichiers de programme générés (*.vml et le dossier contenant les fichiers *ptdata, *.xml, *.kdm) dans un seul répertoire pour une utilisation dans le logiciel de visualisation.
- À l’aide d’un ordinateur hautes performances, chargez toutes les images, y compris celles des appareils photo grand angle et macro, dans un projet Agisoft Metashape en sélectionnant Flux de travail | Ajouter un dossier. Une fois les fichiers chargés, sélectionnez la disposition des données comme Caméras uniques, ajoutez toutes les images à un seul morceau. Supprimez du projet les images contenant trop d’eau bleue dans la scène.
- Échelle et orientation
- Dans le logiciel de visualisation, utilisez l’outil de mise à l’échelle pour placer des paires de marqueurs sur des cibles de barre d’échelle et saisir la distance connue.
REMARQUE : De plus amples détails sur l’outil de détartrage se trouvent à la section 4.2 du fichier supplémentaire 3. - Placez des marqueurs sur chaque tuile de profondeur et utilisez l’outil d’orientation pour ajuster les valeurs de profondeur de chaque tuile afin de définir le plan d’ajustement le mieux à la verticale locale.
REMARQUE : De plus amples détails sur l’outil d’orientation se trouvent à la section 4.4 du fichier supplémentaire 3.
REMARQUE : Vérifiez que les rayons de profondeur pointent vers le haut et se terminent à la surface estimée de l’eau. Dans le cas de rayons orientés vers le bas, vérifiez s’il y a des signes de mouvement dans les tuiles de profondeur qui entraîneraient des erreurs dans la valeur de profondeur par rapport à son emplacement final reconstruit ou des erreurs dans les métadonnées de profondeur.
- Dans le logiciel de visualisation, utilisez l’outil de mise à l’échelle pour placer des paires de marqueurs sur des cibles de barre d’échelle et saisir la distance connue.
- Co-enregistrement temporel
- Créez un fichier de projet d’organisation dans le logiciel pour une collection de données conformément à la section 10.0 du fichier supplémentaire 3. Incluez plusieurs sites avec des enquêtes au fil du temps dans un seul projet d’organisation.
- Ajoutez des fichiers de nuages de points denses au projet d’organisation sous forme de couches et modifiez la structure organisationnelle au niveau du site si nécessaire pour connecter les nuages de points denses d’un site donné au fil du temps.
REMARQUE : Utilisez un schéma de nommage de fichier cohérent de [Région]_[Date]_[Site] pour automatiser l’organisation des couches. - Sélectionnez un point temporel pour qu’un site serve de couche de référence pour l’échelle et l’orientation de la série chronologique.
REMARQUE : Plusieurs couches peuvent être utilisées pour régler l’échelle ; Cependant, une couche de points temporels doit être sélectionnée comme référence pour l’orientation, car les changements de marée et la grande hauteur de la houle entraînent des erreurs dans la précision et la cohérence des mesures de profondeur dans le temps. - Utilisez l’outil de coregistration assistée pour aligner les couches dans le temps.
REMARQUE : De plus amples détails se trouvent à la section 11.0 du Dossier supplémentaire 3. En cas de changement structurel important dû à une forte croissance ou à des événements de forte houle, il peut être préférable d’utiliser le flux de co-enregistrement manuel en utilisant des caractéristiques invariantes candidates. Pour les séries chronologiques plus longues, ou lorsqu’il y a un changement substantiel au fil du temps, il est généralement recommandé de co-enregistrer un modèle donné au point temporel antérieur suivant.
- Orthorectification 2D
- À l’aide de l’outil boîtes du logiciel, définissez une vue à partir d’un angle de surface (g : 0°) avec des limites englobant la zone d’analyse focale (10 m x 10 m) ainsi qu’une zone tampon d’au moins 2 m ( minimum l : 14 m, minimum h : 14 m) s’étendant de chaque bord.
REMARQUE : Les détails sur l’utilisation de l’outil boîtes se trouvent à la section 6.0 du fichier supplémentaire 3. - Dans l’outil Boîtes, activez l’exportation de carte pour créer un fichier d’image d’orthoprojection. Définissez la résolution d’exportation sur 1 mm px-1 et sélectionnez capturer pour générer un aperçu. Faites défiler jusqu’à une vignette d’aperçu contenant une section complète du nuage de points dense et augmentez la valeur pt-size pour combler les espaces entre les points.
- Sélectionnez capturer pour exporter l’orthoprojection sous forme de fichier ppm. Une fois la capture terminée, convertissez le fichier exporté en tif en faisant glisser et en déposant le fichier .ppm généré sur le fichier convert-to-tif-flip.cmd situé dans les fichiers programme.
- Pour les nuages de points denses co-inscrits d’une série chronologique, répétez les étapes 2.4.2 à 2.4.3 pour le site, en modifiant la couche temporelle tout en utilisant la même zone.
- À l’aide de l’outil boîtes du logiciel, définissez une vue à partir d’un angle de surface (g : 0°) avec des limites englobant la zone d’analyse focale (10 m x 10 m) ainsi qu’une zone tampon d’au moins 2 m ( minimum l : 14 m, minimum h : 14 m) s’étendant de chaque bord.
3. Analyse écologique
REMARQUE : Il existe une myriade d’options pour l’extraction de données écologiques, dont nous présentons une sélection ici. Ces flux de travail de base se concentrent sur des mesures établies pour la surveillance à long terme78,79, mais peuvent être utilisés et adaptés pour générer des données suffisantes pour une enquête scientifique basée sur l’observation. Les utilisateurs doivent sélectionner et adapter les flux de travail en fonction de leurs besoins individuels en matière de données et de leurs objectifs analytiques. Les flux de travail décrits ci-dessous sont conçus pour intégrer l’accès direct à l’imagerie source afin de faciliter l’annotation des données biologiques, en utilisant des produits dérivés tels que le nuage de points dense 3D ou l’orthoprojection 2D comme cadre organisationnel.
- Complexité structurelle
- À l’aide de l’outil rugo, créez une boîte de 10 m x 10 m sur le nuage de points dense, en fixant une dimension maximale de 10 m (rugo-dim : 10,0 m) et un rapport d’aspect de 1,0 (quad-aspect : 1,000) pour désigner la zone cible de 100 m2 pour l’extraction des données.
REMARQUE : Vous trouverez de plus amples détails sur l’utilisation de l’outil rugo à la section 7.0 du fichier supplémentaire 3. - Définissez le nombre de lignes de transect à échantillonner (lignes) et le nombre de points le long de chaque transect (échantillons) en fonction de l’espacement d’échantillon souhaité. Sélectionnez Préparer pour exporter un fichier csv contenant les coordonnées x, y et z de chaque point échantillonné, qui peut être utilisé pour diverses analyses de complexité structurelle.
- Exécutez le script trouvé dans le fichier supplémentaire 4 pour générer les fonctions utilisées pour les analyses de complexité structurelle. Ensuite, suivez les scripts trouvés dans le fichier supplémentaire 5 en fonction des paramètres souhaités pour quantifier la complexité structurelle.
REMARQUE : Il est suggéré de sélectionner une échelle d’espacement à la résolution la plus élevée (espacement de 1 cm recommandé) que les utilisateurs peuvent cibler pour répondre à l’échelle qui les intéresse, à partir de laquelle une variété d’échelles, telles que celles présentées ici (espacement des lignes de 0,5 m et espacement des points de 10 cm), peuvent également être évaluées par sous-échantillonnage56.
- À l’aide de l’outil rugo, créez une boîte de 10 m x 10 m sur le nuage de points dense, en fixant une dimension maximale de 10 m (rugo-dim : 10,0 m) et un rapport d’aspect de 1,0 (quad-aspect : 1,000) pour désigner la zone cible de 100 m2 pour l’extraction des données.
- Composition de la communauté
- À l’aide de l’outil Virtual Point Intercept (VPI), créez une boîte de 10 m x 10 m sur le nuage de points dense, en définissant une dimension maximale de 10 m (quad-dim : 10,0 m) et un rapport d’aspect de 1 (quad-aspect : 1,000) pour désigner la zone cible de 100 m2 pour l’extraction des données.
REMARQUE : Les détails sur l’utilisation de l’outil d’interception de points virtuels se trouvent à la section 5.0 du fichier supplémentaire 3. - Définissez les points à échantillonner à partir du nuage de points dense dans une distribution aléatoire stratifiée, avec le nombre de points ciblant une densité choisie. Sélectionnez Préparer pour commencer les points d’échantillonnage.
REMARQUE : Une densité d’échantillonnage de 25 m-2 (2 500 points) est recommandée pour les analyses au niveau taxonomique. Les résultats présentés ici ont utilisé une densité d’échantillonnage plus faible (10 m-2) pour une enquête comparative plus large de la composition de la communauté axée sur un niveau fonctionnel. - Utilisez l’outil Cams pour lier les images sources au nuage de points dense et permettre des vues multi-images spatialement interrogées de points sur le modèle.
REMARQUE : De plus amples détails sur l’outil à cames peuvent être trouvés dans la section 4.5 du fichier supplémentaire 3. - Utilisez l’applet Web du navigateur VPI pour étiqueter principalement chaque point avec sa désignation taxonomique de résolution la plus élevée, directement à l’aide de plusieurs vues de l’imagerie source. Ajoutez deux ensembles facultatifs d’étiquettes secondaires pour chaque point, avec des exemples d’étiquettes de corail, y compris le stress de blanchissement75 et la morphologie.
REMARQUE : Les jeux d’étiquettes primaires et secondaires peuvent être modifiés en modifiant le fichier qclasses.json situé dans le dossier *.pq. - Exportez un résumé du pourcentage de couverture de chaque étiquette sous forme de fichier .csv à l’aide de l’applet Web.
- À l’aide de l’outil Virtual Point Intercept (VPI), créez une boîte de 10 m x 10 m sur le nuage de points dense, en définissant une dimension maximale de 10 m (quad-dim : 10,0 m) et un rapport d’aspect de 1 (quad-aspect : 1,000) pour désigner la zone cible de 100 m2 pour l’extraction des données.
- Relevé de densité
- Assurez-vous que les images ont déjà été liées dans le logiciel en suivant l’étape 3.2.3. Définissez une vue pseudo-cartographique du nuage de points dense en modifiant la distance focale de la vue en perspective à 100 mm et en effectuant un zoom arrière pour obtenir une vue complète du modèle de haut en bas. Utilisez le fichier d’échantillonnage quadrat dans le fichier supplémentaire 6 pour capturer la vue à l’aide de l’applet Web en cliquant sur eval pour la cellule c1, puis sélectionnez le bouton de capture.
REMARQUE : De plus amples détails se trouvent à la section 8.0 du Dossier supplémentaire 3. - Activez les caméras, puis liez les images dans le flux de travail d’échantillonnage par quadrat en cliquant sur Évaluation pour les cellules C2 et C3 dans le script d’échantillonnage par quadrat.
- Assurez-vous qu’une boîte rugo a déjà été fabriquée en suivant l’étape 3.1.1 pour désigner la zone d’extraction de données cible de 100 m2 . Dans l’applet web, évaluez la section des cellules de préparation c4 pour échantillonner 100 1 m2 quadrats.
- Dans l’adresse Web Échantillonnage par quadrat, utilisez l’imagerie source pour rechercher dans un quadrat et étiqueter les organismes cibles. Faites un double clic gauche sur un emplacement pour recibler l’emplacement d’échantillonnage. Cliquez sur un bouton taxonomique pour désigner le point ciblé en tant qu’échantillon. Pour supprimer un point marqué, double-cliquez avec le bouton gauche de la souris sur ce point et sélectionnez RIEN.
REMARQUE : Les quadrats sont présentés dans un ordre aléatoire prédéterminé, ce qui permet d’échantillonner au hasard un sous-ensemble de quadrats pour les levés de densité. - Compilez tous les fichiers d’échantillonnage situés sous *aux/recruits/test1 dans un seul répertoire, en renommant chaque fichier pour inclure le nom du site. Ajoutez le fichier de recherche de bouton (Fichier supplémentaire 7) dans le même répertoire que les fichiers d’échantillonnage. Exécutez le script dans le fichier supplémentaire 8, en suivant les instructions en ligne pour agréger les données d’échantillon en densité par site et par groupe taxonomique.
REMARQUE : Ici, nous échantillonnons des invertébrés sessiles, mais le même outil peut être utilisé pour étudier une variété d’organismes, y compris les densités de coraux juvéniles et adultes.
- Assurez-vous que les images ont déjà été liées dans le logiciel en suivant l’étape 3.2.3. Définissez une vue pseudo-cartographique du nuage de points dense en modifiant la distance focale de la vue en perspective à 100 mm et en effectuant un zoom arrière pour obtenir une vue complète du modèle de haut en bas. Utilisez le fichier d’échantillonnage quadrat dans le fichier supplémentaire 6 pour capturer la vue à l’aide de l’applet Web en cliquant sur eval pour la cellule c1, puis sélectionnez le bouton de capture.
- Démographie
- Chargez le fichier d’orthoprojection pour la segmentation des colonies dans le logiciel d’analyse de segmentation (voir Table des matériaux)80. Chargez des fichiers d’orthoprojection co-enregistrés pour plusieurs points temporels en tant que nouvelles cartes dans le même fichier de projet afin de segmenter et de suivre la taille des colonies dans le temps.
- Utilisez l’imagerie source via l’applet Web pour iView qui se trouve à la section 17.1 du fichier supplémentaire 3 tout en segmentant les colonies comme référence pour l’identification taxonomique et des limites. Assurez-vous que les images ont déjà été liées dans le logiciel de visualisation en suivant l’étape 3.2.3. Placez un marqueur sur le nuage de points dense de la colonie focale et faites défiler les images sources pour l’emplacement du marqueur pour différentes vues en perspective.
- Utilisez l’outil d’annotation des clics positifs/négatifs pour segmenter les colonies de coraux individuelles. Modifiez les limites à l’aide d’un clic ou d’un ajustement manuel des limites.
4. Conservation des données
REMARQUE : Les efforts d’archivage doivent donner la priorité à la préservation de l’imagerie source, car tous les produits dérivés ultérieurs sont reproductibles. Bien que les dépôts disponibles pour un utilisateur donné varient, des efforts doivent être faits pour normaliser les métadonnées d’enquête associées incluses dans l’ensemble de données d’images sources afin de maximiser leur utilité lorsqu’elles sont mises à la disposition de l’ensemble de la communauté.
- Référentiel de données
- Générez un fichier de description des méthodes qui inclut des détails d’arpentage tels que la zone couverte, le système de caméra, les marqueurs de contrôle au sol et le modèle de collecte. Voir le fichier supplémentaire 9 pour un exemple de description de ce protocole.
- Générez un fichier de métadonnées d’arpentage spécifique à l’ensemble de données d’image, y compris des champs tels que le nom du site, la date de collecte, les coordonnées GPS, les relèvements de parcelle, les données de profondeur et d’échelle de contrôle au sol, ainsi que le modèle de collecte et le système de caméra utilisés pour l’enquête donnée.
REMARQUE : Il est fortement recommandé d’ajouter des champs qui incluent un contexte géographique plus large et des conditions pendant l’enquête. Un exemple de fichier de métadonnées avec des champs recommandés se trouve dans le Fichier supplémentaire 10. - Combinez le fichier de description, le fichier de métadonnées et les fichiers image dans une seule archive zip à ingérer dans le référentiel de données choisi.
REMARQUE : Des collections de données d’images ont été mises à disposition à l’https://doi.org/10.6075/J0DV1HDR.
Résultats
La collecte réussie d’images de grande surface sur le terrain devrait aboutir à la création d’une reconstruction dense du nuage de points avec une couverture descendante complète de la zone de levé, tandis qu’une redondance inadéquate de la couverture peut entraîner des lacunes ou une dégradation complète du nuage de points (Figure 4). Pour un ensemble de 43 relevés d’images à grande surface menés dans l’archipel hawaïen en 2016, une moyenne de 99,6 % des images ont été alignées par ensemble de données, et 66 % des ensembles d’images ont été alignés avec succès. Les images recueillies à partir de l’appareil photo à objectif grand-angle avaient une GSD moyenne de 0,52 mm px-1 , tandis que les images de l’appareil photo à zoom avaient une GSD moyenne de 0,18 mm px-1. Ces relevés ont généré des nuages de points denses d’une taille moyenne de 557,7 millions de points (15 Go).
Les flux de travail écologiques décrits ici ont été conçus pour générer des données comparables aux méthodologies existantes pour la surveillance des récifs coralliens78. Les données écologiques extraites des levés LAI à Hawaï montrent, à part quelques valeurs aberrantes, que les mesures de la rugosité linéaire résultant du flux de travail de la complexité structurelle s’alignent bien avec les valeurs relatives par rapport aux mesures in situ de la complexité sur l’ensemble des sites81 (figure 5A,B). D’autres analyses de la composition des communautés à partir de l’indice foliaire local visant à mesurer le pourcentage de couverture des principaux groupes fonctionnels benthiques montrent un alignement similaire par rapport aux relevés photoquadrats traditionnels82 (figures 5C et D). L’échantillonnage par quadrat a été utilisé pour mesurer la densité des invertébrés sessiles, les plus courants étant les oursins, qui ont été résumés comme des mesures catégoriques de l’abondance relative. Les méthodes d’imagerie locale ont régulièrement enregistré des niveaux d’abondance plus élevés par rapport aux méthodes in situ 81 (figures 5E, F), ce qui peut être dû à la capacité de rechercher et d’étudier de manière exhaustive tous les individus dans une zone donnée par rapport à un recensement visuel rapide. La segmentation des colonies de coraux à l’aide de l’orthoprojection 2D a également révélé des distributions de taille des taxons coralliens communs similaires à celles des méthodes in situ 83 (Figure 5G,H).
L’un des principaux avantages des levés LAI est la possibilité d’archiver et de suivre les changements dans les zones récifales au fil du temps grâce à la coregistration du nuage de points dense. Les récifs coralliens sont des substrats vivants, ce qui, pour les études LAI, signifie qu’il peut être difficile d’identifier des surfaces permanentes, naturelles ou installées, qui peuvent être utilisées pour co-enregistrer de manière fiable des nuages de points denses à partir de différents points temporels. L’exemple de l’atoll du millénaire (figure 6) montre un exemple de forte croissance et de perte structurelle où le flux de travail de coregistration assisté a été utilisé pour la coregistration de nuages de points denses malgré une stabilité faible ou nulle de la surface du récif dans le temps.
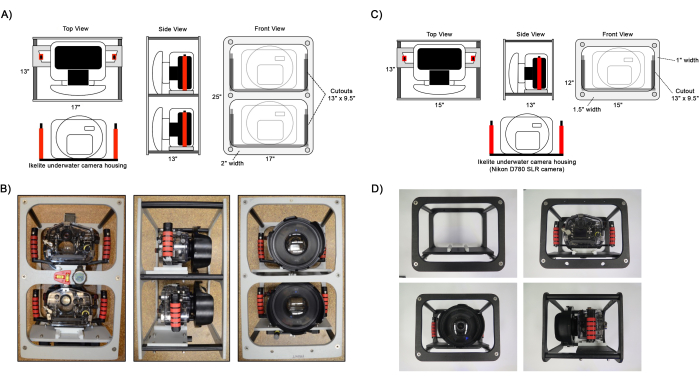
Figure 1 : Schéma des cadres de caméra assemblés. Exemples de vues des configurations d’image de caméra double (A, B) et (C, D) simple. Les boîtiers de caméra Ikelite sont fixés au cadre sur le panneau de montage de la caméra à l’aide d’une plaque coulissante fixée aux poignées du boîtier. Des instruments optionnels pour aider à la navigation, tels qu’un niveau, une boussole et un ordinateur de plongée, peuvent être fixés au cadre comme indiqué en B. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Schéma d’un tracé d’image de grande surface de 100 m2. Schéma d’un tracé d’image de grande surface entièrement mis en place de 100 m2 de surface. Les marqueurs de tracé temporaires comprennent six marqueurs de tuiles de délimitation, quatre barres d’échelle et quatre flotteurs de référence. Les marqueurs de parcelle permanents comprennent deux piquets en acier inoxydable avec le piquet gauche, lorsque vous regardez à terre, y compris un contre-écrou. La référence GPS de la parcelle doit être prise au-dessus de la tuile ou du piquet au centre gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
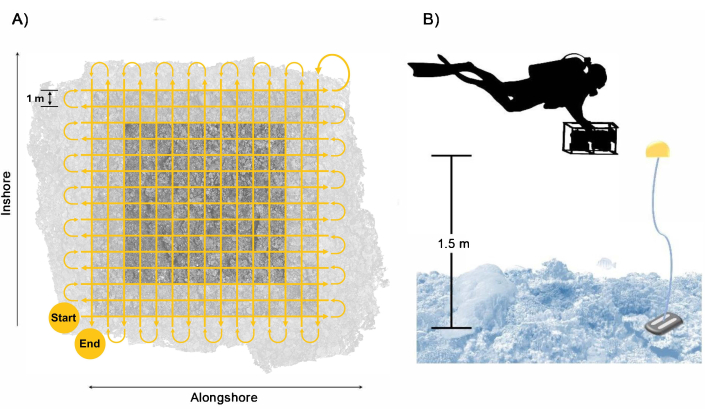
Figure 3 : Modèle de collecte des plongeurs. Exemple de (A) trajectoire de nage du plongeur pour assurer une couverture suffisante et un chevauchement de la zone de la parcelle avec une zone tampon incluse et (B) disposition du plongeur avec le système de caméra avec les flotteurs de référence fournissant un guide pour la hauteur de nage. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Réduction du chevauchement des images. La dégradation du nuage de points dense à mesure que le nombre d’images qui se chevauchent est réduite par échantillonnage aléatoire. Chaque panneau montre le nuage de points dense généré à partir de (A) toutes les images, (B) 1/2, (C) 1/3, (D) 1/5 et (E) 1/10 des images originales. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Extraction de données écologiques. Les données candidates extraites de l’imagerie de grande surface pour chacun des flux de travail écologiques sont présentées en comparaison avec les méthodes de collecte de données in situ établies. Cela comprend (A,B) la complexité structurelle, (C,D) la composition de la communauté (les barres d’erreur indiquent l’erreur-type), (E,F) la densité des invertébrés et (G,H) la démographie de la structure de la taille. Abréviation : LAI = imagerie de grande surface. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Co-enregistrement de nuages de points denses. Un exemple de comparaison visuelle de deux nuages de points denses coenregistrés temporellement. Les zones de perte structurelle, probablement dues à des dommages causés par la houle, sont codées visuellement en rouge, comme l’indique la flèche magenta. Les zones d’ajout structurel, généralement attribuées à la croissance des colonies de coraux, sont codées visuellement en bleu, comme l’indique la flèche jaune. Le flux de travail de co-enregistrement décrit ici peut toujours être utilisé pour des zones de récifs aussi dynamiques que celles illustrées ici, où les points de contrôle au sol (GCP) installés en permanence ne seraient pas fiables en raison d’une prolifération ou d’un délogement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Fonction de l’appareil photo | Réglage recommandé |
| Foyer | Auto |
| Mode de prise de vue | P (Auto programmé) pour l’objectif grand-angle |
| A (priorité à l’ouverture automatique), réglé sur une ouverture de F8 pour l’objectif macro | |
| Mode de relâchement | S (Auto à priorité vitesse) |
| Paramètres de mise au point automatique | Autofocus central (AF-C), point central unique (S) |
| Contrôle automatique de la sensibilité ISO | SUR |
| Sensibilité ISO maximale | 3200 |
| Vitesse d’obturation minimale | 1/320 |
| Qualité d’image | RAW + JPEG |
| Minuterie d’intervalle | 1 s |
| Balance des blancs | Coutume |
Tableau 1 : paramètres recommandés de l’appareil photo Vous trouverez ci-dessous une liste des principaux paramètres de l’appareil photo utilisés pour optimiser la qualité de l’image. Ces paramètres donnent la priorité à la capture d’images nettes capturées par un opérateur en mouvement dans des conditions d’éclairage sous-marin.
| Aligner les photos | |
| Exactitude | Haut |
| Présélection générique | Non |
| Limite de points clés | 5000 |
| Limite de points de rattachement | 0 |
| Correspondance d’images guidée | Non |
| Ajustement du modèle de caméra adaptative | Oui |
| Créez un cloud dense | |
| Qualité | Haut |
| Filtrage en profondeur | Douleur légère |
| Calculer Couleurs de points | Oui |
| Calculer Confiance en points | Oui |
| Exporter des points | |
| Type de fichier | Stanford PLY |
| Système de coordonnées | Coordonnées locales (m) |
| Données sources | Nuage dense |
| Enregistrer les couleurs des points | Oui |
| Point de sauvegarde normal | Oui |
| Confiance des points d’économie | Oui |
| Enregistrer des classes de points | Non |
| Convertir les couleurs en RVB 8 bits | Oui |
| Encodage binaire | Oui |
Tableau 2 : Paramètres de construction des nuages de points denses 3D. Une liste des paramètres utilisés dans Agisoft Metashape pour créer et exporter une reconstruction de nuage de points dense de haute qualité.
Dossier supplémentaire 1 : Feuille de route. Exemple d’image orthomosaïque marquée avec les caractéristiques et les profondeurs du tracé pour aider à trouver la zone du tracé pour un nouveau levé. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : Extract_meta.py. Script exécuté dans Agisoft Metashape pour exporter la pose de la caméra et les informations du répertoire de fichiers à utiliser dans Viscore pour interroger les images originales. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 3 : Guide de Viscore. Guide logiciel pour Viscore, qui comprend des flux de travail pour la visualisation de modèles, le co-enregistrement et les analyses écologiques. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 4 : Rugosity_Functions.Rmd. Script utilisé dans R contenant des fonctions pour traiter les données de rugosité extraites de Viscore. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 5 : Rugosity_Analysis.Rmd. Script utilisé dans R pour calculer les métriques de rugosité. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 6 : Quadrat_sampling.rpl.json. Script utilisé dans Viscore pour le flux de travail d’analyse de la densité des quadrats. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 7 : Density_taxo_lookup.json. Bouton de recherche de fichier pour exécuter un script d’échantillonnage de quadrat afin d’agréger les données d’échantillonnage de quadrat par groupe taxonomique. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire n° 8 : Density_Analysis.R Script utilisé dans R pour agréger les données d’échantillonnage par quadrat qui calcule la densité par groupe taxonomique au niveau de l’enquête. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 9 : README.txt Exemple de fichier texte à inclure avec l’imagerie d’origine pour l’archivage des données qui décrit la méthodologie de capture d’image. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 10 : METADATA_KAH_2016-07_03.txt Exemple de fichier texte à inclure avec l’imagerie d’origine pour l’archivage des données contenant des champs de métadonnées pour l’enquête LAI. Cela inclut des champs pour les données d’échelle et de profondeur de l’enquête pour le référencement, ainsi que les métadonnées globales du site pour le contexte géographique. Abréviation : LAI = imagerie de grande surface. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’imagerie de grande surface est un outil permettant aux scientifiques du domaine de visualiser et d’analyser numériquement les caractéristiques de l’environnement à des échelles plus grandes que celles des images individuelles collectées. En capturant plusieurs images de l’environnement sous plusieurs perspectives, les protocoles LAI aident à créer des représentations de paysages relativement larges (par rapport à la couverture spatiale des images individuelles) tout en conservant les détails collectés à partir de l’imagerie originale. La valeur unique de l’indice LAI réside dans sa capacité à explorer les données environnementales à toutes les échelles, de la plus grande échelle (définie par l’étendue surfacique de l’enquête) à l’échelle la plus fine (définie par la résolution réalisée de l’imagerie originale). Cependant, pour tirer parti de cette force inter-échelle, il est essentiel d’assurer un accès régulier et fluide à tous les niveaux des données capturées, en particulier pour assurer un accès facile à la fois à l’imagerie originale et au modèle 3D dérivé. À chaque étape du protocole présenté ici, nous mettons en évidence cette force unique de l’LAI en nous assurant constamment que l’imagerie originale est accessible, utilisable et archivée en toute sécurité aux côtés des modèles LAI dérivés.
La méthode LAI permettra de livrer des produits qui sont directement liés aux images originales collectées. En déplaçant les détails de l’acquisition d’images, les utilisateurs peuvent produire des produits de données de qualité et de couverture différentes. Lors de l’étude d’environnements de récifs coralliens structurellement complexes, un utilisateur disposant d’un temps de relevé sous-marin limité (ou d’un nombre constant d’images disponibles à capturer) peut donner la priorité à l’augmentation de la couverture surfacique de la zone de relevé ou à l’augmentation du niveau de détail de chaque section de la zone échantillonnée. Il y aura nécessairement un compromis, le modèle grand surfacique ayant moins de détails (et peut-être plus d’occlusions) par unité de surface et le modèle détaillé couvrant moins de surface totale (avec probablement moins d’occlusions). Dans ce protocole, nous incluons l’utilisation de deux caméras, chacune avec des objectifs différents, ce qui permet à l’utilisateur d’échantillonner une zone plus grande (chevauchement suffisant avec l’objectif grand angle pour répondre aux exigences SfM) tout en collectant simultanément des images originales plus détaillées (plus de détails à partir de l’objectif zoom qui a moins de chevauchement photo à photo). En incluant l’estimation de la pose des images des deux caméras, les protocoles de visualisation et d’analyse en aval incluent des vues à plus haute résolution à partir d’une grande partie de la zone échantillonnée. Bien que le protocole vise à élargir la gamme de viabilité des enquêtes, les utilisateurs peuvent constater que les produits dérivés ne couvrent pas suffisamment la surface ou ne détaillent pas suffisamment les images originales pour compléter les routines analytiques préférées. Les utilisateurs sont encouragés à examiner l’imagerie originale et les modèles dérivés pour s’assurer que le protocole de relevé environnemental répond aux besoins du programme et à modifier l’approche du relevé dans l’eau (p. ex., déplacement de la distance d’échantillonnage au sol, modification de la durée du relevé ou du nombre d’images recueillies) pour en arriver à l’équilibre privilégié entre la couverture surfacique et la résolution par unité de surface.
Les méthodes d’IAL apportent de la valeur à la science subaquatique en capturant des « instantanés » riches en informations et à large couverture d’environnements benthiques qui peuvent être rapides et nécessitent une expertise limitée dans un domaine spécifique à la collecte. La valeur de ces produits de données peut être considérée en référence aux flux de données existants ainsi qu’aux applications nouvelles et accélérées spécifiques à un domaine. Si l’on considère la comparaison avec les flux de données existants, les produits d’analyse de l’IAL peuvent fournir des données écologiques directement comparables aux données collectées in situ par les observateurs sous-marins 84,85,86,87. Nous fournissons ici une analyse quantitative des données écologiques issues de chacune des activités classiques de surveillance in situ et de l’analyse standardisée des produits d’IAL, suivant ce protocole. En se concentrant sur quatre paramètres communs aux efforts de surveillance des récifs coralliens (complexité structurelle, composition de la communauté benthique, densité d’invertébrés mobiles et structure de la taille des coraux ; Figure 5), nous démontrons une forte concordance quantitative dans les sorties de données. En particulier, pour les flux de données qui nécessitent des observations à petite échelle (par exemple, des identifications taxonomiques, des définitions précises des frontières biologiques), les flux de travail LAI qui incluent un accès régulier et fiable à l’imagerie originale offrent une force unique pour mettre en parallèle les possibilités d’observation qui se sont historiquement limitées à l’échantillonnage immersif in situ. Les progrès en matière de traitement et de visualisation des données fournis par Viscore et décrits dans ce protocole offrent une valeur unique pour assurer la comparabilité des données écologiques dérivées de l’AMI et des produits de surveillance in situ, permettant une maintenance impartiale des flux de données à long terme avec l’incorporation de flux de travail améliorés numériquement de l’IAL.
Pour les scientifiques sous-marins, LAI offre la possibilité de tirer parti de flux de travail innovants et accélérés dans l’acquisition et l’exploration de données. L’IAL présente des atouts uniques en tant qu’outil de cartographie à haute résolution qui contient de l’information décrivant non seulement la composition relative de l’environnement benthique, mais aussi les caractéristiques spatiales. Explicitement liés à la création d’un modèle 3D à partir du flux de travail SfM, les produits LAI contiennent des informations sur la complexité structurelle qui peuvent être explorées à plusieurs échelles56. En tant qu’outils permettant de capturer des paysages marins de plus grande superficie, les produits LAI peuvent offrir l’occasion d’examiner les modèles de distribution spatiale et les caractéristiques du voisinage pour les organismes benthiques45,66. De plus, en étant capable de visualiser les paysages benthiques à plus grande échelle, il devient possible de détecter des caractéristiques qui ne sont pas facilement visibles dans les habitats sous-marins en raison des limites de la visibilité à longue distance sous l’eau, par exemple le motif polygonal à grande échelle (3-4 m) d’une macroalgue commune sur un récif corallien du Pacifique64.
Bien que l’IAL offre des possibilités d’analyse à grande échelle, des préoccupations ont été exprimées concernant les défis liés à la collecte efficace dans l’eau et au post-traitement des images. L’expansion de l’étendue spatiale de l’acquisition d’images sous-marines exigera des avancées technologiques allant de l’imagerie déployée par les plongeurs à l’utilisation de systèmes de cartographie assistée88 et, finalement, à l’utilisation de ROV38 et d’AUV67,89. Des méthodologies d’enquête robustes en ce qui concerne le modèle d’acquisition et les systèmes de caméras assureront une transition en douceur et une cohérence dans les données générées sur ces différentes plateformes. Compte tenu des exigences de calcul ainsi que du grand format de données des produits LAI, certains scientifiques marins ont exprimé des inquiétudes concernant l’accessibilité technologique du flux de travail90 et les grandes exigences de temps liées à l’extraction de données écologiques84,86. Cependant, un nombre croissant d’outils sont présentés, qui exploitent des solutions créatives pour surmonter les obstacles techniques de l’extraction de données 80,91,92,93. Il est important de noter que l’utilisation de flux de travail améliorés par l’IA pour l’analyse LAI est limitée par la qualité du signal d’entrée fourni. En tant que tel, il reste une demande constante de maintien des normes et de la qualité de l’acquisition d’images et de la gestion des données dans les protocoles LAI, que l’extraction des données soit effectuée par un observateur humain, par un algorithme d’IA entraîné ou (idéalement) par un flux de travail accéléré par l’IA. En maintenant une attention cohérente sur l’importance primordiale de l’imagerie originale dans les protocoles LAI, comme décrit ici, des opportunités uniques émergent pour explorer les habitats sous-marins de manière robuste, transparente et cohérente.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail est soutenu par les efforts du 100 Island Challenge de la Scripps Institution of Oceanography. Nous remercions Schmidt Marine Technology Partners, Ed et Christy Scripps, ainsi que la Fondation de la famille Moore pour leur soutien financier à la recherche associée et aux efforts de formation en imagerie à grande échelle qui ont permis d’affiner la méthodologie. De plus, nous remercions l’équipage des navires de recherche Hi’ialiki, Hanse Explorer et Plan B, qui ont apporté leur soutien aux efforts sur le terrain. Nous remercions tout particulièrement l’équipe de la Division des sciences de l’écosystème du Centre des sciences halieutiques des îles du Pacifique de la NOAA qui a aidé à la collecte sur le terrain des données présentées ici.
matériels
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
Références
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548(2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985(2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535(2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993(2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077(2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197(2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262(2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593(2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979(2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740(2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737(2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276(2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050(2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440(2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957(2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011(2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113(2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077(2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438(2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213(2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594(2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282(2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943(2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569(2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304(2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548(2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145(2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674(2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317(2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon