Method Article
Misurazione della struttura, della composizione e del cambiamento degli ambienti subacquei con l'imaging di grandi aree
In questo articolo
Riepilogo
Questo protocollo copre una metodologia di indagine di imaging su vasta area in quattro fasi utilizzata per estrarre metriche di complessità strutturale, composizione della comunità e dati demografici della popolazione per le comunità della barriera corallina. La qualità delle immagini raccolte e l'accesso integrato alle immagini di origine sono prioritari in ogni fase del protocollo.
Abstract
La tecnologia di imaging ed elaborazione digitale si è evoluta per facilitare l'espansione delle indagini di imaging su grandi aree, che aumentano la nostra capacità di studiare lo stato, le tendenze e le dinamiche degli organismi che vivono negli habitat subtidali. Creando gemelli digitali fotorealistici per analisi ex situ , questi approcci consentono a piccoli team sul campo di raccogliere sostanzialmente più dati di quanto fosse possibile in precedenza. Qui presentiamo una pipeline di indagine di imaging su larga scala in quattro fasi e una metodologia di analisi, che include la raccolta di immagini, la costruzione di modelli, l'analisi ecologica e la cura dei dati, che è stata sviluppata e perfezionata attraverso la sperimentazione nell'ultimo decennio. Ogni passaggio descritto si concentra costantemente sul valore unico delle immagini originali di origine. Sebbene i tipi di dati estratti da indagini di immagini su larga area siano vasti, includiamo qui flussi di lavoro per estrarre dati ecologici per la complessità strutturale, la composizione della comunità e le analisi demografiche preziose per il monitoraggio e gli sforzi basati su ipotesi. Includiamo inoltre raccomandazioni per gli standard di metadati, che completano la raccolta di dati di imaging di grandi dimensioni e supportano gli sforzi di archiviazione facilitando la trasparenza e la collaborazione tra i gruppi di ricerca.
Introduzione
In tutti gli ambienti terrestri, i ricercatori hanno sfruttato il campionamento standardizzato di grandi aree di comunità ecologiche, in particolare nel contesto di siti di studio a lungo termine, tra cui Barro Colorado Island1, la foresta sperimentale Hubbard Brook2 e altri3. Attraverso la raccolta di dati distributivi spazialmente espliciti e risolti tassonomicamente, tale campionamento è stato utilizzato per esplorare dinamiche ecologiche fondamentali, come i modelli di dispersione e reclutamento 3,4,5, la preferenza e la disponibilità dell'habitat, i nuclei di dispersione, la limitazione delle risorse 3,5,6,7,8 e l'uso dello spazio 9,10. Tuttavia, fino ad oggi, la maggior parte degli studi spaziali sulle comunità marine si sono basati su metriche di copertura relativa, riportate come copertura percentuale occupata dal taxon o dal gruppo 11,12,13,14,15. Le stime aggregate della copertura relativa, tuttavia, sono insufficienti per risolvere i dettagli della demografia a livello di popolazione e delle dinamiche a livello di comunità. Gli studi che hanno fornito analisi dettagliate delle comunità bentoniche si sono basati su laboriosi protocolli di monitoraggio in acqua 16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32, ma la scala (comprese le scale tassonomiche, spaziali e cronologiche) di questi studi è notevolmente limitata a causa delle esigenze operative della metodologia in acqua.
L'imaging di grandi dimensioni (LAI) è un approccio che combina le informazioni provenienti da numerose immagini attraverso flussi di lavoro ad alta intensità di calcolo per creare rappresentazioni fotorealistiche di ambienti su scale molto più grandi di quelle delle immagini costituenti33. Il flusso di lavoro LAI è particolarmente adatto per applicazioni in habitat subacquei, data la visibilità limitata dovuta all'assorbimento e alla dispersione della luce nell'acqua. A causa della visibilità limitata, le immagini che catturano i dettagli più fini del benthos devono essere acquisite vicino al soggetto; Per catturare una vista del paesaggio (o del paesaggio marino) di un'ampia fascia di habitat bentonico mantenendo i dettagli fini dei singoli soggetti bentonici, è quindi necessaria un'imaging composito. Inoltre, in ambienti strutturalmente complessi, è essenziale tenere conto della struttura tridimensionale (3D) nella ricostruzione dell'imaging composito per produrre rappresentazioni fedeli della posizione e della relativa vicinanza degli organismi bentonici. Il metodo fotogrammetrico Structure-from-Motion (SfM) è stato applicato ad ambienti con organismi bentonici relativamente immobili, tra cui le barriere coralline 34,35,36, gli ecosistemi bentonici antartici37, le barriere coralline di acqua fredda38, le sorgenti fredde39 e l'habitat delle fanerogame marine40, generando immagini composite senza stereoscopia utilizzate per ricostruire una scena paesaggistica con la generazione di orto-mappe e la stima delle nuvole di punti.
Nella scienza della barriera corallina, LAI ha offerto il potenziale per visualizzare i paesaggi della barriera corallina su scale spaziali sempre più grandi e per condividere queste visualizzazioni attraverso i media digitali. Il LAI può essere utilizzato per stimare la copertura degli organismi della barriera corallina, la densità e la distribuzione delle colonie di coralli, nonché la forma e le condizioni dei singoli organismi 41,42,43,44,45,46,47. Inoltre, quando i prodotti LAI vengono raccolti dallo stesso luogo in momenti diversi, è possibile registrare i cambiamenti nelle dimensioni e nelle condizioni dei singoli organismi 48,49,50,51. Dato che la maggior parte delle colonie di coralli scleractinici cresce nell'ordine di millimetri o centimetri radialmente all'anno, le serie temporali LAI raccolte nel corso degli anni possono fornire un flusso di dati inestimabile per la segnalazione della biologia e dell'ecologia di queste specie52. I dati LAI ripetuti e co-registrati offrono intuizioni uniche con cui studiare le barriere coralline in un formato che può essere condiviso, archiviato e utilizzato come base per la collaborazione in tutto il mondo.
Poiché l'uso della LAI si è ampliato tra gli ecologi della barriera corallina53, è aumentata anche la diversità dei sistemi di telecamere e delle metodologie di indagine52. Un protocollo LAI scelto dovrebbe mirare alla risoluzione e alla portata delle metriche ecologiche desiderate, pur rimanendo limitato all'interno delle risorse disponibili. La qualità di qualsiasi ricostruzione fotogrammetrica dipenderà in ultima analisi dalla risoluzione delle immagini sorgente e dalla copertura spaziale dell'area di indagine. La qualità dell'immagine è determinata dall'influenza dei parametri della telecamera, tra cui la risoluzione del sensore e la lunghezza focale, nonché dalla procedura di raccolta, principalmente la distanza dal benthos54, che contribuiscono all'effettiva distanza di campionamento del suolo (GSD) di un particolare insieme di immagini. Inoltre, velocità dell'otturatore elevate, aperture ridotte e valori ISO bassi produrranno immagini nitide, a fuoco e con un basso rumore elettronico, rispettivamente. Mantenere ciascuna di queste impostazioni a soglie che producano immagini di qualità sufficiente può essere una sfida in ambienti subacquei dove i livelli di luce sono bassi. I sensori più grandi, come quelli che si trovano sulle fotocamere reflex digitali a obiettivo singolo (DSLR) e mirrorless, generano una migliore qualità dell'immagine e, a loro volta, ricostruzioni più accurate rispetto a soluzioni più piccole e più mobili come le action cam55. Altre caratteristiche da non trascurare quando si considera un modello di fotocamera appropriato includono un intervallometro integrato e una capacità di archiviazione e batteria sufficienti per supportare gli sforzi di raccolta delle immagini di lunga durata sul campo.
La progettazione dell'indagine dovrebbe essere guidata dall'ipotesi ecologica, con le metriche candidate che determinano la risoluzione e la copertura spaziale necessarie. Nell'ambito dell'ecologia della barriera corallina, LAI è stato utilizzato per caratterizzare la complessità strutturale 35,36,56,57,58,59, la composizione e l'assemblaggio della comunità 60,61,62, la distribuzione spaziale 45,63,64,65,66 e le traiettorie della comunità 48,49,50,67,68,69. La risoluzione della qualità dell'immagine dovrebbe essere appropriata alle esigenze dei dati ecologici, con una risoluzione di scala più fine sul dettaglio inferiore al millimetro necessaria per supportare le osservazioni su scala di polipo della competizione lungo i bordi delle colonie70 o le indagini di piccoli coralli giovani66,71. Al contrario, l'estrazione di metriche strutturali e di habitat su larga scala per la mappatura costiera 72,73,74 richiede una maggiore estensione spaziale con una ridotta necessità di risoluzione alla scala cm-m. La richiesta di risoluzione deve essere bilanciata con l'estensione spaziale necessaria per ottenere un campionamento sufficiente e i limiti operativi del tempo necessario per completare un'indagine LAI33.
Di seguito viene descritto un protocollo end-to-end per la conduzione di un'indagine LAI, che si concentra sulla massimizzazione della qualità, dell'utilità e del valore delle immagini di origine, suddividendo il protocollo in quattro fasi principali: raccolta delle immagini, costruzione del modello, analisi ecologiche e cura dei dati33. La raccolta di circa 3.500 indagini di immagini LAI di oltre 2.000 siti di barriera corallina unici nell'ultimo decennio ha contribuito al perfezionamento della metodologia per ogni fase qui presentata (https://doi.org/10.6075/J0T43RN1). Il protocollo risultante è un metodo per una robusta raccolta di dati e ricostruzioni accurate e precise dei modelli, che consentono la raccolta di dati ecologici dettagliati in un'ampia gamma di applicazioni, tra cui la complessità strutturale, la composizione della comunità e i dati demografici della popolazione (ad esempio, densità e struttura dimensionale). Includiamo inoltre standard di metadati per l'archiviazione dei dati LAI, la cui definizione è essenziale per garantire la conservazione, la trasparenza e il potenziale collaborativo di questi gemelli digitali.
Protocollo
1. Raccolta di immagini
NOTA: La seguente procedura di raccolta di immagini su grandi superfici delinea un metodo per rilevare un'area di circa 100 m2, sebbene possa essere facilmente adattato per aree che vanno da 10 m2 fino a 2.500 m2. Il metodo di indagine descritto di seguito è progettato per essere impiegato in una varietà di condizioni di lavoro, generare immagini di alta qualità e fornire dati robusti che possono essere utilizzati per molte applicazioni ecologiche dallo sforzo di una singola immersione di un'ora da parte di un team di due persone.
- Preparazione degli ingranaggi
- Assemblare il telaio della fotocamera fissando i pannelli del telaio esterno ai pannelli e alle colonne di montaggio della fotocamera utilizzando viti a testa piatta Philips lunghe 1 1/2" (Figura 1).
- Prepara due fotocamere DSLR, una con un obiettivo grandangolare fisso e una seconda fotocamera dotata di un obiettivo zoom. Vedere la Tabella 1 per le impostazioni dettagliate della fotocamera.
NOTA: Sebbene la seconda fotocamera con obiettivo zoom sia opzionale, si consiglia vivamente di acquisire una maggiore risoluzione dell'immagine per determinare i dettagli della tassonomia75,76, trovare e identificare piccoli coralli giovani66,71 (1-5 cm di diametro) e distinguere i bordi delle colonie di coralli 45,48,50 durante le future analisi ecologiche. - Assemblare gli alloggiamenti della telecamera subacquea fissando la porta a cupola e fissarli con le viti a testa zigrinata a cupola incluse. Fissare le maniglie utilizzando viti a testa Phillips lunghe 1/2" e la piastra di montaggio della fotocamera utilizzando una vite a brugola lunga 1 1/8". Inserire le telecamere nell'alloggiamento e utilizzare la pompa del vuoto per impostare la pressione dell'alloggiamento su 5 pollici. Hg, verificando l'integrità della guarnizione o-ring.
- Installare gli alloggiamenti sul telaio della telecamera facendo scorrere la piastra di montaggio della telecamera sui pannelli del telaio di montaggio e fissarli in posizione utilizzando le viti a testa zigrinata.
- Impostazione del grafico
- Stabilisci i confini del terreno utilizzando sei tessere quadrate in acciaio inossidabile (10 cm di lunghezza laterale) con pennarelli codificati stampati. Posizionare due tessere centrali a 10 m di distanza l'una dall'altra lungo l'isobata bersaglio, con quattro tessere d'angolo aggiunte a 5 m dalla costa e al largo delle tessere centrali per creare un'area di 10 m per 10 m quadrati (Figura 2). Registra la profondità in ciascuna delle sei tessere per fornire l'orientamento alla verticale locale e facilitare le successive fasi di costruzione del modello.
- Aggiungi galleggianti di riferimento con ~1,5 m di linea attaccata a pesi da 0,45 kg (1 lb) a circa 1 m al di fuori di ciascuna delle quattro tessere angolari.
NOTA: Questi galleggianti di riferimento fungono da guida per l'operatore della telecamera per indicare i confini del lotto e l'altezza sopra il benthos alla quale dovrebbero nuotare con la telecamera. Posizionandoli al di fuori dei confini del lotto di 10 m x 10 m si crea una zona cuscinetto delle immagini, contribuendo a garantire che l'area del nucleo dell'immagine sia completamente ricostruita. - Posizionare una barra graduata di 0,5 m di lunghezza costituita da due tessere bersaglio codificate fissate su cloruro di polivinile (PVC) o barra di alluminio in ciascun quadrante del lotto per un totale di quattro barre graduate dispiegate.
NOTA: È importante che le barre di scala e le tessere di profondità rimangano stabili durante tutto il processo di raccolta delle immagini. Le barre di scala e le tessere di profondità possono anche essere utilizzate come punti di riferimento visivi per l'operatore della telecamera per tenere traccia dei progressi del proprio modello di nuoto. - Per stabilire appezzamenti permanenti, installare picchetti in acciaio inossidabile da 0,46 m (18 pollici) (0,95 cm o barra filettata da 3/8 pollici) fissati con resina epossidica marina in due parti utilizzando un martello adiacente a ciascuna piastrella centrale per segnare la linea centrale del lotto. Quando si guarda a terra, il paletto sinistro include un controdado per facilitare l'orientamento durante le future attività di indagine. Al termine dell'indagine, registrare le coordinate GPS (Global Positioning System) direttamente sopra la posizione del paletto al centro sinistro utilizzando un'unità GPS conservata all'interno di una custodia impermeabile fissata a un galleggiante da immersione.
NOTA: Si consiglia l'installazione di paletti permanenti quando consentito dai permessi per ridurre i tempi di ricerca nelle indagini successive e affermare la ricognizione della stessa area della barriera corallina. Utilizzare un'orto-immagine bidimensionale (2D) stampata o una "roadmap" (File supplementare 1) del sito di rilevamento per individuare le caratteristiche invarianti e aiutare a identificare la posizione della stessa area del lotto per l'imaging. Queste tabelle di marcia possono essere utilizzate anche per riposizionare i lotti di rilevamento esatti nei casi in cui l'autorizzazione non consente l'installazione di pali permanenti o quando i pali sono stati rimossi o rimossi.
- Acquisizione di immagini
- Imposta il bilanciamento del bianco personalizzato di ciascuna telecamera utilizzando una scheda grigia alla profondità desiderata del grafico.
- Avviare ciascuna telecamera su un intervallometro impostato per l'acquisizione su un intervallo di 1 s-1 .
- Nuotare con il sistema di telecamere a circa 1,5 m sopra il benthos in uno schema a griglia, seguito da un secondo passaggio a griglia perpendicolare con circa 1 m tra ogni passaggio nuotando a una bassa velocità di circa 0,25 m s-1 (Figura 3). Assicurarsi che le passate si estendano per almeno 2 m oltre i bordi dei bordi del lotto per garantire una sovrapposizione sufficiente all'interno dell'area del lotto di destinazione.
NOTA: Seguendo questo schema di nuoto e velocità, si ottiene la raccolta minima di circa 1.700 immagini da ciascuna fotocamera durante 28 minuti di imaging. Tuttavia, per tenere conto del tempo di risposta tra i passaggi e l'errata misurazione del sovracampionamento per tamponare una sovrapposizione insufficiente che si traduce in dati non ottimali, si consiglia ai subacquei di mirare alla raccolta di 2.500 immagini da ciascuna fotocamera durante circa 40 minuti di imaging. - Tenere il sistema di telecamere approssimativamente perpendicolare alla superficie dell'oceano per garantire una copertura sufficiente dall'alto verso il basso; tuttavia, per i siti di rilevamento con topografia complessa, regolare l'orientamento della telecamera al secondo passaggio in modo che segua la perpendicolare al benthos e ridurre le occlusioni nella ricostruzione 3D. Prestare attenzione durante l'angolazione della fotocamera per ridurre al minimo l'acqua blu catturata nelle immagini.
NOTA: In caso di condizioni oceaniche non ottimali, come forti correnti o pendii ripidi, entrambi i passaggi possono essere effettuati nella stessa direzione lungo la costa. L'uso di una sola fotocamera con obiettivo grandangolare può essere necessario in condizioni di forte corrente per ridurre il profilo di resistenza e lo sforzo del subacqueo necessario per mantenere l'avanzamento in avanti. La seconda serie di passate dovrebbe idealmente essere ruotata leggermente rispetto alla prima. Se due passaggi vengono eseguiti nella stessa direzione lungo la costa, è necessario aggiungere almeno una o due "linee di collegamento" perpendicolari o diagonali che tagliano la serie iniziale di passaggi per migliorare la qualità della ricostruzione.
2. Costruzione del modello
NOTA: La fase di costruzione del modello si concentra sul mantenimento dell'accesso alle immagini sorgente ad alta risoluzione e sulla generazione della nuvola di punti densa derivata. Il riferimento alla nuvola di punti densa avviene all'interno del software di visualizzazione e analisi centralizzato (vedi Tabella dei materiali)77, consentendo all'utente di inserire e modificare al volo. In questo modo si elimina la necessità di rielaborare e riesportare i prodotti di dati per un set di dati quando emergono nuove informazioni, in particolare con ulteriori indagini nel tempo. Le ortomappe 2D, qui denominate ortoproiezioni, vengono generate utilizzando una vista di proiezione ortorettificata della nuvola di punti densa, con l'angolo di proiezione ortogonale alla direzione della gravità.
- Allineamento della telecamera e costruzione di nuvole di punti dense 3D
- Utilizzando un computer ad alte prestazioni, caricare tutte le immagini, comprese quelle provenienti dalle fotocamere grandangolari e macro in un progetto Agisoft Metashape selezionando Flusso di lavoro | Aggiungi cartella. Una volta caricati i file, seleziona il layout dei dati come Telecamere singole, Aggiungi tutte le immagini inun unico blocco. Rimuovi dal progetto le immagini con eccessiva acqua blu nella scena.
NOTA: Prima di aggiungerle al progetto, le immagini di ciascuna fotocamera devono essere organizzate in cartelle separate, che separeranno i file di immagine all'interno del blocco come gruppi di telecamere distinti. - Allineare tutte le immagini selezionando Flusso di lavoro | Allinea le foto. Vedere la Tabella 2 per le impostazioni di elaborazione per l'allineamento.
- Una volta completato l'allineamento, verificare che il set di immagini sia stato allineato correttamente in base alla percentuale di telecamere allineate e ispezionare la nuvola di punti sparsi generata per individuare eventuali lacune nella copertura o disallineamenti. Assicurarsi che il riquadro di delimitazione includa l'intera nuvola di punti sparsi prima di procedere. Se necessario, modificarlo utilizzando le opzioni Ridimensiona o Ruota regione .
NOTA: È possibile avere il 100% delle immagini allineate e avere ancora spazi vuoti in alcune parti del modello e, al contrario, avere l'80-90% delle immagini allineate ma avere un modello completo dell'area di rilevamento target. Pertanto, sia la percentuale di allineamento che la copertura areale dovrebbero essere utilizzate per prendere una decisione informata sull'usabilità, in parte o in toto, del set di dati generato o se sono necessari ulteriori sforzi per aumentare la qualità di acquisizione delle immagini o aggiustare le impostazioni di elaborazione dell'allineamento. - Disabilitare il gruppo di telecamere contenente le immagini dell'obiettivo zoom. Costruisci la nuvola di punti densa selezionando Flusso di lavoro | Costruisci un cloud denso. Vedere la tabella 2 per le impostazioni di elaborazione per Build Dense Cloud.
NOTA: Mentre le immagini di entrambe le fotocamere devono essere utilizzate per l'allineamento per facilitare l'interrogazione di tutte le immagini ad alta risoluzione durante le analisi ecologiche, le immagini dell'obiettivo zoom non devono essere utilizzate durante la creazione della nuvola di punti densa, poiché le sottili differenze nel bilanciamento del bianco e nell'esposizione tra le due fotocamere aggiungeranno rumore visivo alla nuvola di punti densa. - Esporta le stime della posa della videocamera selezionando Strumenti | Esegui script | Extract_meta.py script (File supplementare 2). Esporta la nuvola di punti densa selezionando File | Esportazione | Esporta punti. Vedere la Tabella 2 per le impostazioni per l'esportazione.
- Trascinare e rilasciare il file della nuvola di punti densa esportato sul file di vc5prep-confidence.bat che si trova all'interno dei file di programma del software di visualizzazione.
- Compila i file di dati esportati, inclusi i file di posa della fotocamera (*.cams.xml e *.meta.json) insieme ai file di programma generati (*.vml e cartella contenente file *ptdata, *.xml, *.kdm) in un'unica directory da utilizzare nel software di visualizzazione.
- Utilizzando un computer ad alte prestazioni, caricare tutte le immagini, comprese quelle provenienti dalle fotocamere grandangolari e macro in un progetto Agisoft Metashape selezionando Flusso di lavoro | Aggiungi cartella. Una volta caricati i file, seleziona il layout dei dati come Telecamere singole, Aggiungi tutte le immagini inun unico blocco. Rimuovi dal progetto le immagini con eccessiva acqua blu nella scena.
- Scala e orientamento
- Nel software di visualizzazione, utilizzare lo strumento scaler per posizionare le coppie di marcatori sui target della barra di scala e inserire la distanza nota.
NOTA: Ulteriori dettagli sullo strumento ablatore sono disponibili nella sezione 4.2 del file supplementare 3. - Posiziona i marcatori su ogni tessera di profondità e usa lo strumento di orientamento per regolare i valori di profondità per ogni tessera per definire il piano più adatto alla verticale locale.
NOTA: Ulteriori dettagli sullo strumento di orientamento sono disponibili nella sezione 4.4 del file supplementare 3.
NOTA: Verificare che i raggi di profondità siano rivolti verso l'alto, terminando sulla superficie dell'acqua stimata. In caso di raggi rivolti verso il basso, verificare la presenza di tracce di movimento nelle tessere di profondità che potrebbero causare errori nel valore di profondità rispetto alla posizione finale ricostruita o errori nei metadati di profondità.
- Nel software di visualizzazione, utilizzare lo strumento scaler per posizionare le coppie di marcatori sui target della barra di scala e inserire la distanza nota.
- Coregistrazione temporale
- Creare un file di progetto dell'organizzazione nel software per una raccolta di dati seguendo la sezione 10.0 del File supplementare 3. Includi più siti con sondaggi nel tempo in un unico progetto dell'organizzazione.
- Aggiungi file di nuvole di punti dense al progetto dell'organizzazione come livelli e modifica la struttura organizzativa a livello di sito in base alle esigenze per collegare le nuvole di punti dense di un determinato sito nel tempo.
NOTA: Utilizzare uno schema di denominazione dei file coerente di [Regione]_[Data]_[Sito] per automatizzare l'organizzazione dei livelli. - Selezionare un punto temporale per un sito da utilizzare come livello di riferimento per la scala e l'orientamento della serie temporale.
NOTA: È possibile utilizzare più livelli per impostare la scala; Tuttavia, è necessario selezionare un layer di punti temporali come riferimento per l'orientamento, poiché gli spostamenti di marea e l'altezza delle onde elevate portano a errori nella precisione e nella coerenza delle misurazioni della profondità nel tempo. - Utilizza lo strumento di coregistrazione assistita per allineare i livelli nel tempo.
NOTA: Ulteriori dettagli sono disponibili nella sezione 11.0 del File supplementare 3. In caso di grandi cambiamenti strutturali dovuti a un'elevata crescita o a grandi eventi di mareggiata, potrebbe essere preferibile utilizzare il flusso di lavoro di coregistrazione manuale utilizzando funzionalità invarianti candidate. Per serie temporali più lunghe o quando si verificano modifiche sostanziali nel tempo, in genere si consiglia di registrare congiuntamente un determinato modello al punto temporale precedente successivo.
- Ortorettifica 2D
- Utilizzando lo strumento scatole nel software, impostare una vista da un angolo di superficie (g: 0°) con confini che comprendono l'area di analisi focale (10 m x 10 m) insieme a un buffer minimo di 2 m ( l: 14 m, h : 14 m) che si estende da ciascun bordo.
NOTA: I dettagli per l'utilizzo dello strumento scatole sono disponibili nella sezione 6.0 del file supplementare 3. - All'interno dello strumento caselle, attiva l'esportazione della mappa per creare un file immagine di ortoproiezione. Impostate la risoluzione di esportazione su 1 mm px-1 e selezionate Cattura per generare un'anteprima. Scorrere fino a un riquadro di anteprima contenente una sezione completa della nuvola di punti densa e aumentare il valore pt-size per riempire gli spazi tra i punti.
- Selezionare Acquisisci per esportare l'ortoproiezione come file ppm. Una volta completata l'acquisizione, converti il file esportato in un tif trascinando e rilasciando il file .ppm generato sul file convert-to-tif-flip.cmd che si trova all'interno dei file di programma.
- Per le nuvole di punti dense registrate in concomitanza di una serie temporale, ripetere i passaggi da 2.4.2 a 2.4.3 per il sito, modificando il layer temporale utilizzando la stessa casella.
- Utilizzando lo strumento scatole nel software, impostare una vista da un angolo di superficie (g: 0°) con confini che comprendono l'area di analisi focale (10 m x 10 m) insieme a un buffer minimo di 2 m ( l: 14 m, h : 14 m) che si estende da ciascun bordo.
3. Analisi ecologica
NOTA: Esistono una miriade di opzioni per l'estrazione di dati ecologici, una selezione delle quali presentiamo qui. Questi flussi di lavoro di base si concentrano su metriche consolidate per il monitoraggio a lungo termine78,79, ma possono essere utilizzati e adattati per generare dati sufficienti per l'indagine scientifica basata sull'osservazione. Gli utenti devono selezionare e adattare i flussi di lavoro in base alle proprie esigenze di dati e agli obiettivi analitici individuali. I flussi di lavoro descritti di seguito sono progettati per integrare l'accesso diretto alle immagini di origine per facilitare l'annotazione dei dati biologici, utilizzando prodotti derivati come la nuvola di punti densa 3D o l'ortoproiezione 2D come struttura organizzativa.
- Complessità strutturale
- Utilizzando lo strumento rugo, creare una scatola di 10 m x 10 m sulla nuvola di punti densa, impostando una dimensione massima di 10 m (rugo-dim: 10,0 m) e un rapporto di aspetto di 1,0 (quad-aspect: 1,000) per designare l'area target di 100 m2 per l'estrazione dei dati.
NOTA: Ulteriori dettagli sull'uso dello strumento rugo sono disponibili nella sezione 7.0 del file supplementare 3. - Impostare il numero di linee del transetto da campionare (linee) e il numero di punti lungo ciascun transetto (campioni) in base alla spaziatura del campione desiderata. Selezionare Prepara per esportare un file CSV contenente le coordinate x, y e z di ciascun punto campionato, che può essere utilizzato per una varietà di analisi della complessità strutturale.
- Eseguire lo script trovato nel file supplementare 4 per generare le funzioni utilizzate per le analisi della complessità strutturale. Quindi, segui gli script trovati nel file supplementare 5 in base alle metriche desiderate per quantificare la complessità strutturale.
NOTA: Si consiglia di selezionare una scala di spaziatura alla massima risoluzione (si consiglia una spaziatura di 1 cm ) che gli utenti possono scegliere per indirizzare la loro scala di interesse, da cui una varietà di scale, come quelle presentate qui (interlinea di 0,5 m e interlinea di 10 cm), può essere valutata in modo simile attraverso il downsampling56.
- Utilizzando lo strumento rugo, creare una scatola di 10 m x 10 m sulla nuvola di punti densa, impostando una dimensione massima di 10 m (rugo-dim: 10,0 m) e un rapporto di aspetto di 1,0 (quad-aspect: 1,000) per designare l'area target di 100 m2 per l'estrazione dei dati.
- Composizione della comunità
- Utilizzando lo strumento Virtual Point Intercept (VPI), creare un riquadro di 10 m x 10 m sulla nuvola di punti densa, impostando una dimensione massima di 10 m (quad-dim: 10,0 m) e un rapporto di aspetto di 1 (quad-aspect: 1,000) per designare l'area target di 100 m2 per l'estrazione dei dati.
NOTA: I dettagli sull'utilizzo dello strumento Virtual Point Intercept sono disponibili nella sezione 5.0 del file supplementare 3. - Impostate i punti da campionare dalla nuvola di punti densa in una distribuzione casuale stratificata, con il numero di punti che mirano a una densità scelta. Selezionare Prepara per iniziare i punti di campionamento.
NOTA: Per le analisi a livello tassonomico si raccomanda una densità di campionamento di 25 m-2 (2.500 punti). I risultati qui presentati hanno utilizzato una densità di campionamento inferiore (10 m-2) per un'indagine comparativa più ampia sulla composizione della comunità focalizzata su un livello funzionale. - Utilizzare lo strumento camme per collegare le immagini sorgente alla nuvola di punti densa e consentire viste multi-immagine dei punti sul modello interrogate spazialmente.
NOTA: Ulteriori dettagli sullo strumento camme sono disponibili nella sezione 4.5 del File supplementare 3. - Utilizza l'applet Web del browser VPI per etichettare principalmente ogni punto con la sua designazione tassonomica a risoluzione più alta direttamente utilizzando più viste delle immagini di origine. Aggiungi due set opzionali di etichette secondarie per ogni punto, con esempi per le etichette di corallo, tra cui lo stress da sbiancamento75 e la morfologia.
NOTA: I set di etichette primarie e secondarie possono essere modificati modificando il file qclasses.json che si trova nella cartella *.pq. - Esporta un riepilogo della percentuale di copertura per ogni etichetta come file .csv utilizzando l'applet web.
- Utilizzando lo strumento Virtual Point Intercept (VPI), creare un riquadro di 10 m x 10 m sulla nuvola di punti densa, impostando una dimensione massima di 10 m (quad-dim: 10,0 m) e un rapporto di aspetto di 1 (quad-aspect: 1,000) per designare l'area target di 100 m2 per l'estrazione dei dati.
- Indagine sulla densità
- Assicurarsi che le immagini siano già state collegate nel software seguendo il passaggio 3.2.3. Imposta una vista pseudo-mappa della nuvola di punti densa modificando la lunghezza focale della vista prospettica a 100 mm e riducendo lo zoom fino a una vista completa dall'alto verso il basso del modello. Utilizzare il file di campionamento quadrat nel file supplementare 6 per acquisire la vista utilizzando l'applet Web facendo clic su eval per la cella c1, quindi selezionare il pulsante di acquisizione.
NOTA: Ulteriori dettagli sono disponibili nella sezione 8.0 del file supplementare 3. - Attiva le camme, quindi collega le immagini all'interno del flusso di lavoro di campionamento quadrato facendo clic su Valuta per le celle c2 e c3 nello script di campionamento quadrato.
- Assicurarsi che sia già stata realizzata una rugo box dopo il passaggio 3.1.1 per designare l'area di estrazione dati target di 100 m2 . Nell'applet web, valutare la sezione delle celle di preparazione c4 per campionare 100 1 m2 quadrati.
- Nell'indirizzo Web di campionamento Quadrat, utilizzare le immagini di origine per cercare in un quadrato ed etichettare gli organismi target. Fare doppio clic con il pulsante sinistro del mouse su una posizione per eseguire il retargeting della posizione di campionamento. Fare clic su un pulsante tassonomico per designare il punto di destinazione come campione. Per rimuovere un punto contrassegnato, fare doppio clic con il pulsante sinistro del mouse su quel punto e selezionare NIENTE.
NOTA: I quadrati sono presentati in un ordine casuale predeterminato, consentendo di campionare casualmente un sottoinsieme di quadrati per le indagini sulla densità. - Compila tutti i file di campionamento che si trovano in *aux/recruits/test1 in un'unica directory, rinominando ogni file per includere il nome del sito. Aggiungere il file di ricerca del pulsante (File supplementare 7) alla stessa directory dei file di campionamento. Eseguire lo script nel file supplementare 8, seguendo le istruzioni in linea per aggregare i dati di esempio in densità per sito e gruppo tassonomico.
NOTA: Qui, campionamo gli invertebrati sessili, ma lo stesso strumento può essere utilizzato per esaminare una varietà di organismi, comprese le densità di coralli giovani e adulti.
- Assicurarsi che le immagini siano già state collegate nel software seguendo il passaggio 3.2.3. Imposta una vista pseudo-mappa della nuvola di punti densa modificando la lunghezza focale della vista prospettica a 100 mm e riducendo lo zoom fino a una vista completa dall'alto verso il basso del modello. Utilizzare il file di campionamento quadrat nel file supplementare 6 per acquisire la vista utilizzando l'applet Web facendo clic su eval per la cella c1, quindi selezionare il pulsante di acquisizione.
- Demografia
- Caricare il file di ortoproiezione per la segmentazione delle colonie nel software di analisi della segmentazione (vedere la tabella dei materiali)80. Carica file di ortoproiezione coregistrati per più punti temporali come nuove mappe all'interno dello stesso file di progetto per segmentare e tracciare le dimensioni delle colonie nel tempo.
- Utilizzare le immagini di origine tramite l'applet web per iView che si trova nella sezione 17.1 del file supplementare 3 durante la segmentazione delle colonie come riferimento per l'identificazione tassonomica e dei confini. Assicurarsi che le immagini siano già state collegate nel software di visualizzazione seguendo il passaggio 3.2.3. Posiziona un marcatore sulla nuvola di punti densa per la colonia focale e scorri le immagini sorgente per la posizione del marcatore per diverse viste prospettiche.
- Utilizza lo strumento di annotazione dei clic positivi/negativi per segmentare le singole colonie di coralli. È possibile modificare i limiti utilizzando la regolazione manuale o basata su clic.
4. Cura dei dati
NOTA: Gli sforzi di archiviazione dovrebbero dare priorità alla conservazione delle immagini originali, poiché tutti i prodotti derivati successivi sono riproducibili. Sebbene i repository disponibili per un determinato utente possano variare, è necessario impegnarsi per standardizzare i metadati del sondaggio associati inclusi nel set di dati dell'immagine di origine per massimizzarne l'utilità quando resi disponibili alla comunità più ampia.
- Archivio dati
- Genera un file di descrizione dei metodi che include i dettagli del rilievo come l'area coperta, il sistema di telecamere, i marcatori di controllo a terra e il modello di raccolta. Vedere il file supplementare 9 per una descrizione di esempio per questo protocollo.
- Genera un file di metadati del rilevamento specifico per il set di dati dell'immagine, inclusi campi quali il nome del sito, la data di raccolta, le coordinate GPS, i rilevamenti del grafico, i dati di profondità e scala del controllo a terra e il modello di raccolta e il sistema di telecamere utilizzati per il rilevamento specificato.
NOTA: Si consiglia vivamente di utilizzare campi aggiuntivi che includano un contesto geografico e le condizioni più ampie durante l'indagine. Un esempio di file di metadati con i campi consigliati è disponibile nel file supplementare 10. - Combina il file di descrizione, il file di metadati e i file di immagine in un unico archivio zip da inserire nel repository di dati scelto.
NOTA: Le raccolte di dati delle immagini sono state rese disponibili presso https://doi.org/10.6075/J0DV1HDR.
Risultati
Il successo della raccolta di immagini su grandi aree sul campo dovrebbe portare alla creazione di una densa ricostruzione della nuvola di punti con una copertura completa dall'alto verso il basso dell'area di rilevamento, mentre una ridondanza inadeguata nella copertura può causare lacune o un completo degrado della nuvola di punti (Figura 4). Per una serie di 43 indagini di immagini su larga area condotte in tutto l'arcipelago hawaiano nel 2016, una media del 99,6% delle immagini è stata allineata per set di dati, con il 66% dei set di immagini che hanno il 100% delle immagini allineate con successo. Le immagini raccolte dalla fotocamera con obiettivo grandangolare avevano un GSD medio di 0,52 mm px-1 , mentre le immagini dalla fotocamera con obiettivo zoom avevano un GSD medio di 0,18 mm px-1. Queste indagini hanno generato nuvole di punti dense con una dimensione media di 557,7 milioni di punti (15 GB).
I flussi di lavoro ecologici qui descritti sono stati progettati per generare dati paragonabili alle metodologie esistenti per il monitoraggio della barriera corallina78. I dati ecologici estratti dalle indagini LAI nelle Hawaii mostrano, a parte alcuni valori anomali, misure di rugosità lineare risultanti dal flusso di lavoro della complessità strutturale che si allineano bene con i valori relativi rispetto alle misure in situ della complessità nei siti81 (Figura 5A, B). Ulteriori analisi della composizione della comunità da LAI per misurare la copertura percentuale dei principali gruppi funzionali bentonici mostrano un allineamento simile rispetto alle tradizionali indagini fotoquadrate82 (Figura 5C, D). Il campionamento quadrato è stato utilizzato per misurare la densità degli invertebrati sessili, i più comuni dei quali sono i ricci di mare, che sono stati riassunti come misure categoriali di abbondanza relativa. I metodi LAI registrano regolarmente livelli di abbondanza più elevati rispetto ai metodi in situ 81 (Figura 5E, F), il che può essere dovuto alla capacità di cercare e rilevare in modo completo tutti gli individui all'interno di una data area rispetto a un rapido censimento visivo. La segmentazione delle colonie di coralli utilizzando l'ortoproiezione 2D ha anche rivelato distribuzioni dimensionali simili dei taxa di corallo comuni ai metodi in situ 83 (Figura 5G, H).
Uno dei principali vantaggi delle indagini LAI è la capacità di archiviare e tracciare i cambiamenti nelle aree della barriera corallina nel tempo attraverso la coregistrazione della nuvola di punti densa. Le barriere coralline sono substrati viventi, il che per le indagini LAI significa che può essere difficile identificare superfici permanenti, naturali o installate, che possono essere utilizzate per coregistrare in modo affidabile dense nuvole di punti da diversi punti temporali. L'esempio dell'atollo Millennium (Figura 6) mostra un esempio con crescita elevata e perdita strutturale in cui il flusso di lavoro di coregistrazione assistita è stato utilizzato per la coregistrazione di nuvole di punti dense nonostante la stabilità minima o nulla della superficie della barriera corallina nel tempo.
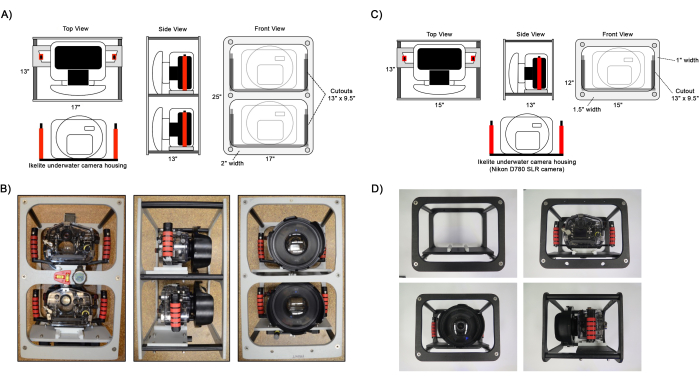
Figura 1: Schema dei fotogrammi della fotocamera assemblati. Viste di esempio delle configurazioni di frame (A,B) a doppia telecamera e (C,D) a telecamera singola. Gli alloggiamenti per telecamere Ikelite sono fissati al telaio sul pannello di montaggio della telecamera utilizzando una piastra di scorrimento fissata alle maniglie dell'alloggiamento. Gli strumenti opzionali per facilitare la navigazione, come una livella, una bussola e un computer subacqueo, possono essere collegati al telaio come mostrato in B. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Schema di allestimento di un grafico di immagini di grandi dimensioni da 100 m2 . Schema di un grafico di immagini di grandi dimensioni completamente allestito di 100 m2 di area. I marcatori di tracciato temporanei includono sei indicatori di tessere di confine, quattro barre di scala e quattro float di riferimento. I marcatori di trama permanenti includono due picchetti in acciaio inossidabile con il paletto sinistro, quando si guarda a terra, incluso un controdado. Il riferimento GPS per il grafico deve essere preso sopra la tessera o il paletto al centro a sinistra. Clicca qui per visualizzare una versione più grande di questa figura.
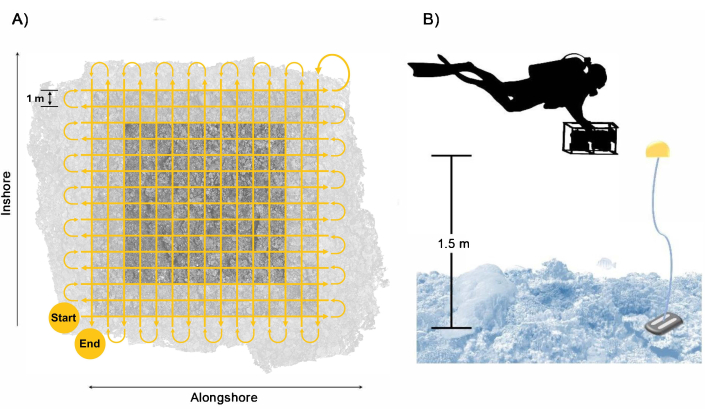
Figura 3: Modello di raccolta dei subacquei. Esempio di (A) percorso di nuoto del subacqueo per garantire una copertura e una sovrapposizione sufficienti dell'area del terreno con un buffer incluso e (B) disposizione del subacqueo con il sistema di telecamere con i galleggianti di riferimento che forniscono una guida per l'altezza del nuoto. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Riduzione della sovrapposizione delle immagini. Il degrado della nuvola di punti densa man mano che il numero di immagini sovrapposte viene ridotto attraverso il campionamento casuale. Ogni pannello mostra la nuvola di punti densa generata da (A) tutte le immagini, (B) 1/2, (C) 1/3, (D) 1/5 e (E) 1/10 delle immagini originali. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Estrazione di dati ecologici. I dati candidati estratti dall'imaging di grandi aree per ciascuno dei flussi di lavoro ecologici sono mostrati rispetto ai metodi di raccolta dei dati in situ stabiliti. Ciò include (A,B) complessità strutturale, (C,D) composizione della comunità (le barre di errore indicano l'errore standard), (E,F) densità degli invertebrati e (G,H) dati demografici della struttura dimensionale. Abbreviazione: LAI = imaging di grandi dimensioni. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Coregistrazione di nuvole di punti dense. Un esempio di confronto visivo di due nuvole di punti dense temporalmente coregistrate. Le aree di perdita strutturale, probabilmente dovute a danni da moto ondoso, sono codificate visivamente in rosso, come indicato dalla freccia magenta. Le aree di aggiunta strutturale, tipicamente attribuite alla crescita di colonie di coralli, sono codificate visivamente in blu, come indicato dalla freccia gialla. Il flusso di lavoro di coregistrazione qui descritto può ancora essere utilizzato per aree di barriera corallina dinamiche come si vede qui, dove i punti di controllo a terra (GCP) installati in modo permanente sarebbero inaffidabili a causa della crescita eccessiva o dello spostamento. Clicca qui per visualizzare una versione più grande di questa figura.
| Funzione fotocamera | Impostazione consigliata |
| Fuoco | Automatico |
| Modalità di scatto | P (Programmed Auto) per obiettivo grandangolare |
| A (Auto a priorità di diaframmi), impostato su un'apertura di F8 per l'obiettivo macro | |
| Modalità di rilascio | S (Auto a priorità di tempi) |
| Impostazioni di messa a fuoco automatica | Autofocus centrale (AF-C), punto centrale singolo (S) |
| Controllo automatico della sensibilità ISO | SU |
| Massima sensibilità ISO | 3200 |
| Velocità minima dell'otturatore | 1/320 |
| Qualità dell'immagine | RAW + JPEG |
| Timer a intervalli | 1 s |
| Bilanciamento del bianco | Costume |
Tabella 1: Impostazioni consigliate per la fotocamera. Di seguito è riportato un elenco delle impostazioni chiave della fotocamera utilizzate per ottimizzare la qualità dell'immagine. Queste impostazioni danno la priorità all'acquisizione di immagini a fuoco catturate da un operatore in movimento in condizioni di illuminazione subacquea.
| Allinea le foto | |
| Accuratezza | Alto |
| Preselezione generica | No |
| Limite di punti chiave | 5000 |
| Limite del punto di pareggio | 0 |
| Corrispondenza guidata delle immagini | No |
| Adattamento del modello di telecamera adattiva | Sì |
| Costruisci una nuvola densa | |
| Qualità | Alto |
| Filtraggio di profondità | Lieve |
| Calcola i colori dei punti | Sì |
| Calcola la confidenza del punto | Sì |
| Esporta punti | |
| Tipo di file | FOGLIO DI Stanford |
| Sistema di coordinate | Coordinate locali (m) |
| Dati di origine | Nuvola densa |
| Salva i colori dei punti | Sì |
| Salva punto normale | Sì |
| Risparmio di punti | Sì |
| Salvare le classi di punti | No |
| Converti i colori in RGB a 8 bit | Sì |
| Codifica binaria | Sì |
Tabella 2: Impostazioni di costruzione della nuvola di punti densa 3D. Un elenco delle impostazioni utilizzate in Agisoft Metashape per creare ed esportare una ricostruzione di nuvole di punti dense di alta qualità.
File supplementare 1: Roadmap. Esempio di immagine ortomosaico contrassegnata con le caratteristiche e le profondità del lotto per aiutare a trovare l'area del lotto per il nuovo rilievo. Clicca qui per scaricare questo file.
File supplementare 2: Extract_meta.py. Script eseguito in Agisoft Metashape per esportare le informazioni sulla posa della telecamera e sulla directory dei file da utilizzare in Viscore per interrogare le immagini originali. Clicca qui per scaricare questo file.
File supplementare 3: Guida a Viscore. Guida software per Viscore, che include flussi di lavoro per la visualizzazione del modello, la coregistrazione e le analisi ecologiche. Clicca qui per scaricare questo file.
File supplementare 4: Rugosity_Functions.rmd. Script utilizzato in R contenente funzioni per elaborare i dati di rugosità estratti da Viscore. Clicca qui per scaricare questo file.
File supplementare 5: Rugosity_Analysis.rmd. Script utilizzato in R per calcolare le metriche di rugosità. Clicca qui per scaricare questo file.
File supplementare 6: Quadrat_sampling.rpl.json. Script utilizzato in Viscore per il flusso di lavoro di analisi della densità quadrata. Clicca qui per scaricare questo file.
File supplementare 7: Density_taxo_lookup.json. File di ricerca dei pulsanti per l'esecuzione dello script di campionamento quadrat per aggregare i dati di campionamento quadrat per gruppo tassonomico. Clicca qui per scaricare questo file.
File supplementare 8: Density_Analysis.R Script utilizzato in R per aggregare i dati di campionamento quadratico che calcola la densità in base al gruppo tassonomico a livello di indagine. Clicca qui per scaricare questo file.
File supplementare 9: README.txt Esempio di file di testo da includere con le immagini originali per l'archiviazione dei dati che descrive la metodologia di acquisizione delle immagini. Clicca qui per scaricare questo file.
File supplementare 10: METADATA_KAH_2016-07_03.txt Esempio di file di testo da includere con le immagini originali per l'archiviazione dei dati che contiene campi di metadati per il rilevamento LAI. Ciò include i campi per la scala all'interno del sondaggio e i dati di profondità per il riferimento, nonché i metadati generali del sito per il contesto geografico. Abbreviazione: LAI = imaging di grandi dimensioni. Clicca qui per scaricare questo file.
Discussione
L'imaging di grandi dimensioni è uno strumento che consente agli scienziati del settore di visualizzare e analizzare digitalmente le caratteristiche dell'ambiente su scale più grandi di quelle delle singole immagini raccolte. Catturando più immagini dell'ambiente da più prospettive, i protocolli LAI aiutano a creare rappresentazioni di paesaggi relativamente ampi (rispetto alla copertura spaziale delle singole immagini) mantenendo i dettagli raccolti dalle immagini originali. Il valore unico dell'LAI risiede nella capacità di esplorare i dati ambientali su scale diverse, dalla scala più grande (definita dall'estensione areale dell'indagine) alla scala più fine (definita dalla risoluzione realizzata delle immagini originali). Tuttavia, per capitalizzare questa forza trasversale, è fondamentale garantire un accesso regolare e fluido a tutti i livelli dei dati acquisiti, in particolare per garantire un facile accesso sia alle immagini originali che al modello 3D derivato. In ogni fase del protocollo qui presentato, evidenziamo questa forza unica dell'IAI, assicurando costantemente che le immagini originali siano accessibili, utilizzabili e archiviate in modo sicuro insieme ai modelli LAI derivati.
Il metodo LAI fornirà prodotti collegati direttamente alle immagini originali raccolte. Spostando i dettagli dell'acquisizione delle immagini, gli utenti possono produrre prodotti di dati di diversa qualità e copertura. Quando si rilevano ambienti di barriera corallina strutturalmente complessi, un utente con un tempo di rilevamento limitato sott'acqua (o un numero costante di immagini disponibili per l'acquisizione) può dare la priorità all'aumento della copertura areale dell'area di indagine o all'aumento del livello di dettaglio di ciascuna sezione dell'area campionata. Ci sarà necessariamente un compromesso, con il modello areale grande che ha meno dettagli (e forse più occlusioni) per unità di area e il modello dettagliato che copre meno area totale (con probabilmente meno occlusioni). In questo protocollo, includiamo l'uso di due telecamere, ciascuna con obiettivi diversi, che consente all'utente di campionare un'area più ampia (sovrapposizione sufficiente con l'obiettivo grandangolare per soddisfare i requisiti SfM) e contemporaneamente di raccogliere immagini originali più dettagliate (dettagli più elevati dall'obiettivo zoom che ha una minore sovrapposizione da foto a foto). Includendo la stima della posa delle immagini da entrambe le telecamere, i protocolli di visualizzazione e analisi a valle includono viste a risoluzione più elevata da gran parte dell'area campionata. Sebbene il protocollo miri ad ampliare la gamma di fattibilità dell'indagine, gli utenti potrebbero scoprire che i prodotti derivati mancano di una copertura areale sufficiente o di un dettaglio sufficiente delle immagini originali per completare le routine analitiche preferite. Gli utenti sono incoraggiati a rivedere le immagini originali e i modelli derivati per assicurarsi che il protocollo di indagine ambientale soddisfi le esigenze del programma e a modificare l'approccio di indagine in acqua (ad esempio, spostando la distanza di campionamento a terra, alterando la durata dell'indagine o il numero di immagini raccolte) per arrivare all'equilibrio preferito tra copertura areale e risoluzione per unità di area.
I metodi LAI forniscono valore alla scienza subacquea catturando "istantanee" ricche di informazioni e ad ampia copertura di ambienti bentonici che possono essere efficienti in termini di tempo e richiedono competenze specifiche di dominio limitate per la raccolta. Il valore di questi prodotti di dati può essere considerato con riferimento ai flussi di dati esistenti e per applicazioni nuove e accelerate specifiche del dominio. Considerando il confronto con i flussi di dati esistenti, i prodotti di analisi di LAI possono fornire dati ecologici direttamente comparabili ai dati raccolti in situ dagli osservatori subacquei 84,85,86,87. Forniamo qui un'analisi quantitativa dei dati ecologici derivati da ciascuna attività di monitoraggio in situ classica e dall'analisi standardizzata dei prodotti LAI, seguendo questo protocollo. Concentrandosi su quattro metriche comuni negli sforzi di monitoraggio della barriera corallina (complessità strutturale, composizione della comunità bentonica, densità di invertebrati mobili e struttura delle dimensioni dei coralli; Figura 5), dimostriamo una forte concordanza quantitativa negli output dei dati. In particolare, per i flussi di dati che richiedono osservazioni su larga scala (ad esempio, identificazioni tassonomiche, definizioni precise dei confini biologici), i flussi di lavoro LAI che includono l'accesso regolare e affidabile alle immagini originali forniscono una forza unica per parallelamente alle opportunità osservative che sono state storicamente limitate solo al campionamento immersivo in situ. I progressi nella gestione e nella visualizzazione dei dati forniti da Viscore e descritti in questo protocollo offrono un valore unico nell'assicurare la comparabilità dei dati ecologici derivati da LAI e dei prodotti di monitoraggio in situ, consentendo una manutenzione imparziale dei flussi di dati a lungo termine con l'incorporazione di flussi di lavoro digitalmente migliorati di LAI.
Per gli scienziati subacquei, LAI offre l'opportunità di sfruttare flussi di lavoro nuovi e accelerati nell'acquisizione e nell'esplorazione dei dati. LAI ha punti di forza unici come strumento di mappatura ad alta risoluzione che contiene informazioni che descrivono non solo la composizione relativa dell'ambiente bentonico, ma anche le caratteristiche spaziali. Espliciti per la creazione di un modello 3D dal flusso di lavoro SfM, i prodotti LAI contengono informazioni sulla complessità strutturale che possono essere esplorate su più scale56. Come strumenti che catturano paesaggi marini di più grandi aree, i prodotti LAI possono fornire l'opportunità di considerare i modelli di distribuzione spaziale e le caratteristiche di vicinato per gli organismi bentonici45,66. Inoltre, essendo in grado di visualizzare paesaggi bentonici su scale più ampie, diventa possibile rilevare caratteristiche che non sono facilmente visibili negli habitat sottomarini a causa delle limitazioni della visibilità a lunga distanza sott'acqua, ad esempio il pattern poligonale su larga scala (3-4 m) di una macroalga comune su una barriera corallina del Pacifico64.
Sebbene la LAI offra opportunità per l'analisi su larga scala, sono state espresse preoccupazioni riguardo alle sfide legate all'efficiente raccolta in acqua e alla post-elaborazione delle immagini. L'espansione dell'estensione spaziale dell'acquisizione di immagini sott'acqua richiederà progressi tecnologici dall'imaging dispiegato da subacquei, all'utilizzo di sistemi di mappatura assistita88 e, infine, all'uso di ROV38 e AUV67,89. Solide metodologie di indagine per quanto riguarda il modello di acquisizione e i sistemi di telecamere garantiranno una transizione fluida e la coerenza dei dati generati su queste diverse piattaforme. Date le esigenze computazionali e il grande formato di dati dei prodotti LAI, alcuni scienziati marini hanno espresso preoccupazioni riguardo all'accessibilità tecnologica del flusso di lavoro90 e alle grandi esigenze di tempo legate all'estrazione ecologicadei dati 84,86. Viene presentato un numero crescente di strumenti, tuttavia, che sfruttano soluzioni creative agli ostacoli tecnici dell'estrazione dei dati 80,91,92,93. È importante sottolineare che l'uso di flussi di lavoro potenziati dall'intelligenza artificiale per l'analisi LAI è limitato dalla qualità del segnale di input fornito. Pertanto, rimane una domanda costante nel mantenere gli standard e la qualità dell'acquisizione delle immagini e della gestione dei dati nei protocolli LAI, indipendentemente dal fatto che l'estrazione dei dati sia condotta da un osservatore umano, da un algoritmo di intelligenza artificiale addestrato o (idealmente) da un flusso di lavoro umano-in-the-loop accelerato dall'intelligenza artificiale. Mantenendo un'attenzione costante sull'importanza primaria delle immagini originali nei protocolli LAI, come descritto qui, emergono opportunità uniche per esplorare gli habitat sottomarini in modo robusto, trasparente e coerente.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è supportato dagli sforzi della 100 Island Challenge presso la Scripps Institution of Oceanography. Ringraziamo Schmidt Marine Technology Partners, Ed e Christy Scripps, e la Moore Family Foundation per il loro sostegno finanziario alla ricerca associata e agli sforzi di formazione sull'imaging su larga scala che hanno contribuito a perfezionare la metodologia. Inoltre, ringraziamo l'equipaggio delle navi da ricerca Hi'ialiki, Hanse Explorer e Plan B, che hanno fornito supporto agli sforzi sul campo. Ringraziamo in particolare il team della Divisione Scienze dell'Ecosistema del Centro di Scienze della Pesca delle Isole del Pacifico presso il NOAA che ha assistito alla raccolta sul campo dei dati qui presentati.
Materiali
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
Riferimenti
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548(2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985(2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535(2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993(2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077(2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197(2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262(2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593(2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979(2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740(2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737(2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276(2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050(2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440(2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957(2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011(2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113(2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077(2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438(2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213(2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594(2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282(2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943(2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569(2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304(2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548(2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145(2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674(2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317(2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon