Method Article
Measuring the Structure, Composition, and Change of Underwater Environments with Large-Area Imaging(대면적 이미징을 통한 수중 환경의 구조, 구성 및 변화 측정)
요약
이 프로토콜은 산호초 군집의 구조적 복잡성, 군집 구성 및 인구 통계에 대한 메트릭을 추출하는 데 사용되는 4단계 대면적 이미징 조사 방법론을 다룹니다. 수집된 이미지의 품질과 소스 이미지에 대한 통합 액세스는 프로토콜의 각 단계 내에서 우선 순위가 지정됩니다.
초록
디지털 이미징 및 처리 기술은 대지역 이미징 조사의 확장을 촉진하기 위해 발전했으며, 이는 조간대 아래 서식지에 사는 유기체의 상태, 추세 및 역학을 연구할 수 있는 능력을 향상시킵니다. 현장 해석을 위한 사실적인 디지털 트윈을 생성함으로써 이러한 접근 방식을 통해 소규모 현장 팀은 이전에 가능했던 것보다 훨씬 더 많은 데이터를 수집할 수 있습니다. 여기에서는 지난 10년 동안 실험을 통해 개발되고 개선된 이미지 수집, 모델 구성, 생태 분석 및 데이터 큐레이션을 포함한 4단계 대면적 이미징 조사 파이프라인 및 분석 방법론을 제시합니다. 설명된 각 단계는 원본 소스 이미지의 고유한 가치에 일관되게 초점을 맞춥니다. 대규모 이미지 조사에서 추출한 데이터 유형은 방대하지만, 여기에는 모니터링 및 가설 기반 노력에 유용한 구조적 복잡성, 커뮤니티 구성 및 인구 통계학적 분석에 대한 생태학적 데이터를 추출하기 위한 워크플로우가 포함되어 있습니다. 또한 메타데이터 표준에 대한 권장 사항을 포함하여 대면적 이미징 데이터 수집을 보완하고 연구 그룹 간의 투명성과 협업을 촉진하는 보관 작업을 지원합니다.
서문
육상 환경 전반에 걸쳐, 연구자들은 특히 Barro Colorado Island1, Hubbard Brook experimental forest2 및 기타3를 포함한 장기 연구 장소의 맥락에서 생태 군집의 표준화된 대지역 샘플링을 활용했습니다. 공간적으로 명시적이고 분류학적으로 해결된 분포 데이터 수집을 통해 이러한 샘플링은 분산 및 모집 패턴3,4,5, 서식지 선호도 및 가용성, 분산 커널, 자원 제한 3,5,6,7,8 및 공간 사용 9,10과 같은 기본적인 생태학적 역학을 탐구하는 데 사용되었습니다. 그러나 현재까지 해양 군집에 대한 대부분의 공간 연구는 분류군 또는 그룹11,12,13,14,15가 차지하는 퍼센트 커버로 보고된 상대적 피복 측정법에 의존해 왔습니다. 그러나 상대적 피복량에 대한 집계된 추정치는 인구 수준 인구 통계학뿐만 아니라 지역 사회 수준의 역학에 대한 세부 사항을 해결하기에는 불충분하다. 저서 군집에 대한 상세한 분석을 제공한 연구는 힘든 수중 모니터링 프로토콜 16,17,18,19,20,21,22,23,24,25,26,27,28,29에 의존했습니다.,30,31,32, 그러나 이러한 연구의 규모(분류학, 공간 및 연대기적 척도 포함)는 수중 방법론의 운영 요구로 인해 현저히 제한적입니다.
LAI(Large-Area Imaging)는 계산 집약적인 워크플로우를 통해 수많은 이미지의 정보를 결합하여 구성 이미지보다 훨씬 큰 규모로 환경을 사진처럼 사실적인 표현으로 생성하는 접근 방식입니다33. LAI 워크플로우는 수중 흡수 및 산란으로 인해 가시성이 제한되는 수중 서식지의 응용 분야에 특히 적합합니다. 가시성이 제한되어 있기 때문에 저서의 미세한 세부 사항을 포착하는 이미지는 피사체 근처에서 획득해야 합니다. 따라서 광활한 저서 서식지의 풍경(또는 바다 경관) 보기를 캡처하는 동시에 개별 저서 피사체의 세부 사항을 유지하려면 복합 이미징이 필요합니다. 또한, 구조적으로 복잡한 환경에서는 저서 유기체의 위치와 상대적 근접성을 충실하게 표현하기 위해 복합 이미징을 재구성할 때 3차원(3D) 구조를 설명하는 것이 필수적입니다. SfM(Structure-from-Motion) 사진 측량 방법은 산호초34,35,36, 남극 저서 생태계37, 냉수 산호초 38, 냉수 산호초39, 해초 서식지40 등 상대적으로 움직이지 않는 저서 생물이 있는 환경에 적용되어 후속 직교 맵 생성 및 포인트 클라우드 추정으로 풍경 장면을 재구성하는 데 사용되는 입체 관찰 없이 복합 이미징을 생성합니다.
산호초 과학에서 LAI는 점점 더 큰 공간 규모에서 산호초 경관을 시각화하고 이러한 시각화를 디지털 미디어에서 공유할 수 있는 잠재력을 제공했습니다. LAI는 산호초 생물의 범위, 산호 군집의 밀도 및 분포, 개별 유기체 41,42,43,44,45,46,47의 모양과 상태를 추정하는 데 사용할 수 있습니다. 또한, LAI 제품이 서로 다른 시점의 동일한 위치에서 수집되는 경우, 개별 유기체의 크기 및 상태 변화를 기록할 수 있습니다 48,49,50,51. 대부분의 경피성 산호 군락이 매년 방사형으로 밀리미터에서 센티미터 정도로 성장한다는 점을 감안할 때, 수년에 걸쳐 수집된 시계열 LAI는 이러한 종의 생물학 및 생태학에 대해 보고하기 위한 귀중한 데이터 스트림을 제공할 수 있습니다52. 반복적이고 공동 등록된 LAI 데이터는 공유, 보관 및 전 세계 협업의 기반으로 사용할 수 있는 형식으로 산호초를 연구할 수 있는 고유한 통찰력을 제공합니다.
산호초 생태학자들 사이에서 LAI의 사용이 확대됨에 따라53 카메라 시스템과 조사 방법론의 다양성도 증가했다52. 선택한 LAI 프로토콜은 사용 가능한 리소스 내에서 제한된 상태를 유지하면서 원하는 생태 메트릭의 해상도와 범위를 목표로 해야 합니다. 모든 사진 측량 재구성의 품질은 궁극적으로 원본 이미지의 해상도와 조사 영역의 공간 범위에 따라 달라집니다. 이미지 품질은 센서 해상도 및 초점 거리를 포함한 카메라 매개변수와 수집 절차, 주로 저서(54)로부터의 거리의 영향에 의해 결정되며, 이 모든 것은 특정 이미지 세트의 유효 지상 샘플링 거리(GSD)에 기여합니다. 또한 빠른 셔터 속도, 작은 조리개 및 낮은 ISO 값은 각각 선명하고 초점이 맞으며 전자 노이즈가 적은 이미지를 생성합니다. 이러한 각 설정을 충분한 품질의 이미지를 생성하는 임계값으로 유지하는 것은 조도가 낮은 수중 환경에서 어려울 수 있습니다. 디지털 일안 반사식(DSLR) 스타일 및 미러리스 카메라에서 볼 수 있는 것과 같은 더 큰 센서는 액션 카메라55와 같은 더 작고 이동성이 높은 솔루션에 비해 더 나은 이미지 품질을 생성하고 더 정확한 재구성을 생성합니다. 적절한 카메라 모델을 고려할 때 간과해서는 안 되는 추가 기능에는 내장 인터벌 미터와 현장에서 장시간 이미지 수집 작업을 지원할 수 있는 충분한 저장 공간 및 배터리 용량이 포함됩니다.
설문조사 설계는 생태학적 가설에 의해 주도되어야 하며, 후보 지표는 필요한 해상도와 공간 범위를 결정해야 합니다. 산호초 생태학 내에서 LAI는 구조적 복잡성 35,36,56,57,58,59, 군집 구성 및 군집 60,61,62, 공간 분포 45,63,64,65,66 및 군집 궤적을 특성화하는 데 사용되었습니다 48,49,50,67,68,69입니다. 이미지 품질의 해상도는 생태학적 데이터 요구에 적합해야 하며, 군체 경계70 또는 작은 어린 산호66,71을 따라 경쟁에 대한 폴립 규모 관찰을 지원하는 데 필요한 mm 미만 세부 사항에 대한 더 미세한 해상도가 있어야 합니다. 대조적으로, 해안 매핑 72,73,74을 위한 광범위한 서식지 및 구조적 지표를 추출하려면 cm-m 규모에서 해상도의 필요성이 감소하면서 더 큰 공간 범위가 필요합니다. 해상도에 대한 요구는 LAI 조사를 완료하는 데 필요한 시간의 충분한 샘플링 및 운영 한계를 얻는 데 필요한 공간적 범위와 균형을 이루어야 합니다33.
여기에 설명된 것은 소스 이미지의 품질, 유용성 및 가치를 극대화하는 데 중점을 두고 프로토콜을 이미지 수집, 모델 구성, 생태 분석 및 데이터 큐레이션의 네 가지 주요 단계로 세분화하여 LAI 설문조사를 수행하기 위한 엔드 투 엔드 프로토콜입니다33. 지난 10년 동안 2,000개 이상의 독특한 산호초 지역에 대한 약 3,500개의 LAI 이미지 조사 수집은 여기에 제시된 각 단계에 대한 방법론을 개선하는 데 기여했습니다(https://doi.org/10.6075/J0T43RN1). 그 결과 생성된 프로토콜은 강력한 데이터 수집과 정확하고 정밀한 모델 재구성을 위한 방법이며, 이를 통해 구조적 복잡성, 커뮤니티 구성 및 인구 통계(예: 밀도 및 크기 구조)를 포함한 광범위한 응용 분야에서 상세한 생태 데이터를 수집할 수 있습니다. 또한 LAI 데이터 보관을 위한 메타데이터 표준을 포함하고 있으며, 이러한 디지털 트윈의 보존, 투명성 및 협업 잠재력을 보장하는 데 반드시 필요한 표준을 수립해야 합니다.
프로토콜
1. 이미지 수집
참고: 다음 대면적 이미지 수집 절차는 약 100m2의 영역을 조사하는 방법을 간략하게 설명하지만 10m2에서 최대 2,500m2의 영역에 쉽게 적용할 수 있습니다. 아래에 설명된 측량 방법은 다양한 작업 조건에서 배포할 수 있고, 고품질 이미지를 생성하며, 두 명으로 구성된 버디 팀이 한 시간 동안 다이빙을 통해 많은 생태 응용 프로그램에 사용할 수 있는 강력한 데이터를 제공하도록 설계되었습니다.
- 기어 준비
- 1 1/2" 길이의 Philips 납작머리 나사를 사용하여 외부 프레임 패널을 카메라 장착 패널 및 기둥에 부착하여 카메라 프레임을 조립합니다(그림 1).
- 고정 광각 렌즈가 있는 카메라와 줌 렌즈가 장착된 두 번째 카메라, 두 개의 DSLR 카메라를 준비합니다. 자세한 카메라 설정은 표 1 을 참조하십시오.
참고: 두 번째 줌 렌즈 카메라는 선택 사항이지만, 향후 생태 분석 중에 분류학75,76의 세부 사항을 결정하고,66,71(직경 1-5cm)의 작은 어린 산호를 찾아 식별하고, 산호 군락 경계 45,48,50을 구별하기 위해 더 높은 이미지 해상도를 캡처하는 것이 좋습니다. - 돔 포트를 부착하여 수중 카메라 하우징을 조립하고 포함된 돔 나비 나사로 고정합니다. 1/2" 길이의 십자 머리 나사를 사용하여 핸들을 부착하고 1 1/8" 길이의 소켓 머리 나사를 사용하여 카메라 장착 플레이트를 부착합니다. 카메라를 하우징에 삽입하고 진공 펌프를 사용하여 하우징 압력을 5인치로 설정합니다. Hg, O-링 씰의 무결성 확인.
- 카메라 마운팅 플레이트를 마운팅 프레임 패널에 밀어 카메라 프레임에 하우징을 설치하고 나비 나사를 사용하여 제자리에 고정합니다.
- 플롯 설정
- 인쇄된 코드 마커가 있는 6개의 정사각형 스테인리스 스틸 타일(측면 길이 10cm)을 사용하여 플롯의 경계를 설정합니다. 대상 등수조를 따라 10m 떨어진 곳에 두 개의 중앙 타일을 배치하고, 중앙 타일의 해안 및 해상 5m에 4개의 모서리 타일을 추가하여 10m x 10m 정사각형 플롯 영역을 만듭니다(그림 2). 6개 타일 각각에서 깊이를 기록하여 로컬 수직에 대한 방향을 제공하고 후속 모델 구성 단계를 용이하게 합니다.
- 4개의 모서리 타일 각각에서 약 1m 바깥쪽에 0.45kg(1lb) 무게에 ~1.5m의 선이 연결된 참조 플로트를 추가합니다.
참고: 이러한 참조 플로트는 카메라 운영자가 플롯의 경계와 카메라를 수영해야 하는 저서 위의 높이를 나타내는 가이드 역할을 합니다. 10m x 10m 플롯 경계 밖에 배치하면 이미지의 버퍼 영역이 생성되어 핵심 이미지 영역이 완전히 재구성되도록 할 수 있습니다. - 폴리염화비닐(PVC) 또는 알루미늄 막대에 부착된 2개의 코딩된 대상 타일로 구성된 0.5m 길이의 축척 막대를 플롯의 각 사분면에 배치하여 총 4개의 전개된 축척 막대를 배치합니다.
참고: 스케일 바(scale bar)와 뎁스 타일(depth tile)은 이미지 수집 프로세스 전반에 걸쳐 안정적으로 유지되는 것이 중요합니다. 스케일 바(scale bar)와 뎁스 타일(depth tile)은 카메라 오퍼레이터가 수영 패턴 진행 상황을 추적할 수 있는 시각적 랜드마크로 사용할 수도 있습니다. - 영구적인 플롯을 설정하려면 각 중앙 타일에 인접한 망치를 사용하여 두 부분으로 구성된 해양 에폭시로 고정된 0.46m(18인치) 스테인리스 스틸 말뚝(0.95cm 또는 3/8인치 나사산 막대)을 설치하여 플롯의 중심선을 표시합니다. 육지를 볼 때 왼쪽 말뚝에는 향후 조사 노력 중에 방향을 잡는 데 도움이 되는 잠금 너트가 포함되어 있습니다. 설문조사가 끝날 때, 다이빙 플로트에 부착된 방수 케이스 안에 보관된 GPS 장치를 사용하여 스테이크 왼쪽 중앙 위치 바로 위에 있는 GPS(Global Positioning System) 좌표를 기록합니다.
참고: 후속 조사에서 검색 시간을 줄이고 동일한 암초 지역을 재조사하는 것을 확인하기 위해 허가를 통해 허용되는 경우 영구 말뚝을 설치하는 것이 좋습니다. 인쇄된 2차원(2D) 정사영상 또는 측량 현장의 "로드맵"(보충 파일 1)을 사용하여 불변 피쳐를 찾고 이미징을 위해 동일한 플롯 영역의 위치를 식별하는 데 도움을 줍니다. 이러한 로드맵은 또한 허가로 인해 영구적인 말뚝 설치가 허용되지 않거나 말뚝이 제거되거나 제거된 경우 정확한 측량 구획을 재배치하는 데 사용할 수 있습니다.
- 이미지 캡처
- 플롯의 목표 깊이에서 회색 카드를 사용하여 각 카메라의 사용자 지정 화이트 밸런스를 설정합니다.
- 1 s-1 간격으로 캡처하도록 설정된 간격계에서 각 카메라를 시작합니다.
- 카메라 시스템을 저서 위 약 1.5m 높이에서 격자 패턴으로 수영한 다음, 각 패스 사이에 약 1m의 두 번째 수직 격자 패스를 약 0.25m s-1 의 느린 속도로 수영합니다(그림 3). 가공 패스가 플롯 경계의 모서리를 넘어 최소 2m 확장되어 대상 플롯 영역 내에서 충분한 중첩이 이루어지도록 합니다.
참고: 이 수영 패턴과 속도를 따르면 28분의 이미징 동안 각 카메라에서 최소 약 1,700개의 이미지를 수집할 수 있습니다. 그러나, 패스 사이의 처리 시간과 최적이 아닌 데이터를 초래하는 불충분한 오버랩을 방지하기 위한 오버샘플링 측면의 오류를 고려하기 위해, 다이버는 약 40분의 이미징 동안 각 카메라에서 2,500개의 이미지 수집을 목표로 하는 것이 좋습니다. - 충분한 하향식 커버리지를 보장하기 위해 카메라 시스템을 바다 표면에 거의 수직으로 잡습니다. 그러나 지형이 복잡한 측량 현장의 경우 두 번째 패스에서 카메라 방향을 조정하여 저서에 수직으로 따르고 3D 재구성에서 폐색을 줄입니다. 이미지에 포착된 푸른 물을 최소화하기 위해 카메라 각도를 조정할 때 주의하십시오.
참고: 강한 해류나 가파른 경사면과 같은 최적이 아닌 해양 조건의 경우 두 패스를 동일한 해안 방향으로 수행할 수 있습니다. 강한 조류에서는 단일 광각 렌즈 카메라만 사용하여 항력 프로파일을 줄이고 전진 진행을 유지하는 데 필요한 다이버의 노력이 필요할 수 있습니다. 두 번째 패스 세트는 이상적으로는 첫 번째 패스에 비해 약간 회전해야 합니다. 해안을 따라 동일한 방향으로 두 개의 패스를 수행하는 경우, 초기 패스 세트를 가로지르는 하나 또는 두 개의 수직 또는 대각선 "타이 라인"을 추가하여 재구성 품질을 개선해야 합니다.
2. 모델 구성
참고: 모델 구성 단계는 고해상도 소스 이미지에 대한 액세스를 유지하고 파생된 밀집된 포인트 클라우드를 생성하는 데 중점을 둡니다. 밀집된 포인트 클라우드의 참조는 중앙 집중식 시각화 및 분석 소프트웨어( 재료 표 참조)77 내에서 발생하므로 사용자가 즉석에서 입력하고 수정할 수 있습니다. 이렇게 하면 새로운 정보가 발생할 때, 특히 시간이 지남에 따라 추가 설문 조사를 수행할 때 데이터 세트에 대한 데이터 제품을 다시 처리하고 다시 내보낼 필요가 없습니다. 여기에서 직교투영법이라고 하는 2D 직교 맵은 중력 방향과 직교하는 투영 각도를 사용하여 밀집된 포인트 클라우드의 직교교정 투영 보기를 사용하여 생성됩니다.
- 카메라 정렬 및 3D 밀집된 포인트 클라우드 구성
- 고성능 컴퓨터를 사용하여 Workflow | 폴더 추가를 클릭합니다. 파일이 로드되면 데이터 레이아웃을 단일 카메라, 하나의청크에 모든 이미지 추가로 선택합니다. 장면에 과도한 푸른 물이 있는 이미지를 프로젝트에서 제거합니다.
참고: 프로젝트에 추가하기 전에 각 카메라의 이미지를 별도의 폴더로 구성해야 하며, 이 폴더는 청크 내의 이미지 파일을 별개의 카메라 그룹으로 분리합니다. - Workflow | 사진 정렬. 정렬에 대한 처리 설정은 표 2를 참조하십시오.
- 정렬이 완료되면 정렬된 카메라의 백분율을 기반으로 이미지 세트가 성공적으로 정렬되었는지 확인하고 생성된 희소 포인트 클라우드를 검사하여 커버리지의 갭 또는 정렬 불량이 있는지 확인합니다. 계속하기 전에 bounding box가 전체 희소 포인트 클라우드를 포함하는지 확인합니다. 필요한 경우 크기 조정(Resize ) 또는 영역 회전(Rotate Region ) 옵션을 사용하여 수정합니다.
참고: 이미지의 100%가 정렬되고 모델 일부에 여전히 간격이 있을 수 있으며, 반대로 이미지의 80-90%가 정렬되지만 대상 측량 영역의 완전한 모델을 가질 수 있습니다. 그러므로, 생성된 데이터 세트의 일부 또는 전체의 사용성에 대한 정보에 입각한 결정을 내리기 위해 정렬의 비율과 면적 커버리지를 모두 사용해야 하며, 또는 이미지 획득 품질을 높이기 위한 추가 노력 또는 정렬 처리 설정에 대한 조정이 필요한지 여부에 대해 정보에 입각한 결정을 내려야 합니다. - 줌 렌즈 이미지가 포함된 카메라 그룹을 비활성화합니다. Dense point cloud를 구성하여 Workflow | 밀집된 클라우드를 구축합니다. Build Dense Cloud에 대한 처리 설정은 표 2를 참조하십시오.
참고: 생태 분석 중에 모든 고해상도 이미지의 쿼리를 용이하게 하기 위해 두 카메라의 이미지를 정렬에 사용해야 하지만, 두 카메라 간의 화이트 밸런스와 노출의 미묘한 차이로 인해 밀집된 포인트 클라우드에 시각적 노이즈가 추가되므로 밀집된 포인트 클라우드를 생성하는 동안에는 줌 렌즈 이미지를 사용해서는 안 됩니다. - Export the camera pose estimates by selecting Tools(도구) | 스크립트 실행 | Extract_meta.py 스크립트 (보충 파일 2). Export the Dense Point Cloud(밀집된 포인트 클라우드를 선택하여 File) | 내보내기 | 포인트 내보내기. 내보내기 설정에 대해서는 표 2 를 참조하십시오.
- 내보낸 밀집된 포인트 클라우드 파일을 시각화 소프트웨어의 프로그램 파일 내에 있는 vc5prep-confidence.bat 파일로 끌어다 놓습니다.
- 생성된 프로그램 파일(*.vml 및 *ptdata, *.xml, *.kdm 파일이 포함된 폴더)과 함께 카메라 포즈 파일(*.cams.xml 및 *.meta.json)을 포함하여 내보낸 데이터 파일을 시각화 소프트웨어에서 사용할 수 있는 단일 디렉토리로 컴파일합니다.
- 고성능 컴퓨터를 사용하여 Workflow | 폴더 추가를 클릭합니다. 파일이 로드되면 데이터 레이아웃을 단일 카메라, 하나의청크에 모든 이미지 추가로 선택합니다. 장면에 과도한 푸른 물이 있는 이미지를 프로젝트에서 제거합니다.
- 크기 및 방향
- 시각화 소프트웨어에서 스케일러 도구를 사용하여 축척 막대 타겟에 마커 쌍을 배치하고 알려진 거리를 입력합니다.
참고: 스케일러 도구에 대한 자세한 내용은 Supplemental File 3의 섹션 4.2에서 확인할 수 있습니다. - 각 깊이 타일에 마커를 배치하고 방향 도구를 사용하여 각 타일의 깊이 값을 조정하여 로컬 수직에 가장 적합한 평면을 정의합니다.
참고: orient 도구에 대한 자세한 내용은 Supplemental File 3의 섹션 4.4에서 확인할 수 있습니다.
알림: 수심 광선이 위쪽을 향하여 예상 수면에서 끝나는지 확인합니다. 아래쪽을 향하는 광선의 경우, 최종적으로 재구성된 위치와 관련된 깊이 값의 오류 또는 깊이 메타데이터의 오류로 이어질 수 있는 깊이 타일의 이동 증거를 확인합니다.
- 시각화 소프트웨어에서 스케일러 도구를 사용하여 축척 막대 타겟에 마커 쌍을 배치하고 알려진 거리를 입력합니다.
- 시간적 공동정합
- Supplemental File 3의 섹션 10.0에 따라 데이터 수집을 위해 소프트웨어에서 조직 프로젝트 파일을 만듭니다. 단일 조직 프로젝트에서 시간별 설문조사가 있는 여러 사이트를 포함합니다.
- 밀집된 포인트 클라우드 파일을 조직 프로젝트에 레이어로 추가하고 필요에 따라 사이트 수준 조직 구조를 수정하여 시간에 따라 지정된 사이트의 밀집된 포인트 클라우드를 연결합니다.
참고: [Region]_[Date]_[Site]의 일관된 파일 명명 체계를 사용하여 레이어 구성을 자동화합니다. - 시계열의 규모와 방향에 대한 참조 계층으로 사용할 사이트의 시점을 선택합니다.
참고: 여러 레이어를 사용하여 배율을 설정할 수 있습니다. 그러나 조수 변화와 큰 너울 높이로 인해 시간에 따른 깊이 측정의 정밀도와 일관성에 오류가 발생하므로 방향에 대한 참조로 하나의 시점 레이어를 선택해야 합니다. - 보조 공동 정합 도구를 사용하여 시간에 따라 레이어를 정렬합니다.
참고: 자세한 내용은 보충 파일 3의 섹션 11.0에서 확인할 수 있습니다. 높은 성장 또는 큰 팽창 이벤트로 인한 큰 구조적 변화의 경우, 후보 불변 기능을 사용하여 수동 공동 정합 워크플로우를 사용하는 것이 더 나을 수 있습니다. 시계열이 길거나 시간에 따른 상당한 변화가 있는 경우 일반적으로 지정된 모델을 다음 이전 시점에 공동 정합하는 것이 좋습니다.
- 2D 정사보정
- 소프트웨어의 상자 도구를 사용하여 초점 분석 영역(10m x 10m)을 포함하는 경계와 각 가장자리에서 연장되는 최소 2m 버퍼(최소 w: 14m, 최소 h: 14m)를 포함하는 표면 각도(g: 0°)에서 보기를 설정합니다.
참고: 상자 도구 사용에 대한 자세한 내용은 보충 파일 3의 섹션 6.0에서 확인할 수 있습니다. - boxes 도구 내에서 map export를 켜서 orthoprojection image 파일을 만듭니다. 내보내기 해상도를 1mm px-1로 설정하고 캡처를 선택하여 미리보기를 생성합니다. 밀집된 포인트 클라우드의 전체 섹션이 포함된 미리보기 타일로 스크롤하고 pt-size 값을 늘려 점 사이의 간격을 채웁니다.
- 캡처를 선택하여 직교투영을 ppm 파일로 내보냅니다. 캡처가 완료되면 생성된 .ppm 파일을 프로그램 파일 내에 있는 convert-to-tif-flip.cmd 파일로 끌어다 놓아 내보낸 파일을 tif로 변환합니다.
- 시계열의 공동 등록된 밀집된 포인트 클라우드의 경우 사이트에 대해 2.4.2-2.4.3단계를 반복하여 동일한 상자를 사용하는 동안 시간 계층을 변경합니다.
- 소프트웨어의 상자 도구를 사용하여 초점 분석 영역(10m x 10m)을 포함하는 경계와 각 가장자리에서 연장되는 최소 2m 버퍼(최소 w: 14m, 최소 h: 14m)를 포함하는 표면 각도(g: 0°)에서 보기를 설정합니다.
3. 생태 분석
참고: 생태 데이터 추출을 위한 수많은 옵션이 존재하며, 그 중 일부를 여기에 제시합니다. 이러한 핵심 워크플로우는 장기 모니터링을 위해 확립된 지표에 초점을 맞추지만, 78,79 관찰 기반 과학적 탐구에 충분한 데이터를 생성하는 데 사용하고 조정할 수 있습니다. 사용자는 개별 데이터 요구 사항 및 분석 목표에 따라 워크플로를 선택하고 조정해야 합니다. 아래에 설명된 워크플로는 3D 밀집 포인트 클라우드 또는 2D 정사투영법과 같은 파생 제품을 조직 프레임워크로 사용하여 생물학적 데이터의 주석을 지원하기 위해 원본 이미지에 대한 직접 액세스를 통합하도록 설계되었습니다.
- 구조적 복잡성
- rugo 도구를 사용하여 밀집된 포인트 클라우드에 10m x 10m 상자를 만들고 최대 치수를 10m(rugo-dim: 10.0m)로 설정하고 종횡비를 1.0(쿼드 종횡비: 1.000)으로 설정하여 데이터 추출을 위한 100m2 대상 영역을 지정합니다.
참고: rugo 도구 사용에 대한 자세한 내용은 Supplemental File 3의 섹션 7.0에서 확인할 수 있습니다. - 원하는 샘플 간격을 기준으로 샘플에 대한 transect 라인의 수(lines)와 각 transect를 따라 점의 수(samples)를 설정합니다. 다양한 구조 복잡성 해석에 사용할 수 있는 각 샘플링된 점의 x, y 및 z 좌표가 포함된 csv 파일을 내보내려면 준비를 선택합니다.
- 보충 파일 4에 있는 스크립트를 실행하여 구조적 복잡성 해석에 사용되는 함수를 생성합니다. 그런 다음 원하는 메트릭을 기반으로 Supplemental File 5에 있는 스크립트를 따라 구조적 복잡성을 정량화합니다.
참고: 사용자가 자신의 관심 스케일을 다루기 위해 목표로 할 수 있는 가장 높은 해상도(1cm 간격 권장)에서 간격 스케일을 선택하는 것이 제안되며, 이로부터 여기에 제시된 것과 같은 다양한 스케일(0.5m 라인 간격 및 10cm 포인트 간격)이 다운샘플링(56)을 통해 유사하게 평가될 수 있습니다.
- rugo 도구를 사용하여 밀집된 포인트 클라우드에 10m x 10m 상자를 만들고 최대 치수를 10m(rugo-dim: 10.0m)로 설정하고 종횡비를 1.0(쿼드 종횡비: 1.000)으로 설정하여 데이터 추출을 위한 100m2 대상 영역을 지정합니다.
- 커뮤니티 구성
- VPI(Virtual Point Intercept) 도구를 사용하여 밀집된 포인트 클라우드에 10m x 10m 상자를 만들고 최대 치수를 10m(쿼드 디밍: 10.0m)로 설정하고 종횡비를 1(쿼드 종횡비: 1.000)으로 설정하여 데이터 추출을 위한 대상 100m2 영역을 지정합니다.
참고: Virtual Point Intercept 도구 사용에 대한 자세한 내용은 보충 파일 3의 섹션 5.0에서 확인할 수 있습니다. - 빽빽한 포인트 클라우드에서 샘플링할 포인트를 층화된 무작위 분포로 설정하고, 포인트 수는 선택한 밀도를 목표로 합니다. 준비를 선택하여 샘플링 포인트를 시작합니다.
참고: 25m-2 (2,500포인트)의 샘플링 밀도는 분류학적 수준의 분석을 위해 권장됩니다. 여기에 제시된 결과는 기능적 수준에 초점을 맞춘 더 광범위한 지역사회 구성 비교 설문조사를 위해 더 낮은 표본 밀도(10m-2)를 사용했습니다. - cams 도구를 사용하여 소스 이미지를 밀집된 포인트 클라우드에 연결하고 모델에 있는 포인트에 대해 공간적으로 쿼리된 다중 이미지 뷰를 허용합니다.
참고: 캠 도구에 대한 자세한 내용은 Supplemental File 3의 섹션 4.5에서 확인할 수 있습니다. - VPI 브라우저 웹 애플릿을 사용하여 주로 소스 이미지의 여러 보기를 사용하여 직접 최고 해상도의 분류학 지정으로 각 포인트에 레이블을 지정합니다. 각 점에 대해 두 개의 선택적 보조 레이블 세트를 추가하고, 표백 응력75 및 형태학을 포함한 산호 레이블에 대한 예를 추가합니다.
참고: 기본 및 보조 레이블 세트는 *.pq 폴더에 있는 qclasses.json 파일을 편집하여 수정할 수 있습니다. - 웹 애플릿을 사용하여 각 레이블에 대한 백분율 커버의 요약을 .csv 파일로 내보냅니다.
- VPI(Virtual Point Intercept) 도구를 사용하여 밀집된 포인트 클라우드에 10m x 10m 상자를 만들고 최대 치수를 10m(쿼드 디밍: 10.0m)로 설정하고 종횡비를 1(쿼드 종횡비: 1.000)으로 설정하여 데이터 추출을 위한 대상 100m2 영역을 지정합니다.
- 밀도 조사
- 3.2.3단계에 따라 이미지가 소프트웨어에 이미 연결되어 있는지 확인합니다. 투시 뷰의 초점 거리를 100mm로 변경하고 모형의 하향식 전체 뷰로 축소하여 밀집된 포인트 클라우드의 의사 맵 뷰를 설정합니다. Supplemental File 6의 Quadrat 샘플링 파일을 사용하여 c1 셀에 대한 eval을 클릭하여 웹 애플릿을 사용하여 보기를 캡처한 다음 grab 버튼을 선택합니다.
참고: 자세한 내용은 보충 파일 3의 섹션 8.0에서 확인할 수 있습니다. - 캠을 켠 다음, Quadrat 샘플링 스크립트에서 C2 및 C3 셀에 대한 eval을 클릭하여 Quadrat 샘플링 워크플로우 내에서 이미지를 연결합니다.
- 대상 100m2 데이터 추출 영역을 지정하기 위해 3.1.1단계에 따라 루고 상자가 이미 만들어졌는지 확인합니다. 웹 애플릿에서 c4 prep cells 섹션을 평가하여 100 1m2 사각형을 샘플링합니다.
- Quadrat Sampling 웹 주소에서 소스 이미지를 사용하여 Quadrat을 검색하고 대상 유기체에 레이블을 지정합니다. 위치를 마우스 왼쪽 버튼으로 두 번 클릭하여 샘플링 위치를 다시 지정합니다. taxonomic 버튼을 클릭하여 대상 지점을 샘플로 지정합니다. 마크 포인트를 제거하려면 해당 포인트를 마우스 왼쪽 버튼으로 두 번 클릭하고 NOTHING을 선택합니다.
참고: Quadrats는 미리 결정된 무작위 순서로 표시되므로 밀도 조사를 위해 Quadrats의 하위 집합을 무작위로 샘플링할 수 있습니다. - *aux/recruits/test1 아래에 있는 모든 샘플링 파일을 단일 디렉토리로 컴파일하고 사이트 이름을 포함하도록 각 파일의 이름을 바꿉니다. 단추 조회 파일(추가 파일 7)을 샘플링 파일과 동일한 디렉터리에 추가합니다. 보충 파일 8의 스크립트를 실행하고, 인라인 지침에 따라 샘플 데이터를 사이트 및 분류 그룹별 밀도로 집계합니다.
참고: 여기에서 우리는 고착성 무척추동물을 샘플링하지만 동일한 도구를 사용하여 어린 산호 및 성인 산호 밀도를 포함한 다양한 유기체를 조사할 수 있습니다.
- 3.2.3단계에 따라 이미지가 소프트웨어에 이미 연결되어 있는지 확인합니다. 투시 뷰의 초점 거리를 100mm로 변경하고 모형의 하향식 전체 뷰로 축소하여 밀집된 포인트 클라우드의 의사 맵 뷰를 설정합니다. Supplemental File 6의 Quadrat 샘플링 파일을 사용하여 c1 셀에 대한 eval을 클릭하여 웹 애플릿을 사용하여 보기를 캡처한 다음 grab 버튼을 선택합니다.
- 인구 통계학
- 군집 분할을 위한 orthoprojection 파일을 분할 분석 소프트웨어( Table of Materials(재료 표 참조)80)에서 로드합니다. 여러 시점에 대해 공동 등록된 orthoprojection 파일을 동일한 프로젝트 파일 내의 새 맵 으로 로드하여 시간에 따른 군집의 크기를 분할하고 추적할 수 있습니다.
- 보충 파일 3의 섹션 17.1에 있는 iView용 웹 애플릿을 통해 원본 이미지를 사용하면서 분류학 및 경계 식별을 위한 참조로 식민지를 분할합니다. 3.2.3단계에 따라 이미지가 시각화 소프트웨어에 이미 연결되어 있는지 확인합니다. 초점 콜로니에 대한 밀집된 포인트 클라우드에 마커를 배치하고 다양한 투시 뷰에 대한 마커 위치에 대한 소스 이미지를 스크롤합니다.
- positive/negative clicks 주석 도구를 사용하여 개별 산호 군락을 분류합니다. 클릭 기반 또는 수동 경계 조정을 사용하여 경계를 수정합니다.
4. 데이터 큐레이션
참고: 보관 노력은 모든 후속 파생 제품을 재현할 수 있으므로 원본 이미지의 보존을 우선시해야 합니다. 특정 사용자가 사용할 수 있는 저장소는 다양하지만, 더 광범위한 커뮤니티에서 사용할 수 있게 될 때 유용성을 극대화하기 위해 소스 이미지 데이터 세트에 포함된 관련 설문 조사 메타데이터를 표준화하기 위해 노력해야 합니다.
- 데이터 저장소
- 대상 영역, 카메라 시스템, 지상 제어 표식기 및 수집 패턴과 같은 측량 세부 정보가 포함된 방법 설명 파일을 생성합니다. 이 프로토콜에 대한 예제 설명은 Supplemental File 9 를 참조하십시오.
- 사이트 이름, 수집 날짜, GPS 좌표, 플롯 방위, 지면 제어 깊이 및 축척 데이터, 지정된 측량에 사용된 수집 패턴 및 카메라 시스템과 같은 필드를 포함하여 이미지 데이터셋에 특정한 측량 메타데이터 파일을 생성합니다.
참고: 설문조사 중에 더 넓은 지리적 맥락과 조건을 포함하는 추가 필드를 적극 권장합니다. 권장 필드가 있는 예제 메타데이터 파일은 추가 파일 10에서 찾을 수 있습니다. - 설명 파일, 메타데이터 파일 및 이미지 파일을 단일 zip 아카이브로 결합하여 선택한 데이터 저장소로 수집합니다.
참고: 이미지 데이터 모음은 https://doi.org/10.6075/J0DV1HDR 에서 사용할 수 있습니다.
결과
현장에서 넓은 영역의 이미지를 성공적으로 수집하면 조사 영역의 전체 하향식 적용 범위를 가진 조밀한 포인트 클라우드 재구성이 생성되어야 하며, 커버리지의 중복성이 부적절하면 포인트 클라우드의 갭 또는 완전한 저하가 발생할 수 있습니다(그림 4). 2016년 하와이 군도 전역에서 실시된 43개의 대형 이미지 조사에서 데이터 세트당 평균 99.6%의 이미지가 정렬되었으며, 이미지 세트의 66%에서 이미지가 100% 성공적으로 정렬되었습니다. 광각 렌즈 카메라에서 수집된 이미지는 평균 GSD가 0.52mm px-1 인 반면 줌 렌즈 카메라의 이미지는 평균 GSD가 0.18mm px-1이었습니다. 이러한 설문 조사는 평균 5억 5,770만 포인트(15GB) 크기의 조밀한 포인트 클라우드를 생성했습니다.
여기에 설명된 생태학적 워크플로우는 산호초 모니터링을 위한 기존 방법론과 유사한 데이터를 생성하도록 설계되었습니다78. 하와이 전역의 LAI 조사에서 추출한 생태학적 데이터는 몇 가지 이상치를 제외하고는 구조적 복잡성 워크플로우에서 비롯된 선형 견고성의 측정값을 보여주며, 이는 현장 전체의 복잡성 측정값과 비교하여 상대적 값과 잘 일치합니다81(그림 5A, B). 주요 저서 작용 그룹의 적용 비율을 측정하기 위한 LAI의 추가 군집 구성 분석은 전통적인 photoquadrat 조사82와 유사한 정렬을 보여줍니다(그림 5C, D). 여기서 Quadrat 샘플링은 고착 무척추 동물의 밀도를 측정하는 데 사용되었으며, 가장 흔한 것은 성게이며, 이는 상대적 풍부도의 범주 형 측정으로 요약되었습니다. LAI 방법은 현장 방법81 (그림 5E, F)에 비해 정기적으로 더 높은 수준의 풍부도를 기록했는데, 이는 신속한 시각적 인구 조사에 비해 주어진 지역 내의 모든 개인을 종합적으로 검색하고 조사할 수 있는 능력 때문일 수 있습니다. 2D orthoprojection을 사용하여 산호 군체를 분할하면 일반적인 산호 분류군의 크기 분포가 in situ 방법83과 유사한 것으로 나타났습니다(그림 5G,H).
LAI 조사의 주요 장점은 밀집된 포인트 클라우드의 공동 정합을 통해 시간에 따른 산호초 지역의 변화를 보관하고 추적할 수 있다는 것입니다. 산호초는 살아있는 기질이며, 이는 LAI 조사의 경우 서로 다른 시점의 조밀한 포인트 클라우드를 안정적으로 공동 정합하는 데 사용할 수 있는 자연 또는 설치의 영구적인 표면을 식별하는 것이 어려울 수 있음을 의미합니다. Millennium Atoll의 예(그림 6)는 높은 성장과 구조적 손실이 모두 있는 예를 보여주며, 시간이 지남에 따라 산호초 표면의 안정성이 거의 또는 전혀 없음에도 불구하고 조밀한 포인트 클라우드 공동 정합에 보조 공동 정합 워크플로우가 사용되었습니다.
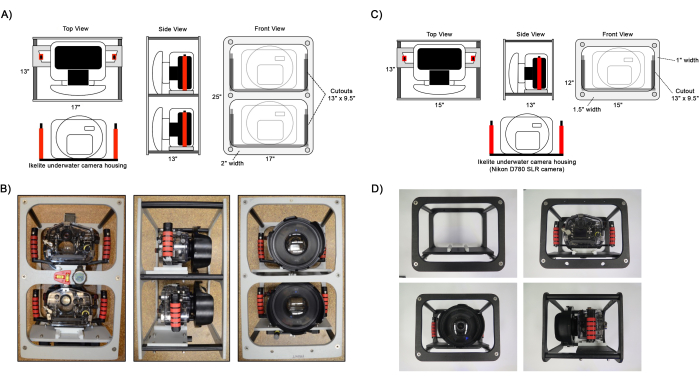
그림 1: 조립된 카메라 프레임의 다이어그램. (A,B) 듀얼 및 (C,D) 단일 카메라 프레임 설정의 예시 보기. Ikelite 카메라 하우징은 하우징 핸들에 부착된 슬라이더 플레이트를 사용하여 카메라 장착 패널의 프레임에 부착됩니다. 레벨, 나침반 및 다이빙 컴퓨터와 같은 탐색을 돕기 위한 옵션 도구는 B와 같이 프레임에 부착할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 100m2 대형 이미지 플롯 설정 다이어그램. 완전히 설정된 대면적 이미지 플롯의 개략도: 100m2 면적. 임시 플롯 표식기에는 6개의 경계 타일 표식기, 4개의 축척 막대 및 4개의 참조 부동 소수점이 포함됩니다. 영구 플롯 마커에는 잠금 너트를 포함하여 육지를 볼 때 왼쪽 말뚝이 있는 두 개의 스테인리스 스틸 말뚝이 포함됩니다. 플롯에 대한 GPS 참조는 왼쪽 중앙 타일 또는 말뚝 위에 있어야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
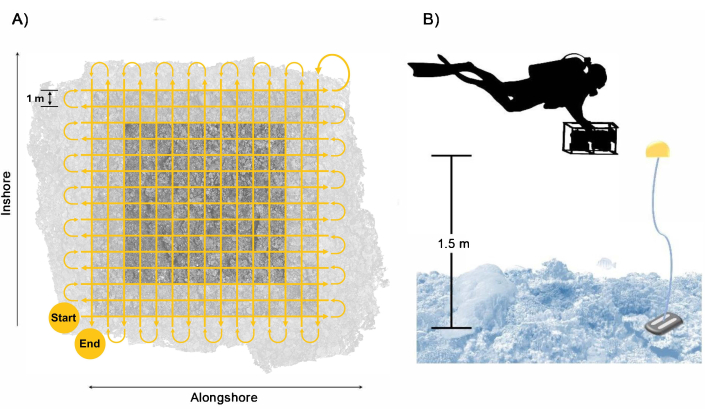
그림 3: 다이버 수집 패턴. (A) 버퍼가 포함된 플롯 영역의 충분한 커버리지와 겹침을 보장하기 위한 다이버의 수영 경로 및 (B) 수영 높이에 대한 가이드를 제공하는 기준 플로트가 있는 카메라 시스템과 다이버의 배치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 이미지 겹침 감소. 중첩되는 이미지의 수에 따른 밀집된 포인트 클라우드의 저하가 무작위 샘플링을 통해 감소합니다. 각 패널에는 원본 이미지의 (A) 모든 이미지, (B) 1/2, (C) 1/3, (D) 1/5 및 (E) 1/10에서 생성된 밀집된 포인트 클라우드가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 생태학적 데이터 추출. 각 생태학적 워크플로우에 대한 대면적 이미징에서 추출된 후보 데이터는 확립된 현장 데이터 수집 방법과 비교하여 표시됩니다. 여기에는 (A,B) 구조적 복잡성, (C,D) 군집 구성(오차 막대는 표준 오류를 나타냄), (E,F) 무척추 동물 밀도 및 (G,H) 크기 구조 인구 통계가 포함됩니다. 약어: LAI = large-area imaging. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 밀집된 포인트 클라우드 정합. 시간적으로 공맞춰진 두 개의 밀집된 포인트 클라우드의 시각적 비교 예제입니다. 너울로 인한 손상으로 인한 구조적 손실 영역은 자홍색 화살표로 표시된 것처럼 시각적으로 빨간색으로 코드화되어 있습니다. 일반적으로 산호 군체의 성장에 기인하는 구조적 추가 영역은 노란색 화살표로 표시된 것처럼 시각적으로 파란색으로 코드화되어 있습니다. 여기에 설명된 공동 정합 워크플로우는 여기에서 볼 수 있는 것처럼 영구적으로 설치된 지상 제어점(GCP)이 과잉 성장 또는 이탈로 인해 신뢰할 수 없는 역동적인 암초 지역에 계속 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 카메라 기능 | 권장 설정 |
| 초점 | 자동 |
| 촬영 모드 | P (Programmed Auto) : 광각 렌즈 |
| A(조리개 우선 모드), 매크로 렌즈의 경우 조리개 F8로 설정 | |
| 릴리스 모드 | S (셔터 우선) |
| 자동 초점 설정 | 자동 초점 중심(AF-C), 단일 중앙 포인트(S) |
| ISO 감도 자동 제어 | 에 |
| 최대 ISO 감도 | 3200 |
| 최소 셔터 속도 | 1/320 |
| 이미지 품질 | 원시 + JPEG |
| 인터벌 타이머 | 1들 |
| 화이트 밸런스 | 관습 |
표 1: 권장 카메라 설정. 다음은 이미지 품질을 최적화하는 데 사용되는 주요 카메라 설정 목록입니다. 이러한 설정은 수중 조명 조건에서 움직이는 작업자가 캡처한 초점이 맞는 이미지를 캡처하는 데 우선 순위를 둡니다.
| 사진 정렬 | |
| 정밀 | 높다 |
| 일반 사전 선택 | 아니요 |
| 키 포인트 제한 | 5000 |
| 타이 포인트 제한 | 0 |
| 가이드 이미지 매칭 | 아니요 |
| 적응형 카메라 모델 피팅 | 예 |
| Dense Cloud 구축 | |
| 질 | 높다 |
| 깊이 필터링 | 심하지 않음 |
| 포인트 색상 계산 | 예 |
| 포인트 신뢰도 계산 | 예 |
| 포인트 내보내기 | |
| 파일 형식 | 스탠포드 플라이 |
| 좌표계 | 로컬 좌표 (m) |
| 소스 데이터 | 짙은 구름 |
| 포인트 색상 저장 | 예 |
| 세이브 포인트 노멀 | 예 |
| 포인트 신뢰도 확보 | 예 |
| 세이브 포인트 클래스 | 아니요 |
| 색상을 8비트 RGB로 변환 | 예 |
| 바이너리 인코딩 | 예 |
표 2: 3D 밀집 포인트 클라우드 구성 설정. Agisoft Metashape 에서 고품질의 밀집된 포인트 클라우드 재구성을 만들고 내보내는 데 사용되는 설정 목록입니다.
보충 파일 1: 로드맵. 재조사할 플롯 영역을 찾는 데 도움이 되도록 플롯 기능과 깊이로 표시된 정사모자이크 이미지의 예. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: Extract_meta.py. Agisoft Metashape 에서 스크립트를 실행하여 Viscore 에서 사용할 카메라 포즈 및 파일 디렉토리 정보를 내보내 원본 이미지를 쿼리합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: Viscore 가이드. Viscore용 소프트웨어 가이드에는 모델 시각화, 공동 정합 및 생태 분석을 위한 워크플로우가 포함되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4: Rugosity_Functions.Rmd. Viscore에서 추출한 rugosity 데이터를 처리하는 함수를 포함하는 R에서 사용되는 스크립트 입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 5: Rugosity_Analysis.Rmd. rugosity 메트릭을 계산하기 위해 R에서 사용되는 스크립트입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 6: Quadrat_sampling.rpl.json. 사분면 밀도 분석 워크플로우를 위해 Viscore 에서 사용되는 스크립트. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 7: Density_taxo_lookup.json. 분류 그룹별로 사분면 샘플링 데이터를 집계하기 위해 사분면 샘플링 스크립트를 실행하기 위한 버튼 조회 파일입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 8: Density_Analysis.R 설문 조사 수준에서 분류 그룹별로 밀도를 계산하는 2 차 샘플링 데이터를 집계하는 R에서 사용되는 스크립트입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 9: README.txt 이미지 캡처 방법론을 설명하는 데이터 보관을 위해 원본 이미지에 포함될 예시 텍스트 파일입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 10: METADATA_KAH_2016-07_03.txt LAI 설문조사에 대한 메타데이터 필드를 포함하는 데이터 보관을 위해 원본 이미지에 포함될 예시 텍스트 파일입니다. 여기에는 참조를 위한 설문조사 축척 및 깊이 데이터 내에 대한 필드와 지리적 컨텍스트에 대한 전체 사이트 메타데이터가 포함됩니다. 약어: LAI = large-area imaging. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
대면적 이미징은 도메인 과학자가 수집된 개별 이미지보다 더 큰 규모로 환경의 특징을 디지털 방식으로 시각화하고 분석할 수 있도록 하는 도구입니다. LAI 프로토콜은 여러 관점에서 환경의 여러 이미지를 캡처함으로써 원본 이미지에서 수집된 세부 정보를 유지하면서 상대적으로 광범위한 풍경(개별 이미지의 공간 범위에 비해)을 표현하는 데 도움이 됩니다. LAI의 고유한 가치는 가장 큰 축척(조사의 면적 범위에 의해 정의됨)에서 가장 작은 축척(원본 이미지의 실현된 해상도에 의해 정의됨)에 이르기까지 규모에 걸쳐 환경 데이터를 탐색할 수 있는 능력에 있습니다. 그러나 이러한 교차 스케일의 강점을 활용하려면 캡처된 데이터의 모든 수준에 대한 정기적이고 유동적인 액세스를 보장하는 것이 중요하며, 특히 원본 이미지와 파생된 3D 모델 모두에 대한 손쉬운 액세스를 보장하는 것이 중요합니다. 여기에 제시된 프로토콜의 각 단계에서는 원본 이미지가 파생된 LAI 모델과 함께 액세스 가능하고 사용 가능하며 안전하게 보관되도록 일관되게 보장함으로써 LAI의 고유한 강점을 강조합니다.
LAI 방법은 수집된 원본 이미지에 직접 연결된 제품을 제공합니다. 이미지 획득의 세부 사항을 이동함으로써 사용자는 다양한 품질과 적용 범위의 데이터 제품을 생성할 수 있습니다. 구조적으로 복잡한 산호초 환경을 조사할 때 수중 조사 시간이 제한된 사용자(또는 캡처할 수 있는 이미지 수가 일정함)는 조사 영역의 면적 범위를 늘리거나 샘플링된 영역의 각 섹션의 세부 수준을 높이는 데 우선순위를 둘 수 있습니다. 큰 면적 모델은 단위 면적당 세부 정보가 적고(아마도 더 많은 폐색) 세부 모델이 전체 면적을 더 적게 커버하는 세부 모델(폐색이 더 적을 수 있음)과 필연적으로 절충안이 있을 것입니다. 이 프로토콜에는 각각 다른 렌즈를 장착한 두 대의 카메라를 사용하여 사용자가 더 넓은 영역(SfM 요구 사항을 충족하기에 충분한 광각 렌즈와 충분한 오버랩)을 샘플링하는 동시에 더 상세한 원본 이미지(사진 간 겹침이 적은 줌 렌즈의 더 높은 디테일)를 수집할 수 있습니다. 두 카메라의 이미지에 대한 포즈 추정을 포함함으로써 다운스트림 시각화 및 분석 프로토콜에는 샘플링된 영역의 많은 부분에서 고해상도 보기가 포함됩니다. 이 프로토콜은 조사 실행 가능성의 범위를 확장하는 것을 목표로 하지만, 사용자는 파생된 제품이 선호하는 분석 루틴을 완료하기에 충분한 면적 범위나 원본 이미지의 충분한 세부 정보가 부족하다는 것을 알게 될 수 있습니다. 사용자는 원본 이미지와 파생된 모델을 검토하여 환경 조사 프로토콜이 프로그램 요구 사항을 충족하는지 확인하고 수중 조사 접근 방식(예: 지면 샘플링 거리 이동, 조사 기간 또는 수집된 이미지 수 변경)을 수정하여 단위 면적당 면적 범위와 해상도의 바람직한 균형을 이루는 것이 좋습니다.
LAI 방법은 시간 효율적일 수 있고 수집을 위해 제한된 도메인별 전문 지식이 필요할 수 있는 저서 환경에 대한 정보가 풍부하고 광범위한 '스냅샷'을 캡처하여 수중 과학에 가치를 제공합니다. 이러한 데이터 제품의 가치는 기존 데이터 스트림뿐만 아니라 새롭고 가속화된 도메인별 응용 프로그램과 관련하여 고려할 수 있습니다. 기존 데이터 스트림과의 비교를 고려할 때, LAI의 분석 제품은 수중 관측자가 현장에서 수집한 데이터와 직접 비교할 수 있는 생태 데이터를 제공할 수 있습니다 84,85,86,87. 우리는 이 프로토콜에 따라 각각, 고전적인 현장 모니터링 활동 및 LAI 제품의 표준화된 분석에서 파생된 생태 데이터 출력에 대한 정량적 분석을 제공합니다. 산호초 모니터링 노력의 네 가지 공통 지표(구조적 복잡성, 저서 군집 구성, 이동성 무척추 동물의 밀도, 산호 크기 구조; 그림 5)에서 우리는 데이터 출력에서 강력한 정량적 일치를 보여줍니다. 특히, 정밀한 관찰(예: 분류학적 식별, 생물학적 경계에 대한 정확한 정의)이 필요한 데이터 스트림의 경우, 원본 이미지에 대한 정기적이고 신뢰할 수 있는 액세스를 포함하는 LAI 워크플로는 역사적으로 몰입형 현장 샘플링으로만 제한되었던 관찰 기회를 병행할 수 있는 고유한 강점을 제공합니다. Viscore가 제공하고 이 프로토콜에 설명된 데이터 처리 및 시각화의 발전은 LAI에서 파생된 생태 데이터 및 현장 모니터링 제품의 비교 가능성을 보장하는 데 고유한 가치를 제공하며, LAI의 디지털 방식으로 향상된 워크플로우를 통합하여 장기 데이터 스트림을 편견 없이 유지 관리할 수 있습니다.
수중 과학자들에게 LAI는 데이터 수집 및 탐사에서 새롭고 가속화된 워크플로우를 활용할 수 있는 기회를 제공합니다. LAI는 저서 환경의 상대적 구성뿐만 아니라 공간적 특성을 설명하는 정보를 포함하는 고해상도 매핑 도구로서 고유한 강점을 가지고 있습니다. SfM 워크플로우에서 3D 모델을 생성하는 데 명시적인 LAI 제품에는 여러 규모56에서 탐색할 수 있는 구조적 복잡성에 대한 정보가 포함되어 있습니다. 더 넓은 지역의 바다 경관을 포착하는 도구로서 LAI 제품은 저서 생물에 대한 공간 분포 패턴과 이웃 특성을 고려할 수 있는 기회를 제공할 수 있습니다45,66. 더욱이, 저서 지형을 더 큰 규모로 시각화할 수 있게 됨으로써, 예를 들어 태평양 산호초64에 있는 일반적인 거대 조류의 대규모(3-4m) 다각형 패턴과 같이 수중에서 장거리 가시성의 한계로 인해 수중 서식지에서 쉽게 볼 수 없는 특징을 감지할 수 있게 되었습니다.
LAI는 대규모 분석을 위한 기회를 제공하지만, 효율적인 수중 수집 및 이미지 후처리와 관련된 문제에 대한 우려가 표명되었습니다. 수중에서 이미지 획득의 공간적 범위를 확장하려면 다이버 배치 이미징에서 보조 매핑 시스템(88)의 활용, 궁극적으로 ROV(38) 및 AUV(67,89)의 사용에 대한 기술 발전이 요구됩니다. 획득 패턴 및 카메라 시스템과 관련된 강력한 설문 조사 방법론은 이러한 다양한 플랫폼에서 생성된 데이터의 원활한 전환과 일관성을 보장합니다. LAI 제품의 대용량 데이터 형식뿐만 아니라 계산 수요를 감안할 때, 일부 해양 과학자들은 워크플로우 90의 기술적 접근성과 생태 데이터 추출84,86과 관련된 많은 시간 요구에 대한 우려를 표명했다. 그러나 데이터 추출의 기술적 장애물에 대한 창의적인 솔루션을 활용하는 도구의 수가 점점 더 많아지고 있습니다 80,91,92,93. 중요한 것은 LAI 분석에서 AI 강화 워크플로우의 사용은 제공된 입력 신호의 품질에 의해 제한된다는 것입니다. 따라서 데이터 추출이 인간 관찰자에 의해 수행되는지, 훈련된 AI 알고리즘에 의해 수행되는지, 아니면 (이상적으로) AI 가속 인간 참여형 워크플로우에 의해 수행되는지에 관계없이 LAI 프로토콜에서 이미지 획득 및 데이터 관리의 표준과 품질을 유지하는 데 대한 일관된 요구가 남아 있습니다. 여기에 설명된 바와 같이 LAI 프로토콜에서 원본 이미지의 주요 중요성에 지속적으로 초점을 맞춤으로써, 수중 서식지를 강력하고 투명하며 일관되게 탐사할 수 있는 고유한 기회가 생깁니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 작업은 스크립스 해양학 연구소(Scripps Institution of Oceanography)의 100개 섬 챌린지(100 Island Challenge)의 노력에 의해 지원됩니다. Schmidt Marine Technology Partners, Ed Scripps와 Christy Scripps, Moore Family Foundation은 방법론을 개선하는 데 도움이 된 관련 연구 및 대면적 이미징 교육 노력에 대한 재정적 지원을 해준 것에 대해 감사드립니다. 또한, 현장 활동을 지원해 주신 연구선 Hi'ialiki, Hanse Explorer, Plan B의 승무원들에게도 감사드립니다. 특히 여기에 제시된 데이터의 현장 수집을 지원한 NOAA의 태평양 제도 수산 과학 센터의 생태계 과학 부서 팀에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1" x 4 1/4" x 3 1/4" custom machined acetal | N/A | N/A | 1.1 Gear Preparation; For contruction of camera slides and mounts |
| 1/2" marine grade high density polyethylene | King Starboard | N/A | 1.1 Gear Preparation; For contruction of camera outer frame and camera mounting panels |
| 18-8 Flathead Stainless Steel Phillips Flat Head Screws, 3/8”-16 Thread Size, 1-1/2” Long | McMaster-Carr | 91771A628 | 1.1 Gear Preparation; For camera frame assembly |
| 18-8 Stainless Steel Socket Head Screw, 10-24 Thread Size, 1-1/8" Long | McMaster-Carr | 92196A248 | 1.1 Gear Preparation; Used to secure mounting plate to handles |
| 1 lb dive weights | House of Scuba | WBELT24 1LB | 1.2 Plot Setup; Used for reference floats |
| 200DL Underwater Housing for Nikon D780 DSLR Camera | Ikelite | 71019 | 1.1 Gear Preparation; Underwater housing for digital camera |
| 24mm fixed lens (AF-S NIKKOR 24mm f/1.8G ED) | Nikkor | 20057 | 1.1 Gear Preparation; Wide-angle lens for greater image overlap |
| 250# gray longline poly soft | Continental Western | 503086 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 3 lb drilling hammer | Estwing | B3-3LB | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| 3/8-16 X 18" THRD ROD W/60 DEGREE POINT 316 S/S | Ababa Bolt | 37C1800ROD6/60DEG | 1.2 Plot Setup; For permanent installation to mark survey site |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 1/4"-20 Thread Size | McMaster-Carr | 90715a125 | 1.2 Plot Setup; For scale bars and frame assembly. |
| 316 Stainless Steel Nylon-Insert Locknut Super-Corrosion-Resistant, 3/8"-16 Thread Size | McMaster-Carr | 90715A145 | 1.2 Plot Setup; Affixed to left stainless steel stake for orientation of the plot |
| 316 Stainless Steel Phillips Flat Head Screws, 10-32 Thread Size, 3/8" Long | McMaster-Carr | 91500a827 | 1.1 Gear Preparation; For camera frame assembly |
| 4"x4" Agisoft marker printed on waterproof paper | Agisoft | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x1/4" Stainless steel tile | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| 4"x4"x3/4" custom printed plastic agisoft marker high density polyethylene color core | N/A | N/A | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| 512 GB Extreme PRO SDXC UHS-I Card - C10, U3, V30, 4K UHD, SD Card | SanDisk | SDSDXXY-512G-GN4IN | 1.1 Gear Preparation; High speed, large capacity storage card. Up to 2 used per camera for image storage |
| 5TB Elements Portable External Hard Drive HDD, USB 3.0 | Western Digital | WDBU6Y0050BBK-WESN | 1.3 Image Capture; Large volume external hard drive for image storage and image backup |
| 60 mm fixed lens (AF-S Micro NIKKOR 60mm F2.8G ED) | Nikkor | 2177 | 1.1 Gear Preparation; Macro zoom lens, optional for dual-camera setup |
| Acetal machined and tapped for 1"x12" 3/8" 16 thread support braces | N/A | N/A | 1.1 Gear Preparation; Camera frame support columns |
| AquaMend Epoxy Putty Stick | JD Industrial Supply | 470550 | 1.2 Plot Setup; Used to install stainless steel stakes at survey site |
| Architectural 6063 Aluminum U-Channel, 1/8" Wall Thickness, 1/2" High x 3/4" Wide Outside | McMaster-Carr | 9001k46 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 1/2" Long | McMaster-Carr | 91249a537 | 1.1 Gear Preparation; To attach ikelite handle to housing |
| Black-Oxide 18-8 Stainless Steel Pan Head Phillips Screws, 1/4"-20 Thread, 5/8" Long | McMaster-Carr | 91249A539 | 1.2 Plot Setup; To build scale bars. Ground control markers for determining model scale |
| Blue Steel Rope | Continental Western | 402020 | 1.2 Plot Setup; Used to secure dive float to the benthos during surveys |
| D780 camera body | Nikon | 1618 | 1.1 Gear Preparation; Camera body model |
| DGX Tech Compass w/Bungee Mount and Cord | Dive Gear Express | DX-9050x | 1.2 Plot Setup; For collection of plot bearings and as an addition to the camera frame as a navigational aid |
| Dive computer - Suunto Zoop Novo | Suunto | N/A | 1.2 Plot Setup; To record depth at reference tiles |
| Dive slate | TexWipe | TX5835 | 1.2 Plot Setup; Used to record plot metadata such as tile depth, and coded target numbers |
| DL 8 inch Dome Port | Ikelite | 75340 | 1.1 Gear Preparation; Dome port for underwater housing |
| FLOAT, PVC SPONGE, 5-3/4" DIA. BY 3/4", RUST | Memphis Net & Twine | SB1 | 1.2 Plot Setup; Used as a visual reference to determine plot boundaries and swim height of camera operator |
| Garmin 78s GPS | Garmin | 010-00864-01 | 1.2 Plot Setup; Used to record location of survey site |
| High performance computer | N/A | N/A | 2.0 Model Construction; For 3D dense point cloud processing, recommended specifications to include a high speed 10+ core CPU, 128GB RAM (64 GB minimum), 1TB solid state drive, and a dedicated NVIDIA or AMD GPU. |
| Inflatable surface dive float | Omer | Atol 6246 | 1.2 Plot Setup; Dual purpose surface marker buoy and |
| JOHNSON Cross Check Level: Nonmagnetic, 2 1/4 in x 1 7/16 in x 3/16 in, Plastic, Hanging Hole, 1mm/m | Grainger | 6C225 | 1.1 Gear Preparation; Optional addition to the camera frame as a navigational aid |
| Long Tape Measure,1/2 In x 30m,Pumpkin | Grainger | 3LJW9 | 1.2 Plot Setup; Used to set up plot area |
| Manta reel SR. Reel | Manta Industries | N/A | 1.2 Plot Setup; Attached to dive float for use during surveys |
| Metashape Professional License | Agisoft | N/A | 2.0 Model Construction; Software for dense point cloud processing |
| Non-glare clear acrylic | N/A | N/A | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| O-Ring 0132.45 for DL Port System, ULTRAcompact Housings | Ikelite | 132.45 | 1.1 Gear Preparation; O-ring for underwater housing |
| O-Ring 0132.59 for DSLR & Mirrorless Housings (Type 1) | Ikelite | 132.59 | 1.1 Gear Preparation; O-ring for underwater housing |
| Paracord or Dacron Line | N/A | N/A | 1.2 Plot Setup; Used to attach referene floats to dive weights |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1" Long | McMaster-Carr | 91771a542 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 1/4"-20 Thread, 1-3/4" Long | McMaster-Carr | 91771a548 | 1.1 Gear Preparation; Frame slider panel |
| Passivated 18-8 Stainless Steel Phillips Flat Head Screw, 82 Degree Countersink, 10-32 Thread, 3/8" Long | McMaster-Carr | 91771A827 | 1.2 Plot Setup; To build corner tiles. Ground control markers for determining model orientation |
| Pelican 1060 micro case | Pelican | 1060-025-100 | 1.2 Plot Setup; Housing for GPS unit that is affixed to the inflatable dive float |
| Plastic-Head Thumb screw 1/4"-20 x 2" | McMaster-Carr | 91185A819 | 1.1 Gear Preparation; Use to secure camera housing to frame |
| Right Hand Quick Release Handle with Extension | Ikelite | 4077.02 | 1.1 Gear Preparation; Handle for underwater housing |
| R | N/A | N/A | 3.0 Ecological Analysis; Software for running structural complexity scripts |
| Taglab | N/A | N/A | 3.0 Ecological Analysis; Software for segmentation analysis |
| Trigger Extension v2 for Shutter or Back Button Focus | Ikelite | 4077.95 | 1.1 Gear Preparation; Trigger extenstion for underwater housing shutter button control |
| Vacuum pump with gauge | Ikelite | 47011 | 1.1 Gear Preparation; To test integrity of o-ring seals for underwater camera housings |
| Viscore | N/A | N/A | 2.0 Model Construction; 3.0 Ecological Analysis; Software for ecological analysis |
참고문헌
- Hubbell, S. P., Foster, R. B. Short-term dynamics of a neotropical forest: Why ecological research matters to tropical conservation and management. Oikos. 63, 48-61 (1992).
- Fahey, T. J., et al. The promise and peril of intensive-site-based ecological research: Insights from the Hubbard Brook ecosystem study. Ecology. 96 (4), 885-901 (2015).
- Condit, R., et al. Spatial patterns in the distribution of tropical tree species. Science. 288 (5470), 1414-1418 (2000).
- Lieberman, D., Lieberman, M., Peralta, R., Hartshorn, G. Mortality patterns and stand turnover rates in a wet tropical forest in Costa Rica. J Ecol. 73 (3), 915-924 (1985).
- Hubbell, S. P. Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science. 203 (4387), 1299-1309 (1979).
- Connell, J. H. The consequences of variation in initial settlement vs. Post-settlement mortality in rocky intertidal communities. J Exp Mar Biol Ecol. 93 (1-2), 11-45 (1985).
- Turner, M. G. Landscape ecology: The effect of pattern on process. Annu Rev Ecol Syst. 20, 171-197 (1989).
- Rietkerk, M., Van De Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Harms, K. E., Wright, S. J., Calderón, O., Hernandez, A., Herre, E. A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature. 404 (6777), 493-495 (2000).
- Marhaver, K., Vermeij, M., Rohwer, F., Sandin, S. Janzen-connell effects in a broadcast-spawning caribbean coral: Distance-dependent survival of larvae and settlers. Ecology. 94 (1), 146-160 (2013).
- Kenyon, J. C., Maragos, J. E., Cooper, S. Characterization of coral communities at rose atoll, american samoa. Atoll Res Bull. 586, 1-28 (2010).
- Goreau, T. F. The ecology of jamaican coral reefs i. Species composition and zonation. Ecology. 40 (1), 67-90 (1959).
- Sandin, S. A., et al. Baselines and degradation of coral reefs in the northern line islands. PLoS One. 3 (2), e1548(2008).
- Newman, M. J. H., Paredes, G. A., Sala, E., Jackson, J. B. C. Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecol Lett. 9 (11), 1216-1227 (2006).
- Smith, J. E., et al. Re-evaluating the health of coral reef communities: Baselines and evidence for human impacts across the central pacific. P Roy Soc B: Biol Sci. 283 (1822), 20151985(2016).
- Lewis, J. B. Spatial distribution and pattern of some Atlantic reef corals. Nature. 227 (5263), 1158-1159 (1970).
- Bradbury, R. H., Young, P. C. The effects of a major forcing function, wave energy, on a coral reef ecosystem. Mar Ecol Prog Ser. 5, 229-241 (1981).
- Bak, R. P. M., Nieuwland, G. Long-term change in coral communities along depth gradients over leeward reefs in the Netherlands Antilles. Bull Mar Sci. 56 (2), 609-619 (1995).
- Connell, J. H., Hughes, T. P., Wallace, C. C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol Monogr. 67 (4), 461-488 (1997).
- Hughes, T. P. Population dynamics based on individual size rather than age: A general model with a reef coral example. Am Nat. 123 (6), 778-795 (1984).
- Hughes, T. P., Tanner, J. E. Recruitment failure, life histories, and long-term decline in Caribbean corals. Ecology. 81 (8), 2250-2263 (2000).
- Fong, P., Glynn, P. A dynamic size-structured population model: Does disturbance control size structure of a population of the massive coral Gardineroseris planulata in the Eastern Pacific. Mar Biol. 130 (4), 663-674 (1998).
- Vardi, T., Williams, D. E., Sandin, S. A. Population dynamics of threatened elkhorn coral in the Northern Florida Keys, USA. Endanger Species Res. 19 (2), 157-169 (2012).
- Doropoulos, C., Ward, S., Roff, G., González-Rivero, M., Mumby, P. J. Linking demographic processes of juvenile corals to benthic recovery trajectories in two common reef habitats. PLoS One. 10 (5), e0128535(2015).
- Edmunds, P. A quarter-century demographic analysis of the Caribbean coral, Orbicella annularis, and projections of population size over the next century. Limnol Oceanogr. 60 (3), 840-855 (2015).
- Deignan, L. K., Pawlik, J. R. Perilous proximity: Does the Janzen-Connell hypothesis explain the distribution of giant barrel sponges on a Florida coral reef. Coral Reefs. 34, 561-567 (2015).
- Zvuloni, A., et al. Spatio-temporal transmission patterns of black-band disease in a coral community. PLoS One. 4 (4), e4993(2009).
- Karlson, R. H., Cornell, H. V., Hughes, T. P. Aggregation influences coral species richness at multiple spatial scales. Ecology. 88 (1), 170-177 (2007).
- Jolles, A. E., Sullivan, P., Alker, A. P., Harvell, C. D. Disease transmission of aspergillosis in sea fans: Inferring process from spatial pattern. Ecology. 83 (9), 2373-2378 (2002).
- Carlon, D. B., Olson, R. R. Larval dispersal distance as an explanation for adult spatial pattern in two Caribbean reef corals. J Exp Mar Biol Ecol. 173 (2), 247-263 (1993).
- Bak, R., Termaat, R., Dekker, R. Complexity of coral interactions: Influence of time, location of interaction and epifauna. Mar Biol. 69, 215-222 (1982).
- Stimson, J. An analysis of the pattern of dispersion of the hermatypic coral Pocillopora meandrina var. Nobilis verril. Ecology. 55 (2), 445-449 (1974).
- Edwards, C., et al. Large-area imaging in tropical shallow water coral reef monitoring, research and restoration: A practical guide to survey planning, execution, and data extraction. NOAA Technical Memorandum NOS NCCOS. (313), (2023).
- Pizarro, O., Eustice, R. M., Singh, H. Large area 3-d reconstructions from underwater optical surveys. IEEE J Oceanic Eng. 34 (2), 150-169 (2009).
- Figueira, W., et al. Accuracy and precision of habitat structural complexity metrics derived from underwater photogrammetry. Remote Sens. 7 (12), 16883-16900 (2015).
- Burns, J., Delparte, D., Gates, R., Takabayashi, M. Integrating structure-from-motion photogrammetry with geospatial software as a novel technique for quantifying 3d ecological characteristics of coral reefs. PeerJ. 3, e1077(2015).
- Piazza, P., et al. Underwater photogrammetry in Antarctica: Long-term observations in benthic ecosystems and legacy data rescue. Polar Biol. 42, 1061-1079 (2019).
- Price, D. M., et al. Using 3d photogrammetry from rov video to quantify cold-water coral reef structural complexity and investigate its influence on biodiversity and community assemblage. Coral Reefs. 38, 1007-1021 (2019).
- Fallati, L., et al. Characterizing Håkon Mosby Mud Volcano (Barents Sea) cold seep systems by combining ROV-based acoustic data and underwater photogrammetry. Front Mar Sci. 10, 1269197(2023).
- Ventura, D., et al. Seagrass restoration monitoring and shallow-water benthic habitat mapping through a photogrammetry-based protocol. J Environ Manage. 304, 114262(2022).
- Combs, I. R., Studivan, M. S., Eckert, R. J., Voss, J. D. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry. PLoS One. 16 (6), e0252593(2021).
- Bongaerts, P., et al. Reefscape genomics: Leveraging advances in 3D imaging to assess fine-scale patterns of genomic variation on coral reefs. Front Mar Sci. 8, 638979(2021).
- Raoult, V., Reid-Anderson, S., Ferri, A., Williamson, J. E. How reliable is Structure from Motion (sfm) over time and between observers? A case study using coral reef bommies. Remote Sens. 9 (7), 740(2017).
- Weinberg, S. A comparison of coral reef survey methods. Bijdr Dierkd. 51 (2), 199-218 (1981).
- Edwards, C. B., et al. Large-area imaging reveals biologically driven non-random spatial patterns of corals at a remote reef. Coral Reefs. 36 (4), 1291-1305 (2017).
- Gracias, N., Santos-Victor, J. Underwater video mosaics as visual navigation maps. Comput Vis Image Und. 79 (1), 66-91 (2000).
- Lirman, D., et al. Development and application of a video-mosaic survey technology to document the status of coral reef communities. Environ Monit Assess. 125 (1-3), 59-73 (2007).
- Kodera, S. M., et al. Quantifying life history demographics of the scleractinian coral genus Pocillopora at Palmyra Atoll. Coral Reefs. 39 (4), 1091-1105 (2020).
- Ferrari, R., et al. 3D photogrammetry quantifies growth and external erosion of individual coral colonies and skeletons. Sci Rep. 7 (1), 16737(2017).
- Sandin, S. A., et al. Considering the rates of growth in two taxa of coral across Pacific Islands. Adv Mar Biol. 87 (1), 167-191 (2020).
- Ventura, D., et al. Integration of close-range underwater photogrammetry with inspection and mesh processing software: A novel approach for quantifying ecological dynamics of temperate biogenic reefs. Remote Sens Ecol Conserv. 7 (2), 169-186 (2021).
- Ferrari, R., et al. Photogrammetry as a tool to improve ecosystem restoration. Trends Ecol Evol. 36 (12), 1093-1101 (2021).
- Remmers, T., et al. Close-range underwater photogrammetry for coral reef ecology: A systematic literature review. Coral Reefs. 43 (1), 35-52 (2024).
- Marre, G., Holon, F., Luque, S., Boissery, P., Deter, J. Monitoring marine habitats with photogrammetry: A cost-effective, accurate, precise and high-resolution reconstruction method. Front Mar Sci. 6, 276(2019).
- Nocerino, E., et al. Comparison of diver-operated underwater photogrammetric systems for coral reef monitoring. Int Arch Photogramm Remote Sens Spat Inf Sci. 42 (2/W10), 143-150 (2019).
- Mccarthy, O. S., Smith, J. E., Petrovic, V., Sandin, S. A. Identifying the drivers of structural complexity on Hawaiian coral reefs. Mar Ecol Prog Ser. 702, 71-86 (2022).
- Pascoe, K. H., Fukunaga, A., Kosaki, R. K., Burns, J. H. 3D assessment of a coral reef at Lalo Atoll reveals varying responses of habitat metrics following a catastrophic hurricane. Sci Rep. 11 (1), 12050(2021).
- Torres-Pulliza, D., et al. A geometric basis for surface habitat complexity and biodiversity. Nat Ecol Evol. 4 (11), 1495-1501 (2020).
- Friedman, A., Pizarro, O., Williams, S. B., Johnson-Roberson, M. Multi-scale measures of rugosity, slope and aspect from benthic stereo image reconstructions. PloS One. 7 (12), e50440(2012).
- Hernández-Landa, R. C., Barrera-Falcon, E., Rioja-Nieto, R. Size-frequency distribution of coral assemblages in insular shallow reefs of the Mexican Caribbean using underwater photogrammetry. PeerJ. 8, e8957(2020).
- Fukunaga, A., Burns, J. H., Pascoe, K. H., Kosaki, R. K. Associations between benthic cover and habitat complexity metrics obtained from 3D reconstruction of coral reefs at different resolutions. Remote Sens. 12 (6), 1011(2020).
- Ferrari, R., et al. Quantifying multiscale habitat structural complexity: A cost-effective framework for underwater 3D modelling. Remote Sens. 8 (2), 113(2016).
- Kopecky, K. L., et al. Quantifying the loss of coral from a bleaching event using underwater photogrammetry and ai-assisted image segmentation. Remote Sens. 15 (16), 4077(2023).
- Sandin, S. A., et al. Evidence of biological self-organization in spatial patterns of a common tropical alga. Am Nat. 200 (5), 722-729 (2022).
- Burns, J. H. R., Alexandrov, T., Ovchinnikova, K., Gates, R. D., Takabayashi, M. Data for spatial analysis of growth anomaly lesions on Montipora capitata coral colonies using 3D reconstruction techniques. Data Br. 9, 460-462 (2016).
- Pedersen, N. E., et al. The influence of habitat and adults on the spatial distribution of juvenile corals. Ecography. 42, 1-11 (2019).
- Ferrari, R., et al. Quantifying the response of structural complexity and community composition to environmental change in marine communities. Glob Chang Biol. 22 (5), 1965-1975 (2016).
- Cresswell, A. K., et al. Structure-from-motion reveals coral growth is influenced by colony size and wave energy on the reef slope at Ningaloo Reef, Western Australia. J Exp Mar Biol Ecol. 530, 151438(2020).
- Lange, I. D., Perry, C. T. A quick, easy and non-invasive method to quantify coral growth rates using photogrammetry and 3D model comparisons. Methods Ecol Evol. 11 (6), 714-726 (2020).
- George, E. E., et al. Space-filling and benthic competition on coral reefs. PeerJ. 9, e11213(2021).
- Sarribouette, L., Pedersen, N. E., Edwards, C. B., Sandin, S. A. Post-settlement demographics of reef building corals suggest prolonged recruitment bottlenecks. Oecologia. 199 (2), 387-396 (2022).
- Lyons, M. B., et al. Mapping the world's coral reefs using a global multiscale earth observation framework. Remote Sens Ecol Conserv. 6 (4), 557-568 (2020).
- Ventura, D., et al. Coastal benthic habitat mapping and monitoring by integrating aerial and water surface low-cost drones. Front Mar Sci. 9, 1096594(2023).
- Castellanos-Galindo, G. A., Casella, E., Mejía-Rentería, J. C., Rovere, A. Habitat mapping of remote coasts: Evaluating the usefulness of lightweight unmanned aerial vehicles for conservation and monitoring. Biol Conserv. 239, 108282(2019).
- Fox, M. D., et al. Limited coral mortality following acute thermal stress and widespread bleaching on palmyra atoll, central pacific. Coral Reefs. 38, 701-712 (2019).
- Charendoff, J. A., et al. Variability in composition of parrotfish bite scars across space and over time on a central pacific atoll. Coral Reefs. 42 (4), 905-918 (2023).
- Petrovic, V., Vanoni, D. J., Richter, A. M., Levy, T. E., Kuester, F. Visualizing high resolution three-dimensional and two-dimensional data of cultural heritage sites. Mediterr Archaeol Ar. 20 (10), 93-100 (2014).
- Noaa Coral Program. National coral reef monitoring plan. NOAA Coral Reef Conservation Program. , (2021).
- Goergen, E. A., et al. Coral reef restoration monitoring guide: Methods to evaluate restoration success from local to ecosystem scales. NOAA Technical Memorandum NOS NCCOS. 279, (2020).
- Pavoni, G., et al. Taglab: Ai-assisted annotation for the fast and accurate semantic segmentation of coral reef orthoimages. J Field Robot. 39 (3), 246-262 (2022).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National coral reef monitoring program: Benthic complexity and urchin abundance at climate stations of the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2016).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Benthic percent cover derived from analysis of benthic images collected for climate stations across the hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2021).
- Coral Reef Ecosystem Program Pacific Islands Fisheries Science Center. National Coral Reef monitoring program: Stratified random surveys (strs) of coral demography (adult and juvenile corals) across the Hawaiian archipelago since 2013. , NOAA's National Center for Environmental Information. (2022).
- Couch, C. S., et al. Comparing coral colony surveys from in-water observations and structure-from-motion imagery shows low methodological bias. Front Mar Sci. 8, 647943(2021).
- Barrera-Falcon, E., Rioja-Nieto, R., Hernández-Landa, R. C., Torres-Irineo, E. Comparison of standard Caribbean coral reef monitoring protocols and underwater digital photogrammetry to characterize hard coral species composition, abundance and cover. Front Mar Sci. 8, 722569(2021).
- Carneiro, I. M., et al. Precision and accuracy of common coral reef sampling protocols revisited with photogrammetry. Mar Environ Res. 194, 106304(2024).
- Curtis, J. S., Galvan, J. W., Primo, A., Osenberg, C. W., Stier, A. C. 3D photogrammetry improves measurement of growth and biodiversity patterns in branching corals. Coral Reefs. 42 (3), 623-627 (2023).
- Menna, F., Battisti, R., Nocerino, E., Remondino, F. Frog: A portable underwater mobile mapping system. Int Arch Photogramm Remote Sens Spat Inf Sci. 48, 295-302 (2023).
- Zhang, Y., Wang, Q., Shen, Y., He, B. An online path planning algorithm for autonomous marine geomorphological surveys based on AUV. Eng Appl Artif Intel. 118, 105548(2023).
- Mccarthy, O. S., et al. Closing the gap between existing large-area imaging research and marine conservation needs. Conserv Biol. 38 (1), e14145(2024).
- Pierce, J., Butler Iv, M. J., Rzhanov, Y., Lowell, K., Dijkstra, J. A. Classifying 3-D models of coral reefs using structure-from-motion and multi-view semantic segmentation. Front Mar Sci. 8, 706674(2021).
- Runyan, H., et al. Automated 2D, 2.5 D, and 3D segmentation of coral reef pointclouds and orthoprojections. Front Robot AI. 9, 884317(2022).
- Pavoni, G., Corsini, M., Pedersen, N., Petrovic, V., Cignoni, P. Challenges in the deep learning-based semantic segmentation of benthic communities from ortho-images. Appl Geomat. 13 (1), 131-146 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유