需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
Cell-free 斑点印迹作为一种实用且适应性强的免疫测定平台,用于检测人和动物血清中的抗体反应
摘要
我们描述了一种最近开发的免疫测定平台,该平台基于无细胞合成生物学原理和斑点印迹技术,用于可定制检测人和动物血清中的抗体反应。
摘要
过去二十年中一连串的全球致病性疫情凸显了血清监测策略的重要性。用于检测患者血清中疾病特异性抗体的免疫检测平台是血清监测的核心。常见示例包括酶联免疫吸附测定和侧向层析测定;然而,虽然这些是金标准方法,但它们需要病原体特异性消耗品和专用设备,这限制了它们在资源充足的实验室之外的使用。
我们最近开发了一种称为无细胞斑点印迹 (CFDB) 的新型免疫测定平台,并使用人类和动物血清对 SARS-CoV-2 进行了验证。与传统免疫检测不同,CFDB 患者血清样品被固定在固相(硝酸纤维素膜)上,而靶抗原悬浮在检测的流动相中。为了提高血清监测能力,CFDB 抗原是按需生产的,并且使用 体外 蛋白表达的低负担基础设施。在这里,抗原与肽标签融合,对于任何 CFDB 检测,可以使用单个通用报告蛋白进行检测。结果是 CFDB 不需要访问多孔板读数仪或纯化的商业分子检测组件。通过这些设计考虑,CFDB 通过提供非集中式实验室的可访问性、对新出现的病原体的适应性以及低收入社区的可负担性来解决现有免疫测定平台的缺点。
在本文中,我们将提供制备和执行 CFDB 免疫测定的分步方案。以我们最近在 SARS-CoV-2 CFDB 方面的工作为例,我们将介绍用于按需无细胞生产的抗原 DNA 设计,然后是 CFDB 报告蛋白的制备,将血清样品固定在固相上,最后是抗原结合和检测步骤测定。我们预计,通过遵循这些说明,研究人员将能够调整 CFDB 检测方法,以检测人类和动物血清中对任何给定病原体的免疫反应。
引言
COVID-19 大流行揭示了对经济实惠、可扩展的诊断工具的迫切需求,尤其是在资源匮乏的环境中1。事实证明,酶联免疫吸附测定 (ELISA) 等传统免疫测定法对于检测免疫反应至关重要 2,3。然而,它们的高成本、对复杂试剂的依赖以及对专用设备的依赖限制了它们的可及性,尤其是在全球健康危机期间。为了应对这些挑战,我们开发了 Cell-Free Dot Blot (CFDB),这是一种低成本、适应性强的免疫测定平台,旨在检测人和动物血清中的抗 SARS-CoV-2 抗体。
CFDB 利用无细胞合成生物学,使用线性 DNA 模板快速、按需生产病毒抗原 4,5。这消除了对传统的基于细胞的克隆、表达和纯化过程的需求,显著加快了抗原生产速度,同时降低了成本。CFDB 方法使用斑点印迹形式,将血清直接点样到硝酸纤维素膜上,从而简化了抗体检测。该系统无需昂贵的多孔板和专用实验室设备,允许为孵育和洗涤步骤提供简单的“浸渍”工作流程。该平台还利用 SpyCatcher-SpyTag 系统,其中 SpyCatcher2-Apex2 过氧化物酶嵌合体用作通用二级检测试剂 5,6。这是使用基于标准大肠杆菌的表达产生的,消除了对昂贵的商业抗体偶联物的依赖。因此,CFDB 系统可以执行性能与 ELISA 相当的血清学检测,成本显著降低 - 每 96 个样品检测约 3 美元,而商业 ELISA 试剂盒的成本超过 300 美元5。
为了证明 CFDB 的有效性,我们测试了其在预先表征的人类和动物血清中检测抗体的能力。我们的结果在识别 COVID-19 阳性和阴性样本方面与 ELISA 密切相关。除了人类诊断外,我们还评估了 CFDB 在动物模型中的效用,检测了 SARS-CoV-2 感染仓鼠和接种重组核衣壳蛋白的仓鼠的血清。这些测试证实了 CFDB 在人类和兽医诊断中的潜力,使其成为监测跨物种免疫反应的多功能工具。CFDB 的主要优势之一是其灵活性。通过简单地修饰编码目标抗原的 DNA 模板,该平台可以快速适应检测针对不同病原体的抗体,使其对未来的大流行防范很有价值。其低成本、简单的工作流程和最低的基础设施要求使其特别适用于商业诊断机会有限的分散实验室和资源匮乏的环境。
在这项工作中,我们将提供准备和进行 CFDB 分析的分步说明。首先,我们介绍了用于无细胞生产抗原的线性 DNA 模板的设计和合成,这是该检测的主要检测试剂。然后,我们描述了制备检测试剂盒的二级检测试剂 SpyCatcher2-Apex2 的步骤。之后,我们提供抗原本身的无细胞生产和质量检查的说明。最后,我们详细描述了对人或动物血清样品进行 CFDB 分析的过程。
研究方案
所有仓鼠实验均在加拿大公共卫生署的国家微生物实验室 (NML) 进行,经加拿大人类和动物健康科学中心批准,并遵循加拿大动物护理委员会指南。所有人血清/血浆样品均来自商业获取用于内部检测,或由临床合作者提供给 NML 在 NML 进行独立检测。
1. 抗原线性表达模板 (LET) 的设计与制备
- 根据 Norouzi 等人 7 中的说明设计靶抗原的无细胞表达 LET,并包含 Norouzi 等人 5 中描述的 N/C 末端 SpyTag。
注:此处我们提供了制备 SARS-CoV-2 核衣壳蛋白(NP,氨基酸 2-419)的详细信息。- 确保 SARS-CoV-2 NP 的 LET(图 1 和 补充文件 1)包含 5' 和 3' Ter 位点,在 T7 启动子之前和终止密码子之后具有 50 个碱基对的缓冲序列。
- 用 His 6-SpyTag-TEV 标记 N 末端的 NP 蛋白。
- 从 UniProt 数据库(登录代码 P0DTC9)获取蛋白质序列,并使用 IDT 密码子优化工具8 对其进行密码子优化以用于基于大肠杆菌的表达。订购此序列进行商业合成,作为单链 DNA 片段,以 10 ng/μL 的浓度重悬于水中。
注意:TEV 蛋白酶切割位点和 His6 标签不是 LET 设计中的基本特征。
- PCR 用通用 Ter FW (GGCTCCGAATAAGTATGTTGTAACTAAAGTGCGGCC
ACGATGCGTCCGGCGTAGAGGATCG) 和 Ter RV (CCGAGGCAATAAGTATGTTGTAACTAAAGTGCTCAG
CTTCCTTTCGGGCTTTGTTAGCAGCC)引物使用高保真 DNA 聚合酶试剂盒(参见 材料表)- 按如下方式设置 100 μL 反应:75 μL 无核酸酶水、20 μL 5x DNA 聚合酶缓冲液、2 μL 10 mM dNTP(终浓度 200 μM)、0.5 μL 100 μM Ter-FW 引物、0.5 μL 100 μM Ter-RV 引物、1 μL 10 ng/μL 单链 LET、1 μL (2U) DNA 聚合酶。
- 使用以下 PCR 设置:在 98 °C 下初始变性 30 秒;35 个循环:98 °C 持续 6 秒,60 °C 持续 15 秒,72 °C 持续 90 秒;保持在 4 °C。
- 使用市售 PCR 纯化试剂盒纯化 PCR 产物,通过在 1% 琼脂糖凝胶上运行样品来检查其质量,并在紫外-可见分光光度计上测量其浓度。
注:粗 PCR 产物也可直接用于无细胞表达。然而,纯化允许更标准化的程序。

图 1:SARS-CoV-2-NP 的线性表达模板。 表示 His-SpyTag-SARS-CoV-2 NP 线性 DNA 模板特征的示意图。标记关键 DNA 模板元件。目标蛋白质的编码序列(此处为 NP)置于 T7 启动子的转录控制下以实现高效表达。在 N 端,NP 蛋白附加一个 SpyTag,以便使用 SpyCatcher2-Apex2 检测试剂进行特异性检测。x6His 标签和 TEV 蛋白酶位点虽然包含在一般 LET 设计中,但对于 CFDB 目的来说可有可无。在线性 DNA 模板的末端,包括“上游”和“下游”Ter 位点,每个位点前面都有相应的 50 个碱基对缓冲液序列,用于 Tus 介导的保护,防止无细胞裂解物中的核酸外切 DNA 降解。缩写: NP = 核衣壳蛋白;LET = 线性表达式模板;TEV = 烟草蚀刻病毒;CFDB = 无细胞斑点印迹。 请单击此处查看此图的较大版本。
2. 纯化 SpyCatcher2-Apex2 报告基因蛋白
- 使用最初在 Norouzi 等人 5 中构建的 pET24b-SpyCatcher2-Apex2 质粒(补充文件 2 中的完整序列和补充图 S1 中的质粒图谱)制备 SpyCatcher2-Apex-2 报告蛋白。
- 制备含有 50 μg/mL 卡那霉素的琼脂平板和溶原肉汤 (LB)。用 pET24b-SpyCatcher2-Apex2 质粒转化 大肠杆菌 BL21 (DE3) 细胞。将单个菌落接种到 15 mL 起始 LB 培养物中,并在 37 °C 下以 250 RPM 振荡生长过夜。
- 第二天,将 10 mL 发酵剂加入 500 mL 含有 50 μg/mL 卡那霉素的新鲜 LB 培养基中。在 37 °C 下孵育,以 250 RPM 振荡,直到培养物在 600 nm 处达到 0.6-0.8 (~3 h) 的光密度。
- 通过向培养物中添加 0.5 mM 异丙基-β-D-1-硫代吡喃半乳糖苷和 1 mM 5-氨基乙酰丙酸盐酸盐来诱导 SpyCatcher2-Apex2 的表达。将生长温度降低至 30 °C,并让培养物再孵育 4 小时。
- 通过以 8,000 × g 离心 15 分钟来收获细菌。进行细胞裂解或将沉淀储存在 -80 °C 直至使用。
- 将沉淀重悬于 20 mL 裂解缓冲液中,其中含有 50 mM Tris-HCl (pH 7.8)、300 mM NaCl、1 mg/mL 溶菌酶、不含 EDTA 的蛋白酶抑制剂片剂和 1 mM 二硫苏糖醇 (DTT)。通过以 50% 的振幅超声处理裂解细胞,间隔为 5 秒 ON 和 10 秒 OFF,总开启时间为 3 分钟。
- 通过在 4 °C 下以 20,000 × g 离心 1 小时来澄清裂解物。 将上清液通过 0.2 μm 注射器过滤器。
- 向澄清的裂解物中加入终浓度为 250 μM 的血红素氯化物,并在 4 °C 下孵育过夜。 进行蛋白质纯化。
注:与氯化血红素一起孵育可最大程度地使血红素掺入 Apex-2 过氧化物酶中,以实现最佳酶活性。 - 向澄清的裂解物中加入 2.5 mL Ni 树脂,并在 4 °C 下轻轻摇动孵育 45 分钟。将混合物涂在重力流柱上,并用 50 mL 的 Tris 缓冲液(50 mM Tris-HCl (pH 7.8)、300 mM NaCl 和 1 mM DTT)洗涤树脂。
- 在 25 mL 含有 400 mM 咪唑的 Tris 缓冲液中洗脱 SpyCatcher2-Apex2 蛋白。使用离心过滤装置将洗脱液浓缩和缓冲液置换为 Tris 缓冲液,最终体积为 0.5-1.0 mL。
- 使用 SpyCatcher2-Apex2 的摩尔消光系数 (27,390 M-1 cm-1) 确定紫外-可见分光光度计上的蛋白质浓度。加入甘油至终浓度为 40%,并将等分试样储存在 -20 °C。
注:该方案预计可产生约 40 mg 高纯度和活性的 SpyCatcher2-Apex2,足以在标准 96 个样品印迹尺寸上进行 400 次 CFDB 运行。 - 对于使用常规蛋白质印迹9 检测 SpyTagged 蛋白和 CFDB 实验,始终在含有 0.05% Tween-20 (TBST) 的 1x Tris 缓冲盐水中,将膜封闭在 5% 脱脂奶粉中。在封闭液中使用终浓度为 10 μg/mL 的 SpyCatcher2-Apex2 蛋白。
注意:SpyCatcher2-Apex2 报告基因需要增强型化学发光 (ECL) 溶液才能进行信号显影。ECL 溶液可以商业获得,也可以根据 Mruk 等人 10 中的说明在内部制备。此处的最终 ECL 溶液由 0.4 mM 对香豆酸、2.5 mM 鲁米诺和 0.015% H2O2 的 100 mM Tris-HCl (pH 8.6) 溶液组成。
3. 抗原的无细胞生产和质量检查
- 按照 Levine 等人 11 和 Norouzi 等人 5 中的说明准备和组装大肠杆菌 BL21 无细胞表达裂解物和反应组分。对于具有代表性的 100 μL 反应,按照以下方法补充 5 μM Tus 蛋白和 1.2 μM T7 RNA 聚合酶的最终反应混合物:14.6 μL 溶液 A、14 μL 溶液 B、33.3 μL 大肠杆菌 BL21 裂解物、2.5 μL 200 mM Tus 蛋白、1.2 μL 100 mM T7 RNA 聚合酶、 1 μL 1.5 μM 线性 DNA 模板,33.4 μL 无核酸酶水。
注:有关制备大肠杆菌 BL21 游离裂解物的关键说明,请参见补充文件 3,有关解决方案 A 和 B 的详细配方,请参阅补充表 S1。大肠杆菌游离表达系统也可以使用替代方案制备或商业获得,只要反应补充有 Tus 和 T7 RNA 聚合酶即可。 - 通过在 PCR 管中的无细胞反应中加入 10% (v/v) 粗 PCR 产物,进行初始 5 μL 规模的表达检测。在 30 °C 下不摇晃孵育 15 小时。
- 通过将 1 μL 无细胞反应加载到 12% 十二烷基硫酸钠聚丙烯酰胺凝胶 (SDS-PAGE) 上,然后将其转移到硝酸纤维素膜上进行蛋白质印迹,检查 NP 抗原的表达质量,如步骤 2.12 所述。使用 SpyCatcher2-Apex2 报告基因蛋白通过 SpyTag 进行印迹标记,也可选择使用针对靶抗原的特异性商业抗体(此处为抗 SARS-CoV-2-NP)。
- 将 1 mL 规模的无细胞反应物与 15 nM 纯化的 LET 产物组装在一起,用于 CFDB 测定。将表达混合物在 15 mL 锥形管中孵育,在 30 °C 下以 80 RPM 振荡 15 小时。 使用 western blot 检查表达质量,并将 50 μL 等分试样储存在 -20 °C 下。
4. 血清样品
- 使用标准程序并遵循机构人类研究伦理委员会或动物护理和使用委员会的指导方针,从商业来源或临床合作者或内部获取人/动物血清(或血浆)样品。确保已采取适当的样品预处理措施以降低污染风险。
注:预处理措施可能包括溶剂洗涤剂处理、热灭活和血源性病毒标志物检测。从全血中分离血清和血浆的有用方案可用12.与其他免疫测定平台一样,在初始感染或疾病发作后早期(<3 周)采集的血清样本预计不包含足够水平的抗体反应,应谨慎处理其结果。 - 对于 SARS-CoV-2 NP CFDB 试剂的质量验证,请使用美国国家生物标准与控制研究所 (NIBSC) 世界卫生组织 (WHO) 抗 SARS-CoV-2 免疫球蛋白国际参考面板,其中包含 x1 个 COVID-19 前和 x4 个 SARS-CoV-2 阳性样品,具有不同水平的抗 NP 免疫球蛋白13。或者,使用来自其他来源的预先表征的健康和阳性血清样品。
- 对于 CFDB 实验,通过混合多个 (>3) 健康血清样品来获得或制备阴性对照样品,以提高准确性并促进结果的分析和解释。
5. 游离斑点印迹 (CFDB) 程序
- 下载并打印主网格图像文件(补充图 S2)。主网格是一个 6 x 6 cm 的图案,包含 12 x 12 个直径为 2 mm 的圆圈,提供类似于 96 孔板的点样能力。
- 将网格牢固地夹在两层粘性 PCR 板密封膜之间,并沿外部网格边界切割成一定尺寸。使用 2 mm 活检打孔器将每个标记的圆圈挖空。
注意:用 70% 乙醇擦拭后,此主网格可多次重复使用。 - 剪下一块 6.5 x 6.5 cm 的硝酸纤维素膜,并将其放置在主网格下方的干净表面上,使用胶带固定设置,如图 2 和补充图 S3 所示。使用记号笔在硝酸纤维素膜上标记最外层的圆圈位置,以用作样品点样后切割膜的指南。
- 用 1x 磷酸盐缓冲盐水 (pH 7.4) 将血清样品稀释 1/10。使用微量移液器将每个样品一式三份的 0.4 μL 体积分配到硝酸纤维素膜上预定的网格位置。每个点大约需要 15 秒才能分配。
注意:确保每次检测都包括阴性和阳性对照样品,因为这是分析结果所必需的。 - 在环境温度下放置 10 分钟,让斑点样品结合并干燥。使用镊子小心地取出硝酸纤维素膜并沿着标记的外圈切开。
- 在 10 cm 培养皿中,在 10 mL 封闭溶液(TBST 中的 5% 脱脂奶粉)中,在室温下封闭膜 30 分钟,以 100 RPM 轻轻摇晃。
- 解冻并将 50 μL 等分试样的游离抗原表达混合物添加到 10 cm 培养皿中的 5 mL 封闭溶液中。将膜直接转移到这种含抗原的溶液中,并在室温下孵育 1 小时,以 100 RPM 摇动。
注:这将是 SpyTagged 抗原与含抗体的斑点位置(如果存在)结合的主要检测步骤。 - 冲洗膜,洗涤 5 分钟,然后在 TBST 中再次冲洗,然后进行二次检测步骤。
- 将膜在 10 mL 含有 10 μg/mL 纯化的 SpyCatcher2-Apex2 蛋白的封闭缓冲液中孵育 1 小时,同时以 100 RPM 振荡。
- 冲洗膜并在 TBST 中洗涤 2 x 5 分钟,最后在 TBS 中冲洗。
- 将一块封口膜粘贴并固定在靠近印迹成像仪器的干净工作区域。使用镊子敲击膜去除多余的液体,然后将膜放在封口膜的顶部。
- 立即在膜顶部加入 3 mL (100 μL/cm2) 的 ECL 溶液,并在室温下孵育 90 秒。
- 立即轻按干燥膜并转移到化学发光兼容的成像仪器上,以获得结果的可视化。
注:最佳成像时间可能因仪器而异。建议使用仪器的默认自动采集时间设置,如果没有,请使用预表征血清样品来优化图像采集时间。 - 使用仪器的图像分析功能获得斑点强度,包括硝酸纤维素膜上的三个空白(背景)位置;保持每个点的测量体积恒定。将数据导出到电子表格,记住要正确标记每个点位置。
- 计算一式三份光斑强度的平均值和标准差 (SD)。然后,从所有样品中减去硝酸纤维素膜背景。
- 使用以下公式获取解释 -/+ 结果的截止值:
(阴性对照的平均值)+(阴性对照的 3 x SD)。如果样本的平均强度高于临界值,则将其视为正样本,如果样本的平均强度低于临界值,则将其视为负样本。
注意: 图 3 提供了 CFDB 程序的示意图。
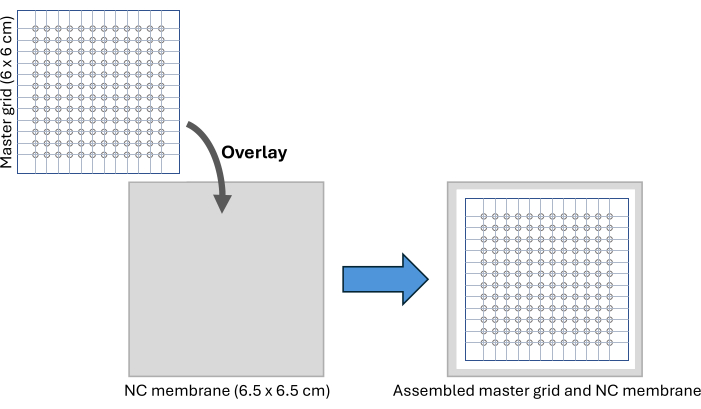
图 2:CFDB 组件。 CFDB 主栅格和 NC 膜组件设置的示意图。主网格覆盖在 NC 膜上,为血清样品的点样和固定提供规则的、可寻址的模式。缩写:CFDB = 无细胞斑点印迹;NC = 硝酸纤维素。 请单击此处查看此图的较大版本。
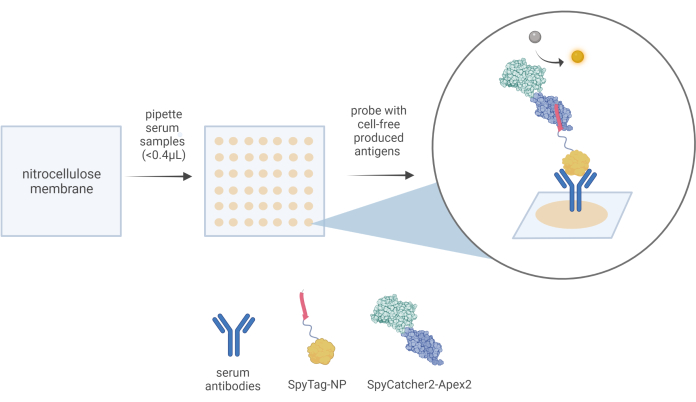
图 3:CFDB 工作流程的示意图。 在 CFDB 分析中,将少量 (<0.4 μL) 10x 稀释血清样品手动分配到预切的硝酸纤维素膜(左图)上,位于离散的可寻址位置(中图)。将每个点份一份血清样品沉积在一式三份的点上,并将蛋白质含量(包括血清的总抗体储液罐)固定在固体 NC 底物上(中间图中的米色点)。在本例中,血清样品中所含的抗 NP 抗体可以首先由 CFDB 一级检测试剂 SpyTag-NP 结合,最后由 CFDB 二级检测试剂 SpyCatcher2-Apex2(右图放大气泡)检测。这个数字取自 Norouzi 等人 5。缩写:CFDB = 无细胞斑点印迹;NP = 核衣壳蛋白;LET = 线性表达式模板。 请单击此处查看此图的较大版本。
结果
靶抗原线性表达模板的 PCR 扩增
为了对 SARS-CoV-2 NP LET 进行 PCR 扩增,按照方案第 1.2 节所述使用通用 Ter 正向和反向引物,并在琼脂糖凝胶上检查 1 μL 产品(图 4),然后再进行 PCR 产物的纯化。

图 4
讨论
COVID-19 强调了可及且强大的诊断方法对于控制感染爆发和优化全球卫生战略的重要性。事实证明,检测保护性抗体的血清学检测对于追踪新变种的传播模式、识别热点、指导疫苗开发、分诊疑似病例和保护弱势群体至关重要14。大流行还暴露了检测可及性方面的不平等,积压和对配备复杂设备的设施的要求加剧了这种情况15。因此,现?...
披露声明
M.N. 和 K.P. 是无细胞斑点印迹法的共同发明者。 已提交与这项工作相关的临时专利申请(PCT/CA2024/050097,2024 年 1 月提交)。
致谢
SS 和 RZ 由国防高级研究计划局 (DARPA) 提供资金支持,合同编号为 N66001-23-2-4042。所表达的观点、意见和/或调查结果是作者的观点、意见和/或调查结果,不应被解释为代表国防部或美国政府的官方观点或政策。这项工作得到了 CIHR 基金会赠款计划 (201610FDN-375469)、CIHR 加拿大研究主席计划(950-231075 和 950-233107)、多伦多大学医学设计计划(接受加拿大第一研究卓越基金的资助)和 KP 的资金,来自加拿大国防研究与发展部、加拿大安全和安保计划(合同 39903-200137)。 图 1 和 补充图 S1 是使用 SnapGene 查看器创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1 kb DNA ladder | NEB | N3232 | Used as a size marker for agarose gels |
| 20 Amino acids | Sigma-Aldrich | LAA21-1KT | A component of the cell-free reaction Solution B |
| 2 mm biopsy punch | Integra Miltex | 33-31-P/25 | For preparation of CFDB master grid |
| 5-aminolevulinic acid hydrochloride | Sigma-Aldrich | A3785 | Heme precursor for induction of SpyCatcher2-Apex2 |
| Agarose powder | BioShop | AGA002 | For electrophoretic analysis of DNA |
| Anti-SARS-CoV2-Nucleocapsid antibody | Sinobiological | 40588-T62 | For WB detection of cell-free produced NP antigen |
| Bio-Rad ChemiDoc XRS+ | Bio-Rad | N/A | Gel imager instrument |
| Centrifugal concentrators | Cytiva | 28-9323-60 | For concentration and buffer exchange of proteins |
| Centrifuge | Eppendorf | EP022628257 | For harvesting bacterial culture |
| Coenzyme A sodium salt hydrate (CoA) | Sigma-Aldrich | C3144 | A component of the cell-free reaction Solution A |
| Color pre-stained protein standard (broad range) | NEB | P7719 | Used as a size marker for SDS-PAGE gels |
| Covid-19 serum panel | RayBiotech | CoV-PosSet | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| D-(−)-3-Phosphoglyceric acid disodium salt (3-PGA) | Sigma-Aldrich | P8877 | A component of the cell-free reaction Solution B |
| Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Component of buffers |
| E. coli 5-alpha | NEB | C2987 | for plasmid preparation |
| E. coli BL21 | NEB | C2530 | For preparation of cell-free lysates |
| E. coli BL21 (DE3) | NEB | C2527 | For expression of SpyCatcher2-Apex2 |
| EDTA-free protease inhibitor tablet | Sigma-Aldrich | 11836153001 | A component of E. coli lysis buffer |
| Eppendorf New Brunswick Innova 43/43R Incubator Shaker | Eppendorf | EPM1320 | Incubator for growing E. coli cells for protein expression and cell-free lysate preparation |
| Folinic acid | Sigma-Aldrich | 47612 | A component of the cell-free reaction Solution A |
| Glycerol | Sigma-Aldrich | G9012 | Component of SpyCatcher2-Apex2 storage buffer |
| Hemin chloride | Sigma-Aldrich | H9039 | For Heme supplementation of SpyCatcher2-Apex2 |
| Hydrogen peroxide 30% | Sigma-Aldrich | H1009 | For making ECL reagent |
| Image Lab Software | Bio-Rad | 1709690 | Software for ChemiDoc gel imaging instrument |
| Isopropyl-b-D-1-thiogalactopyranoside | Bioshop | IPT001 | For induction of SpyCatcher2-Apex2 expressikon |
| Kanamycin Sulfate | Sigma-Aldrich | 60615 | For preparation of SpyCatcher2-Apex2 bacterial culture |
| LB agar | BioShop | LBL406 | For E. coli growth |
| LB broth | BioShop | LBL407 | For E. coli growth |
| luminol | Sigma-Aldrich | A4685 | For making ECL reagent |
| Lysozyme | Sigma-Aldrich | L6876 | For lysis of bacterial cells |
| Magnesium Acetate | Sigma-Aldrich | M5661 | A component of the cell-free reaction Solution B |
| NEBExpress Ni resin | NEB | S1428S | For purification of SpyCatcher2-Apex2 |
| Non-fat dry milk | Bioshop | SKI400 | For blocking of WB and CFDB membranes |
| Parafilm | Bemis | 2099-1337410 | For ECL-incubation of CFDB blots |
| p-coumaric acid | Sigma-Aldrich | C9008 | For making ECL reagent |
| pET24b-SpyCatcher2-Apex2 plasmid | Pardee Laboratory | N/A | Used for the expression of SpyCatcher2-Apex2 protein |
| Petri dish | Fisherbrand | FB0875712 | Container for WB and CFDB membrane incubation |
| Phosphate buffered saline 10% | BioShop | PBS405 | Component of buffers |
| Potassium Glutamate | Sigma-Aldrich | G1501 | A component of the cell-free reaction Solution B |
| Potassium Oxalate Monohydrate (Oxalic acid) | Sigma-Aldrich | 223425 | A component of the cell-free reaction Solution A |
| Precast SDS-PAGE gel | BioRad | 4561036EDU | For electrophoretic analysis of protein |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification of LETs |
| QIAquick PCR purification kit | Qiagen | 28106 | For purification of LETs |
| Ribonucleotide Solution Set | NEB | N0450S | A component of the cell-free reaction Solution A |
| Skim milk powder | BioShop | SKI400 | Used as a blocking agent for western blot and CFDB |
| Sodium Chloride | Sigma-Aldrich | S9625 | A component of protein purification buffers |
| Sonicator | Qsonica | Q500 | For lysis of bacterial cells |
| Spermidine | Sigma-Aldrich | S2626 | A component of the cell-free reaction Solution A |
| Syringe filter | Sigma-Aldrich | SLGSR33SS | For sterilisation of buffers and solutions |
| Thermocycler | BioRad | T100 | Instrument for incubating PCR reactions |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8759 | A component of the cell-free reaction Solution A |
| Tris buffered saline | Thermo Scientific | J60764.K2 | Component of WB and CFDB wash buffer |
| Trizma base | Sigma-Aldrich | T1503 | For making tris buffer |
| Tunair SS-5012 Half-Baffle Shake Flask, 2.5 L | Cole-Parmer | RK-01835-39 | Vessel for growing E. coli cells for protein expression and cell-free lysate preparation |
| Tween-20 | BioShop | TWN510 | Component of WB and CFDB wash buffer |
| Tweezer | Almedic | 7728-A10-100 | For handling CFDB NC membrane |
| UV-Vis spectrophotometer | Thermo Scientific | 13400518 | Used for the measurement of nucleic acid and DNA concentration and bacterial culture OD |
| WHO International Reference Panel for anti-SARS-CoV-2 immunoglubulin | NISBC | 20/268 | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| β-Nicotinamide adenine dinucleotide hydrate (NAD) | Sigma-Aldrich | 10127965001 | A component of the cell-free reaction Solution A |
参考文献
- Carter, L. J., et al. Assay techniques and test development for COVID-19 diagnosis. ACS Cent Sci. 6, 591-605 (2020).
- Amanat, F., et al. A serological assay to detect SARS-CoV-2 seroconversion in humans. Nat Med. 26 (7), 1033-1036 (2020).
- Stadlbauer, D., et al. SARS-CoV-2 seroconversion in humans: A detailed protocol for a serological assay, antigen production, and test setup. Curr Protoc Microbiol. 57 (1), e100 (2020).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259.e12 (2016).
- Norouzi, M., et al. Cell-free dot blot: an ultra-low-cost and practical immunoassay platform for detection of anti-SARS-CoV-2 antibodies in human and animal sera. Microbiol Spectr. 11 (2), e0245722 (2023).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2014).
- Norouzi, M., Panfilov, S., Pardee, K. High-efficiency protection of linear DNA in cell-free extracts from Escherichia coli and Vibrio natriegens. ACS Synth Biol. 10 (7), 1615-1624 (2021).
- . IDT codon optimization tool Available from: https://www.idtdna.com/pages/tools/codon-optimization-tool (2025)
- . General protocol for western blotting Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6376.pdf (2025)
- Mruk, D. D., Cheng, C. Y. Enhanced chemiluminescence (ECL) for routine immunoblotting. Spermatogenesis. 1, 121-122 (2011).
- Levine, M. Z., Gregorio, N. E., Jewett, M. C., Watts, K. R., Oza, J. P. Escherichia coli-based cell-free protein synthesis: Protocols for a robust, flexible, and accessible platform technology. J Vis Exp. (144), (2019).
- . Plasma and serum preparation Available from: https://www.thermofisher.com/ca/en/home/references/protocols/cell-and-tissue-analysis/elisa-protocol/elisa-sample-preparation-protocols/plasma-and-serum-preparation.html (2025)
- Mattiuzzo, G., et al. . WHO/BS.2020.2403 Establishment of the WHO International Standard and Reference Panel for anti-SARS-CoV-2 antibody. , (2020).
- Gong, F., Wei, H., Li, Q., Liu, L., Li, B. Evaluation and comparison of serological methods for COVID-19 diagnosis. Front Mol Biosci. 8, 682405 (2021).
- Peeling, R. W., et al. Serology testing in the COVID-19 pandemic response. Lancet Infect Dis. 20 (9), e245-e249 (2020).
- Smith, M. T., Berkheimer, S. D., Werner, C. J., Bundy, B. C. Lyophilized Escherichia coli-based cell-free systems for robust, high-density, long-term storage. Biotechniques. 56 (4), 186-193 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。