Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan ve hayvan serumlarında antikor yanıtının tespiti için pratik ve uyarlanabilir bir immünoassay platformu olarak hücresiz nokta lekesi
Bu Makalede
Özet
İnsan ve hayvan serumlarında antikor yanıtının özelleştirilebilir tespiti için hücresiz sentetik biyoloji ilkelerine ve nokta-leke tekniğine dayanan yakın zamanda geliştirilmiş bir immünoassay platformunu açıklıyoruz.
Özet
Son yirmi yıldaki küresel patojenik salgınlar dizisi, serosürveyans stratejilerinin önemini vurgulamıştır. Hastaların serumlarında hastalığa özgü antikorları tespit etmeye yarayan immünoassay platformları, serosürveyansın merkezinde yer alır. Yaygın örnekler arasında enzime bağlı immünosorbent testleri ve yanal akış deneyleri bulunur; Bununla birlikte, bunlar altın standart yöntemler olsa da, patojene özgü sarf malzemeleri ve özel ekipman gerektirirler, bu da iyi kaynaklara sahip laboratuvarlar dışında kullanımlarını sınırlar.
Yakın zamanda Cell-Free Dot-Blot (CFDB) adlı yeni bir immünolojik test platformu geliştirdik ve bunu SARS-CoV-2'ye karşı insan ve hayvan serumları kullanarak doğruladık. Konvansiyonel immünolojik testlerin aksine, CFDB hasta serum numuneleri katı bir faza (nitroselüloz membran) immobilize edilirken, hedef antijen testin mobil fazında süspanse edilir. Serosürveyans yeteneklerine erişimi iyileştirmek için, CFDB antijenleri talep üzerine ve in vitro protein ekspresyonu kullanılarak düşük yük altyapısı ile üretilir. Burada, antijen, herhangi bir CFDB testi için tek bir evrensel raportör protein kullanılarak tespit edilebilen bir peptit etiketi ile kaynaştırılır. Sonuç olarak, CFDB çok kuyulu bir plaka okuyucuya veya saflaştırılmış ticari moleküler tahlil bileşenlerine erişim gerektirmez. Bu tasarım hususları ile CFDB, merkezi olmayan laboratuvarlara erişilebilirlik, ortaya çıkan patojenler için uyarlanabilirlik ve düşük gelirli topluluklar için satın alınabilirlik sağlayarak mevcut immünoassay platformlarının eksikliklerini giderir.
Bu makalede, bir CFDB immünolojik testi hazırlamak ve gerçekleştirmek için adım adım bir protokol sağlayacağız. Örnek olarak SARS-CoV-2 CFDB ile ilgili son çalışmamızı kullanarak, talep üzerine hücresiz üretim için antijen DNA tasarımını, ardından CFDB raportör proteininin hazırlanmasını, serum örneklerinin katı fazda immobilizasyonunu ve son olarak testin antijen bağlama ve tespit adımlarını ele alacağız. Bu talimatları izleyerek, araştırmacıların CFDB testini insan ve hayvan serumlarında herhangi bir patojene karşı bağışıklık tepkilerini tespit etmek için uyarlayabileceklerini tahmin ediyoruz.
Giriş
COVID-19 salgını, özellikle düşük kaynak ayarları için uygun fiyatlı, ölçeklenebilir tanı araçlarına olan kritik ihtiyacı ortaya çıkardı1. Enzime bağlı immünosorbent testleri (ELISA'lar) gibi geleneksel immünolojik testlerin, immün yanıtları tespit etmek için gerekli olduğu kanıtlanmıştır 2,3. Bununla birlikte, yüksek maliyetleri, karmaşık reaktiflere güvenmeleri ve özel ekipmanlara bağımlılıkları, özellikle küresel sağlık krizleri sırasında erişilebilirliklerini sınırlar. Bu zorluklara yanıt olarak, insan ve hayvan serumlarında anti-SARS-CoV-2 antikorlarının tespiti için tasarlanmış düşük maliyetli, uyarlanabilir bir immünolojik test platformu olan Cell-Free Dot Blot'u (CFDB) geliştirdik.
CFDB, doğrusal DNA şablonları 4,5 kullanarak viral antijenlerin hızlı, isteğe bağlı üretimi için hücresiz sentetik biyolojiden yararlanır. Bu, geleneksel hücre bazlı klonlama, ekspresyon ve saflaştırma işlemlerine olan ihtiyacı ortadan kaldırarak antijen üretimini önemli ölçüde hızlandırırken maliyetleri düşürür. CFDB yöntemi, serumların doğrudan nitroselüloz membranlar üzerinde lekelendiği bir nokta leke formatı kullanarak antikor tespitini basitleştirir. Bu sistem, pahalı çok kuyulu plakalara ve özel laboratuvar ekipmanlarına olan ihtiyacı ortadan kaldırarak inkübasyon ve yıkama adımları için basit bir "daldırma" iş akışına izin verir. Platform ayrıca, bir SpyCatcher2-Apex2 peroksidaz kimerasının evrensel bir ikincil tespit reaktifi 5,6 olarak işlev gördüğü bir SpyCatcher-SpyTag sistemi kullanır. Bu, maliyetli ticari antikor konjugatlarına bağımlılığı ortadan kaldıran standart Escherichia coli bazlı ekspresyon kullanılarak üretilir. Sonuç olarak, CFDB sistemi, ticari bir ELISA kiti5 için 300 USD'nin üzerinde olan 96 numune tahlili başına yaklaşık 3 ABD Doları gibi önemli ölçüde daha düşük bir maliyetle ELISA'larla karşılaştırılabilir performansla serolojik testler gerçekleştirebilir.
CFDB'nin etkinliğini göstermek için, önceden karakterize edilmiş insan ve hayvan serumlarında antikorları tespit etme yeteneğini test ettik. Sonuçlarımız, COVID-19 pozitif ve negatif örneklerin belirlenmesinde ELISA ile yakından ilişkilidir. İnsan teşhisine ek olarak, CFDB'nin hayvan modellerindeki faydasını değerlendirdik, SARS-CoV-2 ile enfekte olmuş hamsterlerden ve rekombinant Nükleokapsid proteini ile aşılanmış olanlardan serumları test ettik. Bu testler, CFDB'nin hem insan hem de veterinerlik teşhislerinde kullanım potansiyelini doğruladı ve bu da onu türler arasında bağışıklık tepkilerini izlemek için çok yönlü bir araç haline getirdi. CFDB'nin en önemli avantajlarından biri esnekliğidir. Platform, ilgilenilen antijeni kodlayan DNA şablonunu basitçe değiştirerek, farklı patojenlere karşı antikorları tespit etmek için hızla uyarlanabilir ve bu da onu gelecekteki pandemi hazırlığı için değerli kılar. Düşük maliyeti, basit iş akışı ve minimum altyapı gereksinimleri, onu ticari tanılamalara erişimin sınırlı olduğu merkezi olmayan laboratuvarlar ve düşük kaynaklı ortamlar için özellikle uygun hale getirir.
Bu çalışmada, bir CFDB tahlili hazırlamak ve yürütmek için adım adım talimatlar sağlayacağız. İlk olarak, testin birincil tespit reaktifleri olan antijenlerin hücresiz üretimi için doğrusal DNA şablonlarının tasarımını ve sentezini ele alıyoruz. Daha sonra testin ikincil tespit reaktifi SpyCatcher2-Apex2'nin hazırlanması için adımları açıklıyoruz. Bundan sonra, antijenlerin kendilerinin hücresiz üretimi ve kalite kontrolü için talimatlar sağlıyoruz. Son olarak, insan veya hayvan serum numuneleri üzerinde bir CFDB testi yürütme sürecini ayrıntılı olarak açıklıyoruz.
Protokol
Tüm hamster deneyleri, Kanada Halk Sağlığı Kurumu'ndaki Ulusal Mikrobiyoloji Laboratuvarı'nda (NML) gerçekleştirildi, Kanada İnsan ve Hayvan Sağlığı Bilim Merkezi tarafından onaylandı ve Kanada Hayvan Bakımı Konseyi yönergelerine uygun olarak yapıldı. Tüm insan serumu/plazma numuneleri, kurum içi testler için ticari olarak elde edildi veya klinik işbirlikçiler tarafından NML'de bağımsız test için NML'ye sağlandı.
1. Antijen lineer ekspresyon şablonlarının (LET'ler) tasarımı ve hazırlanması
- Norouzi ve ark.7'deki talimatlara dayalı olarak ve Norouzi ve ark.5'te tarif edildiği gibi bir N/C-terminali SpyTag içeren hedef antijen için hücresiz ekspresyon LET'lerini tasarlayın.
NOT: Burada SARS-CoV-2 Nükleokapsid Proteininin (NP, amino asitler 2-419) hazırlanması için ayrıntılar sunuyoruz.- SARS-CoV-2 NP için LET'in (Şekil 1 ve Ek Dosya 1), T5 promotöründen önce ve durdurma kodonundan sonra 3 baz çifti tampon dizisine sahip 50' ve 7' Ter bölgeleri içerdiğinden emin olun.
- N-terminalindeki NP proteinini 6-SpyTag-TEV ile etiketleyin.
- UniProt Veritabanından (Erişim Kodu P0DTC9) protein dizisini alın ve IDT kodon optimizasyon aracını8 kullanarak E. coli tabanlı ekspresyon için kodon optimize edin. Bu diziyi, 10 ng / μL'de suda yeniden süspanse edilmiş tek sarmallı bir DNA parçası olarak ticari sentez için sipariş edin.
NOT: TEV proteaz bölünme bölgesi ve His6 etiketi, LET tasarımındaki temel özellikler değildir.
- PCR, DNA fragmanını evrensel Ter FW (GGCTCCGAATAAGTATGTTGTAACTAAAGTGCGGCC ile çoğaltır.
ACGATGCGTCCGGCGTAGAGGATCG) ve ter RV (CCGAGGCAATAAGTATGTTGTAACTAAAGTGCTCAG
CTTCCTTTCGGGCTTTGTTAGCAGCC) yüksek kaliteli DNA polimeraz kitini kullanan primerler ( Malzeme Tablosuna bakınız)- Aşağıdaki gibi 100 μL'lik bir reaksiyon ayarlayın: 75 μL nükleaz içermeyen su, 20 μL 5x DNA polimeraz tamponu, 2 μL 10 mM dNTP (nihai konsantrasyon 200 μM), 0.5 μL 100 μM Ter-FW primer, 0.5 μL 100 μM Ter-RV primer, 1 μL 10 ng/μL tek sarmallı LET, 1 μL(2U) DNA polimeraz.
- Aşağıdaki PCR ayarlarını kullanın: 30 saniye boyunca 98 °C'de ilk denatürasyon; 35 döngü: 6 sn için 98 °C, 15 sn için 60 °C, 90 sn için 72 °C; 4 °C'de tutun.
- PCR ürününü ticari bir PCR saflaştırma kiti kullanarak saflaştırın, %1'lik bir agaroz jeli üzerinde bir numune çalıştırarak kalitesini kontrol edin ve konsantrasyonunu bir UV-Vis spektrofotometresinde ölçün.
NOT: Ham PCR ürünleri, hücresiz ifade için doğrudan da kullanılabilir. Bununla birlikte, saflaştırma daha standart bir prosedüre izin verir.

Şekil 1: SARS-CoV-2-NP için doğrusal ifade şablonu. His-SpyTag-SARS-CoV-2 NP doğrusal DNA şablonunun özelliklerini temsil eden bir şema. Anahtar DNA şablon elemanları etiketlenmiştir. İlgilenilen protein için kodlama dizisi, burada NP, verimli ekspresyon için bir T7 promotörün transkripsiyonel kontrolü altına yerleştirilir. N-terminalinde, NP proteini, SpyCatcher2-Apex2 algılama reaktifi kullanılarak spesifik algılama için bir SpyTag ile eklenir. x6His-tag ve TEV proteaz bölgeleri, genel LET tasarımının bir parçası olarak dahil edilmesine rağmen, CFDB amaçları için vazgeçilebilir. Doğrusal DNA şablonunun uç noktasında, her biri ilgili 50 baz çifti tampon dizisinden önce gelen "yukarı akış" ve "aşağı" Ter bölgeleri, hücresiz lizatta ekzonükleolitik DNA bozulmasına karşı Tus aracılı koruma için dahil edilir. Kısaltmalar: NP = nükleokapsid proteini; LET = doğrusal ifade şablonu; TEV = tütün aşındırma virüsü; CFDB = hücresiz nokta lekesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. SpyCatcher2-Apex2 raportör proteininin saflaştırılması
- SpyCatcher2-Apex-2 raportör proteinini hazırlamak için orijinal olarak Norouzi ve ark.5'te ( Ek Dosya 2'de tam dizi ve Ek Şekil S1'de plazmit haritası) oluşturulan pET24b-SpyCatcher2-Apex2 plazmidini kullanın.
- 50 μg/mL kanamisin içeren agar plakaları ve lizojen suyu (LB) hazırlayın. E. coli BL21 (DE3) hücrelerini pET24b-SpyCatcher2-Apex2 plazmidi ile dönüştürün. Tek bir koloniyi 15 mL'lik bir başlangıç LB kültürüne aşılayın ve 250 RPM'de çalkalayarak 37 ° C'de gece boyunca büyütün.
- Ertesi gün, 50 μg / mL kanamisin içeren 500 mL taze LB ortamına 10 mL başlangıç kültürü ekleyin. Kültür 600 nm'de 0.6-0.8 (~ 3 saat) optik yoğunluğa ulaşana kadar 250 RPM'de çalkalayarak 37 ° C'de inkübe edin.
- Kültürü 0.5 mM izopropil-β-D-1-tiyogalaktopiranosid ve 1 mM 5-aminolevulinik asit hidroklorür ile takviye ederek SpyCatcher2-Apex2 ekspresyonunu indükleyin. Büyüme sıcaklığını 30 ° C'ye düşürün ve kültürün 4 saat daha kuluçkaya yatmasına izin verin.
- Bakterileri 15 dakika boyunca 8.000 × g'da santrifüjleme ile hasat edin. Hücre lizisine devam edin veya alternatif olarak peleti kullanana kadar -80 °C'de saklayın.
- Pelet, 50 mM Tris-HCl (pH 7.8), 300 mM NaCl, 1 mg / mL lizozim, EDTA içermeyen proteaz inhibitör tableti ve 1 mM ditiyotreitol (DTT) içeren 20 mL lizis tamponunda yeniden süspanse edin. Hücreleri, toplam 3 dakikalık bir AÇIK süre boyunca 5 s AÇIK ve 10 s KAPALI aralıklarla% 50 genlikte sonikasyon ile parçalayın.
- Lizatı 4 ° C'de 1 saat boyunca 20.000 × g'da santrifüjleme ile arıtın. Süpernatanı 0,2 μm'lik bir şırınga filtresinden geçirin.
- Arıtılmış lizata 250 μM'lik bir nihai konsantrasyona hemin klorür ekleyin ve gece boyunca 4 ° C'de inkübe edin. Protein saflaştırmasına devam edin.
NOT: Hemin klorür ile inkübasyon, optimal enzim aktivitesi için Apex-2 peroksidaza hem katılımını en üst düzeye çıkarır. - Arıtılmış lizata 2,5 mL Ni reçinesi ekleyin ve 4 ° C'de 45 dakika hafifçe çalkalayarak inkübe edin. Karışımı bir yerçekimi akış kolonuna uygulayın ve reçineyi 50 mL Tris tamponu (50 mM Tris-HCl (pH 7.8), 300 mM NaCl ve 1 mM DTT) ile yıkayın.
- SpyCatcher2-Apex2 proteinini 400 mM imidazol içeren 25 mL Tris tamponunda elute edin. Konsantre ve tampon, 0.5-1.0 mL'lik bir nihai hacmi hedefleyen bir santrifüj filtre ünitesi kullanarak elüatı Tris tamponuna dönüştürür.
- Bir UV-Vis spektrofotometresinde protein konsantrasyonunu belirlemek için SpyCatcher2-Apex2'nin (27,390 M-1 cm-1) molar sönme katsayısını kullanın. %40'lık bir nihai konsantrasyona gliserol ekleyin ve alikotları -20 °C'de saklayın.
NOT: Bu protokolün, standart 96 örnekli bir leke boyutunda 400 CFDB çalışması için yeterli olan yaklaşık 40 mg yüksek saflıkta ve aktif SpyCatcher2-Apex2 vermesi beklenmektedir. - Konvansiyonel western blot9 kullanarak SpyTagged proteinlerinin tespiti ve CFDB deneyleri için, zarları her zaman% 0.05 Tween-20 (TBST) içeren 1x Tris tamponlu tuzlu su içinde% 5 yağsız kuru sütte bloke edin. SpyCatcher2-Apex2 proteinini bloke edici çözeltide 10 μg / mL'lik bir nihai konsantrasyonda kullanın.
NOT: SpyCatcher2-Apex2 raporlayıcısı, sinyal geliştirme için gelişmiş kemilüminesans (ECL) çözümü gerektirir. ECL çözeltisi ticari olarak elde edilebilir veya Mruk ve ark.10'daki talimatlara göre şirket içinde hazırlanabilir. Buradaki nihai ECL çözeltisi, 100 mM Tris-HCl'de (pH 8.6) 0.4 mM p-kumarik asit, 2.5 mM luminol ve %0.015H2O2'denoluşur.
3. Antijenlerin hücresiz üretimi ve kalite kontrolü
- Levine ve ark.11 ve Norouzi ve ark.5'teki talimatları izleyerek bir E. coli BL21 hücresiz ekspresyon lizat ve reaksiyon bileşenlerini hazırlayın ve birleştirin. Temsili bir 100 μL reaksiyon için son reaksiyon karışımını 5 μM Tus proteini ve 1.2 μM T7 RNA Polimeraz ile tamamlayın: 14.6 μL Çözelti A, 14 μL Çözelti B, 33.3 μL E. coli BL21 lizat, 2.5 μL 200 mM Tus proteini, 1.2 μL 100 mM T7 RNA polimeraz, 1 μL 1.5 μM lineer DNA şablonu, 33.4 μL nükleaz içermeyen su.
NOT: Bir E. coli BL21 hücresiz lizat hazırlamaya ilişkin temel talimatlar için Ek Dosya 3'e ve Çözelti A ve B'nin ayrıntılı bir tarifi için Ek Tablo S1'e bakın. E. coli hücresiz ekspresyon sistemi, reaksiyon Tus ve T7 RNA Polimeraz ile desteklendiği sürece alternatif protokoller kullanılarak da hazırlanabilir veya ticari olarak elde edilebilir. - Bir PCR tüpündeki hücresiz reaksiyona %10 (h/h) ham PCR ürünü ekleyerek ilk 5 μL ölçekli ekspresyon testi gerçekleştirin. 30 °C'de 15 saat çalkalamadan inkübe edin.
- % 12 sodyum dodesil sülfat poliakrilamid jel (SDS-PAGE) üzerine 1 μL hücre serbest reaksiyonu yükleyerek NP antijeninin ekspresyon kalitesini kontrol edin ve ardından adım 2.12'de tarif edildiği gibi western blot için bir nitroselüloz membrana aktarın. SpyTag aracılığıyla leke etiketleme için SpyCatcher2-Apex2 raportör proteinini ve isteğe bağlı olarak hedef antijene karşı spesifik bir ticari antikor (burada bir anti-SARS-CoV-2-NP) kullanın.
- CFDB testi için kullanılacak 15 nM saflaştırılmış LET ürünü ile 1 mL ölçekli hücresiz bir reaksiyonu birleştirin. Ekspresyon karışımını 15 mL'lik konik bir tüpte 80 RPM'de 30 ° C'de 15 saat çalkalayarak inkübe edin. Western blot kullanarak ifade kalitesini kontrol edin ve 50 μL'lik alikotları -20 °C'de saklayın.
4. Serum örnekleri
- İnsan / hayvan serumu (veya plazma) örneklerini ticari kaynaklardan veya klinik işbirlikçilerden veya standart prosedürleri kullanarak ve kurumsal insan araştırmaları etik komitesi veya hayvan bakımı ve kullanımı komitesinin yönergelerini izleyerek kurum içinde alın. Kontaminasyon risklerini azaltmak için uygun numune ön işlem önlemlerinin alındığından emin olun.
NOT: Ön arıtma önlemleri, solvent-deterjan işlemini, ısı inaktivasyonunu ve kan yoluyla bulaşan virüs belirteçlerinin test edilmesini içerebilir. Tam kandan serum ve plazma izolasyonu için yararlı bir protokol mevcuttur12. Diğer immünoassay platformlarında olduğu gibi, ilk enfeksiyon veya hastalık başlangıcından erken (<3 hafta) sonra toplanan serum örneklerinin yeterli düzeyde antikor yanıtı içermesi beklenmemektedir ve sonuçları dikkatle tedavi edilmelidir. - SARS-CoV-2 NP CFDB reaktiflerinin kalite doğrulaması için, Ulusal Biyolojik Standartlar ve Kontrol Enstitüsü (NIBSC) Dünya Sağlık Örgütü'nün (WHO) anti-SARS-CoV-2 immünoglobulin için uluslararası referans panelini kullanın, değişen seviyelerde anti-NP immünoglobulinlere sahip x1 COVID-19 öncesi ve x4 SARS-CoV-2 pozitif numuneler13. Alternatif olarak, diğer kaynaklardan önceden karakterize edilmiş sağlıklı ve pozitif serum örneklerini kullanın.
- CFDB deneyleri için, doğruluğu artırmak ve sonuçların analizini ve yorumlanmasını kolaylaştırmak için birden fazla (>3) sağlıklı serum örneğini bir araya getirerek bir negatif kontrol örneği alın veya hazırlayın.
5. Hücresiz Nokta Lekesi (CFDB) prosedürü
- Ana ızgara görüntü dosyasını indirin ve yazdırın (Ek Şekil S2). Ana ızgara, her biri 2 mm çapında 12 x 12 daire içeren 6 x 6 cm'lik bir desendir ve 96 oyuklu bir plakaya benzer bir tespit kapasitesi sağlar.
- Izgarayı iki kat yapışkan PCR plaka sızdırmazlık filmi arasına sıkıca sıkıştırın ve dış ızgara sınırları boyunca boyutuna göre kesin. İşaretli her daireyi oymak için 2 mm'lik bir biyopsi zımbası kullanın.
NOT: Bu ana ızgara, %70 etanol ile silindikten sonra birden çok kez yeniden kullanılabilir. - 6.5 x 6.5 cm'lik bir nitroselüloz membran parçası kesin ve temiz bir yüzey üzerinde ana ızgaranın altına yerleştirin, kurulumu Şekil 2 ve Ek Şekil S3'te gösterildiği gibi yapışkan bant kullanarak sabitleyin. Numune lekelenmesinden sonra zarı kesmek için bir kılavuz olarak kullanılacak nitroselüloz membran üzerindeki en dıştaki daire konumlarını işaretlemek için bir işaretleyici kalem kullanın.
- Serum örneklerini 1/10 oranında 1x fosfat tamponlu salin (pH 7.4) içinde seyreltin. Her numunenin 0,4 μL hacmini önceden belirlenmiş ızgara konumlarında nitroselüloz membran üzerine üçlü olarak dağıtmak için bir mikropipet kullanın. Dağıtmak için nokta başına yaklaşık 15 s sürecektir.
NOT: Sonuçların analizi için gerekli olacağından, her tahlilde hem negatif hem de pozitif kontrol numunelerini eklediğinizden emin olun. - Benekli numunelerin bağlanması ve kuruması için ortam sıcaklığında 10 dakika bekleyin. Cımbız kullanarak nitroselüloz membranı dikkatlice alın ve işaretli dış daireler boyunca kesin.
- Membranı 10 cm'lik bir Petri kabında 10 mL bloke edici solüsyonda (TBST'de %5 yağsız kuru süt) oda sıcaklığında 30 dakika boyunca 100 RPM'de hafifçe çalkalayarak bloke edin.
- 10 cm'lik bir Petri kabında 5 mL bloke edici çözeltiye hücre içermeyen antijen ekspresyon karışımının 50 μL'lik bir alikotunu çözün ve ekleyin. Membranı doğrudan bu antijen içeren çözeltiye aktarın ve 100 RPM'de çalkalayarak oda sıcaklığında 1 saat inkübe edin.
NOT: Bu, SpyTagged antijeninin varsa antikor içeren nokta pozisyonlarına bağlanacağı birincil tespit adımı olacaktır. - Membranı durulayın, 5 dakika yıkayın ve ikincil algılama adımına geçmeden önce TBST'de tekrar durulayın.
- Membranı, 100 RPM'de çalkalarken 1 saat boyunca 10 μg / mL saflaştırılmış SpyCatcher2-Apex2 proteini içeren 10 mL bloke edici tamponda inkübe edin.
- Membranı durulayın ve TBST'de 2 x 5 dakika yıkayın, TBS'de son bir durulama ile.
- Leke görüntüleme cihazına yakın temiz bir çalışma alanına bir parça parafilm yapıştırın ve sabitleyin. Zara cımbız kullanarak vurarak fazla sıvıyı çıkarın ve zarı parafilmin üzerine yerleştirin.
- Hemen membranın üzerine 3 mL (100 μL/cm2) ECL solüsyonu ekleyin ve oda sıcaklığında tam olarak 90 saniye inkübe edin.
- Membranı hemen muslukla kurutun ve sonuçların görselleştirilmesi için kemilüminesans uyumlu bir görüntüleme cihazına aktarın.
NOT: Optimum görüntüleme süresi farklı cihazlara göre değişebilir. Cihazın varsayılan otomatik çekim süresi ayarlarının kullanılması ve yoksa, görüntü alma süresini optimize etmek için önceden karakterize edilmiş serum örneklerinin kullanılması önerilir. - Nitroselüloz membran üzerindeki üç boş (arka plan) konum dahil olmak üzere nokta yoğunlukları elde etmek için cihazın görüntü analizi işlevini kullanın; Nokta başına sabit bir ölçüm hacmini koruyun. Verileri bir elektronik tabloya aktarın ve her bir nokta konumunu doğru şekilde etiketlemeyi unutmayın.
- Üçlü spot yoğunluklarının Ortalama ve Standart Sapmasını (SD) hesaplayın. Ardından, nitroselüloz membran arka planını tüm numunelerden çıkarın.
- -/+ sonuçlarının yorumlanması için bir kesme değeri elde etmek için aşağıdaki denklemi kullanın:
(Negatif kontrollerin ortalaması) + (negatif kontrollerin 3 x SD'si). Ortalama yoğunlukları kesme değerinin üzerine düşerse numuneleri pozitif, ortalama yoğunlukları kesme değerinin altına düşerse negatif olarak kabul edin.
NOT: CFDB prosedürünün bir şeması Şekil 3'te verilmiştir.
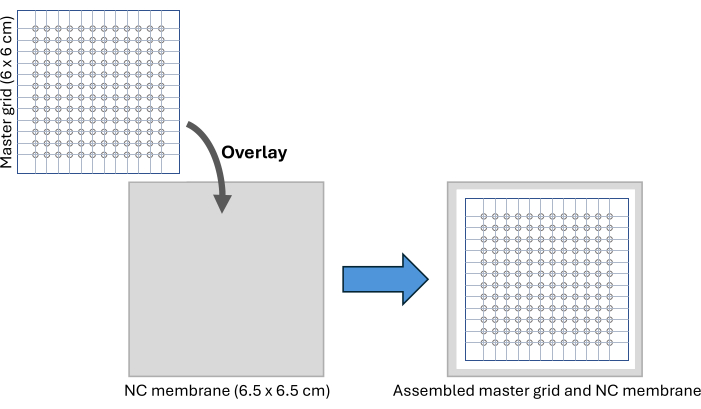
Şekil 2: CFDB montajı. CFDB ana ızgarasının ve NC membran montaj kurulumunun bir şeması. Ana ızgara, serum numunelerinin lekelenmesi ve immobilizasyonu için düzenli, adreslenebilir bir model sağlamak üzere NC membranı üzerine yerleştirilmiştir. Kısaltmalar: CFDB = hücresiz nokta lekesi; NC = nitroselüloz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
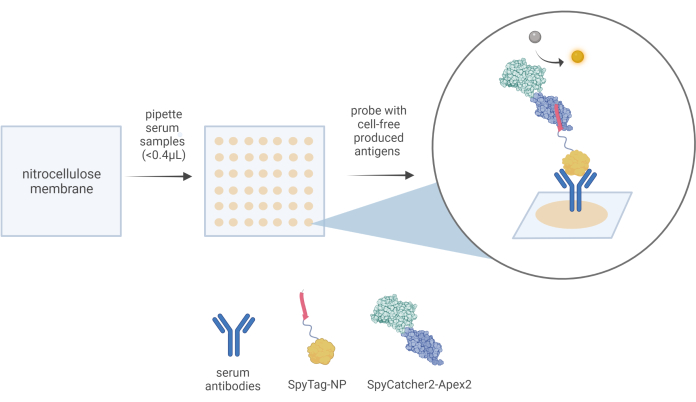
Şekil 3: CFDB iş akışının şematik bir gösterimi. Bir CFDB tahlilinde, küçük bir miktar (<0.4 μL) 10x seyreltilmiş serum numunesi, ayrı, adreslenebilir konumlarda (orta panel) önceden kesilmiş bir nitroselüloz membran (sol panel) üzerine manuel olarak dağıtılır. Nokta başına bir serum örneğinin üçlü noktalara bırakılması ve serumun toplam antikor rezervuarı da dahil olmak üzere protein içeriğinin katı NC substratı (orta panelde bej lekeler) üzerinde hareketsiz hale getirilmesi. Bu örnekte, serum örneklerinde bulunan anti-NP antikorları ilk olarak CFDB birincil tespit reaktifi SpyTag-NP tarafından bağlanabilir ve son olarak CFDB ikincil tespit reaktifi SpyCatcher2-Apex2 (sağ panel büyütülmüş kabarcık) tarafından tespit edilebilir. Bu rakam Norouzi ve ark.5'ten alınmıştır. Kısaltmalar: CFDB = hücresiz nokta lekesi; NP = nükleokapsid proteini; LET = doğrusal ifade şablonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Hedef antijen için doğrusal ekspresyon şablonunun PCR amplifikasyonu
SARS-CoV-2 NP LET'i PCR-amplifiye etmek için, protokol bölüm 1.2'de açıklandığı gibi evrensel Ter ileri ve geri primerler kullanıldı ve ürünün 1 μL'si bir agaroz jel üzerinde kontrol edildi (Şekil 4) PCR ürününün saflaştırılmasına geçmeden önce.
Tartışmalar
COVID-19, enfeksiyon salgınlarını kontrol etmek ve küresel sağlık stratejilerini optimize etmek için erişilebilir ve sağlam teşhislerin önemini vurguladı. Koruyucu antikorları tespit eden serolojik testler, yeni varyantların bulaşıcılık modellerini izlemek, sıcak noktaları belirlemek, aşı geliştirmeye rehberlik etmek, şüpheli vakaları triyaj yapmak ve savunmasız popülasyonları korumak için gerekli olduğunu kanıtladı14. Pandemi ayn?...
Açıklamalar
M.N. ve K.P., hücresiz nokta leke yönteminin ortak mucitleridir. Bu çalışma ile ilgili geçici bir patent başvurusu yapılmıştır (PCT/CA2024/050097, Ocak 2024'te dosyalanmıştır).
Teşekkürler
S.S. ve R.Z., Savunma İleri Araştırma Projeleri Ajansı (DARPA), Sözleşme No. N66001-23-2-4042'den sağlanan fonlarla desteklenmektedir. İfade edilen görüşler, fikirler ve/veya bulgular yazarlara aittir ve Savunma Bakanlığı veya ABD Hükümeti'nin resmi görüşlerini veya politikalarını temsil ettiği şeklinde yorumlanmamalıdır. Bu çalışma, CIHR Vakfı hibe programı (201610FDN-375469), CIHR Kanada Araştırma Kürsüsü Programı (950-231075 ve 950-233107), Toronto Üniversitesi'nin Tasarım Yoluyla Tıp Girişimi'nden K.P.'ye sağlanan fonlarla desteklenmiştir. Şekil 1 ve Ek Şekil S1 , SnapGene Viewer kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 kb DNA ladder | NEB | N3232 | Used as a size marker for agarose gels |
| 20 Amino acids | Sigma-Aldrich | LAA21-1KT | A component of the cell-free reaction Solution B |
| 2 mm biopsy punch | Integra Miltex | 33-31-P/25 | For preparation of CFDB master grid |
| 5-aminolevulinic acid hydrochloride | Sigma-Aldrich | A3785 | Heme precursor for induction of SpyCatcher2-Apex2 |
| Agarose powder | BioShop | AGA002 | For electrophoretic analysis of DNA |
| Anti-SARS-CoV2-Nucleocapsid antibody | Sinobiological | 40588-T62 | For WB detection of cell-free produced NP antigen |
| Bio-Rad ChemiDoc XRS+ | Bio-Rad | N/A | Gel imager instrument |
| Centrifugal concentrators | Cytiva | 28-9323-60 | For concentration and buffer exchange of proteins |
| Centrifuge | Eppendorf | EP022628257 | For harvesting bacterial culture |
| Coenzyme A sodium salt hydrate (CoA) | Sigma-Aldrich | C3144 | A component of the cell-free reaction Solution A |
| Color pre-stained protein standard (broad range) | NEB | P7719 | Used as a size marker for SDS-PAGE gels |
| Covid-19 serum panel | RayBiotech | CoV-PosSet | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| D-(−)-3-Phosphoglyceric acid disodium salt (3-PGA) | Sigma-Aldrich | P8877 | A component of the cell-free reaction Solution B |
| Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Component of buffers |
| E. coli 5-alpha | NEB | C2987 | for plasmid preparation |
| E. coli BL21 | NEB | C2530 | For preparation of cell-free lysates |
| E. coli BL21 (DE3) | NEB | C2527 | For expression of SpyCatcher2-Apex2 |
| EDTA-free protease inhibitor tablet | Sigma-Aldrich | 11836153001 | A component of E. coli lysis buffer |
| Eppendorf New Brunswick Innova 43/43R Incubator Shaker | Eppendorf | EPM1320 | Incubator for growing E. coli cells for protein expression and cell-free lysate preparation |
| Folinic acid | Sigma-Aldrich | 47612 | A component of the cell-free reaction Solution A |
| Glycerol | Sigma-Aldrich | G9012 | Component of SpyCatcher2-Apex2 storage buffer |
| Hemin chloride | Sigma-Aldrich | H9039 | For Heme supplementation of SpyCatcher2-Apex2 |
| Hydrogen peroxide 30% | Sigma-Aldrich | H1009 | For making ECL reagent |
| Image Lab Software | Bio-Rad | 1709690 | Software for ChemiDoc gel imaging instrument |
| Isopropyl-b-D-1-thiogalactopyranoside | Bioshop | IPT001 | For induction of SpyCatcher2-Apex2 expressikon |
| Kanamycin Sulfate | Sigma-Aldrich | 60615 | For preparation of SpyCatcher2-Apex2 bacterial culture |
| LB agar | BioShop | LBL406 | For E. coli growth |
| LB broth | BioShop | LBL407 | For E. coli growth |
| luminol | Sigma-Aldrich | A4685 | For making ECL reagent |
| Lysozyme | Sigma-Aldrich | L6876 | For lysis of bacterial cells |
| Magnesium Acetate | Sigma-Aldrich | M5661 | A component of the cell-free reaction Solution B |
| NEBExpress Ni resin | NEB | S1428S | For purification of SpyCatcher2-Apex2 |
| Non-fat dry milk | Bioshop | SKI400 | For blocking of WB and CFDB membranes |
| Parafilm | Bemis | 2099-1337410 | For ECL-incubation of CFDB blots |
| p-coumaric acid | Sigma-Aldrich | C9008 | For making ECL reagent |
| pET24b-SpyCatcher2-Apex2 plasmid | Pardee Laboratory | N/A | Used for the expression of SpyCatcher2-Apex2 protein |
| Petri dish | Fisherbrand | FB0875712 | Container for WB and CFDB membrane incubation |
| Phosphate buffered saline 10% | BioShop | PBS405 | Component of buffers |
| Potassium Glutamate | Sigma-Aldrich | G1501 | A component of the cell-free reaction Solution B |
| Potassium Oxalate Monohydrate (Oxalic acid) | Sigma-Aldrich | 223425 | A component of the cell-free reaction Solution A |
| Precast SDS-PAGE gel | BioRad | 4561036EDU | For electrophoretic analysis of protein |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification of LETs |
| QIAquick PCR purification kit | Qiagen | 28106 | For purification of LETs |
| Ribonucleotide Solution Set | NEB | N0450S | A component of the cell-free reaction Solution A |
| Skim milk powder | BioShop | SKI400 | Used as a blocking agent for western blot and CFDB |
| Sodium Chloride | Sigma-Aldrich | S9625 | A component of protein purification buffers |
| Sonicator | Qsonica | Q500 | For lysis of bacterial cells |
| Spermidine | Sigma-Aldrich | S2626 | A component of the cell-free reaction Solution A |
| Syringe filter | Sigma-Aldrich | SLGSR33SS | For sterilisation of buffers and solutions |
| Thermocycler | BioRad | T100 | Instrument for incubating PCR reactions |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8759 | A component of the cell-free reaction Solution A |
| Tris buffered saline | Thermo Scientific | J60764.K2 | Component of WB and CFDB wash buffer |
| Trizma base | Sigma-Aldrich | T1503 | For making tris buffer |
| Tunair SS-5012 Half-Baffle Shake Flask, 2.5 L | Cole-Parmer | RK-01835-39 | Vessel for growing E. coli cells for protein expression and cell-free lysate preparation |
| Tween-20 | BioShop | TWN510 | Component of WB and CFDB wash buffer |
| Tweezer | Almedic | 7728-A10-100 | For handling CFDB NC membrane |
| UV-Vis spectrophotometer | Thermo Scientific | 13400518 | Used for the measurement of nucleic acid and DNA concentration and bacterial culture OD |
| WHO International Reference Panel for anti-SARS-CoV-2 immunoglubulin | NISBC | 20/268 | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| β-Nicotinamide adenine dinucleotide hydrate (NAD) | Sigma-Aldrich | 10127965001 | A component of the cell-free reaction Solution A |
Referanslar
- Carter, L. J., et al. Assay techniques and test development for COVID-19 diagnosis. ACS Cent Sci. 6, 591-605 (2020).
- Amanat, F., et al. A serological assay to detect SARS-CoV-2 seroconversion in humans. Nat Med. 26 (7), 1033-1036 (2020).
- Stadlbauer, D., et al. SARS-CoV-2 seroconversion in humans: A detailed protocol for a serological assay, antigen production, and test setup. Curr Protoc Microbiol. 57 (1), e100 (2020).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259.e12 (2016).
- Norouzi, M., et al. Cell-free dot blot: an ultra-low-cost and practical immunoassay platform for detection of anti-SARS-CoV-2 antibodies in human and animal sera. Microbiol Spectr. 11 (2), e0245722 (2023).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2014).
- Norouzi, M., Panfilov, S., Pardee, K. High-efficiency protection of linear DNA in cell-free extracts from Escherichia coli and Vibrio natriegens. ACS Synth Biol. 10 (7), 1615-1624 (2021).
- . IDT codon optimization tool Available from: https://www.idtdna.com/pages/tools/codon-optimization-tool (2025)
- . General protocol for western blotting Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6376.pdf (2025)
- Mruk, D. D., Cheng, C. Y. Enhanced chemiluminescence (ECL) for routine immunoblotting. Spermatogenesis. 1, 121-122 (2011).
- Levine, M. Z., Gregorio, N. E., Jewett, M. C., Watts, K. R., Oza, J. P. Escherichia coli-based cell-free protein synthesis: Protocols for a robust, flexible, and accessible platform technology. J Vis Exp. (144), (2019).
- . Plasma and serum preparation Available from: https://www.thermofisher.com/ca/en/home/references/protocols/cell-and-tissue-analysis/elisa-protocol/elisa-sample-preparation-protocols/plasma-and-serum-preparation.html (2025)
- Mattiuzzo, G., et al. . WHO/BS.2020.2403 Establishment of the WHO International Standard and Reference Panel for anti-SARS-CoV-2 antibody. , (2020).
- Gong, F., Wei, H., Li, Q., Liu, L., Li, B. Evaluation and comparison of serological methods for COVID-19 diagnosis. Front Mol Biosci. 8, 682405 (2021).
- Peeling, R. W., et al. Serology testing in the COVID-19 pandemic response. Lancet Infect Dis. 20 (9), e245-e249 (2020).
- Smith, M. T., Berkheimer, S. D., Werner, C. J., Bundy, B. C. Lyophilized Escherichia coli-based cell-free systems for robust, high-density, long-term storage. Biotechniques. 56 (4), 186-193 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır