Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Бесклеточный дот-блот как практичная и адаптируемая платформа иммуноферментного анализа для выявления ответа антител в сыворотке крови человека и животных
В этой статье
Резюме
Мы описываем недавно разработанную платформу иммуноферментного анализа, основанную на принципах бесклеточной синтетической биологии и методе дот-блоттинга для настраиваемого обнаружения ответа антител в сыворотках крови человека и животных.
Аннотация
Череда глобальных патогенных вспышек за последние два десятилетия высветила важность стратегий серонадзора. Платформы иммуноферментного анализа, которые служат для обнаружения специфических антител к заболеванию в сыворотке крови пациентов, лежат в основе серонадзора. Типичными примерами являются иммуноферментные анализы и анализы бокового потока; Однако, несмотря на то, что эти методы являются золотым стандартом, они требуют расходных материалов и специализированного оборудования, специфичных для патогенов, что ограничивает их использование за пределами хорошо обеспеченных ресурсами лабораторий.
Недавно мы разработали новую платформу иммуноферментного анализа под названием Cell-Free Dot-Blot (CFDB) и валидировали ее с использованием сывороток человека и животных против SARS-CoV-2. В отличие от обычных иммунологических анализов, образцы сыворотки пациента с CFDB иммобилизуются до твердой фазы (нитроцеллюлозной мембраны), в то время как целевой антиген суспендируется в подвижной фазе анализа. Для улучшения доступа к возможностям серонадзора антигены CFDB производятся по требованию и с использованием инфраструктуры с низким уровнем нагрузки с использованием экспрессии белков in vitro . Здесь антиген сливается с пептидной меткой, которую можно обнаружить с помощью одного универсального репортерного белка для любого анализа CFDB. В результате CFDB не требует доступа к считывателю с несколькими лунками или очищенным коммерческим молекулярным компонентам. С учетом этих соображений CFDB устраняет недостатки существующих платформ иммуноферментного анализа, обеспечивая доступность для нецентрализованных лабораторий, адаптируемость к новым патогенам и доступность для сообществ с низким уровнем дохода.
В данной статье мы предоставим пошаговый протокол подготовки и проведения иммунологического анализа CFDB. Используя в качестве примера нашу недавнюю работу по SARS-CoV-2 CFDB, мы рассмотрим дизайн антигенной ДНК для бесклеточного производства по требованию, за которым последует приготовление репортерного белка CFDB, иммобилизация образцов сыворотки в твердой фазе и, наконец, этапы связывания с антигеном и обнаружения анализа. Мы ожидаем, что, следуя этим инструкциям, исследователи смогут адаптировать анализ CFDB для выявления иммунных реакций в сыворотке крови человека и животных на любой конкретный патоген.
Введение
Пандемия COVID-19 выявила острую потребность в недорогих и масштабируемых диагностических инструментах, особенно в условиях ограниченных ресурсов1. Традиционные иммунологические анализы, такие как иммуноферментный анализ (ИФА), доказали свою важность для выявления иммунных реакций 2,3. Однако их высокая стоимость, зависимость от сложных реагентов и зависимость от специализированного оборудования ограничивают их доступность, особенно во время глобальных кризисов в области здравоохранения. В ответ на эти вызовы мы разработали Cell-Free Dot Blot (CFDB) — недорогую адаптируемую платформу иммуноанализа, предназначенную для обнаружения антител к SARS-CoV-2 в сыворотках крови человека и животных.
CFDB использует бесклеточную синтетическую биологию для быстрого производства вирусных антигенов по требованию с использованием линейных шаблонов ДНК 4,5. Это устраняет необходимость в традиционных процессах клонирования, экспрессии и очистки на основе клеток, что значительно ускоряет производство антигена при одновременном снижении затрат. Метод CFDB упрощает обнаружение антител за счет использования формата dot blot, при котором сыворотки обнаруживаются непосредственно на мембранах нитроцеллюлозы. Эта система устраняет необходимость в дорогостоящих многолуночных планшетах и специализированном лабораторном оборудовании, что позволяет упростить рабочий процесс «погружения» на этапах инкубации и промывки. Платформа также использует систему SpyCatcher-SpyTag, в которой химера пероксидазы SpyCatcher2-Apex2 действует как универсальный реагент вторичного обнаружения 5,6. Он производится с использованием стандартной экспрессии на основе кишечной палочки, что устраняет зависимость от дорогостоящих коммерческих конъюгатов антител. В результате, система CFDB может выполнять серологические анализы с производительностью, сравнимой с ИФА, при значительно более низких затратах - около 3 долларов США за анализ 96 образцов по сравнению с более чем 300 долларами США за коммерческий набор ИФА5.
Чтобы продемонстрировать эффективность CFDB, мы проверили его способность обнаруживать антитела в предварительно охарактеризованных сыворотках крови человека и животных. Наши результаты тесно коррелировали с методом ИФА при выявлении положительных и отрицательных образцов на COVID-19. В дополнение к диагностике на людях мы оценили полезность CFDB на животных моделях, тестируя сыворотки от хомяков, инфицированных SARS-CoV-2, и тех, кто был вакцинирован рекомбинантным белком нуклеокапсида. Эти тесты подтвердили потенциал CFDB для использования как в человеческой, так и в ветеринарной диагностике, что делает его универсальным инструментом для мониторинга иммунных реакций у разных видов. Одним из ключевых преимуществ CFDB является ее гибкость. Просто модифицируя матрицу ДНК, кодирующую интересующий антиген, платформу можно быстро адаптировать для обнаружения антител против различных патогенов, что делает ее ценной для будущей готовности к пандемии. Его низкая стоимость, простой рабочий процесс и минимальные требования к инфраструктуре делают его особенно подходящим для децентрализованных лабораторий и сред с ограниченными ресурсами, где доступ к коммерческой диагностике ограничен.
В этой работе мы предоставим пошаговую инструкцию по подготовке и проведению анализа CFDB. Во-первых, мы рассмотрим разработку и синтез линейных матриц ДНК для бесклеточного производства антигенов, которые являются основными реагентами для обнаружения в анализе. Затем мы описываем этапы приготовления реагента для вторичного обнаружения анализа SpyCatcher2-Apex2. После этого мы предоставляем инструкции по бесклеточному производству и проверке качества самих антигенов. Наконец, мы подробно опишем процесс проведения анализа CFDB на образцах сыворотки крови человека или животных.
протокол
Все эксперименты с хомяками проводились в Национальной микробиологической лаборатории (NML) при Агентстве общественного здравоохранения Канады, одобрены Канадским научным центром здоровья человека и животных и в соответствии с рекомендациями Канадского совета по уходу за животными. Все образцы сыворотки/плазмы крови человека были получены коммерческим путем для внутреннего тестирования или предоставлены клиническими сотрудниками NML для независимого тестирования в NML.
1. Проектирование и подготовка шаблонов линейной экспрессии антигена (ЛЭТ)
- Разработайте бесклеточные экспрессионные ЛЭТ для целевого антигена на основе инструкций в Norouzi et al.7 и содержащих N/C-концевой SpyTag, как описано в Norouzi et al.5.
ПРИМЕЧАНИЕ: Здесь мы приводим подробную информацию о получении нуклеокапсидного белка SARS-CoV-2 (NP, аминокислоты 2-419).- Убедитесь, что ЛЭТ для SARS-CoV-2 NP (рис. 1 и дополнительный файл 1) содержит сайты 5' и 3' Ter с буферной последовательностью из 50 пар оснований до промотора T7 и после стоп-кодона.
- Пометьте белок NP на N-конце с помощью His 6-SpyTag-TEV.
- Получить последовательность белка из базы данных UniProt (код присоединения P0DTC9) и оптимизировать ее кодонами для экспрессии на основе E. coli с помощью инструмента оптимизации кодонов IDT8. Закажите эту последовательность для коммерческого синтеза в виде одноцепочечного фрагмента ДНК, ресуспендированного в воде с концентрацией 10 нг/мкл.
ПРИМЕЧАНИЕ: Сайт расщепления протеазы TEV и метка His6 не являются существенными особенностями в дизайне ЛЭТ.
- ПЦР амплифицируют фрагмент ДНК с помощью универсального Ter FW (GGCTCCGAATAAGTATGTTGTAACTAAAGGTGCGGCC
ACGATGCGTCCGGCGTAGAGGATCG) и Ter RV (CCGAGGCAATAAGTATGTTGTAACTAAAGGTGCTCAG
CTTCCTTTCGGGGCTTTTTTAGCAGCC) с использованием высокоточного набора ДНК-полимеразы (см. Таблицу материалов)- Организуйте реакцию объемом 100 мкл следующим образом: 75 мкл воды, не содержащей нуклеаз, 20 мкл 5x буфера ДНК-полимеразы, 2 мкл 10 мМ dNTP (конечная концентрация 200 мкМ), 0,5 мкл 100 мкМ праймера Ter-FW, 0,5 мкл 100 мкМ праймера Ter-RV, 1 мкл одноцепочечного LET 10 нг/μл, 1 мкл (2U) ДНК-полимеразы.
- Используйте следующие настройки ПЦР: начальная денатурация при 98 °С в течение 30 с; 35 циклов: 98 °C в течение 6 с, 60 °C в течение 15 с, 72 °C в течение 90 с; держать при температуре 4 °C.
- Очистите продукт ПЦР с помощью коммерческого набора для очистки ПЦР, проверьте его качество, запустив образец в 1% агарозный гель, и измерьте его концентрацию на спектрофотометре UV-VIS.
ПРИМЕЧАНИЕ: Сырые продукты ПЦР также можно использовать непосредственно для бесклеточной экспрессии. Тем не менее, очистка позволяет проводить более стандартизированную процедуру.

Рисунок 1: Шаблон линейной экспрессии для SARS-CoV-2-NP. Схема, представляющая особенности линейного шаблона ДНК His-SpyTag-SARS-CoV-2 NP. Ключевые элементы шаблона ДНК помечены. Кодирующая последовательность для представляющего интерес белка, в данном случае NP, помещается под транскрипционный контроль промотора Т7 для эффективной экспрессии. На N-конце к белку NP добавляется метка SpyTag для специфического детектирования с помощью реагента для детектирования SpyCatcher2-Apex2. Сайты протеаз x6His-tag и TEV, хотя и включены в общую конструкцию LET, не могут использоваться для целей CFDB. На концах линейной матрицы ДНК «восходящие» и «нисходящие» сайты Ter, каждому из которых предшествуют соответствующие 50 буферных последовательностей пар оснований, включены для Tus-опосредованной защиты от деградации экзонуклеолитической ДНК в бесклеточном лизате. Сокращения: NP = нуклеокапсидный белок; LET = шаблон линейного выражения; TEV = вирус травления табака; CFDB = бесклеточный точечный блоттинг. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Очистка репортерного белка SpyCatcher2-Apex2
- Используйте плазмиду pET24b-SpyCatcher2-Apex2, первоначально созданную в Norouzi et al.5 (полная последовательность в Дополнительном файле 2 и плазмидная карта на Дополнительном рисунке S1), для получения репортерного белка SpyCatcher2-Apex-2.
- Приготовьте агаровые тарелки и лизогенный бульон (LB), содержащий 50 мкг/мл канамицина. Трансформируйте клетки E. coli BL21 (DE3) с помощью плазмиды pET24b-SpyCatcher2-Apex2. Инокулируйте одну колонию в закваску LB объемом 15 мл и выращивайте в течение ночи при 37 °C с встряхиванием при 250 об/мин.
- На следующий день добавьте 10 мл закваски в 500 мл свежей среды LB, содержащей 50 мкг/мл канамицина. Инкубируют при 37 °C с встряхиванием при 250 об/мин до достижения культурой оптической плотности при 600 нм 0,6-0,8 (~3 ч).
- Индуцировать экспрессию SpyCatcher2-Apex2 путем добавления в культуру 0,5 мМ изопропил-β-D-1-тиогалактопиранозида и 1 мМ гидрохлорида 5-аминолевулиновой кислоты. Снизьте температуру роста до 30 °C и дайте культуре инкубироваться еще 4 ч.
- Соберите бактерии центрифугированием при температуре 8 000 × г в течение 15 минут. Перейдите к лизису клеток или храните гранулу при температуре -80 °C до использования.
- Ресуспендируйте гранулу в 20 мл лизисного буфера, содержащего 50 мМ Tris-HCl (pH 7,8), 300 мМ NaCl, 1 мг/мл лизоцима, таблетку ингибитора протеазы без ЭДТА и 1 мМ дитиотреитол (DTT). Лизируйте клетки с помощью ультразвука с амплитудой 50 % с интервалами 5 с ON и 10 s OFF с общим временем включения 3 мин.
- Осветите лизат центрифугированием при 20 000 × г в течение 1 ч при 4 °C. Пропустите надосадочную жидкость через шприцевой фильтр 0,2 мкм.
- Добавьте хлорид гемина до конечной концентрации 250 мкМ к осветленному лизату и инкубируйте в течение ночи при 4 °C. Приступайте к очищению белка.
ПРИМЕЧАНИЕ: Инкубация с хлоридом гемина максимизирует включение гема в пероксидазу Apex-2 для оптимальной активности фермента. - Добавьте 2,5 мл смолы Ni в осветленный лизат и инкубируйте при температуре 4 °C с легким встряхиванием в течение 45 минут. Нанесите смесь на колонку с гравитационным потоком и промойте смолу 50 мл трис-буфера (50 мМ Tris-HCl (pH 7,8), 300 мМ NaCl и 1 мМ DTT).
- Разбавьте белок SpyCatcher2-Apex2 в 25 мл трис-буфера, содержащего 400 мМ имидазола. Концентрат и буфер обменивают элюат на трис-буфер с помощью центробежного фильтрующего блока, достигая конечного объема 0,5-1,0 мл.
- Используйте молярный коэффициент экстинкции SpyCatcher2-Apex2 (27 390 M-1 см-1) для определения концентрации белка на УФ-ВИД спектрофотометре. Добавьте глицерин до конечной концентрации 40% и храните аликвоты при температуре -20 °C.
ПРИМЕЧАНИЕ: Ожидается, что этот протокол даст примерно 40 мг высокочистого и активного SpyCatcher2-Apex2, что достаточно для 400 прогонов CFDB при стандартном размере 96 образцов. - Для обнаружения белков SpyTagged с помощью обычного вестерн-блот-9 и для экспериментов с CFDB всегда блокируйте мембраны в 5% обезжиренном сухом молоке в 1x Трис-буферном физрастворе, содержащем 0,05% Tween-20 (TBST). Используйте белок SpyCatcher2-Apex2 в конечной концентрации 10 мкг/мл в блокирующем растворе.
ПРИМЕЧАНИЕ: Для создания сигнала репортера SpyCatcher2-Apex2 требуется решение с улучшенной хемилюминесценцией (ECL). Раствор ECL может быть получен в промышленных масштабах или приготовлен на месте в соответствии с инструкциями в Mruk et al.10. Конечный раствор ECL здесь состоит из 0,4 мМ-кумаровой кислоты, 2,5 мМ люнола и 0,015%Н2О2 в 100 мМ трис-HCl (рН 8,6).
3. Бесклеточное производство и контроль качества антигенов
- Приготовьте и соберите бесклеточный лизат экспрессии E. coli BL21 и компоненты реакции, следуя инструкциям в Levine et al.11 и Norouzi et al.5. Дополнить конечную реакционную смесь 5 мкМ белком Tus и 1,2 мкМ РНК-полимеразой T7 следующим образом для репрезентативной реакции объемом 100 мкл: 14,6 мкл раствора А, 14 мкл раствора В, 33,3 мкл лизата E. coli BL21, 2,5 мкл 200 мМ белка Tus, 1,2 мкл 100 мМ РНК-полимеразы Т7, 1 мкл 1,5 мкМ линейной матрицы ДНК, 33,4 мкл воды, не содержащей нуклеаз.
ПРИМЕЧАНИЕ: Основные инструкции по получению бесклеточного лизата E. coli BL21 см. в Дополнительном файле 3 и в Дополнительной таблице S1 для подробного рецепта растворов А и В. Система бесклеточной экспрессии E. coli также может быть получена с использованием альтернативных протоколов или получена коммерчески, при условии, что реакция дополнена Tus и РНК-полимеразой T7. - Проведите первоначальный тест экспрессии в масштабе 5 μл, добавив 10% (v/v) сырого продукта ПЦР в бесклеточную реакцию в пробирке для ПЦР. Выдерживать без встряхивания при 30 °C в течение 15 часов.
- Проверьте качество экспрессии NP-антигена путем загрузки 1 мкл бесклеточной реакции на 12% полиакриламидный гель додецилсульфата натрия (SDS-PAGE) и последующего переноса его на нитроцеллюлозную мембрану для вестерн-блоттинга, как описано в шаге 2.12. Используйте репортерный белок SpyCatcher2-Apex2 для блоттинга с помощью SpyTag и, при необходимости, специфическое коммерческое антитело (в данном случае анти-SARS-CoV-2-NP) против целевого антигена.
- Соберите бесклеточную реакцию в масштабе 1 мл с очищенным продуктом LET 15 нМ для использования в анализе CFDB. Смесь для сцеживания инкубируют в конической пробирке объемом 15 мл с встряхиванием при 80 об/мин в течение 15 ч при 30 °C. Проверьте качество сцеживания с помощью вестерн-блоттинга и храните 50 мкл аликвот при температуре -20 °C.
4. Образцы сыворотки крови
- Получение образцов сыворотки (или плазмы) человека/животного из коммерческих источников или у клинических сотрудников или внутри компании с использованием стандартных процедур и в соответствии с рекомендациями институционального комитета по этике исследований на людях или комитета по уходу за животными и их использованию. Убедитесь, что были приняты соответствующие меры по предварительной обработке проб для снижения рисков загрязнения.
ПРИМЕЧАНИЕ: Меры предварительной обработки могут включать обработку растворителем и моющим средством, тепловую инактивацию и тестирование на маркеры вирусов, передающихся через кровь. Полезный протокол выделения сыворотки и плазмы из цельной крови доступен12. Как и в случае с другими платформами иммуноферментного анализа, образцы сыворотки, собранные на ранних этапах (<3 недели) после первоначального инфицирования или начала заболевания, не должны содержать адекватных уровней ответа антител, и к их результатам следует относиться с осторожностью. - Для проверки качества реагентов SARS-CoV-2 NP CFDB используйте международную референс-панель Национального института биологических стандартов и контроля (NIBSC) Всемирной организации здравоохранения (ВОЗ) по анти-SARS-CoV-2 иммуноглобулину, которая содержит x1 pre-COVID-19 и x4 SARS-CoV-2-положительных образца с различным уровнем анти-NP иммуноглобулинов13. В качестве альтернативы используйте предварительно охарактеризованные здоровые и положительные образцы сыворотки из других источников.
- Для экспериментов с CFDB получение или подготовка отрицательного контрольного образца путем объединения нескольких (>3) здоровых образцов сыворотки для повышения точности и облегчения анализа и интерпретации результатов.
5. Процедура бесклеточного точечного блоттинга (CFDB)
- Загрузите и распечатайте файл изображения мастер-сетки (дополнительный рисунок S2). Основная сетка представляет собой узор размером 6 x 6 см, содержащий 12 x 12 кругов диаметром 2 мм каждый и обеспечивающий пятнистую способность, аналогичную 96-луночному планшету.
- Плотно закрепите сетку между двумя слоями клейкой пленки для герметизации ПЦР-пластин и отрежьте по размеру вдоль внешних границ сетки. С помощью биопсийного перфоратора диаметром 2 мм выдолбите каждый отмеченный круг.
ПРИМЕЧАНИЕ: Эту основную сетку можно использовать повторно несколько раз после протирания 70% этанолом. - Отрежьте кусок нитроцеллюлозной мембраны размером 6,5 x 6,5 см и расположите его под главной сеткой на чистой поверхности, закрепив установку с помощью клейкой ленты, как показано на рисунке 2 и дополнительном рисунке S3. С помощью маркера отметьте крайние положения кругов на нитроцеллюлозной мембране, которые будут использоваться в качестве ориентира для разрезания мембраны после выделения образца.
- Разбавьте образцы сыворотки на 1/10 в 1x фосфатно-солевом буфере (pH 7,4). С помощью микропипетки распределите в три раза объем 0,4 мкл каждого образца на мембрану из нитроцеллюлозы в заданных положениях сетки. Для дозирования потребуется примерно 15 секунд на одну точку.
ПРИМЕЧАНИЕ: Обязательно включайте как отрицательные, так и положительные контрольные образцы с каждым анализом, так как это потребуется для анализа результатов. - Дайте 10 минут при температуре окружающей среды, чтобы пятнистые образцы связались и высохли. С помощью пинцета аккуратно извлеките нитроцеллюлозную мембрану и разрежьте вдоль отмеченных наружных кругов.
- Заблокируйте мембрану в 10 мл блокирующего раствора (5% обезжиренного сухого молока в TBST) в чашке Петри диаметром 10 см на 30 минут при комнатной температуре, осторожно встряхивая при 100 об/мин.
- Разморозьте и добавьте аликвоту 50 мкл смеси экспрессии бесклеточного антигена к 5 мл блокирующего раствора в чашке Петри диаметром 10 см. Перенесите мембрану непосредственно в этот антигенсодержащий раствор и инкубируйте при комнатной температуре в течение 1 ч, встряхивая при 100 об/мин.
ПРИМЕЧАНИЕ: Это будет основной этап обнаружения, на котором антиген SpyTagged будет связываться с позициями пятен, содержащими антитела, если они присутствуют. - Промойте мембрану, промойте в течение 5 минут и снова промойте в TBST, прежде чем перейти к вторичному этапу обнаружения.
- Инкубируйте мембрану в 10 мл блокирующего буфера, содержащего 10 мкг/мл очищенного белка SpyCatcher2-Apex2, в течение 1 ч при встряхивании при 100 об/мин.
- Промойте мембрану и промойте 2 x 5 минут в TBST, с заключительным полосканием в TBS.
- Приклейте и закрепите кусок парапленки на чистой рабочей площадке рядом с инструментом для блот-визуализации. Удалите лишнюю жидкость, постукивая по мембране с помощью пинцета, и поместите мембрану поверх парапленки.
- Немедленно добавьте 3 мл (100 μл/см2) раствора ECL поверх мембраны и инкубируйте при комнатной температуре ровно 90 с.
- Немедленно высушите мембрану и перенесите ее на совместимый с хемилюминесценцией инструмент визуализации для визуализации результатов.
ПРИМЕЧАНИЕ: Оптимальное время визуализации может варьироваться на разных инструментах. Рекомендуется использовать стандартные настройки времени автоматического сбора данных прибора, а при их отсутствии использовать предварительно характеризированные образцы сыворотки для оптимизации времени получения изображения. - Используйте функцию анализа изображений прибора для получения интенсивностей пятен, в том числе для трех пустых (фоновых) позиций на нитроцеллюлозной мембране; Поддерживайте постоянный объем измерения на каждую точку. Экспортируйте данные в электронную таблицу, не забывая правильно помечать каждую позицию спота.
- Вычислите среднее значение и стандартное отклонение (SD) для тройной интенсивности пятен. Затем вычтите фон нитроцеллюлозной мембраны из всех образцов.
- Используйте следующее уравнение для получения порогового значения для интерпретации результатов -/+:
(Среднее значение отрицательных контрольных значений) + (3 x SD отрицательных контрольных значений). Сэмплы считаются положительными, если их средняя интенсивность падает выше порогового значения, и отрицательными, если их средняя интенсивность падает ниже порогового значения.
ПРИМЕЧАНИЕ: Схема процедуры CFDB представлена на рисунке 3.
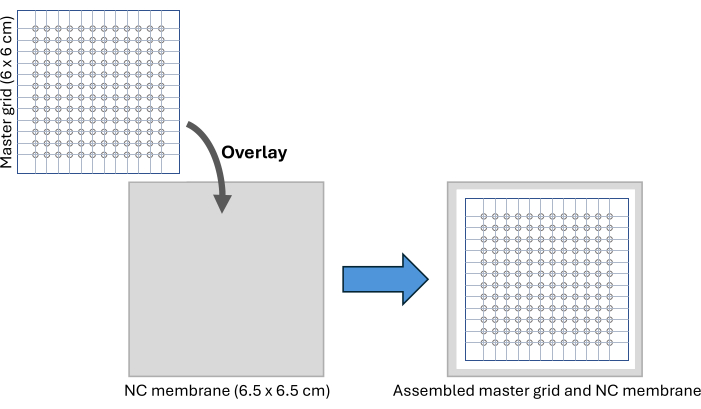
Рисунок 2: Сборка CFDB. Схема настройки главной сетки CFDB и сборки мембраны ЧПУ. Мастер-сетка накладывается на мембрану NC для обеспечения регулярной, адресной картины для пятнистости и иммобилизации образцов сыворотки. Сокращения: CFDB = бесклеточный точечный блот; NC = нитроцеллюлоза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
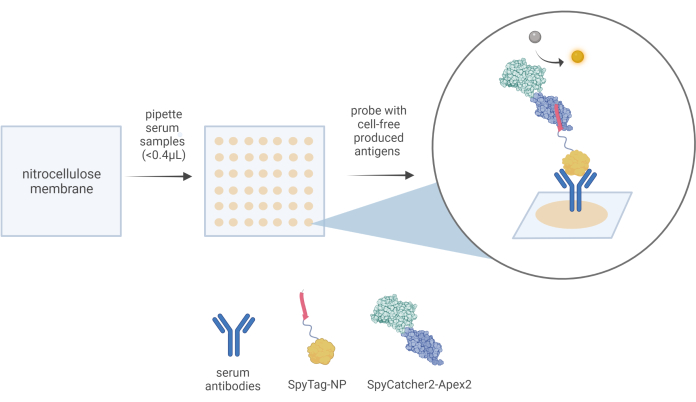
Рисунок 3: Схематическое изображение рабочего процесса CFDB. При анализе CFDB небольшое количество (<0,4 мкл) из 10-кратно разбавленных образцов сыворотки вручную наносится на предварительно разрезанную нитроцеллюлозную мембрану (левая панель) в дискретных, адресуемых местах (средняя панель). Нанесение одного образца сыворотки на пятно в тройные пятна и иммобилизация содержания белка, включая общий резервуар антител сыворотки, на твердом субстрате NC (бежевые пятна на средней панели). В этом примере анти-NP антитела, содержащиеся в образцах сыворотки, могут быть сначала связаны с первичным реагентом детектирования CFDB SpyTag-NP и, наконец, детектированы реагентом вторичного детектирования CFDB SpyCatcher2-Apex2 (увеличенный пузырь на правой панели). Эта цифра была взята из Norouzi et al.5. Сокращения: CFDB = бесклеточный точечный блот; NP = нуклеокапсидный белок; LET = шаблон линейного выражения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
ПЦР-амплификация линейной экспрессии матрицы для целевого антигена
Для ПЦР-амплификации SARS-CoV-2 NP LET использовали универсальные прямые и обратные праймеры Ter, как описано в разделе 1.2 протокола, и проверяли 1 мкл продукта на агарозном геле (рис. 4
Обсуждение
COVID-19 подчеркнул важность доступной и надежной диагностики для борьбы со вспышками инфекций и оптимизации глобальных стратегий здравоохранения. Серологическое тестирование, позволяющее выявлять защитные антитела, оказалось необходимым для отслеживания трансмисси...
Раскрытие информации
М.Н. и К.. являются соавторами метода бесклеточного точечного блоттинга. В связи с этим произведением подана предварительная патентная заявка (PCT/CA2024/050097, подана в январе 2024 года).
Благодарности
S.S. и R.Z. поддерживаются финансированием от Агентства перспективных оборонных исследовательских проектов (DARPA), контракт No N66001-23-2-4042. Выраженные взгляды, мнения и/или выводы принадлежат авторам и не должны толковаться как представляющие официальные взгляды или политику Министерства обороны или правительства США. Эта работа была поддержана средствами К.. из грантовой программы Фонда CIHR (201610FDN-375469), Канадской исследовательской программы CIHR (950-231075 и 950-233107), Инициативы Университета Торонто «Медицина по дизайну», которая получает финансирование от Канадского фонда передового опыта в области исследований и разработок и средств К.., от Министерства оборонных исследований и разработок Канады, Канадской программы безопасности и охраны (контракт 39903-200137). Рисунок 1 и дополнительный рисунок S1 были созданы с помощью SnapGene Viewer.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 kb DNA ladder | NEB | N3232 | Used as a size marker for agarose gels |
| 20 Amino acids | Sigma-Aldrich | LAA21-1KT | A component of the cell-free reaction Solution B |
| 2 mm biopsy punch | Integra Miltex | 33-31-P/25 | For preparation of CFDB master grid |
| 5-aminolevulinic acid hydrochloride | Sigma-Aldrich | A3785 | Heme precursor for induction of SpyCatcher2-Apex2 |
| Agarose powder | BioShop | AGA002 | For electrophoretic analysis of DNA |
| Anti-SARS-CoV2-Nucleocapsid antibody | Sinobiological | 40588-T62 | For WB detection of cell-free produced NP antigen |
| Bio-Rad ChemiDoc XRS+ | Bio-Rad | N/A | Gel imager instrument |
| Centrifugal concentrators | Cytiva | 28-9323-60 | For concentration and buffer exchange of proteins |
| Centrifuge | Eppendorf | EP022628257 | For harvesting bacterial culture |
| Coenzyme A sodium salt hydrate (CoA) | Sigma-Aldrich | C3144 | A component of the cell-free reaction Solution A |
| Color pre-stained protein standard (broad range) | NEB | P7719 | Used as a size marker for SDS-PAGE gels |
| Covid-19 serum panel | RayBiotech | CoV-PosSet | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| D-(−)-3-Phosphoglyceric acid disodium salt (3-PGA) | Sigma-Aldrich | P8877 | A component of the cell-free reaction Solution B |
| Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Component of buffers |
| E. coli 5-alpha | NEB | C2987 | for plasmid preparation |
| E. coli BL21 | NEB | C2530 | For preparation of cell-free lysates |
| E. coli BL21 (DE3) | NEB | C2527 | For expression of SpyCatcher2-Apex2 |
| EDTA-free protease inhibitor tablet | Sigma-Aldrich | 11836153001 | A component of E. coli lysis buffer |
| Eppendorf New Brunswick Innova 43/43R Incubator Shaker | Eppendorf | EPM1320 | Incubator for growing E. coli cells for protein expression and cell-free lysate preparation |
| Folinic acid | Sigma-Aldrich | 47612 | A component of the cell-free reaction Solution A |
| Glycerol | Sigma-Aldrich | G9012 | Component of SpyCatcher2-Apex2 storage buffer |
| Hemin chloride | Sigma-Aldrich | H9039 | For Heme supplementation of SpyCatcher2-Apex2 |
| Hydrogen peroxide 30% | Sigma-Aldrich | H1009 | For making ECL reagent |
| Image Lab Software | Bio-Rad | 1709690 | Software for ChemiDoc gel imaging instrument |
| Isopropyl-b-D-1-thiogalactopyranoside | Bioshop | IPT001 | For induction of SpyCatcher2-Apex2 expressikon |
| Kanamycin Sulfate | Sigma-Aldrich | 60615 | For preparation of SpyCatcher2-Apex2 bacterial culture |
| LB agar | BioShop | LBL406 | For E. coli growth |
| LB broth | BioShop | LBL407 | For E. coli growth |
| luminol | Sigma-Aldrich | A4685 | For making ECL reagent |
| Lysozyme | Sigma-Aldrich | L6876 | For lysis of bacterial cells |
| Magnesium Acetate | Sigma-Aldrich | M5661 | A component of the cell-free reaction Solution B |
| NEBExpress Ni resin | NEB | S1428S | For purification of SpyCatcher2-Apex2 |
| Non-fat dry milk | Bioshop | SKI400 | For blocking of WB and CFDB membranes |
| Parafilm | Bemis | 2099-1337410 | For ECL-incubation of CFDB blots |
| p-coumaric acid | Sigma-Aldrich | C9008 | For making ECL reagent |
| pET24b-SpyCatcher2-Apex2 plasmid | Pardee Laboratory | N/A | Used for the expression of SpyCatcher2-Apex2 protein |
| Petri dish | Fisherbrand | FB0875712 | Container for WB and CFDB membrane incubation |
| Phosphate buffered saline 10% | BioShop | PBS405 | Component of buffers |
| Potassium Glutamate | Sigma-Aldrich | G1501 | A component of the cell-free reaction Solution B |
| Potassium Oxalate Monohydrate (Oxalic acid) | Sigma-Aldrich | 223425 | A component of the cell-free reaction Solution A |
| Precast SDS-PAGE gel | BioRad | 4561036EDU | For electrophoretic analysis of protein |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification of LETs |
| QIAquick PCR purification kit | Qiagen | 28106 | For purification of LETs |
| Ribonucleotide Solution Set | NEB | N0450S | A component of the cell-free reaction Solution A |
| Skim milk powder | BioShop | SKI400 | Used as a blocking agent for western blot and CFDB |
| Sodium Chloride | Sigma-Aldrich | S9625 | A component of protein purification buffers |
| Sonicator | Qsonica | Q500 | For lysis of bacterial cells |
| Spermidine | Sigma-Aldrich | S2626 | A component of the cell-free reaction Solution A |
| Syringe filter | Sigma-Aldrich | SLGSR33SS | For sterilisation of buffers and solutions |
| Thermocycler | BioRad | T100 | Instrument for incubating PCR reactions |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8759 | A component of the cell-free reaction Solution A |
| Tris buffered saline | Thermo Scientific | J60764.K2 | Component of WB and CFDB wash buffer |
| Trizma base | Sigma-Aldrich | T1503 | For making tris buffer |
| Tunair SS-5012 Half-Baffle Shake Flask, 2.5 L | Cole-Parmer | RK-01835-39 | Vessel for growing E. coli cells for protein expression and cell-free lysate preparation |
| Tween-20 | BioShop | TWN510 | Component of WB and CFDB wash buffer |
| Tweezer | Almedic | 7728-A10-100 | For handling CFDB NC membrane |
| UV-Vis spectrophotometer | Thermo Scientific | 13400518 | Used for the measurement of nucleic acid and DNA concentration and bacterial culture OD |
| WHO International Reference Panel for anti-SARS-CoV-2 immunoglubulin | NISBC | 20/268 | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| β-Nicotinamide adenine dinucleotide hydrate (NAD) | Sigma-Aldrich | 10127965001 | A component of the cell-free reaction Solution A |
Ссылки
- Carter, L. J., et al. Assay techniques and test development for COVID-19 diagnosis. ACS Cent Sci. 6, 591-605 (2020).
- Amanat, F., et al. A serological assay to detect SARS-CoV-2 seroconversion in humans. Nat Med. 26 (7), 1033-1036 (2020).
- Stadlbauer, D., et al. SARS-CoV-2 seroconversion in humans: A detailed protocol for a serological assay, antigen production, and test setup. Curr Protoc Microbiol. 57 (1), e100 (2020).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259.e12 (2016).
- Norouzi, M., et al. Cell-free dot blot: an ultra-low-cost and practical immunoassay platform for detection of anti-SARS-CoV-2 antibodies in human and animal sera. Microbiol Spectr. 11 (2), e0245722 (2023).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2014).
- Norouzi, M., Panfilov, S., Pardee, K. High-efficiency protection of linear DNA in cell-free extracts from Escherichia coli and Vibrio natriegens. ACS Synth Biol. 10 (7), 1615-1624 (2021).
- . IDT codon optimization tool Available from: https://www.idtdna.com/pages/tools/codon-optimization-tool (2025)
- . General protocol for western blotting Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6376.pdf (2025)
- Mruk, D. D., Cheng, C. Y. Enhanced chemiluminescence (ECL) for routine immunoblotting. Spermatogenesis. 1, 121-122 (2011).
- Levine, M. Z., Gregorio, N. E., Jewett, M. C., Watts, K. R., Oza, J. P. Escherichia coli-based cell-free protein synthesis: Protocols for a robust, flexible, and accessible platform technology. J Vis Exp. (144), (2019).
- . Plasma and serum preparation Available from: https://www.thermofisher.com/ca/en/home/references/protocols/cell-and-tissue-analysis/elisa-protocol/elisa-sample-preparation-protocols/plasma-and-serum-preparation.html (2025)
- Mattiuzzo, G., et al. . WHO/BS.2020.2403 Establishment of the WHO International Standard and Reference Panel for anti-SARS-CoV-2 antibody. , (2020).
- Gong, F., Wei, H., Li, Q., Liu, L., Li, B. Evaluation and comparison of serological methods for COVID-19 diagnosis. Front Mol Biosci. 8, 682405 (2021).
- Peeling, R. W., et al. Serology testing in the COVID-19 pandemic response. Lancet Infect Dis. 20 (9), e245-e249 (2020).
- Smith, M. T., Berkheimer, S. D., Werner, C. J., Bundy, B. C. Lyophilized Escherichia coli-based cell-free systems for robust, high-density, long-term storage. Biotechniques. 56 (4), 186-193 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены