JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Cell-free Dot Blot은 인간 및 동물 혈청에서 항체 반응을 검출하기 위한 실용적이고 적응 가능한 면역분석 플랫폼입니다.
요약
우리는 cell-free 합성 생물학의 원리와 인간 및 동물 혈청에서 항체 반응의 맞춤형 검출을 위한 dot-blot 기술을 기반으로 최근에 개발된 면역분석 플랫폼에 대해 설명합니다.
초록
지난 20년 동안 전 세계적으로 잇따른 병원성 발병은 혈청감시 전략의 중요성을 강조했습니다. 환자의 혈청에서 질병 특이적 항체를 검출하는 역할을 하는 면역분석 플랫폼은 혈청감시의 핵심입니다. 일반적인 예로는 효소 결합 면역흡착 분석법 및 측방 유동 분석이 있습니다. 그러나 이러한 방법은 황금 표준 방법이지만 병원체 전용 소모품과 특수 장비가 필요하므로 자원이 풍부한 실험실 밖에서는 사용이 제한됩니다.
당사는 최근 CFDB(Cell-Free Dot-Blot)라는 새로운 면역분석 플랫폼을 개발하여 SARS-CoV-2에 대해 인간 및 동물 혈청을 사용하여 검증했습니다. 기존의 면역 분석법과 달리 CFDB 환자 혈청 샘플은 고체상(니트로셀룰로오스 멤브레인)에 고정되는 반면 표적 항원은 분석의 이동상에 부유합니다. 혈청감시 기능에 대한 접근성을 개선하기 위해 CFDB 항원은 체외 단백질 발현을 사용하여 저부하 인프라로 주문형으로 생산됩니다. 여기서 항원은 모든 CFDB 분석을 위해 단일 범용 리포터 단백질을 사용하여 검출할 수 있는 펩타이드 태그와 융합됩니다. 그 결과 CFDB는 다중 웰 플레이트 리더 또는 정제된 상용 분자 분석 구성 요소에 대한 액세스를 요구하지 않습니다. 이러한 설계 고려 사항을 통해 CFDB는 비중앙 집중식 실험실에 대한 접근성, 신종 병원체에 대한 적응성 및 저소득 커뮤니티에 대한 경제성을 제공함으로써 기존 면역분석 플랫폼의 단점을 해결합니다.
현재 기사에서는 CFDB 면역분석을 준비하고 수행하기 위한 단계별 프로토콜을 제공합니다. SARS-CoV-2 CFDB에 대한 최근 연구를 예로 들어 주문형 무세포 생산을 위한 항원 DNA 설계, CFDB 리포터 단백질 준비, 고체상에서 혈청 샘플의 고정화, 마지막으로 분석의 항원 결합 및 검출 단계를 다룰 것입니다. 우리는 이러한 지침을 따름으로써 연구자들이 CFDB 분석을 조정하여 주어진 병원체에 대한 인간 및 동물 혈청의 면역 반응을 검출할 수 있을 것으로 기대합니다.
서문
COVID-19 팬데믹으로 인해 특히 리소스가 부족한 환경에서 저렴하고 확장 가능한 진단 도구에 대한 필요성이 절실히 드러났습니다1. 효소결합 면역흡착 분석법(ELISAs)과 같은 기존 면역분석법은 면역 반응을 검출하는 데 필수적인 것으로 입증되었습니다 2,3. 그러나 높은 비용, 복잡한 시약에 대한 의존도, 특수 장비에 대한 의존성으로 인해 특히 글로벌 보건 위기 시에는 접근성이 제한됩니다. 이러한 문제에 대응하기 위해 당사는 인간 및 동물 혈청에서 항-SARS-CoV-2 항체를 검출하도록 설계된 저비용의 적응형 면역분석 플랫폼인 CFDB(Cell-Free Dot Blot)를 개발했습니다.
CFDB는 선형 DNA 템플릿 4,5를 사용하여 바이러스 항원의 신속한 주문형 생산을 위해 cell-free 합성 생물학을 활용합니다. 이를 통해 기존의 세포 기반 클로닝, 발현 및 정제 공정의 필요성을 없애 항원 생산 속도를 크게 높이는 동시에 비용을 절감할 수 있습니다. CFDB 방법은 혈청이 니트로셀룰로오스 멤브레인에 직접 발견되는 도트 블롯 형식을 사용하여 항체 검출을 단순화합니다. 이 시스템은 값비싼 멀티웰 플레이트와 특수 실험실 장비의 필요성을 없애주어 배양 및 세척 단계를 위한 간단한 "디핑" 워크플로우를 가능하게 합니다. 이 플랫폼은 또한 SpyCatcher2-Apex2 peroxidase 키메라가 범용 2차 검출 시약 5,6으로 작용하는 SpyCatcher-SpyTag 시스템을 활용합니다. 이는 표준 Escherichia coli 기반 발현을 사용하여 생산되며, 이는 값비싼 상용 항체 접합체에 대한 의존성을 제거합니다. 그 결과, CFDB 시스템은 상용 ELISA 키트의 경우 미화 300달러가 넘는 것에 비해 96개 시료 분석당 약 3달러라는 훨씬 저렴한 비용으로 ELISA와 비슷한 성능으로 혈청학적 분석을 수행할 수 있습니다5.
CFDB의 효과를 입증하기 위해 사전 특성화된 인간 및 동물 혈청에서 항체를 검출하는 능력을 테스트했습니다. 우리의 결과는 COVID-19 양성 및 음성 샘플을 식별하는 데 있어 ELISA와 밀접한 상관관계가 있었습니다. 인체 진단 외에도 SARS-CoV-2에 감염된 햄스터와 재조합 뉴클레오캡시드 단백질로 백신을 접종한 햄스터의 혈청을 테스트하여 동물 모델에서 CFDB의 유용성을 평가했습니다. 이 테스트를 통해 CFDB가 인간 및 수의학 진단에 모두 사용할 수 있는 잠재력을 확인했으며, 이는 CFDB가 종 간의 면역 반응을 모니터링하기 위한 다목적 도구가 되었습니다. CFDB의 주요 장점 중 하나는 유연성입니다. 관심 항원을 인코딩하는 DNA 템플릿을 수정하기만 하면 플랫폼을 빠르게 조정하여 다양한 병원체에 대한 항체를 검출할 수 있으므로 향후 팬데믹 대비에 유용합니다. 저렴한 비용, 간단한 워크플로우 및 최소한의 인프라 요구 사항으로 인해 상용 진단에 대한 접근이 제한된 분산된 실험실 및 리소스가 적은 환경에 특히 적합합니다.
이 작업에서는 CFDB 분석을 준비하고 수행하기 위한 단계별 지침을 제공합니다. 먼저, 분석의 주요 검출 시약인 항원의 무세포 생산을 위한 선형 DNA 템플릿의 설계 및 합성을 다룹니다. 그런 다음 분석의 2차 검출 시약인 SpyCatcher2-Apex2의 준비 단계를 설명합니다. 그 후, 무세포 생산 및 항원 자체의 품질 검사에 대한 지침을 제공합니다. 마지막으로, 인간 또는 동물 혈청 샘플에 대한 CFDB 분석을 수행하는 프로세스를 자세히 설명합니다.
프로토콜
모든 햄스터 실험은 캐나다 공중 보건국의 국립 미생물학 연구소(NML)에서 수행되었으며, 캐나다 인간 및 동물 건강 과학 센터의 승인을 받았으며 캐나다 동물 관리 위원회의 지침에 따라 수행되었습니다. 모든 인간 혈청/혈장 샘플은 사내 테스트를 위해 상업적으로 획득하거나 NML에서 독립적인 테스트를 위해 임상 협력자가 NML에 제공했습니다.
1. 항원 선형 발현 템플릿(LET)의 설계 및 준비
- Norouzi et al.7 의 지침에 따라 N/C 말단 SpyTag를 포함하는 Norouzi et al.5에 대한 cell-free 발현 LET를 설계합니다.
참고: 여기에서는 SARS-CoV-2 뉴클레오캡시드 단백질(NP, 아미노산 2-419)의 준비에 대한 세부 정보를 제공합니다.- SARS-CoV-2 NP(그림 1 및 보충 파일 1)에 대한 LET에 T7 프로모터 전과 정지 코돈 후에 50 염기쌍 완충액 서열이 있는 5' 및 3' Ter 부위가 포함되어 있는지 확인합니다.
- N-말단의 NP 단백질을 His 6-SpyTag-TEV로 태그합니다.
- UniProt 데이터베이스(등록 코드 P0DTC9)에서 단백질 염기서열을 얻고 IDT 코돈 최적화 도구8을 사용하여 E. coli 기반 발현에 대해 코돈 최적화합니다. 상업적 합성을 위해 10ng/μL의 물에 재현탁된 단일 가닥 DNA 단편으로 이 염기서열을 주문하십시오.
참고: TEV 프로테아제 절단 부위와 His6 태그는 LET 설계의 필수 기능이 아닙니다.
- PCR은 범용 Ter FW(GGCTCCGAATAAGTATGTTGTAACTAAAGTGCGGCC)로 DNA 단편을 증폭합니다.
ACGATGCGTCCGGCGTAGAGGATCG) 및 Ter RV(CCGAGGCAATAAGTATGTTGTAACTAAAGTGCTCAG
CTTCCTTTCGGGCTTTGTTAGCAGCC) 프라이머를 사용하여 high-fidelity DNA polymerase kit를 사용할 수 있습니다( 재료 표 참조).- 100 μL 반응을 다음과 같이 설정합니다: 뉴클레아제가 없는 물 75 μL, 5x DNA 중합효소 완충액 20 μL, 10 mM dNTP 2 μL(최종 농도 200 μM), 100 μM Ter-FW 프라이머 0.5 μL, 100 μM Ter-RV 프라이머 0.5 μL, 10 ng/μL 단일 가닥 LET 1 μL, DNA 중합효소 1 μL(2U).
- 다음 PCR 설정을 사용하십시오 : 98 ° C에서 30 초 동안 초기 변성; 35 사이클: 98°C에서 6초, 60°C에서 15초, 72°C에서 90초; 4 °C에서 유지하십시오.
- 상용 PCR 정제 키트를 사용하여 PCR 산물을 정제하고, 1% 아가로스 겔에서 샘플을 실행하여 품질을 확인하고, UV-Vis 분광 광도계에서 농도를 측정합니다.
참고: 미처리 PCR 산물은 cell-free 발현에 직접 사용할 수도 있습니다. 그러나 정제를 통해 보다 표준화된 절차를 수행할 수 있습니다.

그림 1: SARS-CoV-2-NP에 대한 선형 발현 템플릿. His-SpyTag-SARS-CoV-2 NP 선형 DNA 템플릿의 특징을 나타내는 회로도. 주요 DNA 템플릿 요소에 라벨이 부착되어 있습니다. 관심 단백질(여기서는 NP)에 대한 암호화 서열은 효율적인 발현을 위해 T7 promoter의 transcriptional control 하에 배치됩니다. N-말단에서 NP 단백질에는 SpyCatcher2-Apex2 검출 시약을 사용하여 특이적 검출을 위한 SpyTag가 추가됩니다. x6His-tag 및 TEV 프로테아제 사이트는 일반 LET 설계의 일부로 포함되지만 CFDB 목적에는 필수적입니다. 선형 DNA 주형의 말단에서, 각각 50개의 염기쌍 완충액 서열이 선행하는 "업스트림(upstream)" 및 "다운스트림(downstream)" Ter 부위가 cell-free lysate에서 exonucleolytic DNA degradation에 대한 Tus 매개 보호를 위해 포함됩니다. 약어: NP = 뉴클레오캡시드 단백질; LET = 선형 표현식 템플릿; TEV = 담배 에칭 바이러스; CFDB = cell-free 점 블롯. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. SpyCatcher2-Apex2 리포터 단백질의 정제
- 원래 Norouzi et al.5 에서 생성된 pET24b-SpyCatcher2-Apex2 플라스미드( 보충 파일 2 의 전체 염기서열 및 보충 그림 S1의 플라스미드 맵)를 사용하여 SpyCatcher2-Apex-2 리포터 단백질을 준비합니다.
- 50μg/mL 카나마이신을 함유한 한천 플레이트와 용원 육수(LB)를 준비합니다. PET24b-SpyCatcher2-Apex2 플라스미드로 E. coli BL21 (DE3) 세포를 형질전환시킵니다. 단일 콜로니를 15mL 스타터 LB 배양액에 접종하고 250RPM으로 진탕하면서 37°C에서 하룻밤 동안 성장합니다.
- 다음날, 50μg/mL 카나마이신이 함유된 500mL의 새로운 LB 배지에 스타터 배양 10mL를 추가합니다. 배양액이 600 nm에서 0.6-0.8 (~ 3 h)의 광학 밀도에 도달 할 때까지 250 RPM에서 진탕하면서 37 ° C에서 배양합니다.
- 0.5 mM 이소프로필-β-D-1-티오갈락토피라노시드 및 1 mM 5-아미노레불린산 염산염으로 배양물을 보충하여 SpyCatcher2-Apex2의 발현을 유도합니다. 성장 온도를 30°C로 낮추고 배양물을 4시간 더 배양합니다.
- 8,000 ×g에서 15 분 동안 원 심분리하여 박테리아를 수확합니다. 세포 용해를 진행하거나 사용할 때까지 펠릿을 -80°C에서 보관합니다.
- 50mM Tris-HCl(pH 7.8), 300mM NaCl, 1mg/mL 라이소자임, EDTA-free 프로테아제 억제제 정제 및 1mM 디티오트레이톨(DTT)을 포함하는 20mL의 용해 완충액에 펠릿을 재현탁합니다. 50 초 ON 및 10 초 OFF 간격으로 50 % 진폭으로 초음파 처리하여 세포를 3 분의 총 ON 시간으로 용해시킵니다.
- 4 °C에서 1 시간 동안 20,000 × g 에서 원심 분리로 용해물을 정화하십시오. 0.2μm 주사기 필터를 통해 상층액을 통과시킵니다.
- 정화된 용해물에 250μM의 최종 농도로 염화헤민을 추가하고 4°C에서 밤새 배양합니다. 단백질 정제를 진행합니다.
참고: 염화헤민을 사용한 배양은 최적의 효소 활성을 위해 Apex-2 과산화효소로의 헴 통합을 최대화합니다. - 정화된 용해물에 Ni 수지 2.5mL를 첨가하고 4°C에서 45분 동안 부드럽게 흔들면서 배양합니다. 혼합물을 중력 흐름 컬럼에 적용하고 50mL의 Tris 완충액(50mM Tris-HCl(pH 7.8), 300mM NaCl 및 1mM DTT)로 수지를 세척합니다.
- SpyCatcher2-Apex2 단백질을 400mM 이미다졸이 함유된 25mL의 Tris 완충액에 용리시킵니다. 농축액과 완충액은 0.5-1.0mL의 최종 부피를 목표로 원심 필터 장치를 사용하여 용출액을 Tris 완충액으로 교환합니다.
- SpyCatcher2-Apex2(27,390 M-1 cm-1)의 몰 흡광 계수를 사용하여 UV-Vis 분광 광도계에서 단백질 농도를 측정합니다. 글리세롤을 최종 농도 40%에 추가하고 부분 표본을 -20°C에서 보관합니다.
참고: 이 프로토콜은 약 40mg의 고순도 및 활성 SpyCatcher2-Apex2를 생성할 것으로 예상되며, 이는 표준 96개 샘플 블롯 크기에서 400 CFDB 실행에 충분합니다. - 기존 웨스턴 블롯9 를 사용하여 SpyTagged 단백질을 검출하고 CFDB 실험을 위해 항상 0.05% Tween-20(TBST)을 함유한 1x Tris-buffered saline의 5% 무지방 분유의 멤브레인을 차단합니다. 차단 용액에서 최종 농도 10μg/mL의 SpyCatcher2-Apex2 단백질을 사용합니다.
참고: SpyCatcher2-Apex2 리포터는 신호 개발을 위해 향상된 화학발광(ECL) 솔루션이 필요합니다. ECL 용액은 상업적으로 얻거나 Mruk et al.10의 지침에 따라 사내에서 준비할 수 있습니다. 여기서 최종 ECL 용액은 100mM Tris-HCl(pH 8.6)에서 0.4mM p-쿠마르산, 2.5mM 루미놀 및 0.015% H2O2로 구성됩니다.
3. Cell-free 생산 및 항원의 품질 검사
- Levine et al.11 및 Norouzi et al.5의 지침에 따라 E. coli BL21 cell-free 발현 용해물 및 반응 성분을 준비하고 조립합니다. 대표적인 100 μL 반응을 위해 다음과 같이 최종 반응 혼합물에 5 μM Tus 단백질과 1.2 μM T7 RNA 중합효소를 보충합니다: 용액 A 14.6 μL, 용액 B 14 μL, E. coli BL21 용해물 33.3 μL, 200 mM Tus 단백질 2.5 μL, 100 mM T7 RNA 중합효소 1.2 μL, 1μL의 1.5μM 선형 DNA 템플릿, 33.4μL의 뉴클레아제가 없는 물.
참고: E. coli BL21 cell-free lysate 준비에 대한 주요 지침은 Supplemental File 3을 참조하고, 용액 A 및 B의 자세한 레시피는 Supplemental Table S1을 참조하십시오. E. coli cell-free 발현 시스템은 반응에 Tus 및 T7 RNA 중합효소가 보충되는 한 대체 프로토콜을 사용하여 준비하거나 상업적으로 얻을 수도 있습니다. - PCR 튜브의 cell-free 반응에 10%(v/v) crude PCR 산물을 첨가하여 초기 5μL 규모의 발현 테스트를 수행합니다. 30°C에서 15시간 동안 흔들지 않고 배양합니다.
- 12% sodium dodecyl sulfate polyacrylamide gel(SDS-PAGE)에 cell-free 반응 1μL를 로딩한 후 2.12단계에서 설명한 대로 웨스턴 블롯용 니트로셀룰로오스 멤브레인으로 전달하여 NP 항원의 발현 품질을 확인합니다. SpyTag를 통한 블롯 라벨링에 SpyCatcher2-Apex2 리포터 단백질을 사용하고, 선택적으로 표적 항원에 대한 특정 상용 항체(여기서는 anti-SARS-CoV-2-NP)를 사용합니다.
- CFDB 분석에 사용할 15 nM 정제 LET 산물로 1 mL 규모의 무세포 반응을 조립합니다. 발현 혼합물을 15mL 원뿔형 튜브에서 30°C에서 15시간 동안 80RPM으로 진탕하여 배양합니다. 웨스턴 블롯을 사용하여 발현 품질을 확인하고 -20 °C에서 50 μL 분취량을 보관합니다.
4. 혈청 샘플
- 기관 인간 연구 윤리 위원회 또는 동물 관리 및 사용 위원회의 지침에 따라 표준 절차를 사용하여 상업적 출처 또는 임상 협력자 또는 사내에서 인간/동물 혈청(또는 혈장) 샘플을 얻습니다. 오염 위험을 완화하기 위해 적절한 시료 전처리 조치를 취했는지 확인합니다.
참고: 전처리 조치에는 용제 세제 처리, 열 불활화 및 혈액 매개 바이러스 마커 테스트가 포함될 수 있습니다. 전혈에서 혈청 및 혈장을 분리하는 데 유용한 프로토콜이 있다12. 다른 면역분석 플랫폼과 마찬가지로 초기 감염 또는 질병 발병 후 조기(<3주)에 채취한 혈청 샘플은 적절한 수준의 항체 반응을 포함하지 않을 것으로 예상되므로 결과를 주의해서 다루어야 합니다. - SARS-CoV-2 NP CFDB 시약의 품질 검증을 위해 NIBSC(National Institute for Biological Standards and Control) 세계보건기구(WHO)의 항-SARS-CoV-2 면역글로불린에 대한 국제 참조 패널을 사용하십시오(여기에는 다양한 수준의 항-NP 면역글로불린13 x1 pre-COVID-19 및 x4 SARS-CoV-2 양성 샘플이 포함되어 있습니다). 또는 다른 출처에서 미리 특성화된 건강하고 긍정적인 혈청 샘플을 사용하십시오.
- CFDB 실험의 경우, 정확도를 높이고 분석 및 결과 해석을 용이하게 하기 위해 여러(>3)의 건강한 혈청 샘플을 풀링하여 음성 대조군 샘플을 얻거나 준비합니다.
5. CFDB(Cell-free Dot Blot) 절차
- 마스터 그리드 이미지 파일(보충 그림 S2)을 다운로드하여 인쇄합니다. 마스터 그리드는 각각 직경 2mm의 12 x 12개의 원을 포함하는 6 x 6cm 패턴이며 96웰 플레이트와 유사한 스포팅 용량을 제공합니다.
- 두 층의 접착 PCR 플레이트 밀봉 필름 사이에 그리드를 단단히 끼우고 외부 그리드 경계를 따라 크기에 맞게 자릅니다. 2mm 바이옵시 펀치를 사용하여 표시된 각 원의 속을 비웁니다.
참고: 이 마스터 그리드는 70% 에탄올로 닦은 후 여러 번 재사용할 수 있습니다. - 6.5 x 6.5cm 니트로셀룰로오스 멤브레인 조각을 절단하여 깨끗한 표면의 마스터 그리드 아래에 놓고 그림 2 및 보충 그림 S3과 같이 접착 테이프를 사용하여 설정을 고정합니다. 마커 펜을 사용하여 니트로셀룰로오스 멤브레인의 가장 바깥쪽 원 위치를 표시하여 샘플 스포팅 후 멤브레인을 절단하기 위한 가이드로 사용합니다.
- 혈청 샘플을 1x 인산염 완충 식염수(pH 7.4)에 1/10 희석합니다. 마이크로피펫을 사용하여 각 시료의 0.4μL 부피를 미리 결정된 그리드 위치에서 니트로셀룰로오스 멤브레인으로 3회 분주합니다. 분배하는 데 지점당 약 15초가 걸립니다.
참고: 결과 분석에 필요하므로 각 분석에 negative control 및 positive control 샘플을 모두 포함해야 합니다. - 점박이 샘플이 결합되고 건조될 때까지 주변 온도에서 10분 동안 기다립니다. 핀셋을 사용하여 니트로 셀룰로오스 막을 조심스럽게 회수하고 표시된 바깥 쪽 원을 따라 자릅니다.
- 10cm 페트리 접시에 10cm 페트리 접시에 10mL의 차단 용액(TBST의 5% 무지방 분유)으로 멤브레인을 실온에서 30분 동안 차단하고 100RPM으로 부드럽게 흔듭니다.
- cell-free 항원 발현 혼합물의 50μL 분취액을 10cm 페트리 접시에 5mL의 차단 용액에 해동하고 첨가합니다. 멤브레인을 이 항원 함유 용액에 직접 옮기고 100RPM으로 진탕하면서 실온에서 1시간 동안 배양합니다.
참고: 이것은 SpyTagged 항원이 항체를 포함하는 스폿 위치(존재하는 경우)에 결합하는 기본 검출 단계입니다. - 멤브레인을 헹구고 5분 동안 세척한 후 2차 검출 단계로 진행하기 전에 TBST에서 다시 헹굽니다.
- 100RPM으로 진탕하면서 1시간 동안 정제된 SpyCatcher2-Apex2 단백질이 10μg/mL 함유된 10mL의 차단 버퍼에 멤브레인을 배양합니다.
- 멤브레인을 헹구고 TBST에서 2 x 5 분 세척하고 TBS에서 최종 헹굽니다.
- 블롯 이미징 기기에 가까운 깨끗한 작업 영역에 파라필름 조각을 붙이고 고정합니다. 핀셋을 사용하여 멤브레인을 두드려 과도한 액체를 제거하고 파라필름 위에 멤브레인을 놓습니다.
- 즉시 멤브레인 위에 3mL(100μL/cm2)의 ECL 용액을 추가하고 실온에서 정확히 90초 동안 배양합니다.
- 즉시 멤브레인을 탭드라이어하고 결과를 시각화하기 위해 화학발광 호환 이미징 기기로 옮깁니다.
참고: 최적의 이미징 시간은 기기마다 다를 수 있습니다. 기기의 기본 자동 획득 시간 설정을 사용하는 것이 좋으며, 없는 경우 사전 특성화된 혈청 샘플을 사용하여 이미지 획득 시간을 최적화하는 것이 좋습니다. - 기기의 이미지 분석 기능을 사용하여 니트로셀룰로오스 멤브레인의 3개의 빈(배경) 위치를 포함한 스폿 강도를 얻을 수 있습니다. 스폿당 일정한 측정량을 유지하십시오. 데이터를 스프레드시트로 내보내고, 각 스폿 위치에 올바르게 레이블을 지정하는 것을 기억합니다.
- 삼중 스폿 강도의 평균 및 표준 편차(SD)를 계산합니다. 그런 다음 모든 샘플에서 니트로셀룰로오스 멤브레인 배경을 뺍니다.
- 다음 방정식을 사용하여 -/+ 결과의 해석을 위한 컷오프 값을 구합니다.
(네거티브 대조군의 평균) + (네거티브 대조군의 3 x SD). 샘플의 평균 강도가 컷오프 값보다 높으면 양수, 평균 강도가 컷오프 값 아래로 떨어지면 음수로 간주합니다.
참고: CFDB 절차의 개략도는 그림 3에 나와 있습니다.
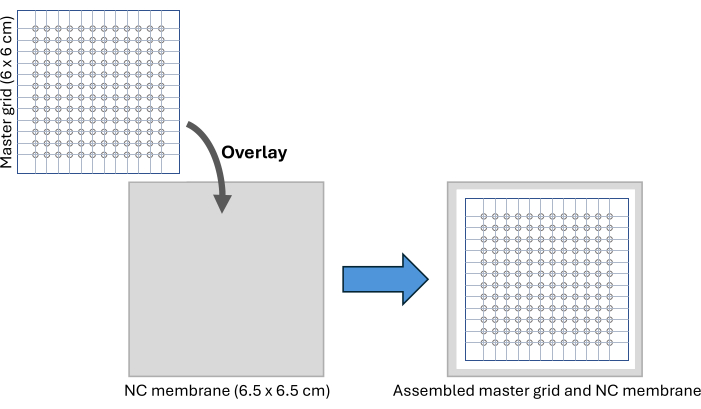
그림 2: CFDB 어셈블리. CFDB 마스터 그리드 및 NC 멤브레인 어셈블리 설정의 회로도입니다. 마스터 그리드는 NC 멤브레인에 오버레이되어 혈청 샘플의 스포팅 및 고정을 위한 규칙적이고 주소 지정 가능한 패턴을 제공합니다. 약어: CFDB = cell-free dot blot; NC = 니트로셀룰로오스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
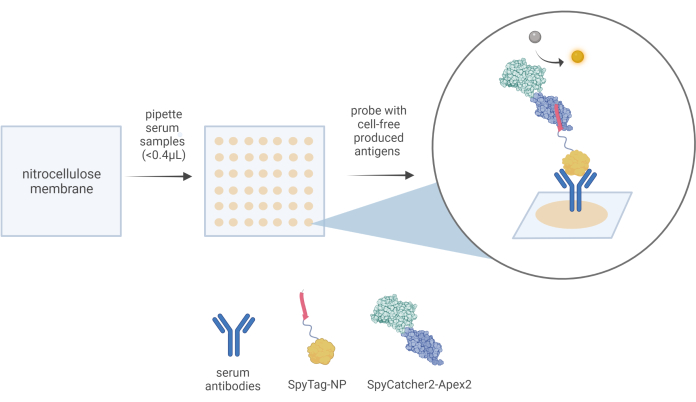
그림 3: CFDB 워크플로우의 개략도 . CFDB 분석에서는 소량(<0.4 μL)의 10x 희석 혈청 샘플을 주소 지정 가능한 개별 위치(중간 패널)의 미리 절단된 니트로셀룰로오스 멤브레인(왼쪽 패널)에 수동으로 분주합니다. 3중 반점에 반점당 하나의 혈청 샘플을 증착하고 혈청의 총 항체 저장소를 포함한 단백질 함량을 고체 NC 기질(중간 패널의 베이지색 반점)에 고정시킵니다. 이 예시에서, 혈청 샘플에 포함된 항-NP 항체는 먼저 CFDB 1차 검출 시약 SpyTag-NP에 의해 결합될 수 있으며, 최종적으로 CFDB 2차 검출 시약 SpyCatcher2-Apex2(오른쪽 패널 확대 버블)에 의해 검출될 수 있습니다. 이 그림은 Norouzi et al.5에서 발췌한 것입니다. 약어: CFDB = cell-free dot blot; NP = 뉴클레오캡시드 단백질; LET = 선형 표현식 템플릿. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
표적 항원에 대한 선형 발현 템플릿의 PCR 증폭
SARS-CoV-2 NP LET를 PCR 증폭하기 위해 프로토콜 섹션 1.2에 설명된 대로 범용 Ter 정방향 및 역방향 프라이머를 사용하고 PCR 산물의 정제를 진행하기 전에 아가로스 겔(그림 4)에서 제품의 1μL를 확인했습니다.
토론
COVID-19는 감염 발생을 통제하고 글로벌 보건 전략을 최적화하기 위해 접근 가능하고 강력한 진단의 중요성을 강조했습니다. 보호 항체를 검출하는 혈청학적 검사는 새로운 변이의 전염 패턴을 추적하고, 핫스팟을 식별하고, 백신 개발을 안내하고, 의심 사례를 분류하고, 취약 인구를 보호하는 데 필수적인 것으로 입증되었다14. 팬데믹은 또한 접근성 테?...
공개
M.N.과 K.P.는 cell-free dot blot 방법의 공동 발명자입니다. 본 작품에 관한 가특허출원이 개시되었습니다(PCT/CA2024/050097, 2024년 1월 출원).
감사의 말
S.S.와 R.Z.는 미국 국방고등연구계획국(DARPA)의 자금 지원을 받고 있으며, 계약 번호는 N66001-23-2-4042입니다. 표현된 견해, 의견 및/또는 조사 결과는 저자의 견해이며 국방부 또는 미국 정부의 공식 견해나 정책을 나타내는 것으로 해석되어서는 안 됩니다. 이 작업은 CIHR 재단 보조금 프로그램(201610FDN-375469), CIHR 캐나다 연구 의장 프로그램(950-231075 및 950-233107), 캐나다 최초 연구 우수성 기금(Canada First Research Excellence Fund)에서 자금을 지원받고 캐나다 국방 연구 개발부의 캐나다 안전 및 보안 프로그램(계약 39903-200137)에서 K.P.에 자금을 지원하는 토론토 대학의 의학 디자인 이니셔티브(Medicine by Design Initiative)에서 K.P.에 대한 자금으로 지원되었습니다. 그림 1 및 보충 그림 S1 은 SnapGene Viewer를 사용하여 생성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 kb DNA ladder | NEB | N3232 | Used as a size marker for agarose gels |
| 20 Amino acids | Sigma-Aldrich | LAA21-1KT | A component of the cell-free reaction Solution B |
| 2 mm biopsy punch | Integra Miltex | 33-31-P/25 | For preparation of CFDB master grid |
| 5-aminolevulinic acid hydrochloride | Sigma-Aldrich | A3785 | Heme precursor for induction of SpyCatcher2-Apex2 |
| Agarose powder | BioShop | AGA002 | For electrophoretic analysis of DNA |
| Anti-SARS-CoV2-Nucleocapsid antibody | Sinobiological | 40588-T62 | For WB detection of cell-free produced NP antigen |
| Bio-Rad ChemiDoc XRS+ | Bio-Rad | N/A | Gel imager instrument |
| Centrifugal concentrators | Cytiva | 28-9323-60 | For concentration and buffer exchange of proteins |
| Centrifuge | Eppendorf | EP022628257 | For harvesting bacterial culture |
| Coenzyme A sodium salt hydrate (CoA) | Sigma-Aldrich | C3144 | A component of the cell-free reaction Solution A |
| Color pre-stained protein standard (broad range) | NEB | P7719 | Used as a size marker for SDS-PAGE gels |
| Covid-19 serum panel | RayBiotech | CoV-PosSet | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| D-(−)-3-Phosphoglyceric acid disodium salt (3-PGA) | Sigma-Aldrich | P8877 | A component of the cell-free reaction Solution B |
| Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Component of buffers |
| E. coli 5-alpha | NEB | C2987 | for plasmid preparation |
| E. coli BL21 | NEB | C2530 | For preparation of cell-free lysates |
| E. coli BL21 (DE3) | NEB | C2527 | For expression of SpyCatcher2-Apex2 |
| EDTA-free protease inhibitor tablet | Sigma-Aldrich | 11836153001 | A component of E. coli lysis buffer |
| Eppendorf New Brunswick Innova 43/43R Incubator Shaker | Eppendorf | EPM1320 | Incubator for growing E. coli cells for protein expression and cell-free lysate preparation |
| Folinic acid | Sigma-Aldrich | 47612 | A component of the cell-free reaction Solution A |
| Glycerol | Sigma-Aldrich | G9012 | Component of SpyCatcher2-Apex2 storage buffer |
| Hemin chloride | Sigma-Aldrich | H9039 | For Heme supplementation of SpyCatcher2-Apex2 |
| Hydrogen peroxide 30% | Sigma-Aldrich | H1009 | For making ECL reagent |
| Image Lab Software | Bio-Rad | 1709690 | Software for ChemiDoc gel imaging instrument |
| Isopropyl-b-D-1-thiogalactopyranoside | Bioshop | IPT001 | For induction of SpyCatcher2-Apex2 expressikon |
| Kanamycin Sulfate | Sigma-Aldrich | 60615 | For preparation of SpyCatcher2-Apex2 bacterial culture |
| LB agar | BioShop | LBL406 | For E. coli growth |
| LB broth | BioShop | LBL407 | For E. coli growth |
| luminol | Sigma-Aldrich | A4685 | For making ECL reagent |
| Lysozyme | Sigma-Aldrich | L6876 | For lysis of bacterial cells |
| Magnesium Acetate | Sigma-Aldrich | M5661 | A component of the cell-free reaction Solution B |
| NEBExpress Ni resin | NEB | S1428S | For purification of SpyCatcher2-Apex2 |
| Non-fat dry milk | Bioshop | SKI400 | For blocking of WB and CFDB membranes |
| Parafilm | Bemis | 2099-1337410 | For ECL-incubation of CFDB blots |
| p-coumaric acid | Sigma-Aldrich | C9008 | For making ECL reagent |
| pET24b-SpyCatcher2-Apex2 plasmid | Pardee Laboratory | N/A | Used for the expression of SpyCatcher2-Apex2 protein |
| Petri dish | Fisherbrand | FB0875712 | Container for WB and CFDB membrane incubation |
| Phosphate buffered saline 10% | BioShop | PBS405 | Component of buffers |
| Potassium Glutamate | Sigma-Aldrich | G1501 | A component of the cell-free reaction Solution B |
| Potassium Oxalate Monohydrate (Oxalic acid) | Sigma-Aldrich | 223425 | A component of the cell-free reaction Solution A |
| Precast SDS-PAGE gel | BioRad | 4561036EDU | For electrophoretic analysis of protein |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification of LETs |
| QIAquick PCR purification kit | Qiagen | 28106 | For purification of LETs |
| Ribonucleotide Solution Set | NEB | N0450S | A component of the cell-free reaction Solution A |
| Skim milk powder | BioShop | SKI400 | Used as a blocking agent for western blot and CFDB |
| Sodium Chloride | Sigma-Aldrich | S9625 | A component of protein purification buffers |
| Sonicator | Qsonica | Q500 | For lysis of bacterial cells |
| Spermidine | Sigma-Aldrich | S2626 | A component of the cell-free reaction Solution A |
| Syringe filter | Sigma-Aldrich | SLGSR33SS | For sterilisation of buffers and solutions |
| Thermocycler | BioRad | T100 | Instrument for incubating PCR reactions |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8759 | A component of the cell-free reaction Solution A |
| Tris buffered saline | Thermo Scientific | J60764.K2 | Component of WB and CFDB wash buffer |
| Trizma base | Sigma-Aldrich | T1503 | For making tris buffer |
| Tunair SS-5012 Half-Baffle Shake Flask, 2.5 L | Cole-Parmer | RK-01835-39 | Vessel for growing E. coli cells for protein expression and cell-free lysate preparation |
| Tween-20 | BioShop | TWN510 | Component of WB and CFDB wash buffer |
| Tweezer | Almedic | 7728-A10-100 | For handling CFDB NC membrane |
| UV-Vis spectrophotometer | Thermo Scientific | 13400518 | Used for the measurement of nucleic acid and DNA concentration and bacterial culture OD |
| WHO International Reference Panel for anti-SARS-CoV-2 immunoglubulin | NISBC | 20/268 | Pre-characterised sera for verification and optimisation of CFDB reagents/conditions |
| β-Nicotinamide adenine dinucleotide hydrate (NAD) | Sigma-Aldrich | 10127965001 | A component of the cell-free reaction Solution A |
참고문헌
- Carter, L. J., et al. Assay techniques and test development for COVID-19 diagnosis. ACS Cent Sci. 6, 591-605 (2020).
- Amanat, F., et al. A serological assay to detect SARS-CoV-2 seroconversion in humans. Nat Med. 26 (7), 1033-1036 (2020).
- Stadlbauer, D., et al. SARS-CoV-2 seroconversion in humans: A detailed protocol for a serological assay, antigen production, and test setup. Curr Protoc Microbiol. 57 (1), e100 (2020).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259.e12 (2016).
- Norouzi, M., et al. Cell-free dot blot: an ultra-low-cost and practical immunoassay platform for detection of anti-SARS-CoV-2 antibodies in human and animal sera. Microbiol Spectr. 11 (2), e0245722 (2023).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2014).
- Norouzi, M., Panfilov, S., Pardee, K. High-efficiency protection of linear DNA in cell-free extracts from Escherichia coli and Vibrio natriegens. ACS Synth Biol. 10 (7), 1615-1624 (2021).
- . IDT codon optimization tool Available from: https://www.idtdna.com/pages/tools/codon-optimization-tool (2025)
- . General protocol for western blotting Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6376.pdf (2025)
- Mruk, D. D., Cheng, C. Y. Enhanced chemiluminescence (ECL) for routine immunoblotting. Spermatogenesis. 1, 121-122 (2011).
- Levine, M. Z., Gregorio, N. E., Jewett, M. C., Watts, K. R., Oza, J. P. Escherichia coli-based cell-free protein synthesis: Protocols for a robust, flexible, and accessible platform technology. J Vis Exp. (144), (2019).
- . Plasma and serum preparation Available from: https://www.thermofisher.com/ca/en/home/references/protocols/cell-and-tissue-analysis/elisa-protocol/elisa-sample-preparation-protocols/plasma-and-serum-preparation.html (2025)
- Mattiuzzo, G., et al. . WHO/BS.2020.2403 Establishment of the WHO International Standard and Reference Panel for anti-SARS-CoV-2 antibody. , (2020).
- Gong, F., Wei, H., Li, Q., Liu, L., Li, B. Evaluation and comparison of serological methods for COVID-19 diagnosis. Front Mol Biosci. 8, 682405 (2021).
- Peeling, R. W., et al. Serology testing in the COVID-19 pandemic response. Lancet Infect Dis. 20 (9), e245-e249 (2020).
- Smith, M. T., Berkheimer, S. D., Werner, C. J., Bundy, B. C. Lyophilized Escherichia coli-based cell-free systems for robust, high-density, long-term storage. Biotechniques. 56 (4), 186-193 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유