需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
晚期糖基化终末产物使人类感觉样神经元细胞对辣椒素诱导的钙内流敏感
* 这些作者具有相同的贡献
摘要
胶原蛋白衍生的晚期糖基化终末产物 (AGEs) 的增加始终与痛苦的疾病有关。在这里,我们研究了糖基化是否使感觉神经元对辣椒素兴奋敏感。
摘要
胶原蛋白衍生的晚期糖基化终末产物 (AGEs) 的增加始终与痛苦疾病有关,包括骨关节炎、糖尿病神经病变和神经退行性疾病。当暴露于 AGEs 时,从 SH-SY5Y 细胞系分化的人类感觉样神经元通过释放 P 物质和上调瞬时受体电位香草酸 1 (TRPV1) 表达获得促伤害感受功能。在这里,我们研究了该受体是否具有功能活性,以及糖基化过程是否使感觉神经元对辣椒素兴奋敏感。通过用全反式维甲酸和脑源性神经营养因子分化 SH-SY5Y 细胞获得感觉样神经元细胞。与糖化胶原蛋白细胞外基质 (ECM-GC) 一起孵育模拟了促伤害性刺激。对照细胞与非糖化细胞外胶原基质 (ECM-NC) 一起孵育。Fluo-8 钙通量检测试剂盒用于评估辣椒素刺激的钙内流。结果表明,与用正常胶原蛋白处理的细胞相比,糖基化增加了钙内流,表明感觉样神经元表达功能性 TRPV1 通道,而糖基化增加了辣椒素的兴奋。这些数据表明 AGEs 超敏的感觉样神经元细胞,触发促伤害性信号传导。总之,我们的结果表明,我们建立了一个对辣椒素有反应的功能模型,该模型可用于筛选管理疼痛状况的候选人。
引言
糖基化是一个非酶促的、不可逆的、自发的过程,其中蛋白质(如胶原蛋白)与还原糖分子结合,导致晚期糖基化终产物 (AGEs)。AGEs 可激活细胞膜受体,触发细胞内途径激活,如细胞外信号调节蛋白激酶 (ERK) 1/2、p38 丝裂原活化蛋白激酶 (MAPK) 和 c-jun N 末端激酶 (JNK)、rho-GTP 酶、磷酸肌醇-3-激酶 (PI3K)、Janus 激酶/信号转导和转录激活因子 (JAK/STAT) 以及蛋白激酶 C (PKC),增加促炎分子的释放和氧化应激1.糖化胶原蛋白还会损害细胞外基质的结构和特性,胶原蛋白衍生的 AGEs 增加始终与痛苦疾病有关,包括骨关节炎、糖尿病神经病变和神经退行性疾病 2,3。
我们小组之前证明,SH-SY5Y 细胞系可以分化为感觉样神经元细胞,因为这些细胞表达参与伤害感受的通道,例如钠通道(Nav 1.7、Nav 1.8 和 Nav 1.9)和瞬时受体电位香草酸样蛋白 1 型 (TRPV1),这些标志物通常存在于外周感觉神经元中 4.TRPV1 是一种可渗透钙离子的非选择性阳离子通道,对辣椒素刺激敏感。重要的是,当感觉样神经元细胞暴露于糖化胶原蛋白基质 (ECM-GC) 时,它们通过增加 c-Fos 表达(一种参与神经元激活的转录因子)和 P 物质释放(一种广泛参与神经炎症和疼痛的神经肽)来获得促伤害感受功能。这些细胞对镇痛药(如吗啡、原型阿片类药物)有反应,减少了 ECM-GC 诱导的 P 物质释放。总之,这些数据表明该模型对促伤害和抗伤害分子有反应 4,5。
监测细胞内 Ca2+ 浓度变化对于研究许多细胞过程至关重要。在神经元中,它可以成为预测神经元损伤和药物神经保护特性的有用工具。辣椒素是辣椒的刺激性活性成分,是 TRPV1 受体5 研究最多的激动剂,也是研究疼痛机制和筛选潜在新镇痛药的宝贵工具。先前的研究表明,与高葡萄糖一起孵育的啮齿动物背根神经节的初级感觉神经元表现出辣椒素诱导的钙内流6 的显着增加。然而,TRPV1 通道在我们的细胞模型中是否具有功能活性,以及糖化胶原蛋白是否使感觉样神经元细胞对辣椒素兴奋敏感,辣椒素兴奋可能激活伤害性信号通路,仍是未知数。因此,我们的目标是开发一种具有成本效益的方案,利用简单的工具在感觉样细胞中实时监测钙,同时确保可靠的分析。在这里,我们提供了一个全面的方案,帮助研究人员完成在感觉样神经元细胞中分化 SH-SY5Y 细胞的步骤,以及如何使它们对促伤害性刺激敏感。这种方法有助于发现新的镇痛或神经保护化合物。
研究方案
1. SH-SY5Y 培养并分化为感觉样神经元细胞
注 1:本节中的所有步骤都需要在层流罩下完成,并且所有溶液和用品都需要无菌。
- 首先,加入 5 mL 培养基,制备培养瓶 (25 cm2)。
注:对于这种细胞类型的解冻、扩增和维持,请使用培养基混合物:补充有 10% 热灭活胎牛血清和 1% 青霉素-链霉素的 Dulbecco 改良 Eagle's 和 Ham's 培养基 F12 (DMEM/F12)。 - 然后,从液氮中取出含有 SH-SY5Y 细胞的冻存管,并将其置于冰上。将细胞在 37 °C 的水浴中解冻 2 分钟。
- 向冻管中加入 1 mL 完全培养基,将细胞转移至 15 mL 试管中,加入 3 mL 完全培养基(DMEM/F12 补充有 10% 热灭活胎牛血清),反复吸取混匀,并使用移液管将其分配回试管中。
- 将细胞移液到 15 mL 试管中,并以 290 g 离心。弃去上清液以去除二甲基亚砜 (DMSO),这是一种冷冻保护剂,用于防止在冷冻细胞期间形成冰晶。
- 向细胞沉淀中加入 1 mL 培养基,用移液管充分混合,然后放入 25 cm2 培养瓶中以扩增细胞。将细胞置于 37 °C 的 5% CO2 潮湿气氛中的培养箱中。
注:当细胞达到大约 80% 汇合时,可以使用细胞。对于神经元分化,建议使用 SH-SY5Y 细胞直至细胞传代 20 次。 - 通过在无菌 PBS 中稀释大鼠尾部 I 型胶原蛋白来制备细胞外胶原蛋白基质 (100 μg/mL),并将 1 mL 该溶液倒入培养皿 (35/10 mm) 中进行涂层。
- 将其在 5% CO2 的潮湿气氛中的培养箱中孵育约 1 小时。
- 在此期间后,用无菌 PBS 洗涤板两次,然后使用 Neubauer 室对细胞进行计数。
- 要对细胞进行计数,首先用 5 mL 无菌 PBS 洗涤含有细胞的 25 cm2 培养瓶,以去除所有培养基。然后取出无菌 PBS,向细胞中加入 3 mL 0.05% 胰蛋白酶,并将它们置于 37 °C 和 5% CO2 的培养箱中约 3-5 分钟以完成细胞分离。
- 之后,从培养箱中取出细胞,向培养瓶中加入 6 mL 培养基,然后将该溶液转移到 15 mL 试管中。以 290 g 离心 5 分钟。
- 去除上清液,将细胞充分重悬于 1 mL 完全培养基中。
- 最后,使用 Neubauer 计数室对细胞进行计数。混合 20 μL 细胞和 20 μL 台盼蓝,并将 10 μL 这种混合物添加到 Neubauer 室中。对不染色的活细胞进行蓝色计数。
- 在培养皿 (35/10 mm) 中,在培养皿 (35/10 mm) 中接种 5 ×10 个 4 4 mL 细胞,并采用上述相同的培养基。每板使用 1 mL 的总体积。
- 然后,等待 24 小时以开始神经元分化方案。为此,取出培养基并用 1 mL 补充有 2% 热灭活胎牛血清、1% 青霉素-链霉素和 10 μM 全反式维甲酸 (RA 10 μM) 的 DMEM/F12 替换。
- 等待 48 小时,每天更换培养基,持续 3 天。将细胞置于 37 °C 的 5% CO2 潮湿气氛中的培养箱中。
- 第 5 天,从细胞中取出培养基,并在每个板中加入 1 mL 补充有人脑来源神经营养因子 (BDNF 50 ng/mL) 的无血清培养基。
注:来自不同公司的 BDNF(见材料表)已经过测试。他们都以相同的方式工作。 - 在分化的第 7 天,用无菌 PBS 洗涤细胞一次,并使用感觉样神经元细胞进行实验。如果无法立即使用这些细胞进行实验,请添加无血清培养基以保持其活力直至使用。
注意:在神经元分化结束时,有必要用无菌 PBS 洗涤细胞以去除剩余的 BDNF,避免细胞毒性。
2. 糖化胶原蛋白和糖化过程
注:本节中的所有步骤都必须在层流罩下进行,并且所有溶液和备件必须是无菌的。
- 通过将大鼠尾纤维状态的 I 型胶原蛋白 (3.89 mg/mL) 与 200 mM D-核糖、160 mM D-葡萄糖和 200 mM D-苏糖在 4 °C 下孵育 7 天来制备胶原糖化。
注:要制备糖化胶原蛋白,请根据糖的分子量称量糖,并将它们与大鼠尾纤维状态的 I 型胶原蛋白 (3.89 mg/mL) 混合。 - 将感觉样神经元细胞培养物与在不含血清和抗生素的 DMEM/F12 培养基中制备的糖化胶原细胞外基质(ECM-GC,100 μg/mL)或正常胶原细胞外基质(ECM-NC,100 μg/mL)孵育 24 小时。
3. 钙内流测定
- 对于钙内流,请使用 Calcium Flux 检测试剂盒并根据制造商的说明制备溶液,如下所示。
- 最初,通过在 998 μL 1x 测定缓冲液(HBSS 缓冲液和 10x Pluronic F127 Plus 的混合物)中加入 2 μL Fluo-8 储备溶液来制备 1 mL Fluo-8 染料负载。
注:该工作溶液在室温 (RT) 下可稳定至少 2 小时。 - 随后,在 37 °C 的 5% CO2 湿润气氛中,将 250 μL 该溶液放入先前分化并用 ECM-NC 或 ECM-GC 处理的感觉样神经元细胞的每个电镀皿中孵育 30 分钟。 然后,从培养箱中取出培养皿,并在室温下(避光)保持 30 分钟。
注意:如果外推 2 小时孵育,该溶液会变得具有细胞毒性。在孵育期间准备辣椒素溶液。
4. 辣椒素诱导
注意:辣椒素是一种 TRPV1 激动剂,用于诱导细胞中的钙内流。
- 称量并在 1% 乙醇和超纯水中稀释辣椒素。然后,制备浓度为 2 μM 的溶液,该溶液也用超纯水稀释。
注意:辣椒素溶液必须在使用当天配制。先在乙醇中稀释辣椒素,然后在水中稀释;否则,它会沉淀。 - 向每个 35/10 mm 培养皿中加入 250 μL 的 2 μM 辣椒素溶液,使最终浓度为 1 μM。
注:辣椒素的储备溶液浓度为 2 μM,以确保更好的分散并避免分离的荧光峰。
5. 钙内流成像和共聚焦显微镜分析
注意:在配备 20x/0.75NA 物镜和 488 nm 激发激光(0.5% 强度)的共聚焦显微镜中进行成像。在 520 nm 处检测到发射。以 600 Hz 的速度在时间 (t) 上沿 xy 轴(512 x 512 像素)扫描细胞,采集间隔为 433 ms,总采集时间为 5 min。使用 microscopy 软件在 37 °C 下进行成像以维持细胞的生理状况。
- 准备一个装有 250 μL 2 μM 辣椒素溶液的注射器(板中的终浓度为 1 μM),并将其连接到头皮静脉组 - Butterfly 型 23 GA 无菌。使用实验室支架和夹子固定注射器。
- 将培养皿放在显微镜载物台上,极其小心地将头皮针放入培养皿中,避免接触底部,针尖不应浸入液体中。
注意: 可以使用胶带固定头皮位置。 - 找到具有足够数量(超过 20 个)的视野,并使用明场光调整焦点。
- 使用 488 nm 激光器启动 实时 模式,并调整焦距和照明参数。
- 开始采集记录,在基线期(t = 0 至 t = 60 秒)后,应用 250 μL 2 μM 辣椒素并轻轻推动注射器柱塞以刺激钙流入细胞。
注意:最终记录采集时间约为每板 300 秒。
6. 后处理/数据分析
- 在 定量 模式下使用显微镜软件进行细胞分析。首先,分析辣椒素刺激前后的荧光刺突细胞。
- 在每个反应性细胞中创建一个感兴趣区域 (ROI),即辣椒素后显示荧光尖峰的细胞。确保在整个细胞区域绘制 ROI,如上所示(图 1)。
- 将数据导出为逗号分隔值 (CSV) 文件以供后续分析。
- 或者,使用免费提供的 FIJI7 (https://fiji.sc) 软件进行分析。
- 要打开图像文件,请使用 Bio-Formats 插件,导航到 File > Import > Bio-Formats 并选择文件。
- 接下来,使用 放大镜 工具进行放大,并使用 手绘选择 工具在响应式单元格周围绘制感兴趣区域 (ROI)。
- 绘制每个 ROI 后,按 T 键将其添加到 ROI 管理器。对所有感兴趣的细胞重复此过程(图 2)。
- 添加所有 ROI 后,转到 ROI 管理器 窗口,选择所有 ROI,然后导航到主菜单中的 Analyze > Set Measurements 。
- 然后,返回到 ROI 管理器并选择 More > Multi Measure 以测量所有帧的强度。结果将显示在新窗口中;通过转到 File > Save As 导出为 CSV 文件。
注意:CSV 文件可以在 Excel、Google 表格和 GraphPad 软件中进行分析。使用公式 ΔF/F0 = (F(t) - F0)/F0 将 Fluo-8 钙通量检测试剂盒获得的荧光强度值转换为钙内流变化的相对测量值。这里,F0 代表基线荧光,计算为用辣椒素刺激前 t = 0 s 到 t = 60 s 捕获的图像的平均强度。F(t) 是刺激后观察到的最大荧光强度的值,可用于评估峰值钙内流。这种方法突出了荧光相对于基线的增加,其中 ΔF/F0 的增加表明细胞内钙水平升高。

图 1:在 LAS X 软件中用于钙内流分析的选定细胞中的 ROI 示例。 (A) 定量模式下的 LAS X 界面。粉红色矩形显示 quantification 选项卡。黄色矩形显示绘制折线工具,青色矩形显示缩小和放大工具。(B) 拍摄的视野 (FOV)。(C) 放大 FOV 以方便绘制整个单元的 ROI。 请单击此处查看此图的较大版本。
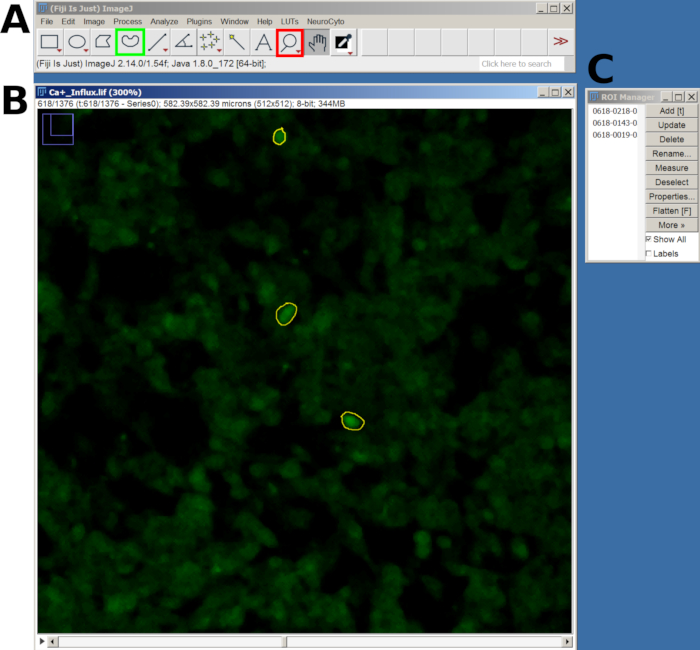
图 2:在 FIJI 软件中用于钙内流分析的选定细胞的 ROI 示例。 (A) 显示主菜单和工具的 FIJI 界面。红色方块显示放大镜工具,绿色方块显示手绘选区。(B) 通过放大和绘制的 ROI 捕获的视野 (FOV)。(C) ROI 管理器窗口。 请单击此处查看此图的较大版本。
7. 故障排除
- 如果图像未聚焦,请尝试以下作:
- 检查胶带的附着力;如果指针松动,这可能会导致指针移动并影响焦点。
- 用额外的胶带重新连接针头,以提高稳定性。
- 更换标准针头。使用预弯曲的牙科针尖来改善在板上的对齐。
- 如果细胞显示饱和信号,请尝试以下步骤:
- 降低激光强度和增益设置。
- 验证试剂孵育时间。如果超过制造商的建议,可能会导致信号饱和,使钙内流检测复杂化。
- 请遵循以下其他建议进行故障排除:
- 定期校准:确保定期校准成像设备,以保持对焦和信号检测质量。
- 文档更改:记录对实验方案所做的任何调整,以备将来参考并便于故障排除。
- 反应性调整:如果问题仍然存在,请考虑使用不同的试剂浓度或替代信号检测方法进行测试。
结果
SH-SY5Y 细胞分化为感觉样神经元
高内涵筛选图像表明神经元分化方案改变了 SH-SY5Y 细胞形态。感觉样神经元细胞(分化细胞)显示圆形细胞体,投射出广泛的神经丝网络。它们形成连接周围神经元的更细长的神经突分支,这与成熟神经元的特征一致(图 3)4。重要的是,与未分化的 SH-SY5Y 细胞相比,这些细胞的 TRPV1 ...
讨论
伤害感受器是介导疼痛的感觉神经元的专门亚群。这些细胞表达电压门控和配体离子通道,例如 TRPV1,其激活导致钙内流以及调节伤害性传递的神经肽和神经递质的释放。在这里,我们描述了一种将 SH-SY5Y 分化为感觉样神经元细胞以评估辣椒素诱导的钙内流的方案 8,9。重要的是,我们表明,用糖化胶原蛋白模拟促伤害性环境,...
披露声明
MCB、AMCT 和 VOZ 拥有一项关于识别与骨关节炎疼痛有关的分子实体的过程的专利 (BR102018008561-1)。
致谢
这项工作得到了 Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP 资助号 2015/50040-4 和 2020/13139-0、圣保罗研究基金会和葛兰素史克、FAPESP 2022/08417-7 和 2024/04023-0 的支持。
材料
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
参考文献
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。