Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Les produits finaux de glycation avancée sensibilisent les cellules neuronales humaines de type sensoriel à l’afflux de calcium induit par la capsaïcine
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’augmentation des produits finaux de glycation avancée (AGE) dérivés du collagène est systématiquement liée à des maladies douloureuses. Ici, nous avons cherché à savoir si la glycation sensibilise les neurones sensoriels à l’excitation de la capsaïcine.
Résumé
L’augmentation des produits finaux de glycation avancée (AGE) dérivés du collagène est systématiquement liée à des maladies douloureuses, notamment l’arthrose, la neuropathie diabétique et les troubles neurodégénératifs. Les neurones humains de type sensoriel différenciés de la lignée cellulaire SH-SY5Y acquièrent des fonctions pro-nociceptives lorsqu’ils sont exposés à des AGE en libérant la substance P et en régulant à la hausse l’expression du récepteur transitoire vanilloïde 1 (TRPV1). Ici, nous avons cherché à savoir si ce récepteur était fonctionnellement actif et si le processus de glycation sensibilisait les neurones sensoriels à l’excitation de la capsaïcine. Des cellules neuronales de type sensoriel ont été obtenues à partir de la différenciation des cellules SH-SY5Y avec de l’acide tout-trans-rétinoïque et du facteur neurotrophique dérivé du cerveau. L’incubation avec une matrice extracellulaire de collagène glyqué (ECM-GC) a simulé un stimulus pro-nociceptif. Les cellules témoins ont été incubées avec une matrice de collagène extracellulaire non glyquée (ECM-NC). Le kit de dosage du flux calcique Fluo-8 a été utilisé pour évaluer l’afflux de calcium, qui a été stimulé par la capsaïcine. Les résultats montrent que la glycation augmente l’afflux de calcium par rapport aux cellules traitées avec du collagène normal, ce qui suggère que les neurones de type sensoriel expriment des canaux TRPV1 fonctionnels et que la glycation augmente l’excitation de la capsaïcine. Ces données indiquent que les cellules neuronales hypersensibles de l’AGE sont de type sensoriel, déclenchant une signalisation pro-nociceptive. Ensemble, nos résultats suggèrent que nous avons établi un modèle fonctionnel répondant à la capsaïcine qui peut être utile pour le dépistage des candidats à la gestion des affections douloureuses.
Introduction
La glycation est un processus non enzymatique, irréversible et spontané dans lequel les protéines, telles que le collagène, se lient à des molécules de sucre réductrices, ce qui donne des produits finaux de glycation avancée (AGE). Les AGE peuvent activer les récepteurs membranaires cellulaires, déclenchant l’activation de voies intracellulaires, telles que la protéine kinase régulée par le signal extracellulaire (ERK) 1/2, la protéine kinase activée par les mitogènes p38 (MAPK) et les kinases n-terminales c-jun (JNK), les rho-GTPases, la phosphoinositol-3-kinase (PI3K), la Janus kinase/transducteur de signal et activateur de transcription (JAK/STAT) et la protéine kinase C (PKC), augmentant la libération de molécules pro-inflammatoires et le stress oxydatif1. Le collagène glyqué altère également la structure et les propriétés de la matrice extracellulaire, et l’augmentation des AGE dérivés du collagène est systématiquement liée à des maladies douloureuses, notamment l’arthrose, la neuropathie diabétiqueet les troubles neurodégénératifs.
Notre groupe a précédemment démontré que la lignée cellulaire SH-SY5Y peut être différenciée en cellules neuronales de type sensoriel puisque ces cellules expriment des canaux impliqués dans la nociception, tels que les canaux sodiques (Nav 1.7, Nav 1.8 et Nav 1.9) et les récepteurs transitoires vanilloïdes de type 1 (TRPV1), marqueurs généralement trouvés dans les neurones sensoriels périphériques4. TRPV1 est un canal cationique non sélectif perméable aux ions calcium et sensible au stimulus de la capsaïcine. Il est important de noter que lorsque les cellules neuronales de type sensoriel sont exposées à la matrice de collagène glyqué (ECM-GC), elles acquièrent des fonctions pro-nociceptives en augmentant l’expression de c-Fos, un facteur de transcription impliqué dans l’activation neuronale, et la libération de substance P, un neuropeptide largement impliqué dans la neuroinflammation et la douleur. Ces cellules réagissent aux analgésiques, tels que la morphine, l’opiacé prototype, diminuant la libération de la substance P induite par l’ECM-GC. L’ensemble de ces données indique que ce modèle est sensible à une molécule pro et anti-nociceptive 4,5.
Le suivi des changements de concentration intracellulaire de Ca2+ est essentiel pour étudier de nombreux processus cellulaires. Dans les neurones, il peut être un outil utile pour prédire les dommages neuronaux et les propriétés neuroprotectrices des médicaments. La capsaïcine, l’ingrédient actif piquant des piments forts, est l’agoniste le plus étudié du récepteur5 du TRPV1 et un outil précieux pour étudier les mécanismes de la douleur et dépister de nouveaux analgésiques potentiels. Des études antérieures ont démontré que les neurones sensoriels primaires des ganglions de la racine dorsale des rongeurs incubés avec un taux élevé de glucose présentent une augmentation significative de l’afflux de calcium induit par la capsaïcine6. Cependant, on ne sait pas si le canal TRPV1 était fonctionnellement actif dans notre modèle cellulaire et si le collagène glyqué sensibilise les cellules neuronales de type sensoriel à l’excitation de la capsaïcine, qui peut activer les voies de signalisation nociceptives. Par conséquent, nous avons cherché à développer un protocole rentable utilisant des outils simples pour la surveillance du calcium en temps réel dans les cellules de type sensoriel tout en assurant une analyse fiable. Ici, nous fournissons un protocole complet pour aider les chercheurs à franchir les étapes de différenciation des cellules SH-SY5Y en cellules neuronales de type sensoriel et à les sensibiliser aux stimuli pro-nociceptifs. Cette méthode peut contribuer à la découverte de nouveaux composés analgésiques ou neuroprotecteurs.
Protocole
Culture 1. SH-SY5Y et différenciation en cellules neuronales de type sensoriel
REMARQUE 1 : Toutes les étapes présentes dans cette section doivent être effectuées sous une hotte à flux laminaire, et toutes les solutions et fournitures doivent être stériles.
- Préparez d’abord une fiole de culture (25 cm2) en ajoutant 5 mL de milieu de culture.
REMARQUE : Pour la décongélation, l’expansion et le maintien de ce type de cellule, utilisez un mélange de milieu de culture : Dulbecco Modified Eagle’s and Ham’s Medium F12 (DMEM/F12) complété par 10 % de sérum fœtal bovin inactivé par la chaleur et 1 % de pénicilline-streptomycine. - Ensuite, retirez le cryotube contenant les cellules SH-SY5Y de l’azote liquide et conservez-le sur de la glace. Décongeler les cellules dans un bain-marie à 37 °C pendant 2 min.
- Ajoutez 1 mL de milieu de culture complet dans le cryoflacon, transférez les cellules dans un tube de 15 mL, ajoutez 3 mL de milieu de culture complet (DMEM/F12 complété par 10 % de sérum fœtal bovin inactivé par la chaleur) et mélangez en l’aspirant à plusieurs reprises et en le redistribuant dans le tube à l’aide d’une pipette.
- Pipeter les cellules dans le tube de 15 mL et centrifuger à 290 g. Jetez le surnageant pour éliminer le sulfoxyde de diméthyle (DMSO), un agent cryoprotecteur utilisé pour empêcher la formation de cristaux de glace pendant la congélation des cellules.
- Ajoutez 1 mL de milieu de culture à la pastille cellulaire, mélangez-les bien à l’aide d’une pipette et placez-les dans une fiole deculture de 25 cm 2 pour dilater les cellules. Placez les cellules dans un incubateur dans une atmosphère humidifiée à 5 % de CO2 à 37 °C.
REMARQUE : Les cellules peuvent être utilisées lorsqu’elles atteignent environ 80 % de confluence. Pour la différenciation neuronale, il est recommandé d’utiliser les cellules SH-SY5Y jusqu’au passage cellulaire vingt. - Préparez la matrice de collagène extracellulaire (100 μg/mL) en diluant du collagène de type I en queue de rat dans du PBS stérile, et versez 1 mL de cette solution dans une boîte de Pétri (35/10 mm) pour un enrobage.
- Incuber dans un incubateur dans une atmosphère humidifiée à 5 % de CO2 pendant environ 1 h.
- Après cette période, lavez la plaque deux fois avec du PBS stérile, puis comptez les cellules à l’aide de la chambre Neubauer.
- Pour compter les cellules, il faut d’abord laver la fiole de culture de 25 cm2 contenant la cellule avec 5 mL de PBS stérile pour retirer tout le milieu de culture. Retirez ensuite le PBS stérile, ajoutez 3 ml de trypsine à 0,05 % dans les cellules et placez-les dans un incubateur à 37 °C et 5 % de CO2 pendant environ 3 à 5 minutes pour compléter le détachement cellulaire.
- Après cela, retirez les cellules de l’incubateur, ajoutez 6 ml de milieu de culture dans le flacon de culture et transférez cette solution dans un tube de 15 ml. Centrifuger à 290 g pendant 5 min.
- Retirer le surnageant et bien remettre les cellules en suspension dans 1 mL de milieu de culture complet.
- Enfin, comptez les cellules à l’aide d’une chambre de comptage Neubauer. Mélangez 20 μL de cellules et 20 μL de bleu de trypan, et ajoutez 10 μL de ce mélange dans une chambre de Neubauer. Comptez les cellules vivantes qui ne se colorent pas en bleu.
- Plaque 5 × 10 cellulesde 4 cellules/mL dans une boîte de Pétri (35/10 mm) sur le même milieu de culture décrit ci-dessus. Utiliser le volume total de 1 mL par assiette.
- Ensuite, attendez 24 h pour démarrer le protocole de différenciation neuronale. Pour cela, retirez le milieu de culture et remplacez-le par 1 mL de DMEM/F12 complété par 2 % de sérum de veau fœtal inactivé par la chaleur, 1 % de pénicilline-streptomycine et 10 μM d’acide rétinoïque tout-trans (RA 10 μM).
- Attendre 48 h et remplacer le milieu de culture tous les jours pendant 3 jours. Placez les cellules dans un incubateur dans une atmosphère humidifiée à 5 % de CO2 à 37 °C.
- Le cinquième jour, retirez le milieu des cellules et ajoutez 1 ml de milieu de culture sans sérum complété par du facteur neurotrophique dérivé du cerveau humain (BDNF 50 ng/mL) dans chaque plaque.
REMARQUE : Le BDNF de différentes sociétés (voir tableau des matériaux) a été testé. Ils fonctionnaient tous de la même manière. - Le septième jour de la différenciation, lavez une fois les cellules avec du PBS stérile et utilisez des cellules neuronales de type sensoriel pour les expériences. S’il est impossible d’utiliser ces cellules immédiatement pour des expériences, ajoutez un milieu de culture sans sérum pour les maintenir en vie jusqu’à l’utilisation.
REMARQUE : À la fin de la différenciation neuronale, il est nécessaire de laver les cellules avec du PBS stérile pour éliminer le BDNF restant, évitant ainsi la toxicité cellulaire.
2. Collagène glyqué et processus de glycation
REMARQUE : Toutes les étapes de cette section doivent être effectuées sous une hotte à flux laminaire, et toutes les solutions et fournitures doivent être stériles.
- Préparez la glycation du collagène en incubant du collagène de type I à partir de l’état fibrillaire de la queue de rat (3,89 mg/mL) avec 200 mM de D-ribose, 160 mM de D-glucose et 200 mM de D-thréose à 4 °C pendant 7 jours.
REMARQUE : Pour préparer du collagène glyqué, pesez les sucres en fonction de leur poids moléculaire et mélangez-les avec du collagène de type I à partir de l’état fibrillaire de la queue de rat (3,89 mg / mL). - Incuber une culture de cellules neuronales de type sensoriel pendant 24 h avec une matrice extracellulaire de collagène glyqué (ECM-GC, 100 μg/mL) ou une matrice extracellulaire de collagène normale (ECM-NC, 100 μg/mL) préparée dans un milieu de culture DMEM/F12 sans supplément sérique ni antibiotique.
3. Test d’afflux de calcium
- Pour l’influx de calcium, utilisez le kit de dosage du flux de calcium et préparez les solutions selon les instructions du fabricant, comme indiqué ci-dessous.
- Initialement, préparez 1 mL de colorant Fluo-8 en ajoutant 2 μL de solution mère Fluo-8 dans 998 μL de 1x tampon de dosage (un mélange de tampon HBSS et de 10x Pluronic F127 Plus.
REMARQUE : Cette solution de travail est stable pendant au moins 2 h à température ambiante (RT). - Plus tard, incubez 250 μL de cette solution dans chaque boîte de cellules neuronales de type sensoriel préalablement différenciées et traitées par ECM-NC ou ECM-GC pendant 30 min dans une atmosphère humidifiée à 5 % de CO2 à 37 °C. Ensuite, retirez le plat de l’incubateur et maintenez-le à RT (dans l’obscurité) pendant 30 min.
REMARQUE : Cette solution devient cytotoxique si l’incubation de 2 h est extrapolée. Préparez la solution de capsaïcine pendant la période d’incubation.
4. Induction de la capsaïcine
REMARQUE : La capsaïcine, un agoniste du TRPV1, a été utilisée pour induire un afflux de calcium dans les cellules.
- Pesez et diluez la capsaïcine dans de l’éthanol à 1 % et de l’eau ultrapure. Ensuite, préparez une solution à une concentration de 2 μM, qui a également été diluée dans de l’eau ultra-pure.
REMARQUE : La solution de capsaïcine doit être préparée le jour de l’utilisation. Diluez la capsaïcine d’abord dans de l’éthanol puis dans de l’eau ; sinon, il se précipitera. - Ajouter 250 μL de solution de capsaïcine à 2 μM dans chaque boîte de Pétri de 35/10 mm de sorte que la concentration finale soit de 1 μM.
REMARQUE : La concentration de capsaïcine dans la solution mère était de 2 μM pour assurer une meilleure dispersion et éviter les pics de fluorescence isolés.
5. Imagerie de l’afflux de calcium et analyse de la microscopie confocale
REMARQUE : L’imagerie a été réalisée à l’aide d’un microscope confocal équipé d’un objectif 20x/0,75NA et d’un laser d’excitation de 488 nm (intensité de 0,5 %). L’émission a été détectée à 520 nm. Les cellules ont été balayées dans des axes xy (512 x 512 pixels) au cours du temps (t) à une vitesse de 600 Hz avec un intervalle d’acquisition de 433 ms et un temps d’acquisition total de 5 min. L’imagerie a été réalisée à 37 °C pour maintenir l’état physiologique des cellules à l’aide du logiciel de microscopie.
- Préparez une seringue avec 250 μL de solution de capsaïcine 2 μM (la concentration finale dans la plaque sera de 1 μM) et connectez-la à un ensemble de veines du cuir chevelu - Papillon type 23 GA stérile. Fixez la seringue à l’aide d’un support de laboratoire et d’une pince.
- Placez la boîte de Pétri sur la platine du microscope et, avec une extrême prudence, placez l’aiguille du cuir chevelu dans la boîte de Pétri, en évitant tout contact avec le fond, la pointe de l’aiguille ne doit pas être immergée dans le liquide.
REMARQUE : Un ruban adhésif peut être utilisé pour fixer la position du cuir chevelu. - Trouvez un champ avec un nombre adéquat de cellules (plus de 20) et ajustez la mise au point à l’aide d’une lumière de champ vif.
- Démarrez le mode Live avec un laser de 488 nm et ajustez les paramètres de mise au point et d’éclairage.
- Démarrez l’enregistrement d’acquisition et, après la période de référence (t = 0 à t = 60 secondes), appliquez 250 μL de capsaïcine 2 μM et poussez doucement le piston de la seringue pour stimuler l’afflux de calcium dans les cellules.
REMARQUE : Le temps d’acquisition final de l’enregistrement était d’environ 300 s par plaque.
6. Post-traitement/analyse des données
- Effectuez l’analyse cellulaire à l’aide du logiciel de microscopie en mode Quantification . Tout d’abord, analysez les cellules de pointe de fluorescence avant et après le stimulus de la capsaïcine.
- Créez une région d’intérêt (ROI) dans chaque cellule réactive, c’est-à-dire des cellules qui présentent un pic de fluorescence après la capsaïcine. Assurez-vous d’afficher le retour d’intérêt dans toute la zone de la cellule, comme illustré ci-dessus (Figure 1).
- Exportez les données dans un fichier CSV (valeurs séparées par des virgules) pour une analyse ultérieure.
- Vous pouvez également effectuer l’analyse à l’aide du logiciel gratuit FIJI7 (https://fiji.sc).
- Pour ouvrir les fichiers image, utilisez le plugin Bio-Formats en accédant à Fichier > Importer > Bio-Formats et en sélectionnant le fichier.
- Ensuite, utilisez l’outil Loupe pour effectuer un zoom avant et l’outil Sélection à main levée pour dessiner une région d’intérêt (ROI) autour des cellules réactives.
- Après avoir dessiné chaque ROI, appuyez sur la touche T pour l’ajouter au Gestionnaire de ROI. Répétez ce processus pour toutes les cellules d’intérêt (Figure 2).
- Une fois que tous les retours sur investissement sont ajoutés, accédez à la fenêtre Gestionnaire de retour sur investissement , sélectionnez tous les rapports d’investissement, puis accédez à Analyser > définir les mesures dans le menu principal.
- Ensuite, retournez au gestionnaire de retour sur investissement et sélectionnez Plus > Multi Mesure pour mesurer l’intensité sur toutes les images. Les résultats apparaîtront dans une nouvelle fenêtre ; exporter sous forme de fichier CSV en accédant à Fichier > Enregistrer sous.
REMARQUE : Le fichier CSV peut être analysé dans les logiciels Excel, Google Sheets et GraphPad. Utilisez l’équation ΔF/F0 = (F(t) - F0)/F0 pour convertir les valeurs d’intensité de fluorescence obtenues avec le kit de dosage du flux calcique Fluo-8 en une mesure relative de la variation de l’afflux de calcium. Ici, F0 représente la fluorescence de base, calculée comme l’intensité moyenne des images capturées de t = 0 s à t = 60 s avant la stimulation par la capsaïcine. F(t) est la valeur de l’intensité maximale de fluorescence observée après le stimulus, ce qui permet d’évaluer l’afflux maximal de calcium. Cette approche met en évidence l’augmentation de la fluorescence par rapport à la ligne de base, où une augmentation de ΔF/F0 indique un taux de calcium intracellulaire élevé.

Figure 1 : Exemple de ROI dans les cellules sélectionnées pour l’analyse de l’afflux de calcium dans le logiciel LAS X. (A) Interface LAS X en mode quantification. Le rectangle rose montre l’onglet de quantification. Le rectangle jaune représente l’outil Dessiner une polyligne et le rectangle cyan affiche les outils de zoom arrière et de zoom avant. (B) Champ de vision (FOV) capturé. (C) Zoomez sur le FOV pour faciliter le dessin du ROI dans l’ensemble de la cellule. Veuillez cliquer ici pour voir une version agrandie de cette figure.
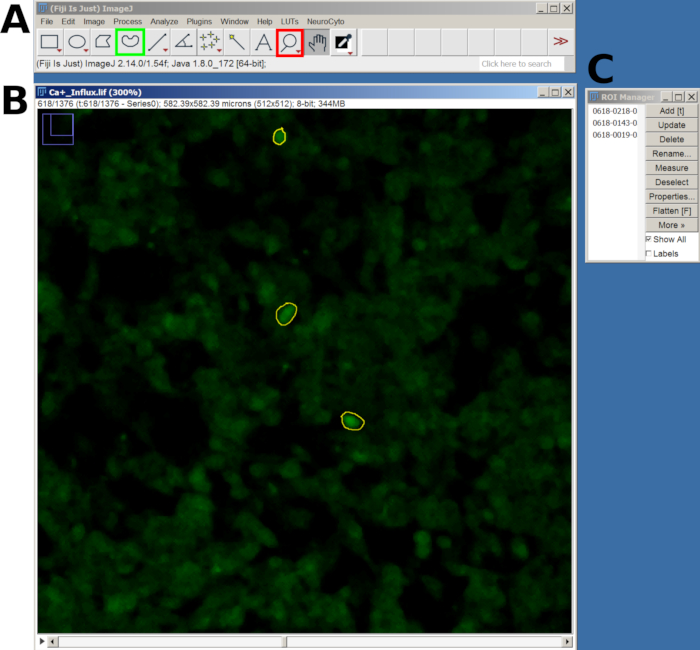
Figure 2 : Exemple de retour sur investissement dans les cellules sélectionnées pour l’analyse de l’afflux de calcium dans le logiciel FIJI. (A) Interface FIJI montrant le menu principal et l’outil. Le carré rouge montre l’outil loupe et le carré vert montre la sélection à main levée. (B) Champ de vision (FOV) capturé avec zoom avant et un retour d’investissement dessiné. (C) La fenêtre du gestionnaire de retour sur investissement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Dépannage
- Si l’image n’est pas nette, essayez ce qui suit :
- Vérifiez l’adhérence du ruban ; S’il s’est desserré, cela peut entraîner le déplacement de l’aiguille et affecter la mise au point.
- Rattachez l’aiguille avec du ruban adhésif supplémentaire pour une stabilité accrue.
- Remplacement des aiguilles standard. Utilisez des pointes d’aiguille dentaire pré-pliées pour améliorer l’alignement sur la plaque.
- Si les cellules présentent un signal saturé, essayez les étapes suivantes :
- Diminuez l’intensité et les paramètres de gain du laser.
- Vérifiez le temps d’incubation du réactif. S’il dépasse les recommandations du fabricant, il peut entraîner une saturation du signal, ce qui complique la détection de l’afflux de calcium.
- Suivez ces suggestions supplémentaires pour le dépannage :
- Étalonnage régulier : Assurez-vous que l’équipement d’imagerie est régulièrement calibré pour maintenir la qualité de la mise au point et de la détection du signal.
- Documentez les modifications : Tenez un registre de toutes les modifications apportées au protocole pour référence future et pour faciliter le dépannage.
- Ajustements réactifs : Si les problèmes persistent, envisagez de tester avec différentes concentrations de réactifs ou d’autres méthodes de détection des signaux.
Résultats
Différenciation des cellules SH-SY5Y en neurones de type sensoriel
Les images de criblage à haut contenu démontrent que le protocole de différenciation neuronale modifie la morphologie des cellules SH-SY5Y. Les cellules neuronales de type sensoriel (cellules différenciées) présentent un corps cellulaire arrondi qui projette un vaste réseau de neurofilaments. Ils forment des branches de projections de neurites plus allongées reliant les neurones environnants, ...
Discussion
Les nocicepteurs sont des sous-ensembles spécialisés de neurones sensoriels qui médient la douleur. Ces cellules expriment des canaux voltage-dépendants et ligands-ions, tels que TRPV1, dont l’activation entraîne un afflux de calcium et la libération de neuropeptides et de neurotransmetteurs qui régulent la transmission nociceptive. Ici, nous décrivons un protocole pour différencier SH-SY5Y en cellules neuronales de type sensoriel afin d’évaluer l’afflux de calcium induit...
Déclarations de divulgation
MCB, AMCT et VOZ détiennent un brevet sur le processus d’identification des entités moléculaires impliquées dans la douleur arthrosique (BR102018008561-1).
Remerciements
Ce travail a été soutenu par la Fundação Amparo à Pesquisa do Estado de São Paulo FAPESP Grant number 2015/50040-4 et 2020/13139-0, São Paulo Research Foundation et GlaxoSmithKline, FAPESP 2022/08417-7 et 2024/04023-0.
matériels
| Name | Company | Catalog Number | Comments |
| All-trans retinoic acid | Tocris | 695 | |
| BDNF | Tocris | TOCR-2837 | |
| BDNF | Sigma-Aldrich | B3795 | |
| Butterfly type 23GA sterile | Beckton Dickinson Asepto | 38833814 | Scalp vein set |
| Capsaicin | Sigma-Aldrich | M2028 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 12500062 | Basal medium |
| D-ribose | Sigma-Aldrich | R7500 | |
| D-threose | Sigma-Aldrich | T7392 | |
| Fluo-8 Calcium Flux Assay Kit | Abcam | ab112129 | No wash |
| Heat-inactivated fetal bovine serum | Gibco | A5670801 | |
| High Content Screening | Molecular Devices | ||
| LASX software | Leica Microsystems | Microscopy software | |
| Leica TCS SP8 | Leica Microsystems | Leica TCS SP8 | Confocal microscope |
| Penicillin-streptomycin | Gibco | 15140130 | |
| Petri dish (35/10 mm) | Greiner bio-one | 627965 | |
| Rat tail type I collagen | Corning | 354236 | |
| SH-SY5Y | Merck | 94030304-1VL | Neuroblastoma cell line |
Références
- Bierhaus, A., et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med. 83 (11), 876-886 (2005).
- Hudson, B. I., et al. Blockade of receptor for advanced glycation endproducts: A new target for therapeutic intervention in diabetic complications and inflammatory disorders. Arch Biochem Biophys. 419 (1), 80-88 (2003).
- Dandia, H., Makkad, K., Tayalia, P. Glycated collagen - a 3D matrix system to study pathological cell behavior. Biomater Sci. 7 (8), 3480-3488 (2019).
- Bufalo, M. C., et al. Human sensory neuron-like cells and glycated collagen matrix as a model for the screening of analgesic compounds. Cells. 11 (2), 247 (2022).
- Frias, B., Merighi, A. Capsaicin, nociception and pain. Molecules. 21 (6), 797 (2016).
- Lam, D., et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose. PLoS One. 13 (2), e0193312 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Li, F., et al. TRPV1 activity and substance P release are required for corneal cold nociception. Nat Commun. 10 (1), 5678 (2019).
- Mickle, A. D., Shepherd, A. J., Mohapatra, D. P. Sensory TRP channels:the key transducers of nociception and pain. Prog Mol Biol Transl Sci. 131, 73-118 (2015).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiol Pain. 11, 100083 (2022).
- Vetter, I., et al. Characterisation of Nav types endogenously expressed in human SH-SY5Y neuroblastoma cells. Biochem Pharmacol. 83 (11), 1562-1571 (2012).
- Dekker, L. V., et al. Analysis of human Nav1.8 expressed in SH-SY5Y neuroblastoma cells. Eur J Pharmacol. 528 (1-3), 52-58 (2005).
- Lam, P. M. W., Hainsworth, A. H., Smith, G. D., Owen, D. E., Davies, J., Lambert, D. G. Activation of recombinant human TRPV1 receptors expressed in SH-SY5Y human neuroblastoma cells increases [Ca2+]i initiates neurotransmitter release and promotes delayed cell death. J Neurochem. 102 (3), 801-811 (2007).
- Koplas, P. A., Rosenberg, R. L., Oxford, G. S. The role of calcium in the desensitization of capsaicin responses in rat dorsal root ganglion neurons. J Neurosci. 17 (10), 3525-3537 (1997).
- Tominaga, M., et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 21 (3), 531-543 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon