细菌生长曲线分析和其环境的应用程序
Overview
资料来源: 实验室的博士伊恩胡椒和博士查尔斯称-亚利桑那大学
演示作者: 路易莎 Ikner
细菌是地球上最丰富的生命形式。他们发现在每一个生态系统,对日常生活至关重要。例如,细菌影响什么人吃,喝,和呼吸,还有实际上更细菌细胞内一个人的身体比哺乳动物细胞。由于细菌的重要性,它是最好研究特定种类的细菌在实验室。要做到这一点,细菌生长在受控条件下纯文化,意思只有一种类型的细菌正在审议中。细菌生长迅速在纯培养和细胞的数量在短时间内急剧增加。通过测量细胞人口的增长率增加随着时间推移,"生长曲线"将被开发。旨在利用或接种细菌分离,例如改善植株的生长、 增加生物降解的有毒有机物,或产生抗生素或其他天然产品在工业规模的已知的数字时,这非常重要。
Principles
细菌繁殖发生通过二进制裂变,在其中一个细菌细胞分裂,并成为两个细胞 (图 1)。细胞分裂所需的时间称为平均的一代人的时间或加倍的时间,这是对双细胞数目所需的时间。

图 1。细胞分裂指数。每个细胞分裂结果的单元格数目增加一倍。在低细胞数量的增加不是很大;然而经过几代,细胞增加爆炸。N 次分裂之后,有 2n个单元格。
要理解和定义特定微生物的生长,他们放在瓶里,在那里的养分供应和环境条件控制。如果液体介质供应增长和有利于增长的环境参数所需的所有营养物质,可以作为时间函数的增长曲线,测量人数的增加。几个不同的生长阶段可以观察内生长曲线 (图 2)。这些包括滞后期、 指数或日志相、 固定相和死亡阶段,每一种都与特定的生理变化 (表 1)。
| 阶段 | 特点 | ||
| 延滞期 | 经济增长缓慢或缺乏带来的细胞培养条件下的生理适应或稀释 exoenzymes 由于初始低细胞密度增加。 | ||
| 指数或登录阶段 | 最优的增长速度,在离散的时间间隔称为均值生成时间双哪个单元格编号。 | ||
| 固定相 | 生长 (细胞分裂) 和死亡的细胞互相没有净增加细胞数量保持平衡。减少的增长率通常是由于缺乏营养和 (或) 有毒废物成分的集结。 | ||
| 死亡阶段 | 病死率超过增长率造成活细胞净损失。 | ||
表 1。细菌生长的四个阶段。
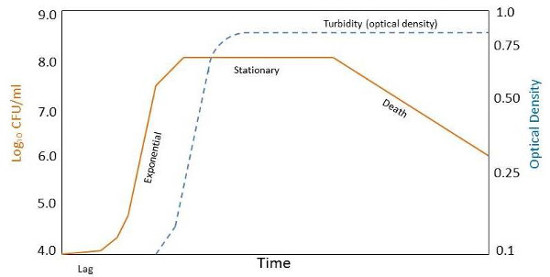
图 2。典型的生长曲线,进行数量的细菌种群。比较形状的曲线基于集落形成单位 (CFUs) 与光密度,特别是在死亡阶段。区别在于,死细胞仍然产生浑浊,但不能形成可行的殖民地,在文化。
总体而言,至关重要的经常来确定给定的细菌分离的细菌的生长动力学为了解目前在液体培养基中细菌细胞的数量。有不同的方法来测量液体介质,包括使用比色分光光度计和连续稀释法电镀的浊度测量中的生长。浊度测量依靠更多的细胞呈现在液体介质中,更浑浊液体成为事实。连续稀释法电镀涉及测定可以形成可行的殖民地上固体培养,称为文化"菌落形成单位"测量液体介质中的单元格数目。但是请注意,这种电镀化验只可以用于细菌是,事实上,可培养。
Procedure
1.收集细菌培养整除数
- 集合的时间的增长点前, 一天接种 20 毫升 50 毫升瓶与大肠杆菌胨大豆肉汤 (TSB)。
- 培养过夜在 27 ° c。这个相对较长的潜伏期结果在野生型大肠杆菌的大约 10 固定相人口9 CFU/mL。
- 第二天,使用准备文化的 100 μ L 接种 250 毫升的 TSB (在 500 毫升瓶)。调匀。 删除 5 毫升分装和冷藏立即在 4 ° c。这是 T = 0 或 T0时间点,并且应该包含大约 4 x 105 CFU/mL。
- 将剩余的大肠杆菌(245 毫升) 的烧瓶置于恒温培养箱 37 ° C。删除 5 毫升整除数文化的每一小时、 达 8 h.存储每个分装在 4 ° c。指定这些整除数 T1通过 T8。
2.连续稀释法
- 从冰箱和置于运输冰上的删除的大肠杆菌整除的数。直到使用保持所有文化在冰上。
- 建立了一系列的稀释管获得不同稀释度的每个大肠杆菌文化 (图 3)。微量离心管,方便此函数。每个稀释管应该有 900 µ L 的稀释液 (无菌生理盐水)。为每个大肠杆菌文化 (T0通过 T8); 需要稀释系列根据表 2每个管的标签。
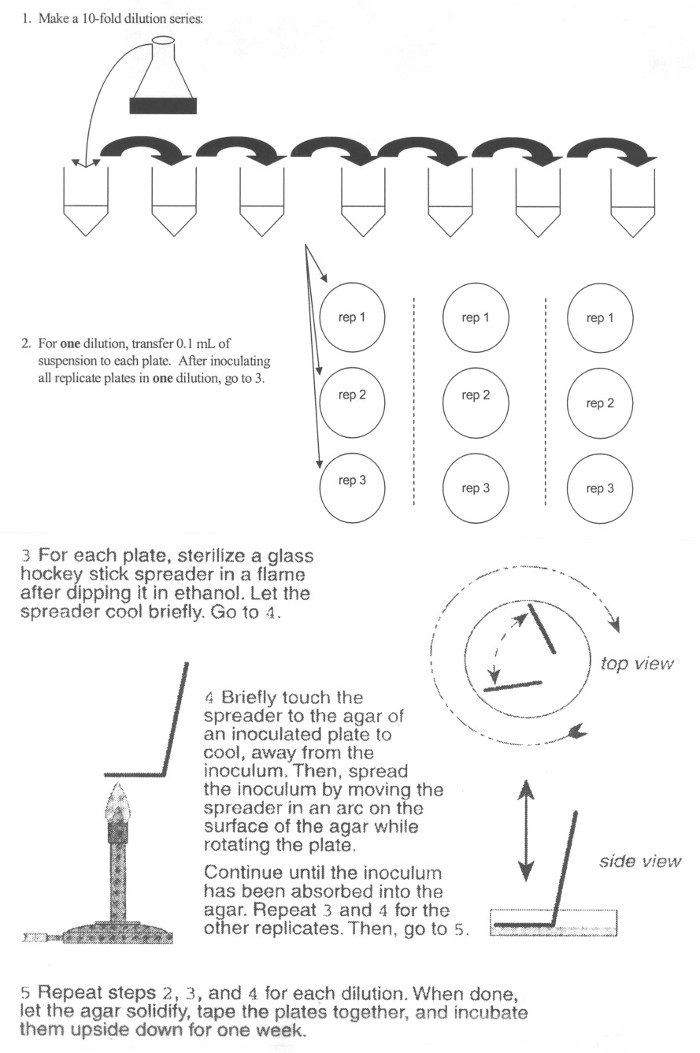
图 3。电镀大肠杆菌过程的示意图。 - 从标记为 T0管加 100 μ L 的大肠杆菌开始稀释 (初始大肠杆菌文化) 到管 A,是 T010-1稀释。涡管 5 s。
- 随后,添加 100 微升管 A 到下管的生理盐水,管 B,这就是 T010-2稀释。继续为每个时间点分装所需的稀释系列。记得到涡传输每个管之前。它也是重要的是为每个传输利用新的移液器提示。
| 大肠杆菌文化 | 稀释需要和管 # | ||||||
| A | B | C | D | E | F | G | |
| T0 | 10-1 | 10-2 | |||||
| T1 | 10-1 | 10-2 | |||||
| T2 | 10-1 | 10-2 | 10-3 | ||||
| T3 | 10-1 | 10-2 | 10-3 | 10-4 | |||
| T4 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | ||
| T5 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | |
| T6 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 |
| T7 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | |
| T8 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | |
表 2。稀释系列所需的每个大肠杆菌文化。
3.电镀
- 将镀三倍稀释物每个大肠杆菌文化时间点分装,根据表 3。标签板的时间点 (T1通过 T8),稀释因子和要添加卷。利用一式三份的盘子里,每个稀释。
- 添加每个稀释 100 μ 的 L 到板吹打到中心大量琼脂平板 (图 3)。利用火焰分装立即传播消毒"L"形玻璃棒。如果分装不立即传播,它在原位上板,造成在点的初始接种细菌过度生长能够吸收或吸附。
- 对于每个时间点 T1通过 T8的稀释系列重复电镀。记住要消毒杆板之间和特别是之间不同的稀释液。
- 一旦板已经干了几分钟,反转,一夜之间放在 37 ° C 的孵化器。逆变板排除冷凝从落在琼脂平板上。经过一夜的孵化,板应存放在冰箱。
| 大肠杆菌文化 | 稀释待镀 | ||
| T0 | 10-1 | 10-2 | 10-3 |
| T1 | 10-1 | 10-2 | 10-3 |
| T2 | 10-2 | 10-3 | 10-4 |
| T3 | 10-3 | 10-4 | 10-5 |
| T4 | 10-4 | 10-5 | 10-6 |
| T5 | 10-5 | 10-6 | 10-7 |
| T6 | 10-6 | 10-7 | 10-8 |
| T7 * | 10-5 | 10-6 | 10-7 |
| T8 * | 10-4 | 10-5 | 10-6 |
*低稀释考虑到低人口由于死亡阶段。
表 3.电镀大肠杆菌文化协议。
4.计数殖民地和计算均值生成时间
- 检查板的殖民地的均匀性和没有受到污染。
- 为每个时间点 (T0通过 T8),选择一个包含 30 和 300 殖民地与张一式三份板之间的稀释。
- 使用稀释因子,背-计算每毫升的原始文化在时间点 T0到 T8细胞数目。例如,如果从 10-4稀释造成的殖民地的数量是 30、 28 和 32:
意思是菌落总数 = 30 殖民地
这些都源于 10-4稀释 0.1 毫升
每毫升菌落总数 = 30 × 104 = 3 x 106 - 情节日志10 CFU/mL 随时间 (以小时为单位)。
- 从图,确定的指数增长的阶段。每一次在指数增长阶段和相应的单元格编号内使用 2 的时间点,计算均值生成时间。
Results
之后连续稀释法电镀实验,得到以下数据。在这里指定的指数增长的开始作为时间 t = 0,细菌细胞的初始浓度是温 1000 CFU/毫升左右。在时间 t = 6 h,细胞浓度是 16,000 CFU/mL。
现在,X = 2n x X0
地点: X0 = 初始浓度的细胞 = 温 1000 CFU/毫升左右
X = 时间 t 后的细胞浓度 = 16,000 CFU/mL
n = 代数目
16,000 = 2n x 1,000
2n = 16
登录10 2n = 日志10 16
n x 0.301 = 1.204
n = 1.204 = 4
0.301
四代时间在 6 小时所以
意思是一代人时间 = 6/4 = 1.5 h。

图 4。包含固氮菌根瘤中。
Application and Summary
知识的培养基中细菌的生长动力学和细菌数量从是重要的研究和商业的角度考虑。在研究中,它往往是关键是要知道中的细菌数量的样本,所以实验是可以复制的如果需要以确切的相同数字。例如,在试验期间菌剂添加到情节的土壤中,最低 104 CFU 需要添加每克土壤得到预期的效果,如加强土壤有毒有机污染物的生物降解。另一个例子是商业化生产的根瘤菌接种、 一例哪里的根瘤菌 (进入与植物的根共生关系的细菌) 的已知的数字浸渍入泥炭的碳排放介质 (图 4)。媒介是然后用来接种豆类种子,以提高生物固氮 (即,分子氮转化为可以利用生物养分的有机形式)。
生长动力学可用于评估是否适应特定株细菌代谢某些底物,如工业废物或油污染。例如,细菌转基因来清理漏油,可以种植存在复杂的碳氢化合物,以确保他们的成长,不会在石油的毒性作用被压抑了。同样,从细菌与混合物的工业废品产生的增长曲线的形状与边坡可以告知科学家细菌是否能代谢的特殊物质,和多少潜在的能量来源的细菌可以发现在废物的混合物。
Tags
跳至...
此集合中的视频:

Now Playing
细菌生长曲线分析和其环境的应用程序
Environmental Microbiology
296.6K Views

在土壤中的水分含量的测定
Environmental Microbiology
360.0K Views

无菌技术在环境科学中
Environmental Microbiology
126.8K Views

革兰氏染色的细菌环境来源
Environmental Microbiology
100.9K Views

可视化的土壤微生物,通过接触滑动检测和显微镜
Environmental Microbiology
42.8K Views

丝状真菌
Environmental Microbiology
58.7K Views

社区从细菌菌落中提取 DNA
Environmental Microbiology
29.1K Views

聚合酶链反应与凝胶电泳检测环境微生物
Environmental Microbiology
44.9K Views

环境样品使用 RT-PCR RNA 分析
Environmental Microbiology
40.9K Views

量化环境微生物和病毒使用 qPCR
Environmental Microbiology
48.2K Views

通过指示生物水质分析
Environmental Microbiology
30.1K Views

通过过滤水样粪便细菌的分离
Environmental Microbiology
39.7K Views

环境样品中的噬菌体的检测
Environmental Microbiology
41.0K Views

培养和枚举从土壤样品的细菌
Environmental Microbiology
185.2K Views

藻类枚举通过可培养方法
Environmental Microbiology
14.1K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。