Method Article
High-Efficiency Transduktion von Liver Cancer Cells von rekombinanten Adeno-assoziierten Virus Serotyp 3 Vektoren
In diesem Artikel
Zusammenfassung
In diesem Artikel beschreiben wir die Identifikation des Adeno-assoziierten Virus Serotyp 3 (AAV3) als die effizienteste Vektor für die Ausrichtung der menschlichen Leber Krebszellen.
Zusammenfassung
Rekombinante Vektoren auf einer nicht-pathogenen menschlichen Parvovirus basieren, haben die Adeno-assoziierten Virus 2 (AAV2) entwickelt worden und sind derzeit im Einsatz in einer Reihe von Gentherapie klinische Studien. In jüngerer Zeit haben eine Reihe von zusätzlichen AAV-Serotypen auch isoliert worden, von denen gezeigt wurde, um eine selektive Gewebe-Tropismus in verschiedenen kleinen und großen Tiermodellen 1 aufweisen. Von den 10 am häufigsten verwendete AAV-Serotypen ist AAV3 mit Abstand die am wenigsten effiziente Transduktion in Zellen und Geweben in vitro als auch in vivo.
Doch in unserem kürzlich veröffentlichten Studien, haben wir dokumentiert, dass AAV3 Vektoren menschlichen Leberkrebs transduzieren - hepatoblastoma (HB) und des hepatozellulären Karzinoms (HCC) - Zelllinien äußerst effizient, weil AAV3 nutzt menschlichen Hepatozyten-Wachstumsfaktor-Rezeptor als zellulären Co-Rezeptor für die Bindung und die Eintragung in diese Zellen 2,3.
In diesem Artikel beschreiben wir die notwendigen Schritte zur hocheffizienten Transduktion von humanen Leber-Krebszellen durch rekombinante AAV3 Vektoren, die ein Reporter-Gen zu erreichen. Die Verwendung von rekombinanten AAV3 Vektoren, die ein therapeutisches Gen kann schließlich das Potenzial der Gentherapie von Lebertumoren beim Menschen führen.
Protokoll
1. Verpackung von rekombinanten Adeno-assoziierten Virus Serotyp 3 (rAAV3) Vektoren
- Besuchen Sie die Website: " http://www.geguchadze.com/calc "und berechnen Sie die DNA-Menge.
- Pre-Mix Plasmide pHelper (Adenovirus Helfer), pACG2c3 (AAV-Helfer) und pdsAAV-CB-EGFP (rAAV-Vektor) in Medium ohne FBS und Antibiotika. Das Gesamtvolumen sollte 8.750 ul für zehn 15 cm 2 Platten sein.
- Fügen Sie direkt 1.250 ul des PEI (0,1% m / v, Polysciences, Kat. Nr. 23966, pH 4,5) in die DNA-Lösung in Schritt 1.2. Vortex die DNA-PEI-Lösung für ein paar Sekunden.
- Inkubieren DNA-PEI Lösung für ein komplexes für 5 min bei Raumtemperatur (RT) zu bilden.
- 1 ml der DNA-PEI-Lösung pro 15 cm 2 Platten.
- Entfernen Medium nach 4 Stunden und ersetzt mit frischen 25 ml Vollmedium +10% FBS (C-DMEM).
- Zweiundsiebzig Stunden nach der Transfektion, kratzen Zellen und gießen in einen konischen 250 ml-Zentrifugenröhrchen.
- Spin bei 3000 Umdrehungen pro Minute, bei 4 ° C für 10 min. Überstand abgießen.
- Re-suspend das Zellpellet in 5 ml RB TMS-Puffer (50 mM Tris-HCl, 150 mM NaCl, pH 8,0). Transfer zu einem neuen 15 ml konischen Rohr.
- Einfrieren in Trockeneis-Ethanol-Bad für 10 min und Auftauen bei 37 ° C für 10 min. Dreimal wiederholen.
- Add 1 ul von 4,8 M MgCl 2 und 2 ul Benzonase (25 U / ul, Novagen, Kat. Nr. 70664-3). Vortex und inkubieren bei 37 ° C für 40 min.
- Spin down bei 4.000 rpm, bei 4 ° C für 40 min und den Überstand (geklärte Lysat).
- In einem 13 mL Quick-Seal-Zentrifugenröhrchen (Beckman, Kat. Nr. 342413), Last Iodixanol Gradienten (OptiPrep, Kat. Nr. 1114542) von oben nach unten: 2 ml 15%, 2 ml 25%, 1,5 ml 40% und 1,5 ml 60% Iodixanol. Legen Sie den Überstand (Schritt 1,12) auf der Oberseite des Iodixanol Gradienten. Füllen Sie das Röhrchen mit RB TMS Buffer.
- Zentrifuge mit 75.000 UpM für 1 Stunde bei 16 ° C mit Beckman 90TI Rotor.
- Sammeln Sie die 40% Iodixanol Fraktion durch Einlegen einer Spritze bei 40-60%-Grenze.
- Übertragen Sie die 40% Iodixanol Bruchteil in einem 50 ml konischen Rohr und machen bis zu 40 ml mit Puffer A (20 mM Tris, 15 mM NaCl, pH 8,5).
- Montieren Sie die Filtrationsvorrichtung mit HiTrap Q HP-Säule (GE Healthcare, Kat. Nr. 17-1154-01). Die Säule wird mit den folgenden Puffer: 25 ml Puffer A (20 mM Tris, 15 mM NaCl, pH 8,5), 25 ml Puffer B (10 mM Tris, 500 mM NaCl, pH 8,5); 50 ml Puffer A; 40 ml Virus-Probe in Puffer A, 50 ml Puffer A (20 mM Tris, 15 mM NaCl, pH 8,5); 20 ml Puffer C (20 mM Tris, 175 mM NaCl, pH 8,5);
- Sammeln Buffer C in einem 20 ml Apollo-Konzentratoren (Orbital Biosciences). Zentrifuge bei 3.000 rpm bei 4 ° C für 10 min.
- Verwerfen Sie den Durchfluss durch und fügen 20 mL gekühlter PBS und Zentrifuge bei 3.000 rpm bei 4 ° C für 10 min.
- Verwerfen Sie den Durchfluss durch und stell 500 ul von gekühlten PBS. Waschen Sie die Vektoren aus der Membran und Transfer zum Silicon behandelten Eppendorf-Röhrchen und lagern in kleinen Aliquots bei -80 ° C eingefroren
2. Bestimmung der rAAV3 Vektortiter
- Tauwetter 10 ul des gereinigten Virus in ein Eppendorf-Röhrchen auf Eis. Add 40 ul ddH 2 O.
- Add 0,2 ul der Benzonase (25 U / ul, Novagen, Kat. Nr. 70664) und bei 37 ° C für 1 Stunde.
- Nehmen Sie 50 ul von Plasmid-Standard (0,2 ng / mL) in einem anderen Eppendorf-Röhrchen.
- Add 50 ul 100 mM NaOH in jedes Röhrchen und inkubieren bei 65 ° C für 30 min.
- Gefühlt auf Eis sofort für mindestens 5 min.
- Cut Transfer-Membran (Millipore, Cat # INYC00010) nach Bio-Dot-Filterpapier (Bio-Rad, Kat. Nr. 1620161). Spülen Sie Membran in 10x SSC mit drei Filterpapiere für 20 min.
- Set Slot-Blot-SF Apparatus (Bio-Dot, Kat. Nr. 170-6542). Schließen Sie eine Thermoskanne und 100 ul von 10x SSC auf die Slot-Blot-Apparatur.
- Add 100 ul 20x SSC und 1 ul 6x Loading Dye zu jeder der Proben in Schritt 2.5.
- Legen Sie 100 ul der einzelnen Proben auf die Membran in die Slot-Blot-Apparatur.
- Add another 100 ul 10x SSC in jeder der Proben.
- Wiederholen Sie die Schritte 2.9 und 2.10, bis alle die Probe geht durch die Membran.
- Zerlegen Sie den Slot-Blot-Apparatur und entfernen Sie die Membran. Legen Sie es in Inspector Linker SL-1000 UV Crosslinker. Schalten Sie "Energy", "Optimal Crosslink" (show 1200) und drücken Sie "Start".
- Boil 1 ml Lachssperma (SS) DNA (Fisher, Kat. Nr. NC9753983) für 5 min. Gefühlt auf Eis für mindestens 5 min.
- Bereiten Sie die Pre-Hybridisierungslösung durch Mischen 27.5 mL ddH 2 O, 15 ml 20x SSC, 5 ml 50x Denhardt-Lösung, 1,25 ml 20% SDS, 0,25 ml PolyA und 1 ml SS DNA aus Schritt 2.13.
- Suspend die Membran in 25 ml pre-Hybridisierungslösung in einem verschlossenen Glaszylinder und Inkubieren bei 65 ° C in einer Hybridisierung Kammer über Nacht.
- Verdünnen Sie 50 ng DNA-Vorlagen in 10 ul ddH 2 O. Kochen bei 100 ° C für 5 min und Chill auf Eis sofort für mindestens 5 min.
- Zentrifuge bei 3.000 rpm bei RT für 1 min. Add 2 &mgr; l 10 mM 3 dNTPs (fehlt dCTP), 2 ul der Hexanukleotid Mix (Roche, Kat. Nr. 11277081001), 1 ul Klenow (Roche, Kat. Nr. 11008404001) und 5 ul α -32 P-dCTP. Bei 37 ° C für 10 min.
- Zentrifuge G-50 Säulen (GE Healthcare, Kat. Nr. 27-5330-01) bei 3.000 rpm für 2 min. Laden Sie die Sonde in Step 2,17 in der Spalte. Zentrifuge bei 3.000 rpm für 2 min und sammeln Sie die Flow-Through.
- Messen der Radioaktivität. Kochen Sie die Sonde bei 100 ° C für 5 min und Chill auf Eis sofort für mindestens 5 min.
- Fügen Sie die Sonde (6x10 5 cpm / ml) in die Pre-Hybridisierungslösung mit Membran.
- Inkubieren über Nacht bei 65 ° C in einer Hybridisierung Kammer.
- Verwerfen der Hybridisierungslösung und spülen Sie die Membran in 2x SSC +0,1% SDS bei RT für 15 min.
- Entsorgen Sie die Lösung und spülen Sie die Membran in 0,1 x SSC +0,1% SDS bei 65 ° C für 30 min.
- Entsorgen Sie die Lösung und spülen Sie die Membran in 0,1 x SSC bei RT kurz.
- Setzen Sie den Film bei -80 ° C für 6 Stunden und Entwicklung des Films. Ein typisches Ergebnis ist in Abbildung 1 dargestellt.
3. rAAV3 Vektor-vermittelte Transduktion und Transgenexpression in Human Liver Cancer Cells
- Seed 1x10 4 Zellen (entweder Huh7 oder Hep293TT) in jede Vertiefung der 96-Well-Platte. Inkubieren in einem befeuchteten CO 2-Inkubator für mindestens 18 Stunden.
- Entfernen Sie Medium aus dem 96-Well-Platte.
- Wash Zellen zweimal mit 50 ul Medium ohne FBS und Antibiotika und zu entfernen.
- Add 50 ul Medium ohne FBS und Antibiotika und rAAV-Vektoren bei 5.000 vgs / Zelle.
- Die Platten in der CO 2-Inkubator für 4 Stunden.
- Entsorgen Sie das Medium. Wash Zellen zweimal mit 50 ul Vollmedium und zu entfernen.
- Add 150 ul C-DMEM in jede Vertiefung und inkubieren Sie die Platte in CO 2-Inkubator für 72 Stunden, und visualisieren die EGFP-Expression mit einem Fluoreszenzmikroskop (DMI 4000B; Leica Microsystems).
- Bilder aus drei Brunnen von Virus-infizierten Zellen quantitativ durch ImageJ-Analyse-Software (NIH, Bethesda, MD, USA) analysiert.
- Transgenexpression als Gesamtfläche von grüner Fluoreszenz (Pixel 2) pro Gesichtsfeld beurteilt. Ein typisches Ergebnis ist in Abbildung 2 dargestellt.
- Transgenexpression kann auch durch Durchflusszytometrie bestimmt werden.
4. Repräsentative Ergebnisse:
Nach dem Protokoll oben genannten, kann man AAV-Serotyp Vektoren effizient zu generieren. Die typische Ausbeute ist ~ 500 ul mit ~ 10 11 vgs / ul des gereinigten Vektor Lager. Die Reinheit des Vektors Lager wird durch den Vergleich Hybridisierungssignale auf quantitative DNA-Slot-Blots, mit und ohne Benzonase Verdauung bestimmt. Gereinigtes rAAV3 Vektoren transduzieren menschlichen Leberkrebs - hepatoblastoma (HB) und des hepatozellulären Karzinoms (HCC) - Zelllinien effizient.
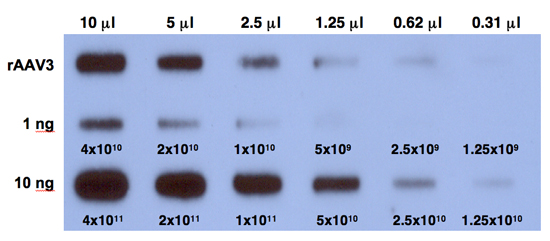
Abbildung 1. Quantitative DNA-Slot-Blot-Analyse zur Bestimmung der Titer von rAAV3 Vektoren. Zweifache Verdünnungen des gereinigten viralen Aktien, mit Benzonase (obere Reihe) verdaut wurden quantitative DNA-Slot Blots mit 32 P-markierten EGFP-spezifischen DNA-Sonde analysiert. Der Titer AAV3 Vektor wurde durch Vergleich mit 1 ng (mittlere Reihe) oder 10 ng (untere Reihe) von AAV-EGFP-Plasmid-Standards auf der Membran geladen bestimmt. Die Zahlen zum DNA-Kopien entsprechen.
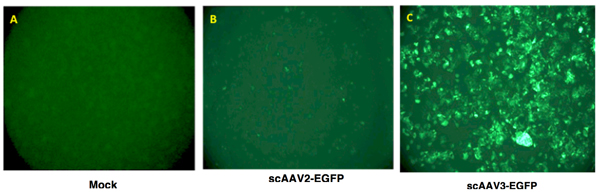
Abbildung 2. Rekombinante AAV-Vektor-vermittelte Transgenexpression in der menschlichen Leber Krebszellen. Hep293TT Zellen, einer kürzlich etablierten humanen Zelllinie hepatoblastoma 4, wurden entweder mock-infiziert (linkes Bild), oder transduziert mit 5.000 vgs / Zelle entweder scAAV2-EGFP oder scAAV3-EGFP-Vektoren bei 37 ° C für 2 Stunden. Transgenexpression visualisiert wurde 72 Stunden nach der Transduktion mit einem Fluoreszenzmikroskop.
Diskussion
Rekombinante Vektoren auf einer nicht-pathogenen menschlichen Parvovirus, das Adeno-assoziierte Virus (AAV) wurden entwickelt und werden derzeit in einer Reihe von Gentherapie klinische Studien 5. Zuvor, von den 10 am häufigsten verwendete AAV-Serotypen, die Transduktionseffizienz von AAV3 Vektoren im Allgemeinen berichtet worden, um besonders niedrig sein, sowohl in vitro und in vivo 1. Aber unsere jüngsten Beobachtung, dass AAV3 Vektoren transduzieren menschlichen Leber Krebszelllinien außerordentlich gut, wie quantitativ mittels Durchflusszytometrie 2 bestimmt, und dass AAV3 nutzt die menschlichen Hepatozyten-Wachstumsfaktor-Rezeptor (hHGFR) als zelluläre Co-Rezeptor für die Bindung und die Eintragung in diese Zellen 3, empfehlen dringend eine selektive Gewebe-Tropismus AAV3 für den menschlichen Leberzellen im allgemeinen und der menschlichen Leber Krebszellen im Besonderen. Da jedoch AAV3 Vektoren auch transduzieren normalen menschlichen Hepatozyten effizient 2, würden ihre mögliche Verwendung in der Krebstherapie Anwendung in vivo werden negativ beeinflusst. Eine mögliche Strategie, um dieses mögliche Problem zu umgehen, besteht Transkriptions-Targeting von Krebszellen durch die Identifizierung eines Gens Produkt, das selektiv durch den Tumor produziert wird, aber nicht durch normale Hepatozyten. Zum Beispiel haben frühere Studien gezeigt, dass der Serumspiegel von α-Fetoprotein (AFP) als ein spezifischer Marker für die Verfolgung der Gegenwart, Progression und / oder Wiederauftreten bestimmter Arten von Leberkrebs eingesetzt werden, da normale Hepatozyten in der Regel sehr geringe Mengen produzieren dieses Proteins. In der Tat haben wir AAV3 Vektoren, die die AFP-Promotor Transgenexpression in Leberkrebszellen Ziel verwendet, aber nicht in normalen Hepatozyten 2 und Studien werden derzeit durchgeführt, um die Wirksamkeit dieses Ansatzes in einem murinen Xenograft-Modell von Leberkrebs zu testen. In unseren zusätzlichen Untersuchungen haben wir festgestellt, dass die Transduktion Effizienz verschiedener AAV-Serotyp Vektoren deutlich durch ortsspezifische Mutagenese von Oberflächen-exponierten Tyrosinreste in der viralen Kapside 6-14 erweitert werden. Seit 6 von 7 Oberflächen-exponierten Tyrosine auch in AAV3 konserviert sind, haben wir Mutagenese dieser Reste durchgeführt und festgestellt, dass die Transduktion von Tyrosin-Mutante AAV3 Vektoren deutlich wird in der menschlichen Leber Krebszellen (unveröffentlichte Daten) erweitert. Die Studien werden derzeit auch im Gange, um die Sicherheit und Wirksamkeit des Tyrosin-Mutante AAV3 Vektoren in Maus-Xenograft-Modellen für den menschlichen hepatoblastoma und des hepatozellulären Karzinoms zu bewerten und, sofern erfolgreich, die optimale Tyrosin-Mutante AAV3 Serotyp Vektoren können sich als nützlich erweisen für die Ausrichtung der menschlichen Leber Krebserkrankungen für die potenzielle Gentherapie.
Offenlegungen
Danksagungen
Wir danken Drs. R. Jude Samulski und Xiao Xiao für ihre Sachspenden von rekombinanten AAV3 und AAV-EGFP-Plasmiden, bzw., und Dr. Gail Tomlinson für die großzügige Bereitstellung von Hep293TT Zellen. Diese Arbeit wurde teilweise durch Public Health Service gewähren Zuschüsse R01 HL-076901, R01 HL-097088 und P01 DK-058327 (Projekt 1) von den National Institutes of Health (AS) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-0170CM | |
| PEI | Polysciences, Inc. | 23966 | |
| Benzonase | Novagen, EMD Millipore | 70664-3 | |
| HiTrap Q HP column | GE Healthcare | 17-1154-01 | |
| Salmon sperm DNA | Fisher Scientific | NC9753983 | |
| Iodixanol gradient | OptiPrep | 1114542 | |
| G-50 Columns | GE Healthcare | 27-5330-01 |
Referenzen
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 16, 1073-1080 (2008).
- Glushakova, L. G., Lisankie, M. J., Eruslanov, E. B., Ojano-Dirain, C., Zolotukhin, I., Liu, C., Srivastava, A., Stacpoole, P. W. AAV3-mediated transfer and expression of the pyruvate dehydrogenase E1 alpha subunit gene causes metabolic remodeling and apoptosis of human liver cancer cells. Mol Genet & Metabol. 98, 289-299 (2009).
- Ling, C., Lu, Y., Kalsi, J. K., Jayandharan, G. R., Li, B., Ma, W., Cheng, B., Gee, S. W., McGoogan, K. E., Govindasamy, L., Zhong, L., Agbandje-McKenna, M., Srivastava, A. Human hepatocyte growth factor receptor is a cellular coreceptor for adeno-associated virus serotype 3. Hum Gene Ther. 21, 1741-1747 (2010).
- Chen, T. T., Rakheja, D., Hung, J. Y., Hornsby, P. J., Tabaczewski, P., Malogolowkin, M., Feusner, J., Miskevich, F., Schultz, R., Tomlinson, G. E. Establishment and characterization of a cancer cell line derived from an aggressive childhood liver tumor. Pediatr Blood & Cancer. 53, 1040-1047 (2009).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Zhong, L., Li, B., Mah, C. S., Govindasamy, L., Agbandje-McKenna, M., Cooper, M., Herzog, R. W., Zolotukhin, I., Warrington, K. H., Weigel-Van Aken, K. A., Hobbs, J. A., Zolotukhin, S., Muzyczka, N., Srivastava, A. Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci USA. 105, 7827-7832 (2008).
- Petrs-Silva, H., Dinculescu, A., Li, Q., Min, S. H., Chiodo, V., Pang, J. J., Zhong, L., Zolotukhin, S., Srivastava, A., Lewin, A. S., Hauswirth, W. W. High-efficiency transduction of the mouse retina by tyrosine-mutant AAV serotype vectors. Mol Ther. 17, 463-471 (2009).
- Jayandharan, G. R., Zhong, L., Sack, B. K., Rivers, A. E., Li, M., Li, B., Herzog, R. W., Srivastava, A. Optimized adeno-associated virus (AAV)-protein phosphatase-5 helper viruses for efficient liver transduction by single-stranded AAV vectors: therapeutic expression of factor IX at reduced vector doses. Hum. Gene Ther. 21, 271-283 (2010).
- Li, M., Jayandharan, G. R., Li, B., Ling, C., Ma, W., Srivastava, A., Zhong, L. High-efficiency transduction of fibroblasts and mesenchymal stem cells by tyrosine-mutant AAV2 vectors for their potential use in cellular therapy. Hum Gene Ther. 21, 1527-1543 (2010).
- Kauss, M. A., Smith, L. J., Zhong, L., Srivastava, A., Wong, K. K. J. r., Chatterjee, S. Enhanced long-term transduction and multilineage engraftment of human hematopoietic stem cells transduced with tyrosine-modified recombinant adeno-associated virus serotype 2. Hum Gene Ther. 21, 1129-1136 (2010).
- Qiao, C., Zhang, W., Yuan, Z., Shin, J. H., Li, J., Jayandharan, G. R., Zhong, L., Srivastava, A., Xiao, X., Duan, D. Adeno-associated virus serotype 6 capsid tyrosine-to-phenylalanine mutations improve gene transfer to skeletal muscle. Hum Gene Ther. 21, 1343-1348 (2010).
- Markusic, D. M., Herzog, R. W., Aslanidi, G. V., Hoffman, B. E., Li, B., Li, M., Jayandharan, G. R., Ling, C., Zolotukhin, I., Ma, W., Zolotukhin, S., Srivastava, A., Zhong, L. High-efficiency transduction and correction of murine hemophilia B using AAV2 vectors devoid of multiple surface-exposed tyrosines. Mol Ther. 18, 2048-2056 (2010).
- Ojano-Dirain, C., Glushakova, L. G., Zhong, L., Zolotukhin, S., Muzyczka, N., Srivastava, A., Stacpoole, P. W. An animal model of PDH deficiency using AAV8-siRNA vector-mediated knockdown of pyruvate dehydrogenase E1α. Mol Genet & Metabol. 101, 183-191 (2010).
- Petrs-Silva, H., Dinculescu, A., Li, Q., Deng, W. T., Pang, J. J., Min, S. H., Chiodo, V., Neeley, A. W., Govindasamy, L., Bennett, A., Agbandje-McKenna, M. Novel properties of tyrosine-mutant AAV2 vectors in the mouse retina. Mol Ther. , (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten