Method Article
Ad alta efficienza di trasduzione delle cellule tumorali del fegato da adeno-associato ricombinante sierotipo Virus 3 Vettori
In questo articolo
Riepilogo
In questo articolo, si descrive l'identificazione del sierotipo del virus adeno-associati 3 (AAV3) come il vettore più efficace per le cellule umane di cancro del fegato.
Abstract
Vettori ricombinanti sulla base di una non patogeno parvovirus umano, il virus adeno-associati 2 (AAV2) sono stati sviluppati e sono attualmente in uso in un certo numero di studi clinici di terapia genica. Più recentemente, una serie di ulteriori sierotipi AAV sono stati anche isolati, che hanno dimostrato di esporre selettivo-trofismo dei tessuti in vari modelli animali piccoli e grandi 1. Dei 10 sierotipi più comunemente utilizzati AAV, AAV3 è di gran lunga il meno efficiente in trasduzione cellule e tessuti in vitro e in vivo.
Tuttavia, nei nostri studi di recente pubblicazione, abbiamo documentato che AAV3 vettori trasdurre il cancro del fegato umano - epatoblastoma (HB) e di carcinoma epatocellulare (HCC) - linee di cellule estremamente efficiente perché utilizza AAV3 umano recettore del fattore di crescita degli epatociti come un cellulare co-recettore per il legame e l'ingresso in queste cellule 2,3.
In questo articolo, si descrivono i passaggi necessari per ottenere alta efficienza di trasduzione di cellule umane di cancro del fegato da ricombinante AAV3 vettori che trasportano un gene reporter. L'uso di vettori ricombinanti AAV3 portatrice di un gene terapeutico può portare alla terapia genica potenziale dei tumori del fegato negli esseri umani.
Protocollo
1. Confezionamento di virus ricombinante adeno-associato sierotipo 3 (rAAV3) Vettori
- Vai al sito: " http://www.geguchadze.com/calc "e calcolare la quantità di DNA.
- Pre-mix plasmidi pHelper (helper Adenovirus), pACG2c3 (AAV helper) e pdsAAV-CB-EGFP (rAAV vettoriale) in mezzo senza FBS e antibiotici. Volume totale dovrebbe essere 8750 microlitri per una decina di 15 cm 2 piastre.
- Aggiungere direttamente 1.250 ml di PEI (0,1% m / v, Polysciences, Cat # 23966, pH 4,5) in soluzione di DNA al punto 1.2. Vortex il DNA-PEI soluzione per alcuni secondi.
- Incubare DNA-PEI soluzione per formare un complesso per 5 minuti a temperatura ambiente (RT).
- Aggiungere 1 ml di DNA-PEI soluzione per 15 cm 2 piastre.
- Rimuovere media dopo 4 ore, sostituendo con fresche 25 ml di mezzo di completa +10% FBS (C-DMEM).
- Settantadue ore dopo la trasfezione, le cellule raschiare e versare in una provetta per centrifuga da 250 ml.
- Rotazione a 3000 rpm, a 4 ° C per 10 min. Eliminare il surnatante.
- Risospendere il pellet in 5 ml di RB TMS buffer (50 mM Tris-HCl, 150 mM NaCl, pH 8,0). Trasferimento in un nuovo tubo di 15 ml.
- Congelamento in ghiaccio secco-etanolo bagno per 10 minuti e scongelare a 37 ° C per 10 min. Ripetete tre volte.
- Aggiungere 1 ml di 4,8 M MgCl 2 e 2 l di benzonasi (25 U / mL, Novagen, Cat # 70664-3). Vortex e incubare a 37 ° C per 40 min.
- Spin down a 4.000 giri, a 4 ° C per 40 minuti e raccogliere il surnatante (lisato chiarificato).
- In una ML 13 Quick-Seal provetta da centrifuga (Beckman, Cat # 342413), carico gradiente Iodixanolo (OptiPrep, Cat # 1114542) da cima a fondo: 2 ml di 15%, 2 ml di 25%, 1,5 mL di 40% e 1,5 mL di 60% Iodixanolo. Caricare il surnatante (Passo 1.12) sulla parte superiore del gradiente Iodixanolo. Riempire i tubi con tampone RB TMS.
- Centrifugare a 75.000 rpm per 1 ora a 16 ° C con rotore Beckman 90TI.
- Raccogliere la frazione Iodixanolo 40% con l'inserimento di una siringa al 40-60% confine.
- Trasferire la frazione Iodixanolo 40% in un tubo da 50 ml e portare a 40 ml con tampone A (20 mM Tris, 15 mM NaCl, pH 8,5).
- Montare l'apparato di filtrazione con HITRAP Q HP colonna (GE Healthcare, Cat # 17-1154-01). Lavare la colonna con le seguenti tampone: 25 ml di tampone A (20 mM Tris, 15 mM NaCl, pH 8,5); 25 mL di tampone B (10 mM Tris, 500 mM NaCl, pH 8,5), 50 ml di tampone A; 40 ml di campione virus nel tampone A, 50 ml di tampone A (20 mM Tris, 15 mM NaCl, pH 8,5), 20 ml di tampone C (20 mM Tris, 175 mM NaCl, pH 8,5);
- Raccogliere C in un buffer da 20 ml Apollo concentratori (Orbital Biosciences). Centrifugare a 3.000 giri, a 4 ° C per 10 min.
- Gettare il flow-through e aggiungere 20 ml di acqua refrigerata PBS e centrifugare a 3.000 giri, a 4 ° C per 10 min.
- Gettare il flow-through e aggiungere 500 ml di PBS freddo. Lavare i vettori fuori dalla membrana e trasferimento siliconata provette Eppendorf e conservare congelata in piccole aliquote a -80 ° C.
2. Determinazione del rAAV3 Titoli Vector
- Scongelare 10 L del virus purificato in una provetta Eppendorf sul ghiaccio. Aggiungere 40 ml di DDH 2 O.
- Aggiungere 0,2 ml di benzonasi (25 U / mL, Novagen, Cat # 70664) e incubare a 37 ° C per 1 ora.
- Prelevare 50 ml di standard di plasmide (0,2 ng / mL) in un'altra provetta Eppendorf.
- Aggiungere 50 ml di 100 mM NaOH in ogni provetta e incubare a 65 ° C per 30 min.
- Freddo su ghiaccio immediatamente per almeno 5 minuti.
- Tagliare a membrana di trasferimento (Millipore, Cat # INYC00010) secondo Bio-Dot filtro di carta (Bio-Rad, Cat # 1620161). Sciacquare membrana in SSC 10x con tre filtri di carta per 20 min.
- Set di slot blot SF Apparatus (Bio-Dot, Cat # 170-6542). Connettersi a un fiasco vuoto e aggiungere 100 ml di SSC 10x a cancellare apparato slot.
- Aggiungere 100 ml di SSC 20x e 1 ml di colorante di caricamento 6x a ciascuno dei campioni al punto 2.5.
- Carico di 100 l di ciascun campione sulla membrana nell'apparato macchia slot.
- Aggiungere altri 100 ml di SSC 10x in ciascuno dei campioni.
- Ripetere i punti 2.9 e 2.10 fino a tutto il campione passa attraverso la membrana.
- Smontare l'apparato macchia slot e rimuovere la membrana. Metterlo in Linker ispettore SL-1000 Crosslinker UV. Girare su "Energia", "Optimal Crosslink" (mostra 1200) e premere "Start".
- Far bollire 1 ml di sperma di salmone (SS) DNA (Fisher, Cat # NC9753983) per 5 min. Freddo in ghiaccio per almeno 5 minuti.
- Preparare la pre-ibridazione soluzione mescolando 27,5 mL di DDH 2 O, 15 ml di SSC 20x, 5 ml di soluzione di 50x Denhardt, 1,25 ml di SDS 20%, 0,25 ml di Polya e 1 ml di SS DNA dal punto 2.13.
- Sospendere la membrana in 25 mL di soluzione pre-ibridazione in un cilindro di vetro ricoperti e incubare a 65 ° C in una camera di ibridazione durante la notte.
- Diluire 50 modelli ng di DNA in 10 ml di DDH 2 O. Fate bollire a 100 ° C per 5 minuti e raffreddare immediatamente in ghiaccio per almeno 5 minuti.
- Centrifugare a 3.000 rpm a temperatura ambiente per 1 min. Aggiungere 2 ml di 10 mM dNTPs 3 (manca dCTP), 2 ml di Mix Hexanucleotide (Roche, Cat # 11277081001), 1 l di Klenow (Roche, Cat # 11008404001) e 5 ml di α -32 P-dCTP. Incubare a 37 ° C per 10 min.
- Centrifuga G-50 colonne (GE Healthcare, Cat # 27-5330-01) a 3.000 rpm per 2 minuti. caricare la sonda nel passo 2,17 nella colonna. Centrifugare a 3.000 rpm per 2 minuti e raccogliere i flow-through.
- Conte radioattività. Lessare la sonda a 100 ° C per 5 minuti e chill su ghiaccio immediatamente per almeno 5 minuti.
- Aggiungere la sonda (6x10 5 cpm / ml) nel pre-ibridazione soluzione con membrana.
- Incubare per una notte a 65 ° C in una camera di ibridazione.
- Gettare la soluzione di ibridazione e risciacquare la membrana in 2x SSC +0,1% SDS a temperatura ambiente per 15 minuti.
- Scartare la soluzione e lavare la membrana in 0.1x SSC +0,1% SDS a 65 ° C per 30 min.
- Scartare la soluzione e lavare la membrana in 0.1x SSC a breve RT.
- Esporre il film a -80 ° C per 6 ore e sviluppare il film. Un risultato tipico è mostrato in Figura 1.
3. rAAV3 Vector-mediata trasduzione e l'espressione del transgene nelle cellule umane di cancro del fegato
- Semi di 1x10 4 celle (sia Huh7 o Hep293TT) in ciascun pozzetto della piastra da 96 pozzetti. Incubare in un incubatore umidificato CO 2 per almeno 18 ore.
- Togliere terreno dalla piastra a 96 pozzetti.
- Lavare le cellule due volte con 50 ml di mezzo senza FBS e antibiotici e rimuovere.
- Aggiungere 50 ml di mezzo senza FBS e antibiotici e vettori rAAV a 5.000 VGS / cell.
- Incubare le piastre in incubatore CO 2 per 4 ore.
- Gettare il mezzo. Lavare le cellule due volte con 50 ml di terreno completo e rimuovere.
- Aggiungere 150 ml di DMEM-C in ciascun pozzetto e incubare la piastra di CO 2 incubatore per 72 ore, e visualizzare l'espressione EGFP utilizzando un microscopio a fluorescenza (DMI 4000B, Leica Microsystems).
- Immagini da tre pozzi di cellule infettate da virus sono analizzate quantitativamente mediante analisi software ImageJ (NIH, Bethesda, MD, USA).
- Espressione del transgene è valutato come superficie complessiva di fluorescenza verde (pixel 2) per campo visivo. Un risultato tipico è illustrato nella figura 2.
- Espressione del transgene può anche essere determinata mediante citometria di flusso.
4. Rappresentante dei risultati:
Seguendo il protocollo di cui sopra, si può generare vettori AAV sierotipo in modo efficiente. Il rendimento tipico è ~ 500 microlitri contiene ~ 10 11 vgs / mL di purificato magazzino vettore. La purezza dello stock vettore è determinato dal confronto segnali di ibridazione su macchine di slot quantitativa del DNA, con e senza digestione benzonasi. Purificata rAAV3 vettori cancro al fegato umano trasdurre - epatoblastoma (HB) e del carcinoma epatocellulare (HCC) - linee cellulari in modo efficiente.
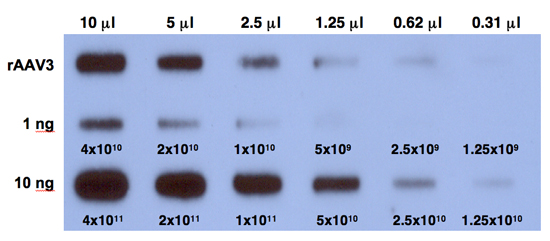
Figura 1. Quantitativa del DNA slot-blot analisi per la determinazione del titoli di rAAV3 vettori. Una diluizione di purificato scorte virale, digerito con benzonasi (riga in alto) sono stati analizzati su macchine di slot quantitativa del DNA con 32 P-etichettati EGFP-sonda specifica del DNA. Il titolo di AAV3 vettore è stato determinato in rapporto con 1 ng (riga centrale) o 10 ng (riga inferiore) di AAV-EGFP standard plasmide caricato sulla membrana. I numeri corrispondono alle copie del DNA.
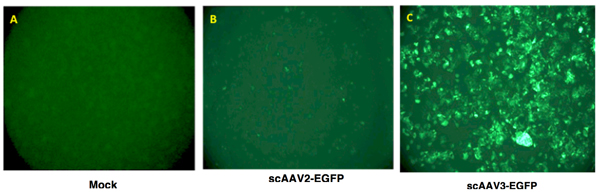
Figura 2. Vettore ricombinante AAV-mediata espressione del transgene nelle cellule umane di cancro del fegato. Cellule Hep293TT, un recente costituzione linea cellulare umana epatoblastoma 4, erano o mock-infettate (a sinistra del pannello), oppure trasdotte con 5.000 VGS / cella di uno scAAV2-EGFP o scAAV3-EGFP vettori a 37 ° C per 2 ore. Espressione del transgene è stata visualizzata 72 ore post-trasduzione utilizzando un microscopio a fluorescenza.
Discussione
Vettori ricombinanti sulla base di una non patogeno parvovirus umano, il virus adeno-associato (AAV) sono stati sviluppati e sono attualmente in uso in un certo numero di studi clinici di terapia genica 5. In precedenza, dei 10 sierotipi più comunemente utilizzati AAV, l'efficienza di trasduzione del AAV3 vettori in genere è stato segnalato per essere particolarmente bassi, sia in vitro che in vivo 1. Tuttavia, la nostra recente osservazione che AAV3 vettori trasdurre fegato umano linee cellulari tumorali estremamente bene, come determinato quantitativamente mediante citometria di flusso 2 e che AAV3 utilizza il recettore umano di crescita degli epatociti (fattore hHGFR) come un cellulare co-recettore per l'iscrizione vincolante e in questi cellule 3, suggeriscono fortemente una selettiva dei tessuti di AAV3 tropismo per le cellule di fegato umano in generale, e cellule umane di cancro del fegato in particolare. Tuttavia, poiché AAV3 vettori anche trasdurre normali epatociti umani in modo efficiente 2, il loro potenziale utilizzo in applicazione della terapia genica del cancro in vivo sarebbe negativamente. Una possibile strategia per aggirare questo potenziale problema coinvolge trascrizionale-targeting delle cellule tumorali attraverso l'identificazione di un prodotto gene che è selettivamente prodotta dal tumore, ma non dagli epatociti normali. Per esempio, studi precedenti hanno dimostrato che i livelli sierici di α-fetoproteina (AFP) è utilizzato come marcatore specifico per il monitoraggio della presenza, la progressione, e / o la recrudescenza di alcuni tipi di tumori del fegato, dato che epatociti normali generalmente producono piccole quantità di questa proteina. Infatti, abbiamo utilizzato AAV3 vettori contenenti il promotore AFP per indirizzare l'espressione del transgene nelle cellule di cancro al fegato, ma non negli epatociti normali 2, e gli studi sono attualmente in corso per testare l'efficacia di questo approccio in un modello murino xenotrapianto di cancro al fegato. Nei nostri studi ulteriori, abbiamo osservato che l'efficienza di trasduzione di vari vettori AAV sierotipo può essere significativamente aumentata da mutagenesi sito-diretta di superficie esposti residui di tirosina nel capsidi virale 6-14. Dal 6 di 7 superficie esposta tirosine sono inoltre conservati in AAV3, abbiamo svolto mutagenesi sito-diretta di detti residui e osservato che l'efficienza di trasduzione di tirosin-mutante AAV3 vettori è significativamente migliorata nelle cellule umane di cancro del fegato (dati non pubblicati). Gli studi sono attualmente in corso per valutare la sicurezza el'efficacia della tirosin-mutante AAV3 vettori nei modelli di xenotrapianto mouse per epatoblastoma umano e il carcinoma epatocellulare, e in caso di successo, l'ottimale tirosina-mutante vettori sierotipo AAV3 potrebbe rivelarsi utile per indirizzare fegato umano tumori per la terapia genica potenziale.
Divulgazioni
Riconoscimenti
Ringraziamo Drs. R. Jude Samulski e Xiao Xiao per i loro doni tipo di ricombinante AAV3 e AAV-EGFP plasmidi, rispettivamente, e il dottor Tomlinson Gail generosamente per fornire cellule Hep293TT. Questa ricerca è stata sostenuta in parte dal Public Health Service concedere borse di R01 HL-076901, R01 HL-097088, e DK P01-058327 (Progetto 1) dal National Institutes of Health (AS).
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-0170CM | |
| PEI | Polysciences, Inc. | 23966 | |
| Benzonase | Novagen, EMD Millipore | 70664-3 | |
| HiTrap Q HP column | GE Healthcare | 17-1154-01 | |
| Salmon sperm DNA | Fisher Scientific | NC9753983 | |
| Iodixanol gradient | OptiPrep | 1114542 | |
| G-50 Columns | GE Healthcare | 27-5330-01 |
Riferimenti
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 16, 1073-1080 (2008).
- Glushakova, L. G., Lisankie, M. J., Eruslanov, E. B., Ojano-Dirain, C., Zolotukhin, I., Liu, C., Srivastava, A., Stacpoole, P. W. AAV3-mediated transfer and expression of the pyruvate dehydrogenase E1 alpha subunit gene causes metabolic remodeling and apoptosis of human liver cancer cells. Mol Genet & Metabol. 98, 289-299 (2009).
- Ling, C., Lu, Y., Kalsi, J. K., Jayandharan, G. R., Li, B., Ma, W., Cheng, B., Gee, S. W., McGoogan, K. E., Govindasamy, L., Zhong, L., Agbandje-McKenna, M., Srivastava, A. Human hepatocyte growth factor receptor is a cellular coreceptor for adeno-associated virus serotype 3. Hum Gene Ther. 21, 1741-1747 (2010).
- Chen, T. T., Rakheja, D., Hung, J. Y., Hornsby, P. J., Tabaczewski, P., Malogolowkin, M., Feusner, J., Miskevich, F., Schultz, R., Tomlinson, G. E. Establishment and characterization of a cancer cell line derived from an aggressive childhood liver tumor. Pediatr Blood & Cancer. 53, 1040-1047 (2009).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Zhong, L., Li, B., Mah, C. S., Govindasamy, L., Agbandje-McKenna, M., Cooper, M., Herzog, R. W., Zolotukhin, I., Warrington, K. H., Weigel-Van Aken, K. A., Hobbs, J. A., Zolotukhin, S., Muzyczka, N., Srivastava, A. Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci USA. 105, 7827-7832 (2008).
- Petrs-Silva, H., Dinculescu, A., Li, Q., Min, S. H., Chiodo, V., Pang, J. J., Zhong, L., Zolotukhin, S., Srivastava, A., Lewin, A. S., Hauswirth, W. W. High-efficiency transduction of the mouse retina by tyrosine-mutant AAV serotype vectors. Mol Ther. 17, 463-471 (2009).
- Jayandharan, G. R., Zhong, L., Sack, B. K., Rivers, A. E., Li, M., Li, B., Herzog, R. W., Srivastava, A. Optimized adeno-associated virus (AAV)-protein phosphatase-5 helper viruses for efficient liver transduction by single-stranded AAV vectors: therapeutic expression of factor IX at reduced vector doses. Hum. Gene Ther. 21, 271-283 (2010).
- Li, M., Jayandharan, G. R., Li, B., Ling, C., Ma, W., Srivastava, A., Zhong, L. High-efficiency transduction of fibroblasts and mesenchymal stem cells by tyrosine-mutant AAV2 vectors for their potential use in cellular therapy. Hum Gene Ther. 21, 1527-1543 (2010).
- Kauss, M. A., Smith, L. J., Zhong, L., Srivastava, A., Wong, K. K. J. r., Chatterjee, S. Enhanced long-term transduction and multilineage engraftment of human hematopoietic stem cells transduced with tyrosine-modified recombinant adeno-associated virus serotype 2. Hum Gene Ther. 21, 1129-1136 (2010).
- Qiao, C., Zhang, W., Yuan, Z., Shin, J. H., Li, J., Jayandharan, G. R., Zhong, L., Srivastava, A., Xiao, X., Duan, D. Adeno-associated virus serotype 6 capsid tyrosine-to-phenylalanine mutations improve gene transfer to skeletal muscle. Hum Gene Ther. 21, 1343-1348 (2010).
- Markusic, D. M., Herzog, R. W., Aslanidi, G. V., Hoffman, B. E., Li, B., Li, M., Jayandharan, G. R., Ling, C., Zolotukhin, I., Ma, W., Zolotukhin, S., Srivastava, A., Zhong, L. High-efficiency transduction and correction of murine hemophilia B using AAV2 vectors devoid of multiple surface-exposed tyrosines. Mol Ther. 18, 2048-2056 (2010).
- Ojano-Dirain, C., Glushakova, L. G., Zhong, L., Zolotukhin, S., Muzyczka, N., Srivastava, A., Stacpoole, P. W. An animal model of PDH deficiency using AAV8-siRNA vector-mediated knockdown of pyruvate dehydrogenase E1α. Mol Genet & Metabol. 101, 183-191 (2010).
- Petrs-Silva, H., Dinculescu, A., Li, Q., Deng, W. T., Pang, J. J., Min, S. H., Chiodo, V., Neeley, A. W., Govindasamy, L., Bennett, A., Agbandje-McKenna, M. Novel properties of tyrosine-mutant AAV2 vectors in the mouse retina. Mol Ther. , (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon