Method Article
De Alta Eficiência Transdução de células de câncer de fígado por recombinante sorotipo de vírus adeno-associado 3 Vetores
Neste Artigo
Resumo
Neste artigo, descrevemos a identificação da adeno-associated virus sorotipo 3 (AAV3) como o vetor mais eficiente para alvejar células humanas de câncer de fígado.
Resumo
Vetores recombinantes baseado em um parvovirus patogênico não-humanos, o vírus adeno-associado 2 (AAV2) foram desenvolvidos e estão atualmente em uso em uma série de ensaios clínicos de terapia genética. Mais recentemente, um número de sorotipos adicionais AAV também foram isolados, que foram mostrados para expor seletiva tropismo de tecido em vários modelos animais pequenos e grandes 1. Dos 10 sorotipos mais comumente usados AAV, AAV3 é de longe o menos eficiente na transdução de células e tecidos in vitro, bem como in vivo.
No entanto, em nossos estudos recentemente publicados, temos documentado que AAV3 vetores transduzir câncer de fígado humano - hepatoblastoma (HB) e carcinoma hepatocelular (HCC) - linhas de células de forma extremamente eficiente porque utiliza AAV3 receptor do fator humano como um hepatócito crescimento celular co-receptor para a ligação e entrada nestas células 2,3.
Neste artigo, descrevemos os passos necessários para atingir alta eficiência de transdução de células humanas de câncer de fígado por vetores recombinantes AAV3 carregando um gene repórter. O uso de vetores recombinantes AAV3 carregando um gene terapêutico pode eventualmente levar à terapia genética potencial de câncer de fígado em humanos.
Protocolo
1. Embalagem de adeno-associados recombinantes do vírus sorotipo 3 (rAAV3) Vetores
- Acesse o site: " http://www.geguchadze.com/calc "e calcular a quantidade de DNA.
- Pré-mix plasmídeos pHelper (helper Adenovirus), pACG2c3 (AAV helper) e pdsAAV-CB-EGFP (rAAV vector) em meio sem SFB e antibióticos. Volume total deve ser 8.750 mL por dez placas de 15 cm 2.
- Adicionar diretamente mL de 1250 PEI (0,1% m / v, Polysciences, Cat # 23966, pH 4.5) na solução de DNA no Passo 1.2. Vortex solução do DNA-PEI por alguns segundos.
- Incubar solução DNA-PEI para formar um complexo de 5 min à temperatura ambiente (RT).
- Adicionar 1 mL de DNA-PEI solução por 15 cm 2 chapa.
- Remova o meio após 4 horas, substituindo com fresca média de 25 mL completa 10% FBS (C-DMEM).
- Setenta e duas horas após a transfecção, as células raspar e despeje em um tubo de centrífuga de 250 mL cônico.
- Giram a 3000 rpm, a 4 ° C por 10 min. Deitar fora o sobrenadante.
- Re-suspender o pellet celular em 5 mL de RB TMS Buffer (pH 50 mM Tris-HCl, 150 mM NaCl, 8,0). Transferência para um novo tubo de 15 mL cônico.
- Congelamento em banho de gelo-seco de etanol por 10 min e descongelamento a 37 ° C por 10 min. Repita três vezes.
- Adicionar 1 mL de 4,8 M MgCl 2 e 2 mL de Benzonase (25 U / mL, Novagen, Cat # 70664-3). Vortex e incubar em 37 ° C por 40 min.
- Girar a 4.000 rpm, a 4 ° C por 40 min e coletar o sobrenadante (lisado clarificado).
- Em um tubo de centrífuga de 13 mL Seal-rápida (Beckman, Cat # 342413), o gradiente de carga iodixanol (OptiPrep, Cat # 1114542) de cima para baixo: 2 mL de 15%, 2 mL de 25%, 1,5 mL de 40% e 1,5 mL de iodixanol 60%. Carregar o sobrenadante (Passo 1.12) na parte superior do gradiente iodixanol. Encher os tubos com RB buffer TMS.
- Centrifugar a 75.000 rpm por 1 hora a 16 ° C utilizando rotor Beckman 90TI.
- Recolher a fração iodixanol 40% através da inserção de uma seringa no limite de 40-60%.
- Alienar a fração iodixanol 40% em um tubo de 50 mL cônica e fazer até 40 mL com tampão A. (20 mM Tris, 15 mM NaCl, pH 8,5)
- Montar o aparelho de filtração utilizando HiTrap Q coluna HP (GE Healthcare, Cat # 17-1154-01). Lavar a coluna com o tampão seguinte: 25 mL de tampão A (20 mM Tris, 15 mM NaCl, pH 8,5);; 25 mL de tampão B (10 mM Tris, 500 mM NaCl, pH 8,5), 50 mL de tampão A 40 mL de amostra de vírus em tampão A; 50 mL de tampão A (20 mM Tris, 15 mM NaCl, pH 8,5);; 20 mL de tampão C (20 mM Tris, 175 mM NaCl, pH 8,5)
- Colete C em um tampão de 20 mL Apollo Concentradores (Orbital Biosciences). Centrifugar a 3.000 rpm, a 4 ° C por 10 min.
- Descartar o fluxo através de e adicionar 20 mL de PBS refrigerado e centrifugar a 3.000 rpm, a 4 ° C por 10 min.
- Descartar o fluxo através de e adicionar 500 mL de PBS gelado. Lavar os vetores fora da membrana e transferir para tubos de silicone tratados com Eppendorf e armazenar congelada em pequenas alíquotas a -80 ° C.
2. Determinação de rAAV3 Títulos Vector
- Thaw 10 mL de vírus purificado em um tubo Eppendorf no gelo. Adicionar 40 mL de DDH 2 O.
- Adicionar 0,2 mL de Benzonase (25 U / mL, Novagen, Cat # 70664) e incubar a 37 ° C por 1 hora.
- Tomar 50 mL de padrão plasmídeo (0,2 ng / mL) em outro tubo Eppendorf.
- Adicionar 50 mL de NaOH 100 mM em cada tubo e incubar em 65 ° C por 30 min.
- Frio no gelo imediatamente para pelo menos 5 min.
- Corte de membrana de transferência (Millipore, Cat # INYC00010) de acordo com papel de filtro Bio-Dot (Bio-Rad, Cat # 1620161). Enxágüe membrana em SSC 10x com três papéis de filtro por 20 min.
- Set Slot blot SF Aparelho (Bio-Dot, Cat # 170-6542). Conectar a um balão de vácuo e adicionar 100 mL de SSC 10x para slot blot aparelho.
- Adicionar 100 mL de 20x SSC e 1 mL de corante carregamento 6x de cada uma das amostras no Passo 2.5.
- Carga de 100 mL de cada amostra para a membrana no aparelho blot slot.
- Adicionar outro mL 100 de SSC 10x em cada uma das amostras.
- Repita os passos 2.9 e 2.10 até que todas as amostras o atravessa a membrana.
- Desmontar o aparelho blot slot e remover a membrana. Colocá-lo em Linker Inspector SL-1000 Agente de crosslinking UV. Transformar em "Energia", "Crosslink Optimal" (show 1200) e empurre "Start".
- Ferva 1 mL de esperma de salmão (SS) DNA (Fisher, Cat # NC9753983) por 5 min. Frio no gelo por pelo menos 5 min.
- Prepare a solução de pré-hibridação através da mistura de 27,5 mL de DDH 2 O, 15 mL de 20x SSC, 5 mL de solução 50x Denhardt é, 1,25 mL de SDS 20%, 0,25 mL de Polya e 1 mL de SS DNA a partir da Etapa 2.13.
- Suspender a membrana em 25 mL de solução de hibridização pré-nos um cilindro de vidro tampado e incubar a 65 ° C em uma câmara de hibridização durante a noite.
- Diluir 50 modelos DNA ng em 10 mL de DDH 2 O. Ferver a 100 ° C por 5 min e frio no gelo imediatamente para pelo menos 5 min.
- Centrifugar a 3000 rpm em temperatura ambiente por 1 min. Adicione 2 mL de 10 mM dNTPs 3 (falta dCTP), 2 mL da mistura de Hexanucleotide (Roche, Cat # 11277081001), 1 mL de Klenow (Roche, Cat # 11008404001) e 5 mL de α -32 P-dCTP. Incubar a 37 ° C por 10 min.
- Centrífuga G-50 Colunas (GE Healthcare, Cat # 27-5330-01) a 3.000 rpm por 2 min. carga a sonda em Passo 2,17 na coluna. Centrifugar a 3.000 rpm por 2 min e recolher o escoamento.
- Contagem de radioatividade. Ferva a sonda a 100 ° C por 5 min e frio no gelo imediatamente para pelo menos 5 min.
- Adicionar a sonda (6x10 5 cpm / mL) na solução de pré-hibridação com membrana.
- Incubar durante a 65 ° C em uma câmara de hibridação.
- Descartar a solução de hibridação e enxaguar a membrana em 2x SSC SDS 0,1% no RT por 15 min.
- Descartar a solução e lave a membrana em 0,1 x SSC SDS 0,1% a 65 ° C por 30 min.
- Descartar a solução e lave a membrana em 0,1 x SSC em breve RT.
- Expor o filme a -80 ° C durante 6 horas e desenvolver o filme. Um resultado típico é mostrado na Figura 1.
3. rAAV3 Transdução Vector mediada e expressão do transgene em células humanas de câncer de fígado
- Semente de 1x10 4 células (ou Huh7 ou Hep293TT) em cada poço da placa de 96 poços. Incubar em umidificado incubadora de CO 2 por pelo menos 18 horas.
- Remova o meio da placa de 96 poços.
- Lave as células duas vezes com 50 mL de meio, sem FBS e antibióticos e remover.
- Adicionar 50 mL de meio sem FBS e antibióticos e vetores rAAV menos 5.000 vgs / célula.
- Incubar as placas na incubadora de CO 2 para 4 horas.
- Descartar o meio. Lave as células duas vezes com 50 mL de meio completo e remover.
- Adicionar 150 mL de C-DMEM a cada poço e incube a placa na incubadora de CO 2 por 72 horas, e visualizar a expressão EGFP usando um microscópio de fluorescência (DMI 4000B; Leica Microsystems).
- Imagens a partir de três poços de células infectadas por vírus são analisados quantitativamente através de análise de software ImageJ (NIH, Bethesda, MD, EUA).
- Expressão do transgene é avaliada como a área total de fluorescência verde (pixel 2) por campo visual. Um resultado típico é mostrado na Figura 2.
- Expressão do transgene também pode ser determinado por citometria de fluxo.
4. Resultados representativos:
Seguindo o protocolo descrito acima, pode-se gerar vetores AAV sorotipo eficiente. O rendimento típico é ~ 500 mL contendo ~ 10 11 vgs / mL de ações purificadas vetor. A pureza do estoque vetor é determinada pela comparação de sinais de hibridação em blots slot de DNA quantitativo, com e sem digestão Benzonase. Purificada rAAV3 vetores transduzir câncer de fígado humano - hepatoblastoma (HB) e carcinoma hepatocelular (HCC) - linhas de células de forma eficiente.
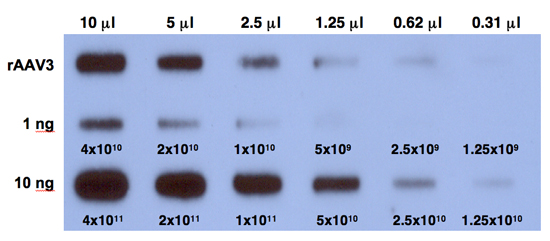
Figura 1. Quantitativa de análises de ADN Slot blot para determinar os títulos de rAAV3 vetores. Diluições duplas de purificada stocks viral, digerido com Benzonase (linha superior) foram analisados em blots ranhura quantitativa DNA com 32 P-sonda marcada DNA EGFP-específicas. A título de AAV3 vetor foi determinada pela comparação com 1 ng (linha do meio) ou 10 ng (linha inferior) de AAV-EGFP padrões plasmídeo carregado na membrana. Os números correspondem a cópias de DNA.
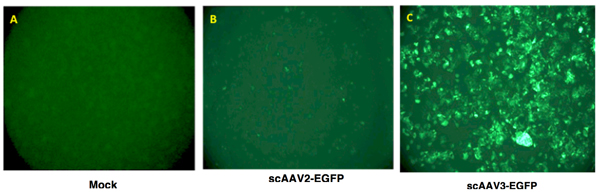
Figura 2. AAV recombinante vector mediada expressão do transgene em células humanas de câncer de fígado. Hep293TT células, uma recém-criada linha celular humana hepatoblastoma 4, eram (painel esquerdo) mock-infectados, ou transduzidas com 5.000 vgs / célula de qualquer scAAV2-EGFP ou scAAV3-EGFP vetores a 37 ° C por 2 horas. Expressão do transgene foi visualizado 72 horas pós-transdução usando um microscópio de fluorescência.
Discussão
Vetores recombinantes baseados em um parvovírus não-patogênicos humanos, o vírus adeno-associado (AAV) têm sido desenvolvidas, e estão atualmente em uso em uma série de ensaios clínicos de terapia genética 5. Anteriormente, dos 10 sorotipos mais comumente usados AAV, a eficiência de transdução de AAV3 vetores em geral, tem sido relatada a ser particularmente baixo, tanto in vitro como in vivo 1. No entanto, a nossa observação recente de que AAV3 vetores transdução do fígado humano linhas celulares de cancro muito bem, conforme determinado quantitativamente por citometria de fluxo 2, e que o ser humano utiliza AAV3 hepatócito receptor do fator de crescimento (hHGFR) como um co-receptor celular para a entrada obrigatória e nestes 3 células, sugerem fortemente uma seletiva do tecido tropismo de AAV3 de células do fígado humano em geral, e as células humanas de câncer de fígado em particular. No entanto, desde AAV3 vetores também transdução de hepatócitos humanos normais de forma eficiente 2, seu uso potencial no câncer de aplicação da terapia gênica in vivo seria impactado negativamente. Uma possível estratégia para contornar esse problema em potencial envolve a transcrição de metas de células de câncer através da identificação de um produto gene que é seletivamente produzida pelo tumor, mas não pelos hepatócitos normal. Por exemplo, estudos anteriores mostraram que os níveis séricos de α-fetoproteína (AFP) são usados como um marcador específico para o rastreamento da presença, progressão e / ou a recorrência de certos tipos de cânceres de fígado, uma vez que os hepatócitos normais geralmente produzem quantidades muito pequenas de esta proteína. Na verdade, temos utilizado AAV3 vetores contendo o promotor AFP para atingir a expressão do transgene em células de câncer de fígado, mas não em hepatócitos normais 2, e os estudos estão em andamento para testar a eficácia desta abordagem em um modelo murino xenoenxerto de câncer de fígado. Em nossos estudos adicionais, temos observado que a eficiência de transdução de vetores sorotipo vários AAV pode ser significativamente aumentada pelo sítio-dirigida mutagênese da superfície exposta resíduos de tirosina na capsídeos virais 14/06. Desde 6 de 7 de superfície exposta tirosinas também são conservados em AAV3, temos realizado mutagênese sítio-dirigida desses resíduos e observaram que a eficiência de transdução de tirosina-mutante AAV3 vetores é significativamente maior em células de fígado humano com câncer (dados não publicados). Estudos também estão em andamento para avaliar a segurança ea eficácia da tirosina-mutante AAV3 vetores em modelos xenoenxerto mouse para hepatoblastoma humanos e carcinoma hepatocelular, e se bem sucedida, o ideal tirosina-mutante vetores sorotipo AAV3 pode vir a ser útil para a segmentação do fígado humano câncer para a terapia genética potencial.
Divulgações
Agradecimentos
Agradecemos a drs. R. Jude Samulski e Xiao Xiao para os presentes o seu tipo de AAV3 recombinante e AAV-EGFP plasmídeos, respectivamente, e Gail Dr. Tomlinson para generosamente fornecimento de células Hep293TT. Esta pesquisa foi suportada em parte pelo Serviço de Saúde Pública conceder bolsas R01 HL-076901, R01 HL-097088, e P01 DK-058327 (Projeto 1) do National Institutes of Health (para AS).
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-0170CM | |
| PEI | Polysciences, Inc. | 23966 | |
| Benzonase | Novagen, EMD Millipore | 70664-3 | |
| HiTrap Q HP column | GE Healthcare | 17-1154-01 | |
| Salmon sperm DNA | Fisher Scientific | NC9753983 | |
| Iodixanol gradient | OptiPrep | 1114542 | |
| G-50 Columns | GE Healthcare | 27-5330-01 |
Referências
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 16, 1073-1080 (2008).
- Glushakova, L. G., Lisankie, M. J., Eruslanov, E. B., Ojano-Dirain, C., Zolotukhin, I., Liu, C., Srivastava, A., Stacpoole, P. W. AAV3-mediated transfer and expression of the pyruvate dehydrogenase E1 alpha subunit gene causes metabolic remodeling and apoptosis of human liver cancer cells. Mol Genet & Metabol. 98, 289-299 (2009).
- Ling, C., Lu, Y., Kalsi, J. K., Jayandharan, G. R., Li, B., Ma, W., Cheng, B., Gee, S. W., McGoogan, K. E., Govindasamy, L., Zhong, L., Agbandje-McKenna, M., Srivastava, A. Human hepatocyte growth factor receptor is a cellular coreceptor for adeno-associated virus serotype 3. Hum Gene Ther. 21, 1741-1747 (2010).
- Chen, T. T., Rakheja, D., Hung, J. Y., Hornsby, P. J., Tabaczewski, P., Malogolowkin, M., Feusner, J., Miskevich, F., Schultz, R., Tomlinson, G. E. Establishment and characterization of a cancer cell line derived from an aggressive childhood liver tumor. Pediatr Blood & Cancer. 53, 1040-1047 (2009).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Zhong, L., Li, B., Mah, C. S., Govindasamy, L., Agbandje-McKenna, M., Cooper, M., Herzog, R. W., Zolotukhin, I., Warrington, K. H., Weigel-Van Aken, K. A., Hobbs, J. A., Zolotukhin, S., Muzyczka, N., Srivastava, A. Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci USA. 105, 7827-7832 (2008).
- Petrs-Silva, H., Dinculescu, A., Li, Q., Min, S. H., Chiodo, V., Pang, J. J., Zhong, L., Zolotukhin, S., Srivastava, A., Lewin, A. S., Hauswirth, W. W. High-efficiency transduction of the mouse retina by tyrosine-mutant AAV serotype vectors. Mol Ther. 17, 463-471 (2009).
- Jayandharan, G. R., Zhong, L., Sack, B. K., Rivers, A. E., Li, M., Li, B., Herzog, R. W., Srivastava, A. Optimized adeno-associated virus (AAV)-protein phosphatase-5 helper viruses for efficient liver transduction by single-stranded AAV vectors: therapeutic expression of factor IX at reduced vector doses. Hum. Gene Ther. 21, 271-283 (2010).
- Li, M., Jayandharan, G. R., Li, B., Ling, C., Ma, W., Srivastava, A., Zhong, L. High-efficiency transduction of fibroblasts and mesenchymal stem cells by tyrosine-mutant AAV2 vectors for their potential use in cellular therapy. Hum Gene Ther. 21, 1527-1543 (2010).
- Kauss, M. A., Smith, L. J., Zhong, L., Srivastava, A., Wong, K. K. J. r., Chatterjee, S. Enhanced long-term transduction and multilineage engraftment of human hematopoietic stem cells transduced with tyrosine-modified recombinant adeno-associated virus serotype 2. Hum Gene Ther. 21, 1129-1136 (2010).
- Qiao, C., Zhang, W., Yuan, Z., Shin, J. H., Li, J., Jayandharan, G. R., Zhong, L., Srivastava, A., Xiao, X., Duan, D. Adeno-associated virus serotype 6 capsid tyrosine-to-phenylalanine mutations improve gene transfer to skeletal muscle. Hum Gene Ther. 21, 1343-1348 (2010).
- Markusic, D. M., Herzog, R. W., Aslanidi, G. V., Hoffman, B. E., Li, B., Li, M., Jayandharan, G. R., Ling, C., Zolotukhin, I., Ma, W., Zolotukhin, S., Srivastava, A., Zhong, L. High-efficiency transduction and correction of murine hemophilia B using AAV2 vectors devoid of multiple surface-exposed tyrosines. Mol Ther. 18, 2048-2056 (2010).
- Ojano-Dirain, C., Glushakova, L. G., Zhong, L., Zolotukhin, S., Muzyczka, N., Srivastava, A., Stacpoole, P. W. An animal model of PDH deficiency using AAV8-siRNA vector-mediated knockdown of pyruvate dehydrogenase E1α. Mol Genet & Metabol. 101, 183-191 (2010).
- Petrs-Silva, H., Dinculescu, A., Li, Q., Deng, W. T., Pang, J. J., Min, S. H., Chiodo, V., Neeley, A. W., Govindasamy, L., Bennett, A., Agbandje-McKenna, M. Novel properties of tyrosine-mutant AAV2 vectors in the mouse retina. Mol Ther. , (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados