Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Einem zellfreien Assay System Schätzung der neutralisierende Wirkung von GM-CSF Antikörper mit rekombinanten löslichen GM-CSF-Rezeptor
In diesem Artikel
Zusammenfassung
Wir haben eine zellfreie Rezeptorbindungstest, um die Bindung von Granulozyten-Makrophagen-Kolonie-stimulierender Faktor (GM-CSF) an die Rezeptoren zu schätzen. Es ermöglicht uns, kompetitive Hemmung des biotinylierten GM-CSF-Bindung an löslichen GM-CSF-Rezeptor alpha von GM-CSF Autoantikörper mit ausgezeichneter Reproduzierbarkeit zu bewerten.
Zusammenfassung
Hintergrund: Bisher haben wir gezeigt, dass neutralisierende Wirkung, nicht aber die Konzentration von GM-CSF Autoantikörper wurde mit dem Schweregrad der Erkrankung bei Patienten mit Autoimmun-pulmonale Alveolarproteinose (PAP) 1-3 korreliert. Als Aufhebung der GM-CSF-Bioaktivität in der Lunge ist die wahrscheinliche Ursache für Autoimmunerkrankungen PAP 4,5, ist es das Versprechen, die neutralisierende Wirkung des GM-CSF Autoantikörper für die Beurteilung der Schwere der Erkrankung bei jedem Patienten mit PAP zu messen.
Bis jetzt hat neutralisierende Wirkung von GM-CSF-Autoantikörpern durch die Auswertung der Wachstumshemmung von menschlichen Knochenmarkzellen oder TF-1-Zellen mit GM-CSF stimuliert 6-8 bewertet. Im Tierversuch System, jedoch ist es oft problematisch, verlässliche Daten sowie die Daten aus verschiedenen Laboratorien zu vergleichen, aufgrund der technischen Schwierigkeiten bei der Aufrechterhaltung der Zellen in einem konstanten Zustand zu erhalten.
ZIEL: GM-CSF imitieren Bindung an GM-CSF-Rezeptor auf der Zelloberfläche mit zellfreien Rezeptor-Bindungs-Assays.
Methoden: Transgene Seidenraupen-Technologie wurde für den Erhalt einer großen Menge für rekombinante, lösliche GM-CSF-Rezeptor alpha (sGMRα) mit hoher Reinheit 9-13 aufgetragen. Das rekombinante sGMRα war in der hydrophilen Sericin Schichten von Seidenfäden, ohne auf die Seidenproteine verschmolzen enthalten, und somit können wir leicht aus den Kokons in guter Reinheit Extrakt mit neutralen wässrigen Lösungen 14,15. Glücklicherweise sind die Oligosaccharid-Strukturen, die entscheidend für die Bindung mit GM-CSF sind, mehr Ähnlichkeit mit den Strukturen des menschlichen sGMRα als die von anderen Insekten oder Hefen hergestellt.
ERGEBNISSE: Die zellfreien Testsystem mit sGMRα ergaben die Daten mit hoher Plastizität und Zuverlässigkeit. GM-CSF-Bindung an sGMRα war dosisabhängig gehemmt durch polyklonale GM-CSF Autoantikörper in ähnlicher Weise wie die Biotest mit TF-1-Zellen, was darauf hinweist, dass unser neues zellfreien Testsystem mit sGMRα mehr nützlich für die Messung von neutralisierenden Aktivität ist von GM-CSF-Autoantikörpern als der Bioassay-System mit TF-1 Zelle oder menschliche Knochenmarkszellen.
FAZIT: Wir haben einen zellfreien Assay quantifiziert die neutralisierende Kapazität von GM-CSF Autoantikörper.
Protokoll
1. Produktion und Aufreinigung von sGMRα
- Amplify cDNA von sGMRα aus menschlicher Plazenta-cDNA-Bank mittels Polymerase-Kettenreaktion (PCR).
- Dann werden 50 Basis-5'-UTR-Sequenz von Baculovirus-Polyhedrin Ende und 27 Basis-Codierung RGS His-tag an das 3'-Ende der PCR Amplikon von einer anderen PCR.
- Legen Sie die amplifizierte PCR-Produkt in ein Plasmid pMSG1.1MG.
- Inject das Konstrukt psGMR/M1.1MG mit dem Helfer-Vektor pHA3PIG in Eier der Seidenraupe PND-w1 Belastung.
- Hinten die geschlüpften Larven zu Motten G0 bei 25 ° C. Screen-G1 Embryonen, die durch Paarung unter Geschwistern oder mit PND-w1 erhalten für MGFP Ausdruck in den Augen zu erhalten transgenen Seidenraupen mit dem sGMRα Gen.
- Auszug rekombinanten sGMRα aus den Kokons der Seidenraupen transgenen mit Phosphat-Puffer mit 500 mM NaCl und rühren bei 4 ° C für 24 Stunden.
- Centrifuge Probe bei 20000 g für 15 Minuten zu entfernen ausfällt.
- Wenden Sie den Überstand in ein Nickel-Affinitätssäule.
- Die Säule wird mit 10 mM Imidazol, 500 mM NaCl und 20 mM Natriumphosphat, pH6.3, und eluieren mit einem linearen Gradienten von Imidazol von 10mm bis 250mm. Pool der Fraktionen, die das gereinigte sGMRα und dialysieren gegen Phosphat-gepufferte Kochsalzlösung (pH 7,4) (PBS).
2. Biotinylierung von rekombinantem GM-CSF
- Entfernen Sorbit Vorbereitung durch Dialyse gegen PBS.
- Add 1 ml 20 mM kalten Natrium-meta-Perjodat-Lösung bei 4 ° C, um die Lösung auf Eis.
- Inkubieren Sie die Probe für 30min auf Eis im Dunkeln.
- Add Glycerin, um die Lösung in einer Endkonzentration von 15 mm.
- Dialysieren die Lösung gegen 100 mM Natriumacetat-Puffer (pH 5,5)
- Add Biotinhydrazid die Lösung mit einer Endkonzentration von 5 mM und kontinuierlich rühren die Lösung für 2 h bei Raumtemperatur.
- Entfernen Sie das nicht umgesetzte Material durch Dialyse gegen PBS, pH 7,4.
3. Ein zellfreier GM-CSF-Rezeptor-Ligand-Bindungs-Assay
- Coat eine Mikrotiterplatte mit 50 ul monoklonalen anti-Polyhistidin Antikörper über Nacht bei 4 ° C.
- Wash fünfmal mit 500μl PBST.
- Add 100 &mgr; einer Blockierungslösung und Inkubation für 3h bei 4 ° C.
- Wash fünfmal mit 500μl PBST.
- Add 50 ul sGMRα in Blocking-Lösung und Inkubation über Nacht bei 4 ° C.
- Wash fünfmal mit 500μl PBST.
- Add 25 &mgr; l der Proben mit GM-CSF Autoantikörper und dann 25 &mgr; l des biotinylierten GM-CSF. Inkubieren 1h bei 4 ° C zu bilden sGMRα-GM-CSF-Komplex.
- Wash fünfmal mit 500μl PBST.
- Add 50 ul 0,4 mM Streptavidin-alkalische Phosphatase für 1 Stunde bei 4 ° C an den biotinylierten GM-CSF gebunden sGMRα erkennen.
- Wash fünfmal mit 500μl PBST.
- Add 50 ul einer Chemilumineszenzsubstrat zur Lösung resuspendiert und für 1h bei Raumtemperatur.
- Mit Hilfe eines Chemilumineszenz-Reader, erkennen die Chemilumineszenz-Aktivität.
4. Repräsentative Ergebnisse:
Der erste Schritt in die GM-CSF-Rezeptor-Signalweg ist die Bindung von GM-CSF, GM-CSF-Rezeptor alpha auf der Zelloberfläche. Weil GM-CSF Autoantikörper bindet spezifisch an GM-CSF und blockieren die Bindung an den Rezeptor in vitro 16,17 stellten wir die Hypothese, dass die Autoantikörper dieser ersten Reaktion unmittelbar verbindlich GM-CSF zu hemmen. Wie zuvor beschrieben (Ref. 9-15), wandten wir transgene Seidenraupe Technologie, um eine große Menge an rekombinantem sGMRα mit hoher Reinheit zu erhalten.
Wenn die Seidenraupe abgeleitete rekombinante sGMRα auf SDS-PAGE wurde unter nicht-reduzierenden Bedingungen geladen, zeigte die sGMRα sowohl monomere (45 kDa) und dimeren (90 kDa) bildet, während nur die monomere Form unter reduzierenden Bedingungen festgestellt wurde (Abbildung 1B) , was darauf hinweist, dass die rekombinanten sGMRα eine Mischung aus Monomeren und Disulfid-linked-Dimmer 18 Jahre alt war.
Mit dem zellfreien System (Abb. 2A), wir die Hemmung der GM-CSF-Bindung an sGMRα von GM-CSF-Autoantikörpern (Abb. 2B und Abb.. 2C) ausgewertet. Diese Methoden wurden in Bezug 19 von Urano et al. Die Wachstumshemmung war eng mit dem Binding-Hemmung (r = 0,988, p = 0,002) bei verschiedenen Konzentrationen der GM-CSF Autoantikörper (Abb. 3A) 19 korreliert. Ebenso wurde die Bindung Hemmung signifikant mit der Wachstumshemmung korreliert. Die Binding-Hemmung in einer dosisabhängigen Weise durch GM-CSF-Autoantikörpern (Abb. 3B) 19 erhöht. Diese beiden Parameter für die Serum-IgG-Fraktionen von verschiedenen Patienten wurden miteinander korreliert (r = 0,589 p = 0,006, Abb.. 3C). Weder Bindungsinhibition noch Wachstumshemmung mit Kd-Werten korreliert, und somit waren beide Parameter unabhängig von Bindungsaffinität 19. Folglich Reproduzierbarkeit der Daten zwischen Bindung und gachstum Hemmung durch drei unabhängige Experimente an drei verschiedenen Proben erhalten wurde, ausgewertet. Der Variationskoeffizient angedeutet, dass die zellfreien System mehr gute als die von Biotest (Tabelle 1) wurde.
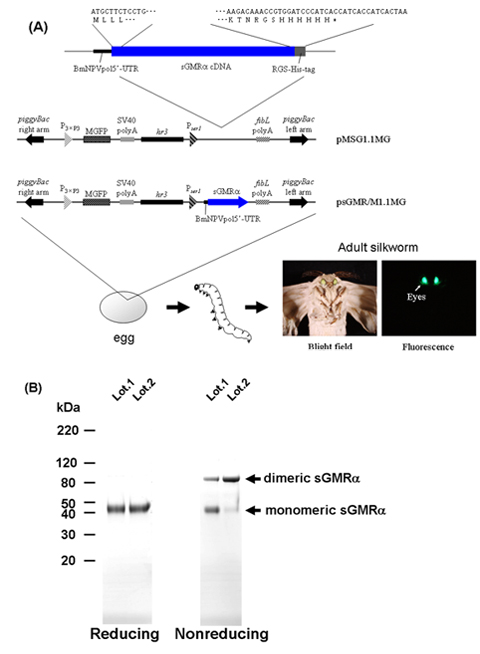
Abbildung 1. Flussdiagramm des Verfahrens zur Herstellung von sGMRα mit transgenen Seidenraupen. A) Strukturen der Transformationsvektoren 9-11. B) SDS-PAGE und Coomassie Brilliant Blue-Färbung des gereinigten sGMRα unter reduzierenden und nicht reduzierenden Bedingungen. sGMRα, lösliches GM-CSF-Rezeptor alpha; MGFP, Monster grün fluoreszierendes Protein; BmNPVpol5'-UTR, 5'-untranslatierten Region Abfolge von Bombyx mori nuklearen polyhedrosis Virus Polyhedrin; SV40 polyA, SV40 polyA-Signal-Sequenz; P 3xP3, 3xP3 Promotor; P SER1, SER1 Promotor; FibL polyA, Fibroin L-Kette polyA-Signal-Sequenz, hr3, Bombyx mori nuklearen polyhedrosis Virus hr3-Enhancer.
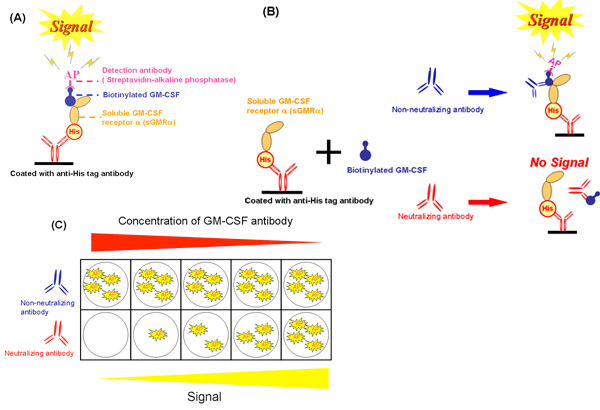
Abbildung 2. Schema der zellfreien Assay-System. A) Ein wettbewerbsfähiger Bindungsassay mit sGMRα von Seidenraupen produziert. B) Wirkung zu neutralisieren und nicht-neutralisierende Antikörper auf die Bindung der Hemmung durch zellfreien System. C) Die Differenz von Bindungsinhibition zwischen verschiedenen Konzentrationen von neutralisierenden Antikörpern und nicht-neutralisierenden Antikörpern. GM-CSF, Granulozyten-Makrophagen-Kolonie-stimulierender Faktor; sGMRα, lösliches GM-CSF-Rezeptor alpha, His, RGS-His-tag, AP, alkalische Phosphatase.
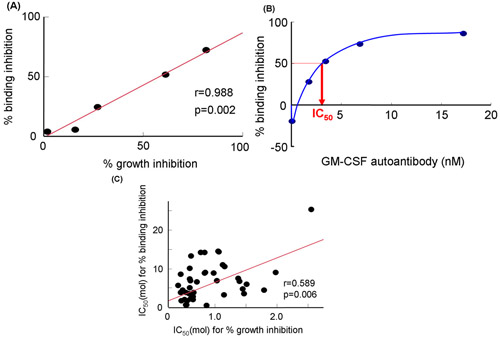
Abbildung 3. GM-CSF Bindungsinhibition zu sGMRα durch Wirkung von GM-CSF polyklonale Antikörper oder das Serum IgG-Fraktionen von Patienten mit Autoimmun-PAP. A) Beziehung zwischen verbindlichen Hemmung und Wachstumshemmung von GM-CSF Autoantikörper. B) Binding-Hemmung bei verschiedenen Konzentrationen von GM-CSF Autoantikörper. C) Beziehung zwischen IC 50 für Prozent Bindungsinhibition und Prozent Wachstumshemmung durch das Serum IgG-Fraktionen 19. IC 50, 50% ige Hemmkonzentration; GM-CSF, Granulozyten-Makrophagen-Kolonie-stimulierender Faktor.
| Probe | A | B | C |
| Inter-Assay- | |||
| Anzahl der Bestimmungen | 3 | 3 | 3 |
| Mittelwert (% Bindung Hemmung) | 61,6 | 63,8 | 69,7 |
| Mittelwert (% Wachstumshemmung) | 21,0 | 73,4 | 82,8 |
| Variationskoeffizient (%) (% Bindung Hemmung) | 6,0 | 5,6 | 8,3 |
| Variationskoeffizient (%) (% Wachstumshemmung) | 64,4 | 18,3 | 10,4 |
Beide Assays wurden bei 5 ng / ml GM-CSF und einer Konzentration von GM-CSF Autoantikörper durchgeführt.
Tabelle 1. Vergleich der Koeffizienten von Variationen zwischen Prozent verbindlich und Wachstum Hemmungen durch drei unabhängigen Experimenten.
Diskussion
Die zellfreien Assay schätzte die neutralisierende Wirkung des GM-CSF-Autoantikörpern mit ausgezeichneter Reproduzierbarkeit und Schnelligkeit. Die Bindung der Hemmung durch GM-CSF Autoantikörper oder Serum des Patienten IgG-Fraktionen wurde durch diesen Test ausgewertet. Die Daten zeigten eine Korrelation zwischen der Bindung Hemmung der zellfreien Assay und die Wachstumshemmung von einem Bioassay mit TF-1 Zellen. Der Bioassay wurde vielfach genutzt, sondern beherbergt Schwierigkeiten beim Vergleich der Daten zwisch...
Offenlegungen
Danksagungen
Wir sind sehr dankbar, K. Nakagaki, Dr. H. Ishii, Dr. K. Suzuki, A. Yamagata, K. Oofusa für ihre wertvollen Beiträge.
Materialien

Referenzen
- Arai, T. Serum neutralizing capacity of GM-CSF reflects disease severity in a patient with pulmonary alveolar proteinosis successfully treated with inhaled GM-CSF. Respir Med. 98, 1227-1230 (2004).
- Tazawa, R. Granulocyte-macrophage colony-stimulating factor and lung immunity in pulmonary alveolar proteinosis. Am J Respir Crit Care Med. 171, 1142-1149 (2005).
- Inoue, Y. Characteristics of a large cohort of patients with autoimmune pulmonary alveolar proteinosis in Japan. Am J Respir Crit Care Med. 177, 752-762 (2008).
- Uchida, K. High-affinity autoantibodies specifically eliminate granulocyte-macrophage colony-stimulating factor activity in the lungs of patients with idiopathic pulmonary alveolar proteinosis. Blood. 103, 1089-1098 (2004).
- Sakagami, T. Human GM-CSF autoantibodies and reproduction of pulmonary alveolar proteinosis. N Engl J Med. 361, 2679-2681 (2009).
- Raines, M. Identification and molecular cloning of a soluble human granulocyte-macrophage colony-stimulating factor receptor. Proc Natl Acad Sci U S A. 88, 8203-8207 (1991).
- Williams, W., VonFeldt, J., Rosenbaum, H., Ugen, K., Weiner, D. Molecular cloning of a soluble form of the granulocyte-macrophage colony-stimulating factor receptor alpha chain from a myelomonocytic cell line. Expression, biologic activity, and preliminary analysis of transcript distribution. Arthritis Rheum. 37, 1468-1478 (1994).
- Prevost, J. Granulocyte-macrophage colony-stimulating factor (GM-CSF) and inflammatory stimuli up-regulate secretion of the soluble GM-CSF receptor in human monocytes: evidence for ectodomain shedding of the cell surface GM-CSF receptor alpha subunit. J Immunol. 169, 5679-5688 (2002).
- Iizuka, M. Production of a recombinant mouse monoclonal antibody in transgenic silkworm cocoons. FEBS J. 276, 5806-5820 (2009).
- Iizuka, M., Tomita, M., Shimizu, K., Kikuchi, Y., Yoshizato, K. Translational enhancement of recombinant protein synthesis in transgenic silkworms by a 5'-untranslated region of polyhedrin gene of Bombyx mori Nucleopolyhedrovirus. J Biosci Bioeng. 105, 595-603 (2008).
- Zou, W., Ueda, M., Yamanaka, H., Tanaka, A. Construction of a combinatorial protein library displayed on yeast cell surface using DNA random priming method. J Biosci Bioeng. 92, 393-396 (2001).
- Tamura, T. Germline transformation of the silkworm Bombyx mori L. using a piggyBac transposon-derived vector. Nat Biotechnol. 18, 81-84 (2000).
- Tomita, M. Transgenic silkworms produce recombinant human type III procollagen in cocoons. Nat Biotechnol. 21, 52-56 (2003).
- Ogawa, S., Tomita, M., Shimizu, K., Yoshizato, K. Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. J Biotechnol. 128, 531-544 (2007).
- Tomita, M. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon. Transgenic Res. 16, 449-465 (2007).
- Kitamura, T. Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J Exp Med. 190, 875-880 (1999).
- Tanaka, N. Lungs of patients with idiopathic pulmonary alveolar proteinosis express a factor which neutralizes granulocyte-macrophage colony stimulating factor. FEBS Lett. 442, 246-250 (1999).
- Brown, C., Pihl, C., Murray, E. Oligomerization of the soluble granulocyte-macrophage colony-stimulating factor receptor: identification of the functional ligand-binding species. Cytokine. 9, 219-225 (1997).
- Urano, S. A cell-free assay to estimate the neutralizing capacity of granulocyte-macrophage colony-stimulating factor autoantibodies. J Immunol Methods. 360, 141-148 (2010).
- Hayashida, K. Molecular cloning of a second subunit of the receptor for human granulocyte-macrophage colony-stimulating factor (GM-CSF): reconstitution of a high-affinity GM-CSF receptor. Proc Natl Acad Sci U S A. 87, 9655-9659 (1990).
- Hansen, G. The structure of the GM-CSF receptor complex reveals a distinct mode of cytokine receptor activation. Cell. 134, 496-507 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten