É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A célula do sistema de Ensaio grátis Estimar a capacidade de neutralização de GM-CSF recombinante usando anticorpo receptor GM-CSF Solúvel
Neste Artigo
Resumo
Nós projetamos um ensaio de receptor de células livres vinculativas, a fim de estimar a ligação de granulócitos e macrófagos fator estimulante de colônia (GM-CSF) para os receptores. Ele nos permite avaliar inibição competitiva do biotinilado GM-CSF ligação a solúvel GM-CSF receptor alfa por GM-CSF auto-anticorpos com excelente reprodutibilidade.
Resumo
FUNDOS: Anteriormente, demonstramos que a capacidade de neutralizar, mas não a concentração de GM-CSF auto-anticorpos foi correlacionada com a severidade da doença em pacientes com proteinose alveolar pulmonar auto-imunes (PAP) 1-3. Como revogação da GM-CSF bioatividade no pulmão é a causa mais provável para PAP auto-imunes 4,5, é promissora para medir a capacidade de neutralização de GM-CSF auto-anticorpos para avaliar a gravidade da doença em cada paciente com PAP.
Até agora, a capacidade de neutralização de GM-CSF auto-anticorpos foi avaliada através da avaliação da inibição do crescimento de células de medula óssea humana ou TF-1 células estimuladas com GM-CSF 6-8. No sistema de bioensaio, no entanto, muitas vezes é problemático para obter dados fiáveis, bem como comparar os dados de diferentes laboratórios, devido a dificuldades técnicas na manutenção das células em uma condição constante.
OBJETIVO: Para imitar GM-CSF ligação ao GM-CSF receptor na superfície celular utilizando células livres receptor-ensaio de ligação.
MÉTODOS: Transgênicos bicho-da-tecnologia foi aplicada para a obtenção de uma grande quantidade de recombinante solúvel GM-CSF receptor alfa (sGMRα) com alta pureza 9-13. O sGMRα recombinante foi contido nas camadas sericin hidrofílica de fios de seda sem ser fundida ao proteínas da seda, e assim, podemos facilmente extrair os casulos na pureza bom com soluções aquosas neutras 14,15. Felizmente, as estruturas de oligossacarídeos, que são críticos para a ligação com a GM-CSF, são mais semelhantes às estruturas de sGMRα humana do que aquelas produzidas por outros insetos ou leveduras.
RESULTADOS: O sistema de ensaio livre de células usando sGMRα rendeu os dados com alta plasticidade e confiabilidade. GM-CSF ligação a sGMRα foi dose-dependente inibida por policlonal GM-CSF auto-anticorpos de forma semelhante ao bioensaio usando TF-1 células, indicando que o nosso novo livre de células do sistema de ensaio utilizando sGMRα é mais útil para a medição da atividade neutralizante de GM-CSF auto-anticorpos que o sistema de bioensaio utilizando TF-1 célula ou células humanas de medula óssea.
CONCLUSÕES: Nós estabelecemos um ensaio livre de células quantificar a capacidade de neutralização da GM-CSF auto-anticorpos.
Protocolo
1. Produção e purificação de sGMRα
- Amplificar cDNA de sGMRα da biblioteca de cDNA placenta humana por reação em cadeia da polimerase (PCR).
- Adicionar 50 base de 5'-UTR seqüência de final poliedrina baculovírus e 27 RGS base de codificação Sua tag-de-final 3 'do fragmento amplificado pela PCR por outro PCR.
- Inserir o produto amplificado de PCR em um pMSG1.1MG plasmídeo.
- Injetar o psGMR/M1.1MG construir com o vetor helper pHA3PIG em ovos de bicho-da-tensão pnd-w1.
- Traseira do chocados G0 larvas às traças a 25 ° C. Tela de embriões obtidos por meio de cruzamentos G1 entre irmãos ou com pnd-w1 para a expressão MGFP nos olhos para obter transgênicos bichos tendo o gene sGMRα.
- Extrato recombinante sGMRα dos casulos de bicho-da-transgênicos com tampão fosfato contendo 500mM NaCl e mexa a 4 ° C por 24h.
- Centrífuga de amostra em 20.000 g por 15 min para remover um precipitados.
- Aplicar o sobrenadante para uma coluna de níquel afinidade.
- Lavar a coluna com 10mM imidazol, NaCl 500mM e fosfato de sódio 20mM, pH6.3, e eluir com um gradiente linear de imidazol de 10mm a 250mm. Piscina as frações contendo o sGMRα purificado e diálise contra tampão fosfato (pH7.4) (PBS).
2. Biotinilação de GM-CSF recombinante
- Remover preparação sorbitol por diálise contra PBS.
- Adicionar 1 ml de solução de sódio 20mM frio meta-periodato a 4 ° C para a solução em gelo.
- Incubar a amostra por 30min no gelo no escuro.
- Adicionar glicerol para a solução em uma concentração final de 15mM.
- Diálise a solução contra tampão acetato de sódio 100mM (pH5.5)
- Adicionar biotina hidrazida para a solução em uma concentração final de 5mM e continuamente agitar a solução para 2h em temperatura ambiente.
- Remover o material não reagiu por diálise contra PBS, pH7.4.
3. Uma célula-livre GM-CSF receptor-ligand-binding ensaio
- Placa de um casaco de microtitulação com 50μl de anticorpo monoclonal anti-polyHistidine overnight a 4 ° C.
- Lavar cinco vezes com 500μl de PBST.
- Adicionar 100μl de uma solução de bloqueio e incubar por 3h a 4 ° C.
- Lavar cinco vezes com 500μl de PBST.
- Adicionar 50μl de sGMRα na solução de bloqueio e incubar overnight a 4 ° C.
- Lavar cinco vezes com 500μl de PBST.
- Adicionar 25μl das amostras contendo GM-CSF auto-anticorpos e, em seguida, 25μl de biotinilado GM-CSF. Incubar por 1h a 4 ° C para formar sGMRα-GM-CSF complexo.
- Lavar cinco vezes com 500μl de PBST.
- Adicionar 50μl de 0.4mm fosfatase alcalina estreptavidina para uma hora a 4 ° C para detectar a biotinilado GM-CSF ligado sGMRα.
- Lavar cinco vezes com 500μl de PBST.
- Adicionar 50μl de um substrato quimioluminescente para a solução e incubados por 1h em temperatura ambiente.
- Usando um leitor de placas de quimioluminescência, detectar a atividade quimioluminescência.
4. Resultados representativos:
O primeiro passo para a GM-CSF via de transdução de sinal receptor é a ligação do GM-CSF a GM-CSF alpha receptor na superfície da célula. Porque a GM-CSF auto-anticorpos se liga especificamente GM-CSF e bloquear a sua ligação ao receptor in vitro 16,17, temos a hipótese de que os auto-anticorpos inibem esta primeira reação diretamente ligação a GM-CSF. Como descrito anteriormente (Ref. 15/09), foi aplicado transgênicos tecnologia-da-seda para obter uma grande quantidade de sGMRα recombinante com alta pureza.
Quando o bicho derivados sGMRα recombinante foi carregado no SDS-PAGE em condições não-condições redutoras, o sGMRα mostrou tanto monomérica (45 kDa) e dimérica (90 kDa) formas, enquanto que apenas a forma monomérica foi detectado em condições redutoras (Figura 1B) , indicando que o sGMRα recombinante foi uma mistura de monômeros e dissulfeto-linked dimmers 18.
Utilizando o sistema de células livres (Fig. 2A), avaliou-se a inibição da GM-CSF ligação a sGMRα pela GM-CSF auto-anticorpos (Fig. 2B e Figura. 2C). Estes métodos foram descritos na referência 19 por Urano et al. A inibição do crescimento foi estreitamente relacionado com a inibição de ligação (r = 0,988, p = 0,002) em várias concentrações dos auto-anticorpos GM-CSF (Fig. 3A) 19. Da mesma forma, a inibição de ligação foi significativamente correlacionada com a inibição do crescimento. A inibição de ligação aumentou de forma dose-dependente pela GM-CSF auto-anticorpos (Fig. 3B) 19. Estes dois parâmetros para as frações de soro IgG de diferentes pacientes foram correlacionados entre si (r = 0,589 p = 0,006, fig. 3C). Nem a inibição de ligação, nem a inibição do crescimento correlacionado com os valores de Kd, e assim, ambos os parâmetros não foram afetados pela afinidade de ligação 19. Consequentemente, reprodutibilidade de dados entre vinculativo e gCRESCIMENTO inibição obtidos através três experimentos independentes em três diferentes amostras foi avaliada. O coeficiente de variação indicou que o sistema livre de células foi mais excelente do que o de bioensaio (tabela 1).
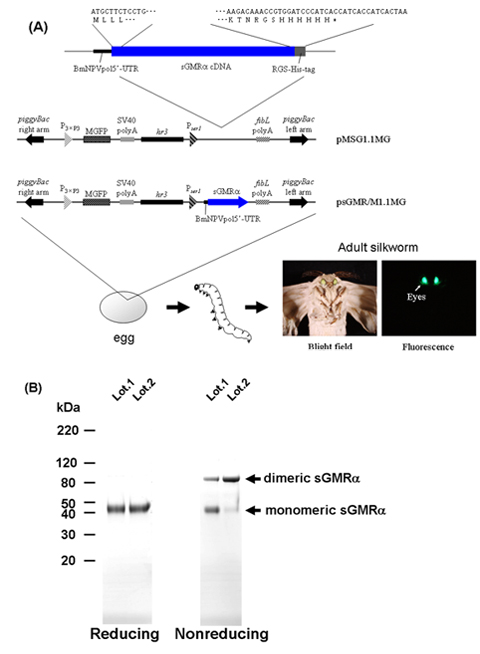
Figura 1. Fluxograma do procedimento para a produção de transgênicos sGMRα usando bichos. A) As estruturas dos vetores de transformação 9-11. B) SDS-PAGE e coloração Coomassie Brilliant Blue-do sGMRα purificada sob redutores e não redutores condições. sGMRα, solúvel GM-CSF receptor alfa; MGFP, monstro proteína verde fluorescente; BmNPVpol5'-UTR, 5'-não traduzida seqüência região de Bombyx mori poliedrose nuclear vírus poliedrina; polyA SV40, SV40 seqüência de sinal polyA; P 3xP3, 3xP3 promotor; P SER1, SER1 promotor; FIBL polyA, fibroína L de cadeia seqüência de sinal polyA; hr3, Bombyx mori vírus da poliedrose nuclear hr3 enhancer.
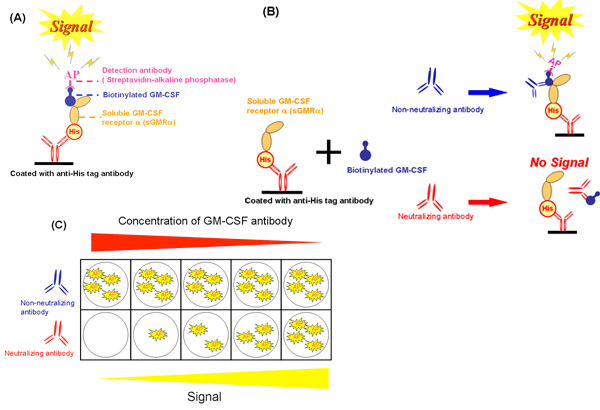
Figura 2. Esquema do sistema de ensaio livre de células. A) Um ensaio de ligação competitiva utilizando sGMRα produzido pelo bicho da seda. B) Efeito de anticorpos neutralizantes e não-neutralizantes na inibição de ligação por celular sem sistema. C) A diferença de inibição de ligação entre várias concentrações de anticorpos neutralizantes e não-anticorpos neutralizantes. GM-CSF, estimulante de colônias de granulócitos e macrófagos fator; sGMRα, solúvel GM-CSF receptor alfa; Sua, RGS-His-tag, AP, fosfatase alcalina.
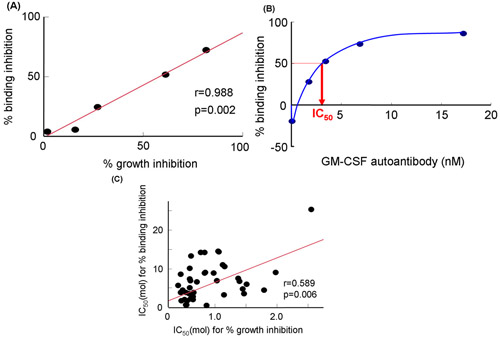
Figura 3. GM-CSF inibição de ligação para sGMRα por efeito de GM-CSF anticorpos policlonais ou frações de soro IgG de pacientes com PAP auto-imunes. A) Relação entre a inibição de ligação e inibição do crescimento por GM-CSF auto-anticorpos. B) inibição Binding em várias concentrações de GM-CSF auto-anticorpos. C) Relação entre IC 50 por cento para a inibição da ligação e inibição do crescimento por cento em frações de soro IgG 19. IC 50, 50% da concentração inibitória; GM-CSF, granulócitos e macrófagos fator estimulante de colônia.
| Amostra | A | B | C |
| Inter-ensaio | |||
| # Das determinações | 3 | 3 | 3 |
| Valor médio (% de inibição de ligação) | 61,6 | 63,8 | 69,7 |
| Valor médio (inibição do crescimento%) | 21,0 | 73,4 | 82,8 |
| Coeficiente de variação (%) (% de inibição de ligação) | 6 | 5,6 | 8,3 |
| Coeficiente de variação (%) (inibição do crescimento%) | 64,4 | 18,3 | 10,4 |
Ambos os ensaios foram realizados em 5 ng / ml de GM-CSF e uma concentração igual a GM-CSF auto-anticorpos.
Tabela 1. Comparação de coeficiente de variação entre vinculativo por cento e as inibições de crescimento obtidos através de três experimentos independentes.
Discussão
O ensaio livre de células estimou a capacidade de neutralização de GM-CSF auto-anticorpos com excelente reprodutibilidade e rapidez. A inibição de ligação por auto-anticorpos GM-CSF ou frações de soro do paciente IgG foi avaliada por este ensaio. Os dados mostraram uma correlação entre a inibição de ligação do ensaio livre de células ea inibição do crescimento de um bioensaio utilizando células TF-1, respectivamente. O bioensaio tem sido amplamente utilizada, mas abrigava dificuldades na comparação ...
Divulgações
Agradecimentos
Estamos muito gratos a K. Nakagaki, H. Dr. Ishii, Dr. K. Suzuki, Yamagata A., K. Oofusa por suas valiosas contribuições.
Materiais

Referências
- Arai, T. Serum neutralizing capacity of GM-CSF reflects disease severity in a patient with pulmonary alveolar proteinosis successfully treated with inhaled GM-CSF. Respir Med. 98, 1227-1230 (2004).
- Tazawa, R. Granulocyte-macrophage colony-stimulating factor and lung immunity in pulmonary alveolar proteinosis. Am J Respir Crit Care Med. 171, 1142-1149 (2005).
- Inoue, Y. Characteristics of a large cohort of patients with autoimmune pulmonary alveolar proteinosis in Japan. Am J Respir Crit Care Med. 177, 752-762 (2008).
- Uchida, K. High-affinity autoantibodies specifically eliminate granulocyte-macrophage colony-stimulating factor activity in the lungs of patients with idiopathic pulmonary alveolar proteinosis. Blood. 103, 1089-1098 (2004).
- Sakagami, T. Human GM-CSF autoantibodies and reproduction of pulmonary alveolar proteinosis. N Engl J Med. 361, 2679-2681 (2009).
- Raines, M. Identification and molecular cloning of a soluble human granulocyte-macrophage colony-stimulating factor receptor. Proc Natl Acad Sci U S A. 88, 8203-8207 (1991).
- Williams, W., VonFeldt, J., Rosenbaum, H., Ugen, K., Weiner, D. Molecular cloning of a soluble form of the granulocyte-macrophage colony-stimulating factor receptor alpha chain from a myelomonocytic cell line. Expression, biologic activity, and preliminary analysis of transcript distribution. Arthritis Rheum. 37, 1468-1478 (1994).
- Prevost, J. Granulocyte-macrophage colony-stimulating factor (GM-CSF) and inflammatory stimuli up-regulate secretion of the soluble GM-CSF receptor in human monocytes: evidence for ectodomain shedding of the cell surface GM-CSF receptor alpha subunit. J Immunol. 169, 5679-5688 (2002).
- Iizuka, M. Production of a recombinant mouse monoclonal antibody in transgenic silkworm cocoons. FEBS J. 276, 5806-5820 (2009).
- Iizuka, M., Tomita, M., Shimizu, K., Kikuchi, Y., Yoshizato, K. Translational enhancement of recombinant protein synthesis in transgenic silkworms by a 5'-untranslated region of polyhedrin gene of Bombyx mori Nucleopolyhedrovirus. J Biosci Bioeng. 105, 595-603 (2008).
- Zou, W., Ueda, M., Yamanaka, H., Tanaka, A. Construction of a combinatorial protein library displayed on yeast cell surface using DNA random priming method. J Biosci Bioeng. 92, 393-396 (2001).
- Tamura, T. Germline transformation of the silkworm Bombyx mori L. using a piggyBac transposon-derived vector. Nat Biotechnol. 18, 81-84 (2000).
- Tomita, M. Transgenic silkworms produce recombinant human type III procollagen in cocoons. Nat Biotechnol. 21, 52-56 (2003).
- Ogawa, S., Tomita, M., Shimizu, K., Yoshizato, K. Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. J Biotechnol. 128, 531-544 (2007).
- Tomita, M. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon. Transgenic Res. 16, 449-465 (2007).
- Kitamura, T. Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J Exp Med. 190, 875-880 (1999).
- Tanaka, N. Lungs of patients with idiopathic pulmonary alveolar proteinosis express a factor which neutralizes granulocyte-macrophage colony stimulating factor. FEBS Lett. 442, 246-250 (1999).
- Brown, C., Pihl, C., Murray, E. Oligomerization of the soluble granulocyte-macrophage colony-stimulating factor receptor: identification of the functional ligand-binding species. Cytokine. 9, 219-225 (1997).
- Urano, S. A cell-free assay to estimate the neutralizing capacity of granulocyte-macrophage colony-stimulating factor autoantibodies. J Immunol Methods. 360, 141-148 (2010).
- Hayashida, K. Molecular cloning of a second subunit of the receptor for human granulocyte-macrophage colony-stimulating factor (GM-CSF): reconstitution of a high-affinity GM-CSF receptor. Proc Natl Acad Sci U S A. 87, 9655-9659 (1990).
- Hansen, G. The structure of the GM-CSF receptor complex reveals a distinct mode of cytokine receptor activation. Cell. 134, 496-507 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados