このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
組換え可溶性GM - CSF受容体を用いてGM - CSF抗体の中和能を推定する無細胞アッセイシステム
要約
我々は、受容体への顆粒球マクロファージコロニー刺激因子(GM - CSF)の結合を推定するために、無細胞受容体結合アッセイをデザインしました。それは、優れた再現性とGM - CSF自己抗体による可溶性GM - CSF受容体αに結合するビオチン化GM - CSFの競合的阻害を評価することを可能にします。
要約
背景:これまで、我々はその中和能を示したが、GM - CSF自己抗体の濃度は、自己免疫性肺肺胞タンパク症(PAP)1-3患者の疾患の重症度と相関していたではない。肺におけるGM - CSFの生物活性の廃止は、4,5自己免疫PAPの可能性が高い原因であるとして、それはPAPと各患者の病気の重症度を評価するためのGM - CSF自己抗体の中和能を測定するために期待される。
今までは、GM - CSF自己抗体の中和能は、ヒト骨髄細胞またはGM - CSF 6月8日で刺激TF - 1細胞の増殖阻害を評価することによって評価されている。バイオアッセイ系では、しかしながら、一定の条件で細胞を維持するための技術的な問題に起因する別の研究室からのデータを、比較するだけでなく、信頼性の高いデータを得るためにしばしば問題になります。
目的:無細胞受容体結合アッセイを用いて細胞表面にGM - CSF受容体に結合するGM - CSFを模倣する。
方法:トランスジェニックカイコ技術は、高純度9月13日に組換え可溶性GM - CSF受容体α(sGMRα)のための大規模な量を得るために適用した。組換えsGMRαは、絹のタンパク質に融合されることなく、絹の糸の親水性のセリシン層に含まれていた、従って、我々は容易に中性の水溶液14,15との良好な純度で繭から抽出することができます。幸いなことに、GM - CSFとの結合に不可欠なオリゴ糖の構造は、他の昆虫や酵母によって生成されるものよりも人間のsGMRαの構造に、より類似しています。
結果:無細胞アッセイ系sGMRαを使用しては高い可塑性と信頼性でデータが得られた。 sGMRαにGM - CSF結合を用量依存sGMRαを使って、新しい無細胞アッセイ系は、中和活性の測定のためのより有用であることを示す、TF - 1細胞を用いたバイオアッセイと同様の方法でポリクローナルGM - CSF自己抗体によって阻害されたTF - 1細胞またはヒト骨髄細胞を用いたバイオアッセイ系よりGM - CSF自己抗体の。
結論:我々はGM - CSF自己抗体の中和能を定量化する無細胞アッセイを確立した。
プロトコル
1。 sGMRαの生産と精製
- ポリメラーゼ連鎖反応(PCR)により、ヒト胎盤cDNAライブラリーからsGMRαのcDNAを増幅する。
- Hisタグ別のPCRによるPCRアンプリコンの3'末端に50塩基のバキュロウイルスポリヘドリン最後の5' - UTR配列と27塩基のコーディングRGSを追加。
- プラスミドpMSG1.1MGに増幅されたPCR産物を挿入します。
- カイコPND - W1株の卵にpHA3PIGヘルパーのベクトルを持つ構造psGMR/M1.1MGを注入する。
- 25蛾のリア孵化したG0幼虫℃にトランスジェニックカイコがsGMRα遺伝子を有する得るために目にMGFP発現に兄弟間やPND - W1との交配によって得られる画面のG1の胚。
- 500mmのNaClを含むリン酸緩衝液をトランスジェニックカイコの繭から組換えsGMRαを抽出し、4℃で撹拌℃で24時間のために。
- 沈殿除去するために15分を20000 gでサンプルを遠心する。
- ニッケル親和性カラムに上清を適用する。
- 10mMのイミダゾール、500mmのNaClおよび20mMのリン酸ナトリウム、pH6.3、および10mmから250mmのへのイミダゾールの直線勾配で溶出するとカラムを洗浄します。プール精製sGMRαを含む画分と液(pH7.4)リン酸緩衝生理食塩水に対して透析(PBS)。
2。組換えGM - CSFのビオチン化
- PBSに対して透析によってソルビトール製剤を削除します。
- ℃の氷の上で解決するために4℃で20mMの冷ナトリウムメタ過ヨウ液を1ml追加。
- 暗所で氷上で30分間サンプルをインキュベートする。
- 15mmの最終濃度で溶液にグリセロールを追加。
- 100mMの酢酸ナトリウム緩衝液(pH5.5)に対してソリューションを透析
- 5mmの最終濃度の溶液にビオチンヒドラジドを追加し、継続的に室温で2時間のためのソリューションを撹拌。
- PBS、pH7.4の透析によって未反応物質を取り除きます。
3。無細胞GM - CSF受容体 - リガンド結合アッセイ
- 一晩4モノクローナル抗ヒスチジン抗体50μlのあるコートマイクロタイタープレート℃の
- PBSTの500μLで5回洗浄する。
- 4℃で3時間のためのブロッキング溶液とインキュベート℃の100μLを加える
- PBSTの500μLで5回洗浄する。
- ブロッキング溶液でsGMRα50μlのを追加し、4℃で一晩インキュベート℃、
- PBSTの500μLで5回洗浄する。
- その後、GM - CSF自己抗体とビオチン標識GM - CSFの25μlのを含むサンプルの25μlのを追加。 4℃で1時間インキュベート° CsGMRα- GM - CSFの複合体を形成する。
- PBSTの500μLで5回洗浄する。
- ° C、ビオチン化GM - CSF結合sGMRαを検出するために4℃で1時間のために0.4mmのストレプトアビジンアルカリホスファターゼ50μlのを追加。
- PBSTの500μLで5回洗浄する。
- ソリューションに化学発光基質50μlのを追加し、室温で1時間インキュベートした。
- 化学発光プレートリーダーを用いて、化学発光活性を検出する。
4。代表的な結果:
GM - CSF受容体のシグナル伝達経路の最初のステップは、細胞表面上にGM - CSF受容体αに対するGM - CSFのバインディングです。 GM - CSF自己抗体が特にGM - CSFに結合し、in vitroで16,17の受容体への結合をブロックするため、我々は、自己抗体が直接的にGM - CSFに結合することによって、この最初の反応を抑制するという仮説を立てた。前述のように(文献9-15)、我々は高純度の組換えsGMRαを大量に得るために遺伝子組換えカイコ技術を適用。
唯一の単量体は還元条件下で検出されたのに対し、カイコ由来の組換えsGMRαが非還元条件下SDS - PAGEにロードされたときに、sGMRαは(図1B)、両方の単量体(45 kDa)と二量体(90 kDa)はフォームを示した、組換えsGMRαはモノマーとジスルフィド結合調光器18の混合物であることを示す。
無細胞系(図2A)を使用して、我々はGM - CSF自己抗体(図2Bおよび図2C)によるsGMRαにGM - CSF結合の阻害を評価した。これらのメソッドは、浦野らによって文献19に記述されている。増殖阻害は、密接にGM - CSF自己抗体(図3A)19の種々の濃度の結合阻害した(r = 0.988、P = 0.002)と相関していた。同様に、結合阻害は著しく成長の阻害と相関していた。結合阻害は、GM - CSF自己抗体(図3B)19によって用量依存的に増加した。別の患者からの血清IgG分画のため、これらの2つのパラメータが互いに相関した(R = 0.589、P = 0.006、図3C)。どちらの結合阻害も生育阻害は、Kd値と相関し、したがって、両方のパラメータは、結合親和性19によって影響を受けなかった。結合とgの間でデータの結果として再現性3つの異なるサンプル上の3つの独立した実験で得られたrowthの阻害を評価した。変動係数は、無細胞系は、バイオアッセイ(表1)のそれより優れていることを示した。
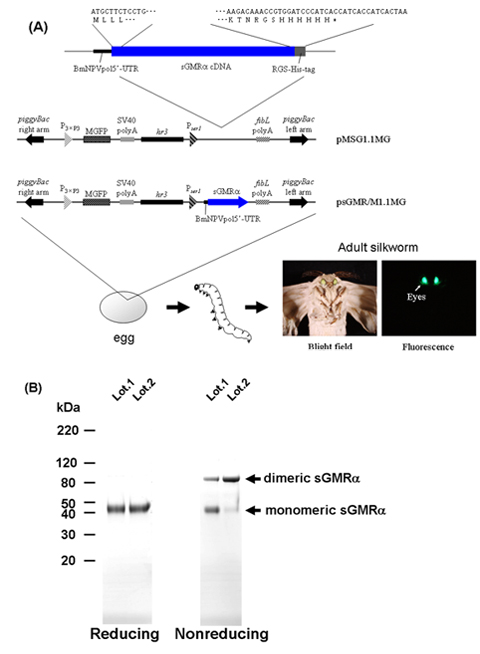
図1トランスジェニックカイコを用いたsGMRαの生産のための手順のフローチャート。形質転換ベクター9-11 A)構造。還元および非還元条件下での精製sGMRαのB)SDS - PAGEとクマシーブリリアントブルー染色。 sGMRα、可溶性のGM - CSF受容体α、MGFP、モンスター緑色蛍光タンパク質、BmNPVpol5' - UTR、 カイコ核多角体病ウイルス多角体の5' -非翻訳領域配列; SV40ポリA、SV40ポリAシグナル配列、P 3xP3、3xP3プロモーター、P SER1、SER1プ ロモーター; fibLポリA、フィブロインL鎖ポリAシグナル配列、HR3、 カイコ核多角体病ウイルスHR3エンハンサー。
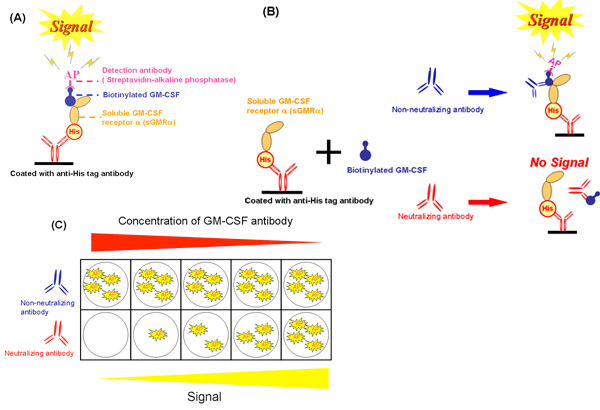
図2無細胞アッセイ系のスキーム。 A)カイコで生産さsGMRαを用いた競合結合アッセイは。 B)中和と非中和抗体の効果は、無細胞系による結合阻害について。 C)様々な中和抗体の濃度と非中和抗体との間の結合阻害の差は。 GM - CSF、顆粒球マクロファージコロニー刺激因子、sGMRα、水溶性のGM - CSF受容体α、彼の、RGS - Hisタグ、AP、アルカリホスファターゼ。
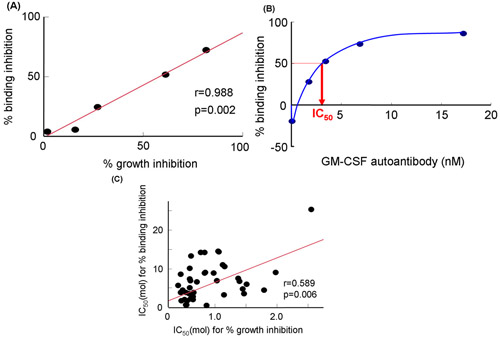
図3。GM - CSFモノクローナル抗体または自己免疫PAP患者からの血清IgG画分の影響によりsGMRαにGM - CSF結合阻害。 GM - CSF自己抗体による結合阻害や増殖阻害との間のA)の関係。 B)GM - CSF自己抗体の種々の濃度の結合阻害。血清IgG画分19重量%の結合阻害と%の成長阻害のIC 50との間のC)の関係。 IC 50、50%阻害濃度、GM - CSF、顆粒球マクロファージコロニー刺激因子。
| サンプル | A | B | C |
| アッセイ間 | |||
| #決定の | 3 | 3 | 3 |
| 平均値(%結合阻害) | 61.6 | 63.8 | 69.7 |
| 平均値(%増殖阻害) | 21.0 | 73.4 | 82.8 |
| 変動係数(%)(%結合阻害) | 6.0 | 5.6 | 8.3 |
| 変動係数(%)(%増殖阻害) | 64.4 | 18.3 | 10.4 |
両方のアッセイは、5 ng / mlのGM - CSFのとGM - CSF自己抗体と同等の濃度で行った。
表1 3つの独立した実験で得られたパーセントの結合と成長の阻害との間の変動係数の比較。
ディスカッション
無細胞アッセイは、優れた再現性と速さとGM - CSF自己抗体の中和能を推定する。 GM - CSF自己抗体または患者の血清IgG分画による結合阻害は、このアッセイにより評価した。データは、無細胞アッセイの結合阻害とそれぞれTF - 1細胞を用いてバイオアッセイの増殖阻害との間の相関を示した。バイオアッセイは、広く利用され、しかし別の施設と我々はこの新しいシステムを使用すること?...
開示事項
謝辞
我々は彼らの貴重な貢献のためのK.中垣、博士石井、博士鈴木、A.山形、K. Oofusaに非常に感謝しています。
資料

参考文献
- Arai, T. Serum neutralizing capacity of GM-CSF reflects disease severity in a patient with pulmonary alveolar proteinosis successfully treated with inhaled GM-CSF. Respir Med. 98, 1227-1230 (2004).
- Tazawa, R. Granulocyte-macrophage colony-stimulating factor and lung immunity in pulmonary alveolar proteinosis. Am J Respir Crit Care Med. 171, 1142-1149 (2005).
- Inoue, Y. Characteristics of a large cohort of patients with autoimmune pulmonary alveolar proteinosis in Japan. Am J Respir Crit Care Med. 177, 752-762 (2008).
- Uchida, K. High-affinity autoantibodies specifically eliminate granulocyte-macrophage colony-stimulating factor activity in the lungs of patients with idiopathic pulmonary alveolar proteinosis. Blood. 103, 1089-1098 (2004).
- Sakagami, T. Human GM-CSF autoantibodies and reproduction of pulmonary alveolar proteinosis. N Engl J Med. 361, 2679-2681 (2009).
- Raines, M. Identification and molecular cloning of a soluble human granulocyte-macrophage colony-stimulating factor receptor. Proc Natl Acad Sci U S A. 88, 8203-8207 (1991).
- Williams, W., VonFeldt, J., Rosenbaum, H., Ugen, K., Weiner, D. Molecular cloning of a soluble form of the granulocyte-macrophage colony-stimulating factor receptor alpha chain from a myelomonocytic cell line. Expression, biologic activity, and preliminary analysis of transcript distribution. Arthritis Rheum. 37, 1468-1478 (1994).
- Prevost, J. Granulocyte-macrophage colony-stimulating factor (GM-CSF) and inflammatory stimuli up-regulate secretion of the soluble GM-CSF receptor in human monocytes: evidence for ectodomain shedding of the cell surface GM-CSF receptor alpha subunit. J Immunol. 169, 5679-5688 (2002).
- Iizuka, M. Production of a recombinant mouse monoclonal antibody in transgenic silkworm cocoons. FEBS J. 276, 5806-5820 (2009).
- Iizuka, M., Tomita, M., Shimizu, K., Kikuchi, Y., Yoshizato, K. Translational enhancement of recombinant protein synthesis in transgenic silkworms by a 5'-untranslated region of polyhedrin gene of Bombyx mori Nucleopolyhedrovirus. J Biosci Bioeng. 105, 595-603 (2008).
- Zou, W., Ueda, M., Yamanaka, H., Tanaka, A. Construction of a combinatorial protein library displayed on yeast cell surface using DNA random priming method. J Biosci Bioeng. 92, 393-396 (2001).
- Tamura, T. Germline transformation of the silkworm Bombyx mori L. using a piggyBac transposon-derived vector. Nat Biotechnol. 18, 81-84 (2000).
- Tomita, M. Transgenic silkworms produce recombinant human type III procollagen in cocoons. Nat Biotechnol. 21, 52-56 (2003).
- Ogawa, S., Tomita, M., Shimizu, K., Yoshizato, K. Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. J Biotechnol. 128, 531-544 (2007).
- Tomita, M. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon. Transgenic Res. 16, 449-465 (2007).
- Kitamura, T. Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J Exp Med. 190, 875-880 (1999).
- Tanaka, N. Lungs of patients with idiopathic pulmonary alveolar proteinosis express a factor which neutralizes granulocyte-macrophage colony stimulating factor. FEBS Lett. 442, 246-250 (1999).
- Brown, C., Pihl, C., Murray, E. Oligomerization of the soluble granulocyte-macrophage colony-stimulating factor receptor: identification of the functional ligand-binding species. Cytokine. 9, 219-225 (1997).
- Urano, S. A cell-free assay to estimate the neutralizing capacity of granulocyte-macrophage colony-stimulating factor autoantibodies. J Immunol Methods. 360, 141-148 (2010).
- Hayashida, K. Molecular cloning of a second subunit of the receptor for human granulocyte-macrophage colony-stimulating factor (GM-CSF): reconstitution of a high-affinity GM-CSF receptor. Proc Natl Acad Sci U S A. 87, 9655-9659 (1990).
- Hansen, G. The structure of the GM-CSF receptor complex reveals a distinct mode of cytokine receptor activation. Cell. 134, 496-507 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved