Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Бесклеточной системе Пробирной Оценка нейтрализующей способности ГМ-КСФ антител с использованием рекомбинантных растворимых ГМ-КСФ рецептор
В этой статье
Резюме
Мы разработали бесклеточной связывание с рецепторами анализа для оценки связывания гранулоцитов и макрофагов колониестимулирующий фактор (GM-CSF) с рецепторами. Это позволяет нам оценить конкурентного ингибирования биотинилированного GM-CSF связывания с растворимыми GM-CSF рецепторов альфа-ГМ-КСФ аутоантител с отличной воспроизводимости.
Аннотация
ФОН: Ранее мы показали, что нейтрализующей способности, но не концентрации ГМ-КСФ аутоантител коррелирует с тяжестью заболевания у пациентов с аутоиммунными легочного альвеолярного протеиноз (PAP) 1-3. Как отмена GM-CSF биологическую активность в легких является вероятной причиной аутоиммунных PAP 4,5, это перспективное для измерения нейтрализующей способности ГМ-КСФ аутоантител для оценки тяжести заболевания у каждого пациента с PAP.
До сих пор, нейтрализующей способности ГМ-КСФ аутоантител была оценена путем вычисления замедление роста у человека клеток костного мозга или TF-1 клетки стимулировали ГМ-КСФ 6-8. В биопроб система, однако, часто бывает проблематично получить достоверные данные, а также сравнивать данные из различных лабораторий, в связи с техническими трудностями в поддержании клеток в постоянном состоянии.
ЦЕЛЬ: имитировать GM-CSF привязки к GM-CSF рецепторов на поверхности клетки использованием бесклеточных рецептор-связывающий-анализа.
Методы: Трансгенные шелкопряда технология применяется для получения большого количества рекомбинантных растворимых GM-CSF рецепторов альфа (sGMRα) с высокой чистоты 9-13. Рекомбинантный sGMRα содержится в гидрофильные слои серицина шелковых нитей, не будучи слит с протеинами шелка, и, таким образом, мы можем легко извлечь из коконов в хорошей чистоты с нейтральным водных растворах 14,15. К счастью, олигосахарид структур, которые имеют решающее значение для связывания с GM-CSF, больше похожи на структуры человеческого sGMRα, чем те, производимых другими насекомыми или дрожжей.
РЕЗУЛЬТАТЫ: бесклеточной анализа системы с помощью sGMRα дали данные с высокой пластичностью и надежности. GM-CSF привязки к sGMRα была дозозависимой ингибируется поликлональных GM-CSF аутоантител в подобной манере к биопроб использованием ТФ-1 клетках, что свидетельствует о нашей новой бесклеточной анализа системы с помощью sGMRα более полезно для измерения нейтрализующей активностью ГМ-КСФ аутоантител, чем системы с помощью биопроб TF-1 ячейки или человеческих клеток костного мозга.
Заключение: Мы созданы бесклеточной анализа количественного нейтрализующей способности ГМ-КСФ аутоантител.
протокол
1. Производство и очистка sGMRα
- Amplify кДНК sGMRα из плаценты человека библиотеки кДНК с помощью полимеразной цепной реакции (ПЦР).
- Добавить 50 базовых 5'-UTR последовательность бакуловирус конце полиэдрина и 27 базы кодирования RGS Его-теги к концу 3 'ампликона ПЦР другим ПЦР.
- Вставьте усиливается ПЦР-продукта в плазмиду pMSG1.1MG.
- Inject построить psGMR/M1.1MG с помощником вектор pHA3PIG в яйца тутового шелкопряда PND-w1 напряжения.
- Задняя вылупились G0 личинок моли при температуре 25 ° C. Экран G1 эмбрионов, полученных в результате скрещивания между братьями и сестрами или с PND-W1 для выражения MGFP в глазах целью получения трансгенных шелкопрядов подшипников sGMRα гена.
- Извлечение рекомбинантный sGMRα из коконов тутового шелкопряда трансгенных с фосфатным буфером, содержащим 500 мм NaCl и перемешивали при 4 ° С в течение 24 часов.
- Центрифуга образца при 20000 г в течение 15 мин для удаления осадков.
- Применить к надосадочной Никель-аффинной колонке.
- Промыть колонку с 10 мМ имидазол, 500 мм и 20 мм NaCl фосфат натрия, pH6.3 и элюируются с градиентом имидазола от 10мм до 250мм. Бассейн Фракции, содержащие очищенный sGMRα и диализировать против фосфатно-солевом буфере (pH7.4) (PBS).
2. Биотинилирование рекомбинантного GM-CSF
- Удалить сорбитол подготовки путем диализа против PBS.
- Добавить 1 мл 20 мМ холодной натрия мета-периодатом решение при 4 ° С до решения на льду.
- Инкубируйте образца в течение 30 минут на льду в темноте.
- Добавить глицерина в растворе при конечной концентрации 15 мм.
- Диализировать решение против 100 мМ буфера ацетата натрия (pH5.5)
- Добавить биотин гидразида к раствору при конечной концентрации 5 мМ и непрерывно перемешивать раствор для 2 часа при комнатной температуре.
- Удалить непрореагировавшего материала путем диализа против PBS, pH7.4.
3. Бесклеточной ГМ-КСФ рецептор-лиганд-связывающего анализа
- Пальто планшет с 50 мкл моноклональных анти-polyHistidine антител течение ночи при 4 ° C.
- Вымойте пять раз с 500 мкл из PBST.
- Добавить 100 мкл блокирующего раствора и инкубировать в течение 3 часов при температуре 4 ° C.
- Вымойте пять раз с 500 мкл из PBST.
- Добавить 50 мкл sGMRα в блокировании решения и инкубировать в течение ночи при 4 ° C.
- Вымойте пять раз с 500 мкл из PBST.
- Добавить 25 мкл образцов, содержащих ГМ-КСФ аутоантител, а затем 25 мкл биотинилированного GM-CSF. Инкубировать 1 час при температуре 4 ° С с образованием sGMRα-GM-CSF комплекса.
- Вымойте пять раз с 500 мкл из PBST.
- Добавить 50 мкл 0,4 стрептавидином щелочной фосфатазы на 1 час при температуре 4 ° С до обнаружения биотинилированного GM-CSF связана sGMRα.
- Вымойте пять раз с 500 мкл из PBST.
- Добавить 50 мкл хемилюминесцентного субстрата в раствор и выдерживают в течение 1 часа при комнатной температуре.
- Использование читателя пластины хемилюминесценции, обнаружения хемилюминесценции деятельности.
4. Представитель Результаты:
Первый шаг в ГМ-КСФ рецептор путь передачи сигнала является обязательным ГМ-КСФ, ГМ-КСФ рецептор альфа на поверхности клетки. Потому что ГМ-КСФ аутоантитела специфически связывается GM-CSF и блокировать его связывания с рецептором в пробирке 16,17, мы предположили, что аутоантитела подавляют эту первую реакцию непосредственно привязки к ГМ-КСФ. Как было описано ранее (см. 9-15), мы применили трансгенных шелкопряда технологии получения большого количества рекомбинантных sGMRα с высокой чистоты.
Когда шелкопряда полученных рекомбинантных sGMRα был погружен на SDS-PAGE при невосстанавливающих условиях, sGMRα показал как мономерные (45 кДа) и димерных (90 кДа) формы, тогда как только мономерной форме был обнаружен в восстановительных условиях (рис. 1В) , указывая, что рекомбинантные sGMRα был смеси мономеров и дисульфид-связанных диммеры 18.
Использование бесклеточной системе (рис. 2), мы оценили, ингибирование GM-CSF привязки к sGMRα ГМ-КСФ аутоантител (рис. 2, б и рис. 2С). Эти методы были описаны в ссылке 19, Урана и соавт. Ингибирование роста был тесно связан с обязательным торможение (г = 0,988, р = 0,002) при различных концентрациях ГМ-КСФ аутоантител (рис. 3А) 19. Кроме того, обязательным торможение было значительно коррелирует с ростом торможения. Обязательные торможение увеличилась в зависимости от дозы, по GM-CSF аутоантител (рис. 3Б) 19. Эти два параметра для сыворотки фракции IgG у разных больных были соотнесены друг с другом (г = 0,589 р = 0,006, рис. 3C). Ни одна из обязательных торможение, ни ингибирование роста коррелирует с Kd ценности, и таким образом, оба параметра были затронуты сродство 19. Поэтому воспроизводимость данных между обязательными и гrowth торможение получены с помощью трех независимых экспериментах на трех различных образцов было оценено. Коэффициент вариации показал, что бесклеточной системе было больше отличных, чем у биопроб (таблица 1).
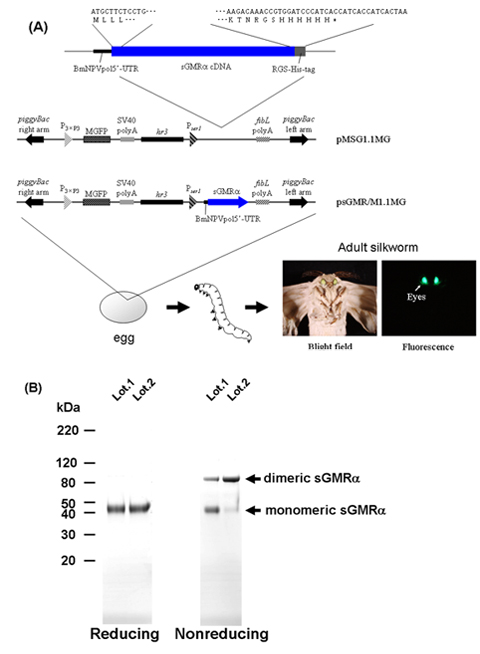
Рисунок 1. Блок-схема процедуры для производства sGMRα использованием трансгенных шелкопрядов. ) Структуры преобразования векторов 9-11. Б) SDS-PAGE и Кумасси бриллиантовый синий-окрашивания очищенная sGMRα под сокращение и не-восстановительных условиях. sGMRα, растворимые GM-CSF рецепторов альфа MGFP, монстр зеленый флуоресцентный белок; BmNPVpol5'-UTR, 5'-нетранслируемой области последовательность Bombyx море ядерного полиэдроза вирус полиэдрина; SV40 Поля, SV40 полиА сигнальной последовательности, P 3xP3, 3xP3 промоутер, P Ser1, Ser1 промоутер; FiBL Поля, фиброина L-цепи полиА сигнальной последовательности; HR3, Bombyx море ядерного полиэдроза вирус HR3 усилитель.
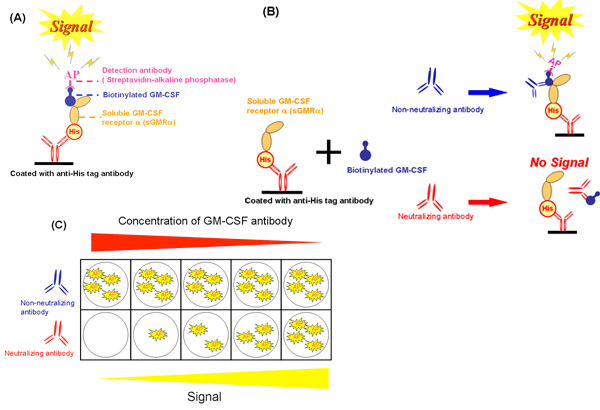
Рисунок 2. Схема бесклеточной анализа системы. ) Конкурентного связывания методом с использованием sGMRα производства тутового шелкопряда. В) Влияние нейтрализации и не-нейтрализующих антител на обязательную ингибирования бесклеточной системе. C) разница между обязательными торможение различных концентраций нейтрализующих антител и не-нейтрализующих антител. GM-CSF, гранулоцитов и макрофагов колониестимулирующий фактор; sGMRα, растворимые GM-CSF рецепторов альфа, Его, РГС-His-теги; А.П., щелочной фосфатазы.
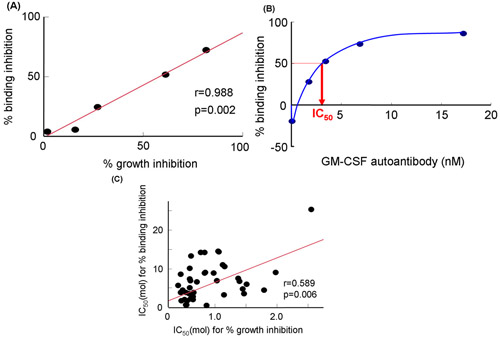
Рисунок 3. GM-CSF обязательным торможения к sGMRα от влияния ГМ-КСФ или поликлональных антител в сыворотке крови фракции IgG у пациентов с аутоиммунными PAP. ) Взаимосвязь между обязательными торможение и торможение роста ГМ-КСФ аутоантител. Б) Привязка торможения при различных концентрациях ГМ-КСФ аутоантител. C) Взаимосвязь между IC 50 процентов обязательными для торможения и торможения процентов роста в сыворотке крови фракции IgG 19. IC 50, 50% ингибирующая концентрация, GM-CSF, гранулоцитов и макрофагов колониестимулирующий фактор.
| Образец | B | C | |
| Inter-анализа | |||
| # Определений | 3 | 3 | 3 |
| Среднее значение (% обязательные торможения) | 61,6 | 63,8 | 69,7 |
| Среднее значение (ингибирование% роста) | 21,0 | 73,4 | 82,8 |
| Коэффициент вариации (%) (% обязательные торможения) | 6,0 | 5,6 | 8,3 |
| Коэффициент вариации (%) (торможение% роста) | 64,4 | 18,3 | 10,4 |
И анализы были проведены на 5 нг / мл GM-CSF и концентрации, равной GM-CSF аутоантител.
Таблица 1. Сравнение коэффициент вариации между обязательными процентов, а рост запреты получены с помощью трех независимых экспериментах.
Обсуждение
Бесклеточной анализа оценкам нейтрализующей способности ГМ-КСФ аутоантител с отличной воспроизводимостью и быстротой. Обязательные ингибирования GM-CSF аутоантитела IgG или сыворотке пациента фракций оценивали результаты анализа. Данные показали корреляцию между обязательными тормож...
Раскрытие информации
Благодарности
Мы очень благодарны К. Nakagaki, д-р Х. Ишии, д-р К. Судзуки, А. Ямагата, К. Oofusa за их ценный вклад.
Материалы

Ссылки
- Arai, T. Serum neutralizing capacity of GM-CSF reflects disease severity in a patient with pulmonary alveolar proteinosis successfully treated with inhaled GM-CSF. Respir Med. 98, 1227-1230 (2004).
- Tazawa, R. Granulocyte-macrophage colony-stimulating factor and lung immunity in pulmonary alveolar proteinosis. Am J Respir Crit Care Med. 171, 1142-1149 (2005).
- Inoue, Y. Characteristics of a large cohort of patients with autoimmune pulmonary alveolar proteinosis in Japan. Am J Respir Crit Care Med. 177, 752-762 (2008).
- Uchida, K. High-affinity autoantibodies specifically eliminate granulocyte-macrophage colony-stimulating factor activity in the lungs of patients with idiopathic pulmonary alveolar proteinosis. Blood. 103, 1089-1098 (2004).
- Sakagami, T. Human GM-CSF autoantibodies and reproduction of pulmonary alveolar proteinosis. N Engl J Med. 361, 2679-2681 (2009).
- Raines, M. Identification and molecular cloning of a soluble human granulocyte-macrophage colony-stimulating factor receptor. Proc Natl Acad Sci U S A. 88, 8203-8207 (1991).
- Williams, W., VonFeldt, J., Rosenbaum, H., Ugen, K., Weiner, D. Molecular cloning of a soluble form of the granulocyte-macrophage colony-stimulating factor receptor alpha chain from a myelomonocytic cell line. Expression, biologic activity, and preliminary analysis of transcript distribution. Arthritis Rheum. 37, 1468-1478 (1994).
- Prevost, J. Granulocyte-macrophage colony-stimulating factor (GM-CSF) and inflammatory stimuli up-regulate secretion of the soluble GM-CSF receptor in human monocytes: evidence for ectodomain shedding of the cell surface GM-CSF receptor alpha subunit. J Immunol. 169, 5679-5688 (2002).
- Iizuka, M. Production of a recombinant mouse monoclonal antibody in transgenic silkworm cocoons. FEBS J. 276, 5806-5820 (2009).
- Iizuka, M., Tomita, M., Shimizu, K., Kikuchi, Y., Yoshizato, K. Translational enhancement of recombinant protein synthesis in transgenic silkworms by a 5'-untranslated region of polyhedrin gene of Bombyx mori Nucleopolyhedrovirus. J Biosci Bioeng. 105, 595-603 (2008).
- Zou, W., Ueda, M., Yamanaka, H., Tanaka, A. Construction of a combinatorial protein library displayed on yeast cell surface using DNA random priming method. J Biosci Bioeng. 92, 393-396 (2001).
- Tamura, T. Germline transformation of the silkworm Bombyx mori L. using a piggyBac transposon-derived vector. Nat Biotechnol. 18, 81-84 (2000).
- Tomita, M. Transgenic silkworms produce recombinant human type III procollagen in cocoons. Nat Biotechnol. 21, 52-56 (2003).
- Ogawa, S., Tomita, M., Shimizu, K., Yoshizato, K. Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. J Biotechnol. 128, 531-544 (2007).
- Tomita, M. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon. Transgenic Res. 16, 449-465 (2007).
- Kitamura, T. Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J Exp Med. 190, 875-880 (1999).
- Tanaka, N. Lungs of patients with idiopathic pulmonary alveolar proteinosis express a factor which neutralizes granulocyte-macrophage colony stimulating factor. FEBS Lett. 442, 246-250 (1999).
- Brown, C., Pihl, C., Murray, E. Oligomerization of the soluble granulocyte-macrophage colony-stimulating factor receptor: identification of the functional ligand-binding species. Cytokine. 9, 219-225 (1997).
- Urano, S. A cell-free assay to estimate the neutralizing capacity of granulocyte-macrophage colony-stimulating factor autoantibodies. J Immunol Methods. 360, 141-148 (2010).
- Hayashida, K. Molecular cloning of a second subunit of the receptor for human granulocyte-macrophage colony-stimulating factor (GM-CSF): reconstitution of a high-affinity GM-CSF receptor. Proc Natl Acad Sci U S A. 87, 9655-9659 (1990).
- Hansen, G. The structure of the GM-CSF receptor complex reveals a distinct mode of cytokine receptor activation. Cell. 134, 496-507 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены