Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Methoden zur Untersuchung der neuronalen Morphogenese:
In diesem Artikel
Zusammenfassung
Um eine rasche Beurteilung der Funktion von Genen in der Entwicklung der Hirnrinde führen, beschreiben wir Verfahren, die die Ex vivo Elektroporation von Plasmiden co-exprimieren, inhibitorische RNA (RNAi) und GFP in murinen embryonalen Kortex. Dieses Protokoll ist offen für das Studium der verschiedenen Aspekte der Entwicklung des Nervensystems, wie zB Neurogenese, neuronale Migration und neuronalen Morphogenese einschließlich Dendriten und Axonen Auswuchs.
Zusammenfassung
Die Großhirnrinde leitet höheren kognitiven Funktionen. Diese sechs Schichtstruktur in einer Innenseite-Zuerst-, Außen-letzten Weise, in der die ersten geboren Neuronen bleiben näher an den Ventrikel während die letzten geboren Neuronen an den ersten geboren Neuronen in Richtung der Oberfläche des Gehirns 1 durchwandern erzeugt. Neben der neuronalen Migration 2, ist ein wichtiger Prozess für die normale Funktion der kortikalen Regulation der neuronalen Morphogenese 3. Während die neuronalen Morphogenese in vitro in primären Kulturen untersucht werden können, gibt es viel zu aus, wie diese Prozesse werden im Gewebe reguliert Umgebungen gelernt werden.
Wir beschreiben Techniken, um neuronale Migration und / oder Morphogenese in organotypischen Schnitten der Großhirnrinde 4,6 analysieren. Ein pSilencer modifizierte Vektor verwendet wird, die sowohl eine U6-Promotor, der die doppelsträngige Haarnadel-RNA antreibt und einen separaten Expressionskassette, die GFP-Protein codiert, b angetriebenya CMV-Promotor 7-9. Unser Ansatz ermöglicht die schnelle Beurteilung von Defekten in Neuritenwachstum auf spezifischen Knockdown von Kandidatengenen und wurde erfolgreich in einem Screen für Regulatoren der Neuritenwachstum 8 verwendet. Da nur ein Teil der Zellen die RNAi-Konstrukte zum Ausdruck bringen wird, erlauben die organotypischen Slices für ein Mosaik Analyse der potenziellen Phänotypen. Darüberhinaus ist der Analyse in einem in der Nähe Angleichung der in vivo-Umgebung durchgeführt wird, bietet es eine kostengünstige und schnelle Alternative zur Erzeugung von transgenen oder Knockout-Tieren für Gene unbekannter Kortex. Schließlich, im Vergleich zu in vivo Elektroporation Technologie, ist der Erfolg der Ex-vivo-Elektroporation Experimente nicht auf die Entwicklung von Fähigkeiten beherrschen Operation abhängig und kann mit einer kürzeren Ausbildung Zeit und Geschick durchgeführt werden.
Protokoll
1. Vorbereiten Kultur-Lösungen und Medien (nicht im Video)
- Planen 1 Liter physiologischer Kochsalzlösung vollständiger Hanks-Lösung (HBSS) mit 1x HBSS, 2,5 mM Hepes (pH 7,4), 30 mM D-Glucose, 1 mM CaCl 2, 1 mM MgSO 4 und 4 mM NaHCO 3. Fügen Sie doppelt destilliertem Wasser (ddH 2 O). Filter mit einem 0,2-um-Filter und Speicher bei 4 ° C sterilisieren
- Slice Kulturmedium unter Verwendung von 35 ml Basal Medium Eagle Medium, 12,9 ml vollständigem HBSS, 20 mM D-Glucose (1,35 ml 1 M Lösung), 1 mM Glutamax (0,25 ml einer 200 mM Lösung), 0,5 ml Penicillin Streptomycin-100x Lager. Filter sterilisiert mit einer 0,2-um-Filter, fügen hitzeinaktiviertem Pferdeserum bis zu einer Endkonzentration von 5%.
- Planen Laminin Arbeitslösung durch Herstellung einer 1 mg / ml Stammlösung Laminin mit sterilem destilliertem entionisiertem Wasser. Es werden 100 ul Aliquots in 0,5 ml Eppendorf-Röhrchen und bei -80 ° C einfrieren
- Planen Poly-L-Lysin arbeiten, sosung durch Zugabe von 5 ml sterilem H 2 O bis 5 mg Poly-L-Lysin zu einer 1 mg / ml Stammlösung zu machen. Bereiten Sie 1 mL Aliquots und bei -20 ° C.
- Planen Beschichtungslösung durch Verdünnen von 1 ml Poly-L-Lysin und 100 ul Laminin auf ein Endvolumen von 12 ml mit sterilem Wasser. Machen Sie diese Lösung jedes Mal frisch.
2. Vorbereiten organotypischen Inserts (nicht im Video)
- Bereiten Sie zwei Sechs-Well-Platten mit einem Kultur-Einsatz pro Loch mit einer sterilen Pinzette. Geben Sie 2 ml steriles ddH 2 O unter den Kultur-Einsätze.
- 1 ml der Beschichtungslösung auf der Oberseite der Membran dabei nicht Punktion der Membran. Inkubieren über Nacht in einem befeuchteten Inkubator bei 37 ° C und 5% CO 2.
- Entfernen Beschichtung Medien und Waschen Sie die Membran mit sterilem H 2 0 dreimal. Lassen Einsätze vor Gebrauch trocknen. In 1,8 ml Slice Kulturmedium und in 37 ° C-Inkubator. Wickeln Sie die nicht verwendeten Platten mit Parafilmund lagern bei 4 ° C für bis zu 4 Wochen.
3. Vorbereitung für die Elektroporation (nicht im Video)
- Bereiten Sie RNAi-Konstrukten für die Elektroporation. Doppel-Strang-RNA-Haarnadel-Einsätze wurden in ein pSilencer kloniert. Das Plasmid enthält: 1) eine U6-Promotor, der die Doppelstrang-RNA-Generation antreibt; und 2) eine GFP-Expression Kassette durch den CMV-Promotor 8,9 angetrieben. Dieses Plasmid wurde zuvor von Konishi et al 9 und andere 7,8 beschrieben. Plasmide werden unter Verwendung eines Qiagen Maxi-Prep-Kit, und bei einer Konzentration von 1 mg / ml.
- Um DNA sichtbar während der Injektion ist, bereiten Sie einen 0,5% schnell grünen Farbstoff-Lösung und nutzen es um 1:20 mit der DNA, die injiziert (in der Regel 20 uL von DNA mit 1 ul schnell grün) werden. Links über DNA-grünen Farbstoff schnell Mischung kann bei -20 ° C bis zu einer Woche aufbewahrt werden.
- Saubere Dissektion Bereich, dissecting Werkzeuge und Vibratom Gefäß mit 70% Ethanol. Entspannen komplette HBSS, so dass es eiskalt ist. Gefühlt Vibratom Schiff durch die Verpackung Eis um es im Inneren des Vibratom mit etwas Wasser zum raschen Abkühlen. Bereiten Sie 3% Agarose mit niedrigem Schmelzpunkt mit kompletten HBSS. Mikrowelle für 1 min. Vermeiden Sie zu kochen. An einem 42 ° C im Wasserbad bis zum Gebrauch.
- Die Elektroporation Parameter sind wie folgt festgelegt. Für einen Einsatz E15 Embryo 35 V, 5 Impulse, Länge 100 ms, 900 ms Intervall zwischen den Impulsen. Für ältere Tiere, die Elektroporation gewährleisten, verwenden Sie eine höhere Spannung bis 50 V oder erhöhen Sie die Anzahl der Impulse bis zu 8 Impulse. Um eine Beschädigung des Gewebes bei jüngeren Tieren, verwenden Sie entweder weniger Impulse oder bis zu 2 Pulse und niedrigere Spannung bis zu 25 V. Diese Parameter können variiert werden und empirisch ermittelt abhängig von dem Alter des Tieres.
4. Dissection und Elektroporation (im Video)
- Nach Tötung einer schwangeren Frau, sezieren Embryonen aus in eiskaltes komplette HBSS. Keep jeder Embryo in ihrer individuellen Plazenta-Säcke.
- Sezieren Embryo aus und schnitt den Kopf nach dem ersten Wirbel. Halten Sie in eiskaltem HBSS komplette.
- Für die Injektion setzen Sie den Kopf auf einem Stück Parafilm auf einer Petrischale. Mit maßgeschneiderten Hamilton-Spritze (siehe Tabelle I) injizieren etwa 6 bis 8 &mgr; l DNA: schnell grünen Farbstoff-Mix durch den dritten Ventrikel, um in beiden Seitenventrikel in den kortikalen Vesikel zu füllen. Alternativ kann eine Injektion direkt in jedes lateralen Ventrikel durchgeführt werden.
- Für die Ex-vivo-Elektroporation, verwenden BTX-Pinzette Platinelektroden. Legen Sie die positive Elektrode auf der Seite des Kortex Sie wollen also oben auf dem Kopf für die dorsale Kortikalis elektroporieren.
- Nach der Elektroporation, bebrüten die Köpfe auf Eis für mindestens 5 Minuten vor dem Sezieren.
- Gehirne sezieren in eiskaltem HBSSby er einen kleinen Schnitt an der Seite des Kopfes und Peeling die Haut von den Seiten des Kopfes. Als nächstes wird mitfeinen Pinzette vorsichtig ablösen, der pia aus dem Gehirn. Entfernen Sie das intakte Gehirn aus dem Schädel, dabei nicht auf den Kortex beschädigt werden.
5. Einbetten und Schneiden von elektroporiertem Rinden (im Video)
- Übertragen Sie 3% Agarose mit niedrigem Schmelzpunkt in eine große Form auf Eis gestellt. Der Boden der Form beginnt, wird schneller, die Gehirne von versinkt bis auf den Boden der Form verhindern zu verfestigen. Sanft, übertragen Gehirn mit feinen Pinzetten eins nach dem anderen nach dem Entfernen der überschüssigen Puffer mit einem Kimwipe oder Filterpapier. Verwenden Sie eine 10 ul Pipettenspitze zu wirbeln die Gehirne im Inneren der Form, um maximale Schnittstelle zwischen der Agarose und Hirngewebe zu gewährleisten.
- Orient die Gehirne aller Gehirne zu gewährleisten sind in der gleichen Ausrichtung und bei etwa dem gleichen Niveau in der Agarose. Lassen Sie die Agarose für ca. 5 min zu verfestigen. Verwenden Sie Bindekleber (Crazy Glue), um die Agarose-Blöcke, so dass die Riechkolben werden im Stehen zu befestigen. Sobald die Blöcke angebracht sind, sofort hinzuzufügen ice kaltem HBSS und schneiden Sie die Agarose zu machen, dass einzelne Segmente werden für jedes Gehirn erhalten.
- Um die Blöcke in Scheiben schneiden, legen Sie die Vibratom die Geschwindigkeit auf eine niedrige Geschwindigkeit (etwa die Hälfte des Maximums) und stellen Sie die Klinge Schwingungsfrequenz bei der höchsten Einstellung. Generieren Sie 250-um dicke koronare Scheiben schneiden. Abrufen Scheiben mit einem gebogenen feinen Spatel und übertragen Sie sie auf Gewebe Brunnen mit einem feinen Pinsel oder einer Pinzette.
- In Gewebekulturen Haube, übertragen Scheiben in beschichteten Einsätze. Fügen Sie 500 ul der Scheibe Kulturmedien zu jedem Einsatz, um die Übertragung einfach. Bis zu 5 Scheiben können pro Einsatz gebracht werden. Entfernen Sie überschüssige Medien aus der Oberseite der Scheiben und Inkubation bei 37 ° C in befeuchteten Inkubator.
6. Kultur und Analyse der organotypischen Slices (im Video)
- Um gesund Scheiben zu erhalten, sollte frisches Medium hinzugefügt mindestens jeden zweiten Tag unter der Membran durch den Ersatz der Hälfte der Medien jedes Mal sein.
- Um Scheiben nach dem d analysierenesired Tagen in Kultur, fixieren Scheiben in der Membran. Waschen mit 1x phosphatgepufferte Kochsalzlösung (PBS) bei 37 ° C dreimal für jeweils 10 Minuten Zeit. Als nächstes wird mit 4% Paraformaldehyd (PFA) über Nacht beheben bei 4 ° C oder für 1 Stunde bei Raumtemperatur.
- Scheiben können mit verschiedenen zellulären Marker analysiert werden oder gefärbt mit Hoechst allein zu elektroporierte und nicht-elektroporierten Zellen sichtbar zu machen. Permeabilisieren und blockieren Scheiben für 2 Stunden bei Raumtemperatur mit 10% Ziegenserum, 0,1% Triton in 1 × PBS unter leichtem Schütteln.
- Färbung mit Hoechst für 1 Stunde bei Raumtemperatur, Waschen insgesamt 3 Mal mit 1 × PBS 10 min jeweils unter leichtem Schütteln.
- Für die Montage von Scheiben schneiden die Membran mit einem Skalpell und einer feinen Pinzette verwenden, um die Membran mit Scheiben auf ein Milchglas zu übertragen Folien in einer Wasserkammer. Bis zu 5 Scheiben können pro Objektträger aus Glas gelegt werden. Entfernen Sie überschüssiges Wasser und einen Tropfen Flourmount Lösung in jedes Gehirn in Scheiben schneiden. Vorsichtig einen Deckglas oben auf den Hirnschnitten und entfernen Sie einy Luftblasen. Analysieren Scheiben mit einem konfokalen Mikroskop.
7. Alternative Paraffineinbettung von organotypischen Slices (nicht im Video)
- Organotypische Scheiben auch für Paraffin für eine feinere morphologische Analyse eingebettet werden, zu diesem Zweck die Membran mit den organotypischen Scheiben können in 4% PFA, wie oben beschrieben befestigt werden.
- Die festen Scheiben werden in 1% Agarose (auf 37 ° C vorgewärmt) eingebettet ist, und verfestigt Eis für 30 min. Die Agarose-Blöcke können dann nach in 4% PFA bei 4 ° C für 30 min.
- Die Agarose-Block mit dem organotypischen wird dann in Paraffin eingebettet und verarbeitet werden, wie zuvor für Immunfluoreszenz 10 beschrieben.
8. Repräsentative Ergebnisse
Eine schematische Darstellung der Elektroporation von murinen Cortex und Kultur von organotypischen Schnitten in 1 gezeigt. Diese Methode ist eine nützliche Strategie für rapid Bewertung der Funktion von Genen in der neuronalen Entwicklung 11 verwickelt. Je nach der Menge an DNA elektroporiert und der embryonalen Phase bei Elektroporation, wird die Transfektionseffizienz zu variieren. Scheiben beginnen, die GFP mindestens 8 Stunden nach der Elektroporation und Zellen wird die normale Abfolge der Ereignisse neurogenen (Proliferation, Migration, und Anfang der neuronalen Differenzierung) in Kultur zu unterziehen. Abbildung 2 zeigt ein elektroporierte Hirnschnitt, die Ausdruck einer Kontrolle wird pSilencer-GFP Vektor und kann man beobachten, neuronale Vorläuferzellen, die Migration Neuronen und differenzierten Neuronen in der Scheibe. Organotypische Slices ihrer Morphologie solange behalten, wie sie in einem guten Medien-Luft-Grenzfläche auf den Membranen erhalten werden und auch bis zu mindestens 5 Tagen in Kultur verwendet werden.
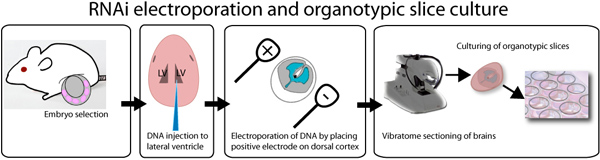
Abbildung 1. Illustration von Ex-vivo-Elektroporation und organotypischenKultur Assay. E14.5 Embryonen sind, präpariert und einzeln mit DNA mit schnellen grünen Farbstoff gemischt injiziert, um die Injektionsstelle zu visualisieren. DNA kann in beiden der lateralen Ventrikel injiziert werden, wie in der Abbildung oder im dritten Ventrikel dargestellt, um der lateralen Ventrikel zu füllen. Nach der Injektion werden Gehirne mit einer Rechteckwelle Elektroporator elektroporiert, indem die positive Elektrode auf der gewünschten Seite des Gehirns. Gehirne werden in 3% Agarose mit niedrigem Schmelzpunkt und geschnitten unter Verwendung eines Vibratom eingebettet. 250 um Hirnschnitten auf 0,4 um Einsätze platziert und bis zu einer Woche kultiviert. GFP nach 8 Stunden nach der Transfektion beobachtet werden.
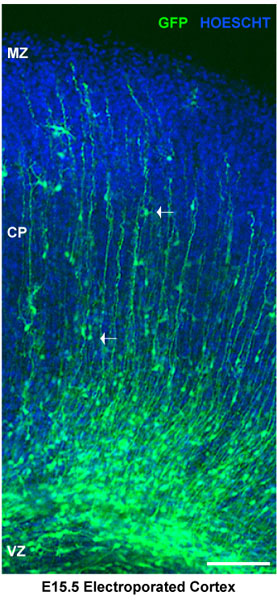
Abbildung 2. Die Analyse der elektroporierte Hirnschnitten. Elektroporiertem Hirnschnitten wurden für Hoechst gefärbt. Dorsale Kortikalis zeigt neuronale Vorläuferzellen elektroporiert bei der ventrikulären Zone (VZ). Neuronen im CortiCAL-Platte (cp) werden begrenzt durch die Randzone (mz). Weiße Pfeile zeigen die Migration Neuronen. In diesem Fall wurden Gehirne von E15.5 injiziert und Elektroporation mit einem GFP-Kontroll-Vektor pSilencer. Die Abschnitte repräsentieren kortikalen Explantate 4 Tage nach der Elektroporation. Maßstabsbalken 100 um.
Fehlerbehebung:
- Niedrige Transfektionseffizienz: Passen Sie die Konzentration von DNA verwendet werden, um mindestens 1 ug / ul. Verwenden Sie immer sehr sauber DNA aus einer Maxi Prep gegebenenfalls Gebrauch eine Endo-free-Kit Quiagen die DNA zu reinigen.
- Zellen in einer anderen Bereich des Gehirns als die gewünschte transfiziert: Sicherstellen, dass die Elektroden korrekt mit der positiven Elektrode in Richtung auf die Seite des Gehirns zu elektroporiert positioniert werden.
- Organotypische Scheiben verlieren Morphologie: Change Medien jeden Tag und sorgen für die Scheiben nicht schwebend in Medien
- Scheiben kommen aus der Agarose, wie sie in der vi geschnitten werdenbratome: Stellen Sie sicher, dass eine gute Schnittstelle gemacht wird, wenn die Einbettung der Gehirne in der Agarose mit niedrigem Schmelzpunkt.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese Verfahren, die die Ex-vivo-Elektroporation von Plasmiden, die doppelsträngige RNA-Haarnadeln 8 und Kultur der organotypischen Slices 4 bieten mehrere deutliche Vorteile. Erstens erlauben diese Methoden für eine schnelle Beurteilung der RNAi-derived Phänotypen. Die Einbeziehung einer Expressionskassette GFP-codierende in der gleichen pSilencer Vektor, der die U6-Promotor, der die doppelsträngige RNA-Haarnadel treibt enthält ermöglicht eine schnelle Identifizierung und Charakteri...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir danken Dr. Shirin Bonni für die Bereitstellung der PSIL-GFP-Konstrukt, Dr. Alper Uzun für die Darstellung von 1, und die Leduc Bioimaging Anlage für die konfokale Mikroskopie. EMM wird durch den Career Award für die medizinische Wissenschaft von der Burroughs Wellcome Fund, ein NARSAD Young Investigators Award und NIH NCRR Cobre RR018728 P20-01 unterstützt. SBL wird durch NIH P20 NCRR Cobre RR018728-01 unterstützt wird, und erhielt Unterstützung von PHS NRSA 5T32MH019118-20.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Hamilton-Spritze | HAMILTON | 80008 | 31 Gauge, 0,5 cm lang, PT-4 (Ebene der Punkt Abschrägung), 10 &mgr; l Volumen |
| Platinum Tweezertrodes | BTX | 45-0489 | 5mm Größe |
| ECM830 Elektroporator | BTX | 45-0002 | |
| BTX-Fußschalter | BTX | 45-0208 | Für den Einsatz mit ECM830 Elektroporator |
| Vibrierender Klinge Mikrotom | LEICA | VT1000 S | |
| 6 - gut zu Gericht mit Beilagen verwenden | FALCON | 353502 | Enthält Kerben auf Einsätze passen |
| Zellkultureinsätze | FALCON | 353090 | 0,4 Mikrometer |
| Fast Green | SIGMA | F7252 | |
| Niedrig schmelzender Agarose | FISHER | BP165-25 | DNA-Klasse |
| Laminin | Sigma-Aldrich | L2020 | |
| Poly-L-Lysin | Sigma-Aldrich | P5899 | |
| Basal Medium Eagle | Sigma Aldrich | B-1522 | |
| 10x HBSS ohne Ca und Mg | GIBCO | 14180-046 | |
| HEPES-freier Säure | Sigma-Aldrich | H4034 |
Referenzen
- Angevine, J. B. Jr, Sidman, R. L. Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature. 192, 766-766 (1961).
- Kriegstein, A. R., Noctor, S. C. Patterns of neuronal migration in the embryonic cortex. Trends Neurosci. 27, 392-392 (2004).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci. 32, 347-347 (2009).
- Haydar, T. F., Bambrick, L. L., Krueger, B. K., Rakic, P. Organotypic slice cultures for analysis of proliferation, cell death, and migration in the embryonic neocortex. Brain Res. Brain Res. Protoc. 4, 425-425 (1999).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. 2002, pl9-pl9 (2002).
- Guerrier, S. The F-BAR domain of srGAP2 induces membrane protrusions required for neuronal migration and morphogenesis. Cell. 138, 990-990 (2009).
- Stegmuller, J. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-389 (2006).
- Sepp, K. J. Identification of neural outgrowth genes using genome-wide RNAi. PLoS Genet. 4, e1000111-e1000111 (2008).
- Konishi, Y. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303, 1026-1026 (2004).
- Vankelecom, H. Fixation and paraffin-embedding of mouse tissues for GFP visualization. Cold Spring Harb Protoc. 2009, 5298-5298 (2009).
- Hand, R. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-45 (2005).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In Utero Electroporation as a Tool for Genetic Manipulation in Vivo to Study Psychiatric Disorders: From Genes to Circuits and Behaviors. Neuroscientist. 18, 169-179 (2012).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten