É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Métodos de Estudo da morfogênese neuronal:
Neste Artigo
Resumo
Para realizar uma avaliação rápida da função de genes no desenvolvimento de córtex cerebral, que descrevem métodos que envolvem a Ex vivo Electroporação de plasmídeos co-expressando RNA inibitória (RNAi) e GFP no córtex embrionário de murídeo. Este protocolo é favorável ao estudo de vários aspectos do neurodesenvolvimento, como neurogênese, migração neuronal e morfogênese neuronal incluindo dendrito e crescimento axonal.
Resumo
O córtex cerebral dirige funções cognitivas superiores. Esta estrutura de seis camadas é gerado no interior um do primeiro, a maneira de fora para último, em que os neurónios primeiros nascidos permanecem mais próximos do ventrículo enquanto que os neurónios últimos nascidos migrar passado os neurónios primeiros nascidos no sentido da superfície do cérebro 1. Além disso a migração neuronal 2, um processo chave para a função cortical normal é a regulação da morfogénese neuronal 3. Enquanto morfogênese neuronal pode ser estudada in vitro em culturas primárias, há muito a ser aprendido a partir de como esses processos são regulados em ambientes de tecido.
Nós descrevemos técnicas para analisar a migração neuronal e / ou morfogénese em fatias organotípicas do córtex cerebral 4,6. Um vetor pSilencer modificado é usado que contém um promotor U6 que impulsiona as duplas de RNA hairpin encalhados e um cassete de expressão separado que codifica a proteína GFP dirigido bya promotor de CMV 7-9. Nossa abordagem permite a rápida avaliação de defeitos no crescimento de neuritos em knockdown específica de genes candidatos e tem sido utilizado com sucesso em uma tela para os reguladores de crescimento neurite 8. Como apenas um subconjunto de células irão expressar as construções RNAi, as fatias organotípicas permitir uma análise do mosaico dos fenótipos potenciais. Além disso, porque esta análise é feita de uma aproximação próxima da ambiente in vivo, ele fornece uma alternativa de baixo custo e rápida para a geração de animais transgénicos ou knockout para os genes de função desconhecida cortical. Finalmente, em comparação com a tecnologia in vivo electroporação, o sucesso de experiências de electroporação ex vivo não é dependente de desenvolvimento proficiente cirurgia habilidade e pode ser realizada com um menor tempo de formação e habilidade.
Protocolo
1. Preparar Soluções Cultura e Mídia (e não em vídeo)
- Prepare 1 litro de solução de Hank completa do sal equilibrada (HBSS) contendo HBSS 1x, 2,5 mM de HEPES (pH 7,4), 30 mM de D-glucose, 1 mM de CaCl2, 1 mM de MgSO4 e 4 mM de NaHCO3. Adicione a água bidestilada (DDH 2 O). Filtrar esterilizar com um filtro de 0,2 mícrons e armazenar a 4 ° C.
- Preparar meio de cultura usando fatia 35 mL de Basal Eagle Médium meios de comunicação, 12,9 mL de HBSS completos, 20 mM de D-glucose (1,35 mL de solução 1 M), 1 mM de Glutamax (0,25 mL de uma solução 200 mM), 0,5 ml de penicilina -estreptomicina estoque 100x. Filtrar esterilizar com um filtro de 0,2 mícrons, em seguida, adicionar calor soro de cavalo inactivado a uma concentração final de 5%.
- Preparar solução de trabalho laminina, fazendo um 1 mg / mL de solução stock laminina com água destilada estéril desionizada. Preparar alíquotas de 100 uL em tubos de 0,5 mL eppendorf e congelar a -80 ° C.
- Prepare Poly-L-lisina de trabalho paralução pela adição de 5 mL de estéril de H2O a 5 mg de poli-L-lisina para fazer uma 1 mg / mL de solução stock. Preparar alíquotas de 1 ml e congeladas a -20 ° C.
- Preparar solução de revestimento por diluição de 1 mL de poli-L-lisina e 100 uL de laminina a um volume final de 12 mL com água estéril. Faça desta nova solução de cada vez.
2. Preparando Insere Slice organotípicas (e não em vídeo)
- Prepare-se dois períodos de seis poços com uma inserção de cultura por bem, usando uma pinça estéril. Adicionar 2 mL de estéril ddH2O debaixo das inserções de cultura.
- Adicionar 1 mL da solução de revestimento no topo da membrana tendo o cuidado de não perfurar a membrana. Incubar durante a noite numa incubadora humidificada a 37 ° C e 5% de CO 2.
- Remova a mídia de revestimento e lave com membrana estéreis H 2 0 três vezes. Deixe insere secos antes do uso. Adicionar 1,8 mL de meio de cultura e fatia lugar em 37 ° C incubadora. Enrole as placas não utilizados com Parafilme armazenar a 4 ° C durante até 4 semanas.
3. Preparando-se para eletroporação (e não em vídeo)
- Prepare construções RNAi para eletroporação. Dupla fita inserções hairpin RNA foram clonados num vector pSilencer. O contém o plasmídeo: 1) um promotor que dirige a U6 duplo filamento geração de RNA, e 2) uma cassete de expressão da GFP conduzida pelo promotor CMV 8,9. Este plasmídeo foi descrito previamente por Konishi e colaboradores 9 e outros 7,8. Os plasmídeos são purificados utilizando um kit Qiagen maxi-prep, e utilizado a uma concentração de 1 mg / mL.
- A fim de visualizar o DNA enquanto injectando-o, preparar uma solução 0,5% de corante verde rápido e usá-lo às 1:20 com o DNA a ser injectado (geralmente 20 uL de ADN com 1 uL de verde rápido). Sobra DNA-rápido mistura corante verde pode ser armazenada a -20 ° C durante até uma semana.
- Área de dissecção Limpo, dissecting ferramentas e vasos vibratome com etanol 70%. Arrefeça HBSS completas de modo que é arrefecida em gelo. Frio navio vibratome por embalagem de gelo ao seu redor dentro do vibratome com um pouco de água para o resfriamento rápido. Preparar 3% de agarose de baixo ponto de fusão usando HBSS completos. Microondas durante 1 min. Evitar o excesso de ebulição. Manter em um banho-maria a 42 ° C até à utilização.
- Eletroporação parâmetros são definidos da seguinte forma. Para um uso de embriões E15 35 V, 5 pulsos, comprimento de 100 ms, 900 ms de intervalo entre os pulsos. Para os animais mais velhos, para assegurar a electroporação, utilizar uma tensão mais elevada até 50 V ou aumentar o número de pulsos até 8 pulsos. Para evitar danificar o tecido em animais jovens, usar pulsos ou menos, ou até 2 leguminosas e inferior de tensão até 25 V. Estes parâmetros podem ser variados e determinada empiricamente, dependendo da idade do animal.
4. Dissecção e eletroporação (em vídeo)
- Após eutanásia de uma mulher grávida, dissecar embriões para fora geladas HBSS completos. Keep cada embrião nos seus individuais sacos da placenta.
- Dissecar embrião fora e cortar a cabeça após a primeira vértebra. Tenha em geladas HBSS completos.
- Para injecção, colocar a cabeça sobre um pedaço de Parafilm no topo de uma placa de Petri. Usando feitos Hamilton seringa (ver Tabela I) injectar cerca de 6-8 ul de DNA: mistura rápida do corante verde através do ventrículo terceiro, a fim de encher, em ambos os ventrículos laterais nas vesículas corticais. Alternativamente, a injecção pode ser feito directamente em cada ventrículo lateral.
- Para a eletroporação in vivo ex, usar eletrodos BTX-pinça de platina. Coloque o eléctrodo positivo para o lado do córtex deseja electroporate topo isto é, da cabeça para o córtex dorsal.
- Após a electroporação, as cabeças incubar em gelo durante pelo menos 5 minutos antes de dissecação.
- Dissecar cérebros em HBSSby gelada de uma pequena incisão na parte lateral da cabeça e descamação da pele fora dos lados da cabeça. Em seguida, compinça fina descascar delicadamente fora da pia do cérebro. Remover o cérebro intacto do crânio, tendo o cuidado para não danificar o córtex.
5. Incorporação e Seccionamento de córtices eletroporados (em vídeo)
- Transferir a 3% de agarose de baixo ponto de fusão dentro de um molde grande colocada em gelo. A parte inferior do molde irá começar a solidificar rapidamente o que irá impedir cérebros de afundar para baixo para o fundo do molde. Suavemente, transferir cérebros com fórceps finos, um por um tampão após a remoção do excesso com uma Kimwipe ou papel de filtro. Usar uma ponta de pipeta 10 uL de redemoinho os cérebros no interior do molde para assegurar a interface entre o máximo de agarose e tecido cerebral.
- Orientar os cérebros para assegurar que todos os cérebros são na mesma orientação e em aproximadamente o mesmo nível no agarose. Deixe a agarose solidificar durante cerca de 5 min. Use substância adesiva (cola maluca) para anexar os blocos de agarose para que os bulbos olfatórios são em pé. Uma vez que os blocos estão ligados, imediatamente adicionar iHBSS ce frio e aparar o agarose para certificar-se fatias individuais são obtidos para cada cérebro.
- Para cortar os blocos, definir a velocidade do vibratome a uma baixa velocidade (cerca de metade do máximo) e definir a freqüência de vibração lâmina na configuração mais alta. Gerar 250-mm de espessura cortes coronais. Recuperar fatias usando uma espátula dobrada bem e transferi-las para poços de tecidos com um pincel fino ou fórceps.
- Em capuz de cultura de tecidos, transferir fatias em pastilhas revestidas. Adicionar 500 ul de meio de cultura de fatia para cada inserção para fazer a transferência fácil. Até 5 fatias pode ser colocado por pastilha. Remover o excesso de mídia do topo das fatias e incubar a 37 ° C em incubadora humidificada.
6. Cultura e Análise de fatias organotípicas (em vídeo)
- A fim de manter fatias saudáveis, meios frescos deve ser adicionado pelo menos um dia todos os outros por baixo da membrana através da substituição de metade dos meios de cada vez.
- A fim de analisar fatias após a ddia esired em cultura, fixar as fatias na membrana. Lavar com 1x tampão salina de fosfato (PBS) a 37 ° C três vezes durante 10 min de cada vez. Em seguida, fixar com paraformaldeído a 4% (PFA) durante a noite a 4 ° C ou durante 1 hora à temperatura ambiente.
- Fatias podem ser analisados com diferentes marcadores celulares ou coradas com Hoechst sozinho para visualizar as células eletroporados e não-electroporado. Permeabilizar e bloquear fatias para 2 h à temperatura ambiente com soro de cabra a 10%, Triton 0,1% em PBS 1x com agitação suave.
- Stain com a Hoechst durante 1 h à temperatura ambiente, lavar 3 vezes com PBS 1x 10 min de cada vez com agitação suave.
- Para montar as fatias cortar a membrana com um bisturi, e usar um fórceps finos para transferir a membrana contendo fatias para um vidro fosco desliza em uma câmara de água. Até 5 fatias pode ser colocado por lâmina de vidro. Retire o excesso de água e adicione uma gota de solução Flourmount a cada fatia do cérebro. Suavemente colocar uma lamela sobre as fatias de cérebro e remover umay bolhas de ar. Analise fatias utilizando um microscópio confocal.
7. Inclusão em Parafina alternativa de fatias organotípicas (e não em vídeo)
- Fatias organotípicas também podem ser incorporados para parafina para uma análise mais fina morfológica, para este fim, a membrana contendo as fatias organotípicas pode ser fixado em 4% PFA como descrito acima.
- As fatias fixos são incorporados em 1% de agarose (pré-aquecido a 37 ° C), e solidificado em gelo durante 30 min. Os blocos de agarose pode então ser pós-fixadas em 4% PFA a 4 ° C durante 30 min.
- O bloco de agarose contendo a fatia organotípico será então embebidos em parafina e processados para imunofluorescência como descrito anteriormente 10.
8. Os resultados representativos
Uma representação esquemática do electroporação de córtex de murino e de cultura de fatias organotípicas é mostrado na Figura 1. Este método é uma estratégia útil para rapid avaliação da função de genes envolvidos no desenvolvimento neuronal 11. Dependendo da quantidade de ADN electroporado eo estágio embrionário em electroporação, a eficiência de transfecção irá variar. Fatias começará expressando GFP, pelo menos, 8 horas após a electroporação e células serão submetidos a sequência normal dos acontecimentos neurogénicos (proliferação, migração e diferenciação neuronal precoce) em cultura. A Figura 2 mostra uma fatia do cérebro electroporado que está expressando um controlo pSilencer-GFP vetor e pode-se observar progenitores neuronais, neurônios que migram e neurônios diferenciados da fatia. Fatias organotípicas irá manter a sua morfologia, enquanto que são mantidas em uma interface de meios de comunicação de ar-boa sobre as membranas e pode ser usado até pelo menos 5 dias em cultura.
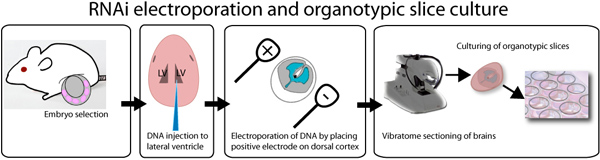
Figura 1. Ilustração de eletroporação in vivo e ex fatia organotípicode cultura de ensaio. E14.5 embriões são dissecados, e individualmente injectados com DNA misturado com corante verde rápido a fim de visualizar o local de injecção. O ADN pode ser injectado em ambos os ventrículos laterais, conforme ilustrado na figura ou no ventrículo terceiro, a fim de encher os ventrículos laterais. Após a injecção, os cérebros são electroporados com um electroporator onda quadrada, colocando o eléctrodo positivo sobre o lado desejado do cérebro. Os cérebros são incorporados em 3% de agarose de baixo ponto de fusão e seccionados usando um vibratome. 250 fatias de cérebro iM são colocados em 0,4 inserções iM e cultivadas até uma semana. GFP pode ser observado após 8 horas pós transfecção.
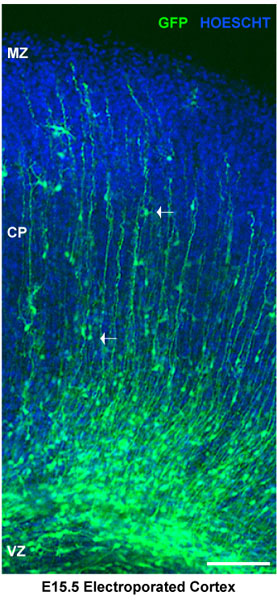
Figura 2. Análise de fatias de cérebro eletroporados. Fatias de cérebro electroporado foram coradas para Hoescht. Córtex dorsal mostra eletroporados progenitores neuronais na zona ventricular (VZ). Neurônios na cortical placa (cp) são delimitadas por a zona marginal (mz). As setas brancas mostram os neurônios que migram. Neste caso, os cérebros foram injectados em E15.5 e electroporado com um vector de controlo pSilencer GFP. As secções representam explantes corticais 4 dias após a electroporação. Barra de escala de 100 um.
Solução de problemas:
- Baixa eficiência de transfecção: Ajustar a concentração de ADN utilizado para pelo menos 1 ug / uL. Sempre use DNA muito limpa a partir de uma preparação maxi se necessário utilizar uma endo-livre Quiagen kit para purificar o DNA.
- As células transfectadas de uma área do cérebro diferente do que o desejado um: Assegure-se que os eléctrodos estão correctamente posicionada e com a posição do eléctrodo positivo para o lado do cérebro a ser electroporado.
- Fatias organotípicas perder morfologia: Troca de mídia a cada dia e garantir que os cortes não estão flutuando na mídia
- Fatias de sair da agarose como eles estão a ser cortada na vibratome: Certifique-se que uma boa interface é feita ao incorporar os cérebros no baixo ponto de fusão de agarose.
Access restricted. Please log in or start a trial to view this content.
Discussão
Estes métodos envolvem a eletroporação ex vivo de plasmídeos codificando a fita dupla de RNA grampos 8 e cultura de fatias organotípicas 4 oferece diversas vantagens. Primeiro, estes métodos permitem uma avaliação rápida de RNAi derivados de fenótipos. A inclusão de uma GFP codificação expressão cassete no vector pSilencer mesmo que contém o promotor U6 que impulsiona o gancho de cabelo de ARN de cadeia dupla permite uma identificação rápida e caracterização de células...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Agradecemos Dr. Shirin Bonni para proporcionar o construto pSil-GFP, Dr. Alper Uzun para a ilustração da Figura 1, e com a instalação bioimaging Leduc para microscopia confocal. EMM é suportado pelo Prémio Carreira para a Ciência Médica da Burroughs Wellcome Fund, uma NARSAD Prêmio jovens investigadores, e NCRR NIH COBRE P20 RR018728-01. SBL é suportado pelo NIH NCRR COBRE P20 RR018728-01, e tem recebido apoio do PHS NRSA 5T32MH019118-20.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Hamilton seringa | HAMILTON | 80008 | 31 gauge, 0,5 centímetros de comprimento, PT-4 (nível de chanfradura ponto), o volume de 10 ul |
| Tweezertrodes Platinum | BTX | 45-0489 | Tamanho 5 milímetros |
| ECM830 electroporator | BTX | 45-0002 | |
| BTX Footswitch | BTX | 45-0208 | Para utilização com ECM830 electroporator |
| Vibratório micrótomo de lâmina | LEICA | VT1000 S | |
| 6 - prato bem para usar com inserções | FALCON | 353502 | Contém entalhes para encaixar inserções |
| Cultura inserções de tecido | FALCON | 353090 | 0,4 micrômetro |
| Verde rápido | SIGMA | F7252 | |
| Baixo ponto de fusão Agarose | FISHER | BP165-25 | DNA grau |
| A laminina | Sigma-Aldrich | L2020 | |
| Poli-L-lisina | Sigma-Aldrich | P5899 | |
| Basal Eagle Médium | Sigma Aldrich | B-1522 | |
| HBSS 10x sem Ca e Mg | GIBCO | 14180-046 | |
| HEPES livre de ácido | Sigma-Aldrich | H4034 |
Referências
- Angevine, J. B. Jr, Sidman, R. L. Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature. 192, 766-766 (1961).
- Kriegstein, A. R., Noctor, S. C. Patterns of neuronal migration in the embryonic cortex. Trends Neurosci. 27, 392-392 (2004).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci. 32, 347-347 (2009).
- Haydar, T. F., Bambrick, L. L., Krueger, B. K., Rakic, P. Organotypic slice cultures for analysis of proliferation, cell death, and migration in the embryonic neocortex. Brain Res. Brain Res. Protoc. 4, 425-425 (1999).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. 2002, pl9-pl9 (2002).
- Guerrier, S. The F-BAR domain of srGAP2 induces membrane protrusions required for neuronal migration and morphogenesis. Cell. 138, 990-990 (2009).
- Stegmuller, J. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-389 (2006).
- Sepp, K. J. Identification of neural outgrowth genes using genome-wide RNAi. PLoS Genet. 4, e1000111-e1000111 (2008).
- Konishi, Y. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303, 1026-1026 (2004).
- Vankelecom, H. Fixation and paraffin-embedding of mouse tissues for GFP visualization. Cold Spring Harb Protoc. 2009, 5298-5298 (2009).
- Hand, R. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-45 (2005).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In Utero Electroporation as a Tool for Genetic Manipulation in Vivo to Study Psychiatric Disorders: From Genes to Circuits and Behaviors. Neuroscientist. 18, 169-179 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados