Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методы изучения морфогенеза нейронов:
В этой статье
Резюме
Для проведения экспресс-оценки функции генов в развитии коры головного мозга, мы опишем методы, связанные с Бывший естественных условиях Электропорации плазмид совместно выразить тормозные РНК (РНК-интерференции) и GFP в мышиных эмбриональных мозга. Этот протокол поддается изучению различных аспектов развития нервной системы, таких как нейрогенез, миграцию нейронов и нейронных морфогенеза в том числе дендритов и аксонов результат.
Аннотация
Кора головного мозга направляет высших когнитивных функций. Это шесть слоистая структура создается в в первой, за пределами последней манере, в которой родился первый нейроны остаются ближе к желудочка в то время как последний родился нейроны мигрировать прошлом первенца нейронов на поверхности мозга 1. В дополнение к миграции нейронов 2, ключевой процесс для нормальной корковой функции регуляции морфогенеза нейронов 3. В то время как нейронные морфогенеза могут быть изучены в пробирке в первичных культурах, есть много можно извлечь из того, как эти процессы регулируются в тканях среды.
Мы опишем методы для анализа миграции нейронов и / или морфогенеза в органотипической кусочки коры головного мозга 4,6. PSilencer изменение вектора используется в который входят и промоутер U6, которая управляет двухцепочечной РНК шпильку и отдельные кассеты выражение, которое кодирует белок GFP приводом бя CMV промотора 7-9. Наш подход позволяет оперативно оценить дефекты в аксонов от конкретных нокдауна генов-кандидатов и успешно используется в экран для регуляторов аксонов 8. Потому что только часть клеток будет выражать RNAi конструкции, органотипической ломтиками позволяет мозаика анализ потенциальных фенотипов. Кроме того, поскольку этот анализ делается в ближайшем приближении в окружающую среду естественных условиях, он обеспечивает низкую стоимость и быстрая альтернатива поколение трансгенных животных или нокаут генов неизвестных корковых функций. Наконец, в сравнении с технологией электропорации в естественных условиях, успех бывшего экспериментов электропорации естественных условиях не зависит от развития навыков опытными хирургии и может быть выполнена с более короткие сроки подготовки и повышения квалификации.
протокол
1. Подготовка решения культуры и средств массовой информации (не видео)
- Подготовить 1 л сбалансированный солевой Полный Хэнка решение (HBSS), содержащий 1x HBSS, 2,5 мм Hepes (pH7.4), 30 мМ D-глюкозы, 1 мМ CaCl 2, 1 мМ MgSO 4 и 4 мМ NaHCO 3. Добавить бидистиллированной воды (DDH 2 O). Фильтр стерилизовать с 0,2-мкм фильтр и хранят при температуре 4 ° C.
- Подготовить часть культуры среде с использованием 35 мл основной среды Eagle СМИ, 12,9 мл Полный HBSS, 20 мМ D-глюкозы (1,35 мл 1 М раствора), 1 мМ Glutamax (0,25 мл 200 мМ раствора), 0,5 мл пенициллина стрептомицин-100x акций. Фильтр стерилизовать с 0,2-мкм фильтр, а затем добавить тепла инактивированной лошадиной сыворотки до конечной концентрации 5%.
- Подготовить Ламинин рабочего раствора, делая 1 мг / мл Ламинин маточного раствора стерильной дистиллированной деионизированной водой. Подготовить 100 мкл аликвоты в 0,5 мл пробирок Эппендорф и заморозить при температуре -80 ° C.
- Подготовка поли-L-лизин работает такlution добавлением 5 мл стерильной H 2 O до 5 мг поли-L-лизин, чтобы сделать 1 мг / мл маточного раствора. Подготовить 1 мл аликвоты и заморозить при температуре -20 ° C.
- Подготовить раствор для покрытия путем разбавления 1 мл поли-L-лизина и 100 мкл ламинин до конечного объема в 12 мл стерильной воды. Сделать это решение каждый раз свежее.
2. Подготовка органотипической вставки фрагментов (не видео)
- Приготовьте два шесть и плит с одной культуры на вставки и использование стерильных щипцов. Добавить 2 мл стерильной DDH 2 O под культурой вставками.
- Добавить 1 мл раствора для нанесения покрытия на верхней части мембраны, стараясь не проколоть мембрану. Выдержите в течение ночи в увлажненном инкубаторе при температуре 37 ° С и 5% CO 2.
- Удалите покрытие СМИ и мыть мембраны стерильной H 2 0 три раза. Давайте вставки сухой перед использованием. Добавить 1,8 мл кусочек культуральной среде и в 37 ° C инкубатора. Оберните неиспользованных плит с парафильмоми хранят при температуре 4 ° С до 4 недель.
3. Подготовка к Электропорация (не видео)
- Подготовить RNAi конструкции для электропорации. Двухместные вставки цепи РНК шпилька были клонированы в pSilencer вектор. Плазмида содержит: 1) промоутер U6, которая управляет двойной нити РНК поколения и 2) Кассета GFP выражении обусловлен промоутер ЦМВ 8,9. Эта плазмида ранее описываемых Кониши и коллеги 9 и другие 7,8. Плазмиды очищены использованием Qiagen макси-подготовительные комплект, и используется в концентрации 1 мг / мл.
- Для того, чтобы визуализировать ДНК при введении его, подготовить 0,5% быстрый зеленый раствор красителя и использовать его в 1:20 с ДНК для инъекций (обычно 20 мкл ДНК с 1 мкл быстро зеленый). Остатки ДНК быстро зеленый краситель смесь можно хранить при температуре от -20 ° C до недели.
- Чистая площадь вскрытия, dissectiнг инструменты и vibratome судно с 70% этанола. Холод полный HBSS так, чтобы она ледяным холодом. Холод vibratome судна упаковки лед вокруг него внутри vibratome с небольшим количеством воды для быстрого охлаждения. Подготовить 3% с низкой температурой плавления агарозы использованием полного HBSS. Микроволновая течение 1 мин. Избегайте чрезмерного кипения. Имейте в 42 ° С водяной бане до использования.
- Электропорация параметры задаются следующим образом. Для использования эмбрионов E15 35 V, 5 импульсов, длина 100 мс, 900 мс, интервал между импульсами. Для пожилых животных, для обеспечения электропорация, использовать более высокое напряжение до 50 В или увеличить количество импульсов до 8 импульсов. Чтобы не повредить ткани у молодых животных, использовать или меньше импульсов или до 2 импульсов и низкого напряжения до 25 В. Эти параметры могут быть изменены и определяется опытным путем в зависимости от возраста животного.
4. Вскрытие и Электропорация (в видео)
- После эвтаназии беременных женщин, анализировать эмбрионов из в ледяной полный HBSS. Keер каждый эмбрион в своем личном плацентарный мешков.
- Проанализируйте эмбрион, и отсекли голову после первого позвонка. Имейте в ледяной полный HBSS.
- Для инъекций, поместить голову на кусок парафильмом в верхней части чашки Петри. Использование заказ Гамильтон шприц (см. таблицу I) вводят около 6 до 8 мкл ДНК: быстрый зеленый краситель смесь через третий желудочек, чтобы заполнить обе боковых желудочков в корковых пузырьков. Кроме того, инъекция может быть сделано непосредственно в каждой боковой желудочек.
- Для экс электропорации естественных условиях, использовать BTX-пинцет платиновыми электродами. Поместите положительного электрода в сторону коры вы хотите electroporate т.е. верхней части головы для спинного мозга.
- После электропорации, инкубировать руководителей на льду в течение по крайней мере, 5 минут до вскрытия.
- Проанализируйте мозги в ледяной HBSSby сделав небольшой разрез на боковой части головы и шелушение кожи по бокам головы. Далее, сштрафа щипцы осторожно удаляйте мягкой из мозга. Удалить нетронутым мозг от черепа, стараясь не повредить кору.
5. Вложения и секционирования электропорации коры (в видео)
- Передача 3% с низкой температурой плавления агарозы в большую форму помещают на лед. В нижней части формы начнет затвердевать быстрее, что позволит предотвратить мозг от опускаясь на дно формы. Осторожно, передают мозгу с мелким пинцетом по одному после удаления избытка буфер Kimwipe или фильтровальную бумагу. Используйте 10 мкл наконечник пипетки в водоворот мозги в форму для обеспечения максимального взаимодействия между агарозы и ткани головного мозга.
- Восток мозги, чтобы обеспечить все мозги в той же ориентации и примерно на том же уровне в агарозы. Пусть агарозном укрепить в течение примерно 5 мин. Использование клея (клей сумасшедший), чтобы присоединить агарозном блоки таким образом, что обонятельные луковицы стоя. Когда блоки крепятся сразу добавить ясе холодным HBSS и обрезать агарозном чтобы убедиться, что отдельные кусочки получаются для каждого мозга.
- Чтобы нарезать блоки, установить скорость vibratome на низкой скорости (около половины от максимума) и установить лезвие вибрации на максимальных настройках. Создание 250-мкм корональных ломтиками. Получение срезов при использовании изогнутой тонкой лопаточкой и передавать их на ткани скважин с тонкой кисточкой или щипцами.
- В тканях капот культуры, передача кусочки в покрытие вставками. Добавить 500 мкл среды часть культуры каждой вставки, чтобы сделать передачу легко. До 5 ломтиков могут быть размещены на вставке. Удалите излишки средств массовой информации в верхней части ломтиками и инкубировать при температуре 37 ° C в увлажненном инкубаторе.
6. Культура и анализ органотипической фрагментов (в видео)
- Для того, чтобы поддерживать здоровый ломтиками, свежие средства массовой информации следует добавить по крайней мере, через день под мембрану заменить половину средств массовой информации каждый раз.
- Для того чтобы проанализировать кусочки после того, как гesired дней культуры, исправить кусочки в мембране. Промыть 1x фосфат солевом буфере (PBS) при 37 ° С три раза в течение 10 минут каждый раз. Далее, фиксируем с 4% параформальдегид (PFA) в течение ночи при температуре 4 ° С или в течение 1 часа при комнатной температуре.
- Фрагменты могут быть проанализированы с различных клеточных маркеров или окрашенные Hoechst только визуализировать электропорации и не электропорации клеток. Permeabilize и блокировать кусочками в течение 2 часов при комнатной температуре с 10% сыворотки козьего, 0,1% тритона в 1x PBS с нежным тряски.
- Пятно с Hoechst в течение 1 часа при комнатной температуре, промыть 3 раза 1x PBS 10 минут каждый раз, с нежным тряски.
- Для установки ломтиками резать мембраны с помощью скальпеля, а также использовать тонкий пинцет для передачи мембраной, содержащей срезы матовое стекло скользит в воде камеру. До 5 ломтиков могут быть размещены на стекле. Удалите излишки воды, и добавить каплю Flourmount решение каждой мозга срез. Аккуратно поместите покровное в верхней части мозга ломтиками и удалитеу пузырьков воздуха. Анализ ломтиками помощью конфокальной микроскопии.
7. Внедрение альтернативных парафин из органотипической фрагментов (не видео)
- Органотипической ломтиками может быть встроен в парафин для тонких морфологического анализа, с этой целью мембраной, содержащей органотипической кусочки могут быть зафиксированы в 4% PFA, как описано выше.
- Фиксированные кусочки встроенные в 1% агарозном (предварительно нагревают до 37 ° C), а также укрепили во льду в течение 30 мин. Агарозном блоков может быть после фиксировали в 4% PFA при 4 ° С в течение 30 мин.
- Блок агарозном содержащие органотипической часть будет затем заливали в парафин и обрабатываются для иммунофлуоресценции, как описано выше 10.
8. Представитель Результаты
Схематическое изображение электропорации мышей коры и культуры органотипической ломтиками показано на рисунке 1. Этот метод является полезным стратегии RAPIг оценки функции генов, вовлеченных в развитие нейронов 11. В зависимости от количества ДНК электропорации и эмбриональной стадии электропорации, эффективность трансфекции будет меняться. Ломтики начнет выражения GFP не менее 8 часов после электропорации и клетки будут проходить обычную последовательность событий нейрогенный (пролиферации, миграции, и в начале дифференциации нейронов) в культуре. На рисунке 2 показан электропорации часть мозга, которая выражает контроль pSilencer-GFP вектора и можно наблюдать нейронных предшественников, миграцию нейронов и дифференцированных нейронов в срезе. Органотипической ломтики будут держать их морфологии, если они поддерживаются в хорошем медиа-воздух на мембранах и может быть использован по крайней мере до 5 дней в культуре.
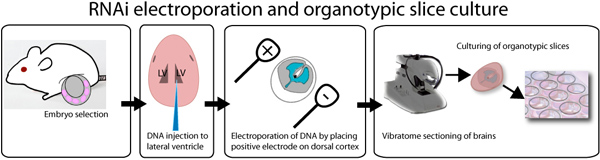
Рисунок 1. Иллюстрация бывшего электропорации естественных и органотипической частькультура анализа. E14.5 эмбрионов иссекали, так и индивидуально вводили ДНК смешивается с быстрым зеленого красителя для визуализации месте инъекции. ДНК может быть введен в обоих боковых желудочков, как показано на рисунке или в третий желудочек, чтобы заполнить боковых желудочков. После инъекции мозги электропорации с квадратным электропоратора волны, размещение на положительном электроде в нужную сторону мозга. Мозги встроенные в 3% с низкой температурой плавления агарозы и секционные помощью vibratome. 250 мкм кусочки мозга помещают на 0,4 мкм вставками и культивировали в течение недели. GFP можно наблюдать через 8 часов после трансфекции.
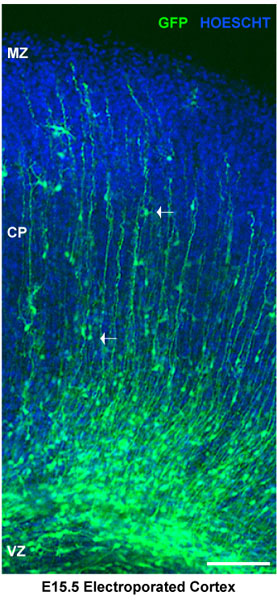
Рисунок 2. Анализ электропорации кусочки мозга. Электропорации кусочки мозга были окрашены для Hoescht. Спинной коры показывает электропорации нейронных предшественников в желудочковой зоны (ВЗ). Нейроны в Кортикал пластины (ф) ограничиваются маргинальной зоны (МЗ). Белые стрелки показывают миграцию нейронов. В этом случае мозг вводили в E15.5 и электропорации с векторным управлением pSilencer GFP. Разделы представляют собой корковый эксплантов через 4 дня после электропорации. Шкала бар 100 мкм.
Устранение неполадок:
- Низкая эффективность трансфекции: Регулировка концентрации ДНК использовали по крайней мере, 1 мкг / мкл. Всегда используйте очень чистой ДНК из макси подготовительные при необходимости использования эндо-бесплатно Quiagen комплект для очистки ДНК.
- Клетки трансфекции в другой области мозга, чем хотелось бы: Убедитесь, что электроды расположены правильно с положительным электродом позиции в сторону мозга для электропорации.
- Органотипической ломтики потеряют морфологии: Изменение СМИ каждый день, и обеспечить кусочки не плавают в СМИ
- Ломтики оторваться агарозы как они сокращаются в VIbratome: Убедитесь, что хороший интерфейс сделан, когда вложение мозгов в низкой температурой плавления агарозы.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Эти методы, связанные с бывшим электропорации естественных плазмид кодирования двухцепочечной РНК шпильки 8 и культуры органотипической ломтиками 4 обеспечивают несколько явных преимуществ. Во-первых, эти методы позволяют быстро оценить RNAi производных фенотипо?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы благодарим доктора Ширин Бонни для обеспечения pSil-GFP конструкции, доктор Альпер Узун для иллюстрации на рисунке 1, а Ледюк объекта Bioimaging для конфокальной микроскопии. EMM поддерживает Карьера премии за медицинской науки от Burroughs Wellcome Фонд NARSAD премия для молодых исследователей и NIH NCRR Кобре P20 RR018728-01. SBL поддерживается NIH NCRR Кобре P20 RR018728-01, и получил поддержку со стороны PHS НРСА 5T32MH019118-20.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Гамильтон шприц | HAMILTON | 80008 | 31 датчика, 0,5 дюйма длиной, ПТ-4 (уровень точки фаски), 10 мкл объема |
| Платиновый tweezertrodes | BTX | 45-0489 | 5 мм, размер |
| ECM830 электропоратора | BTX | 45-0002 | |
| BTX переключатель | BTX | 45-0208 | Для использования с ECM830 электропоратора |
| Вибрационный лезвие микротома | LEICA | VT1000 S | |
| 6 - и блюдо для использования с вставками | FALCON | 353502 | Содержит вырезы, чтобы соответствовать вставками |
| Вставками культуры ткани | FALCON | 353090 | 0,4 мкм |
| Быстрый зеленый | SIGMA | F7252 | |
| Низкой температурой плавления агарозы | FISHER | BP165-25 | ДНК класса |
| Ламинин | Sigma-Aldrich | L2020 | |
| Poly-L-лизин | Sigma-Aldrich | P5899 | |
| Базальной среды Eagle | Sigma Aldrich | B-1522 | |
| HBSS 10x без кальция и магния | GIBCO | 14180-046 | |
| HEPES-свободной кислоты | Sigma-Aldrich | H4034 |
Ссылки
- Angevine, J. B. Jr, Sidman, R. L. Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature. 192, 766-766 (1961).
- Kriegstein, A. R., Noctor, S. C. Patterns of neuronal migration in the embryonic cortex. Trends Neurosci. 27, 392-392 (2004).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci. 32, 347-347 (2009).
- Haydar, T. F., Bambrick, L. L., Krueger, B. K., Rakic, P. Organotypic slice cultures for analysis of proliferation, cell death, and migration in the embryonic neocortex. Brain Res. Brain Res. Protoc. 4, 425-425 (1999).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. 2002, pl9-pl9 (2002).
- Guerrier, S. The F-BAR domain of srGAP2 induces membrane protrusions required for neuronal migration and morphogenesis. Cell. 138, 990-990 (2009).
- Stegmuller, J. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-389 (2006).
- Sepp, K. J. Identification of neural outgrowth genes using genome-wide RNAi. PLoS Genet. 4, e1000111-e1000111 (2008).
- Konishi, Y. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303, 1026-1026 (2004).
- Vankelecom, H. Fixation and paraffin-embedding of mouse tissues for GFP visualization. Cold Spring Harb Protoc. 2009, 5298-5298 (2009).
- Hand, R. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-45 (2005).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In Utero Electroporation as a Tool for Genetic Manipulation in Vivo to Study Psychiatric Disorders: From Genes to Circuits and Behaviors. Neuroscientist. 18, 169-179 (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены