Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Phänotypische und funktionelle Charakterisierung von Endothelial Kolonie-bildenden Zellen aus humanem Nabelschnurblut
In diesem Artikel
Zusammenfassung
Endothelial Kolonie-bildenden Zellen (ECFCs) im Umlauf Endothelzellen mit robusten klonale proliferative Potential zeigen, dass intrinsische In-vivo- Gefäß bildet Fähigkeit. Phänotypische und funktionelle Charakterisierung von Auswuchs Endothelzellen aus CB abgeleitet sind wichtig zur Identifizierung und Isolierung Bona fide ECFCs für mögliche klinische Anwendung bei der Reparatur von beschädigtem Gewebe.
Zusammenfassung
Langjährige Blick auf die Bildung neuer Blutgefäße durch Angiogenese, Vaskulogenese und Arteriogenese wurden vor kurzem 1 bewertet. Die Anwesenheit von zirkulierenden endothelialen Vorläuferzellen (EPCs) wurden erstmals im erwachsenen menschlichen peripheren Blut von Asahara et al. In 1997 2 bringt eine Infusion von neuen Hypothesen und Strategien für die vaskuläre Regeneration und Reparatur. EPCs sind selten, aber normale Bestandteile des zirkulierenden Blutes, dass die Heimat von Seiten der Bildung von Blutgefäßen oder vaskuläre Remodeling, und erleichtern Sie entweder postnatalen Vaskulogenese, Angiogenese, Arteriogenese oder zum größten Teil über parakrine Stimulation der bestehenden Gefäßwand-Zellen abgeleitet sind 3. Keine spezifische Marker zu identifizieren, einen EPC identifiziert wurde, und zur Zeit der Zustand des Feldes ist es, dass zahlreiche Zelltypen, einschließlich proangiogenen hämatopoetischen Stamm-und Vorläuferzellen zu verstehen, zirkulierenden angiogenen Zellen, Tie2 + Monozyten, myeloischen Vorläuferzellen cells, Tumor-assoziierte Makrophagen und aktivierten Makrophagen M2 bei der Stimulierung der angiogenen Prozess in verschiedenen präklinischen Tiermodellsystemen und beim Menschen in zahlreichen Erkrankungen 4, 5 teilnehmen. Endothelial Kolonie-bildenden Zellen (ECFCs) sind selten zirkulierenden lebensfähigen Endothelzellen durch robuste klonale Proliferationspotential, sekundäre und tertiäre Koloniebildungsfähigkeit auf Wiederplattieren und Fähigkeit zur Bildung von Gefäßen in vivo nach der Transplantation intrinsischen in immundefizienten Mäusen 6-8, dadurch gekennzeichnet. Während ECFCs wurden erfolgreich aus dem peripheren Blut von gesunden erwachsenen Probanden, Nabelschnurblut (CB) von gesunden Neugeborenen und Gefäßwand von zahlreichen menschlichen arteriellen und venösen Gefäße 6-9 isoliert, besitzt CB die höchste Frequenz von 7 ECFCs dass Display die robusteste klonale proliferative Potenzial und Form robuste und funktionelle Blutgefäße in vivo 8, 10-13. Während die AbleitungECFC aus adulten peripheren Blut wurde 14, 15 vorgestellt, hier haben wir die Methoden für die Ableitung beschreiben, Klonen, Expansion und in vitro sowie in vivo Charakterisierung ECFCs aus der humanen Nabelschnur CB.
Protokoll
Reagenzien und Lösungen
EMG-2-Medien (Lonza, Cat. No CC-3162 mit EBM-2 Basalmedium und EGM-2 SingleQuot Kit Ergänzungen, und Wachstumsfaktoren)
EBM-2 (Lonza, Cat No. Cc-3156) mit dem gesamten SingleQuot Kit ergänzt und Wachstumsfaktoren ergänzt (Lonza, Cat No. Cc-4176), 10% (v / v) fötales Rinderserum (FBS) und 1% (v / v) Penicillin (10000 U / ml) / Streptomycin (10.000 g / ml) / Amphotericin (25 ug / ml). Speichern Sie bis zu 1 Monat bei 4 ° C Empfohlen EGM-2 Bände für ECFC Kultur verwenden sind 500 ul / Well für 24-Well-Platten, 2 ml / Vertiefung für 6-well Platten, 5ml/25-cm 2 Flaschen und 10 ml/75-cm 2 Flaschen, es sei denn, sonst im Protokoll angegeben.
Kollagen I-Lösung
Verdünnen 0,575 ml Eisessig (17.4N) in 495 ml sterilem destilliertem Wasser (0,02 N Endkonzentration). Sterilfilter die verdünnte Essigsäure mit einem 0,22-um-VACuum Filtersystem. In 25 mg Rattenschwanzkollagen ich zum verdünnter Essigsäure auf eine Endkonzentration von 50 ug / ml. Die Menge an Kollagen hinzugefügt wird abhängig von der Stoffkonzentration Kollagen. Speichern Sie bis zu einem Monat bei 4 ° C
Herstellung von Kollagen I-beschichteten Gewebekulturplatten Oberflächen
1 ml der Kollagen I-Lösung in jede Vertiefung einer 6-well Gewebekulturplatte (verwenden 300 ul / Well für 24-Well-Platten, 3ml/25-cm 2 Flaschen und 8 ml/75-cm 2 Flaschen). Inkubieren 1 Stunde bis über Nacht bei 37 ° C Entfernen Sie die Kollagen-I-Lösung und waschen Fläche zwei Mal, jedes Mal mit PBS (verwenden 500 ul / Well für 24-Well-Platten, 2 ml / Vertiefung für 6-well Platten, 5ml/25-cm 2 Flaschen und 10 ml/75 cm 2-Kolben). Verwenden Platten sofort für Zellkulturen.
FACS-Färbung Puffer
Phosphat-gepufferte Salzlösung (PBS) mit 2% (v / v) fötales Rinderserum (FBS) ergänzt. Shop up bis 2 Wochen bei 4 ° C
A. ECFC Auswuchs, Klonierung und Expansion
- Sammle CB mit Heparin (10 U Heparin / ml Blut) oder EDTA als Antikoagulans und Transport ins Labor bei Raumtemperatur und sofort (innerhalb von 2 Stunden Säuglings Lieferung) Prozess der Probe für mononukleären Zellen (MNC) Isolation.
- Aliquot von 15 ml in jede CB 50-ml konischen Zentrifugenröhrchen eingewogen und mit 20 ml PBS in jedes Röhrchen von CB und Pipette mehrmals zu mischen. Zeichnen Sie bis 15 ml Ficoll-Paque in einen 20-ml-Spritze eine 20G Nadel oder Mischkanüle. Setzen Sie die Spitze der Mischkanüle an der Unterseite des Rohres verdünntes Blut und sorgfältig zu unterlegen 15 ml Ficoll-Pague. Die Röhrchen 30 min bei 740 × g bei Raumtemperatur, ohne die Verzögerung Bremseinstellung.
- Mit einer Pipette, entfernen Sie das trübe Schicht von Low-Density-Multis an der Schnittstelle zwischen der Ficoll-Paque und verdünnte Plasma entfernt. Pipettieren Sie die multinationalen Unternehmen in einem 50-ml konischen Röhrchen containing 10 ml EGM-2 Medium. Zentrifugieren Sie die MNU 10 min bei 515 xg bei Raumtemperatur, mit einer hohen Verzögerung Bremse Einstellung.
- Vorsichtig absaugen und den Überstand verwerfen. Waschen Sie die pelletierten Zellen mit EGM-2 zweimal (10 min bei 515 xg) und erneut zu suspendieren die multinationalen Unternehmen in EGM-2 bei 1,25 x 10 7 Zellen / ml. Bereiten Kollagen I beschichteten 6-well-Zellkulturplatten durch Zugabe von 1 ml Rattenschwanz Kollagen Typ I (50 ug / ml) pro Well und Inkubation der Platte über Nacht. Pipette 4 ml dieser MNC Suspension in jede Vertiefung gegeben und stellen die Zellen bei 37 ° C, 5% CO 2 befeuchteten Inkubator. A.1.5) Nach 24 Stunden (Tag 1), langsam entfernen Sie die verbrauchte Medium (nicht zu stören lose anhaftenden Zellen) aus dem Brunnen mit einer Pipette, langsam 4 ml EGM-2 zu dem Brunnen zurück und Platte in den Inkubator . An Tag 2, aktualisieren Sie die Medium durch langsames Entfernen des Mediums (nicht zu stören lose anhaftenden Zellen) aus dem Brunnen mit einer Pipette und Zugabe von 4 ml EGM-2 in jede Vertiefung. Wiederholen Sie das Medium ändert sich täglich until Tag 7 und jeden zweiten Tag danach, bis ECFC Kolonien erscheinen für das Klonen. Typischerweise Kolonien erscheinen zwischen Tag 5 und Tag 14 Tage 7 (Abb. 1).
- Visualisieren Sie typische ECFC Kolonien mit Kopfsteinpflastermorphologie mit inversen Mikroskop (Vergrößerung 10x) und markieren die Grenzen Kolonie mit einer Markierung auf der Unterseite des Brunnens, um die Position der einzelnen Kolonie zeigen.
- Am Tag 14, waschen Sie diesen primären Kolonien 2 mal mit PBS und Ernte einzelnen Kolonien mit Klonzylinder und gerade genug TrypLE Express, um die Zellen in den Zylindern zu decken. Nach Absaugen der letzten Wäsche von PBS, legen Sie eine sterile Gel beschichtet Klonen Zylinder um jede Kolonie, und drücken Sie fest auf die Platte mit Hilfe einer sterilen Pinzette. 2-3 Tropfen einer warmen TrypLE Express in jeden Zylinder das Klonen und inkubieren Sie für 3-5 Minuten, bis die Zellen in dem Zylinder beginnen zu lösen. In etwa 250 ul EGM-2-Medium in der Mitte des Zylinders und und Abpipettieren bis generate Einzelzellsuspension. Übertragen der Einzelzellsuspension aus jedem Zylinder einzeln Klonierung in einen einzelnen Mikro-Zentrifugenröhrchen.
- Waschen Sie den Bereich innerhalb der Zylinder 2-3 mal mit ca. 250 ul EGM-2 Medium, um alle weiteren Zellen zu sammeln und übertragen Sie die Wäsche aus jedem Zylinder in die jeweilige Mikro-Zentrifugenröhrchen. Zentrifugation der Zellen mit hoher Geschwindigkeit (≤ 300 × g) auf Tischzentrifuge für 5 min.
- Entfernen Sie den Überstand und resuspendieren das Zellpellet in 1,5 ml frisches EGM-2 Medium. Übertragen der Zellsuspension (welche alle die Zellen aus einzelnen Kolonien) von jedem Rohr in eine Vertiefung einer 24-Well-Gewebekulturplatte vorbeschichtet mit 500 ul Rattenschwanz Kollagen I (50 ug / ml).
- Platz im Inkubator für die Erweiterung mit Medien ändern sich jeden zweiten Tag durchgeführt.
- Wenn die Zellen 80-90% Konfluenz nähern, entfernen Sie die verbrauchte Medium waschen dann die Zellen 2 mal mit PBS und fügen 500 ul TrypLE Express Medium in jede Vertiefungvon 24-Well-Gewebekulturplatte. Die Platte im Inkubator für 3-5 Minuten, bis die Zellen zu vervollständigen und zu lösen beginnen. 1 ml der EGM-2 (mit 10% FBS definiert) in jede Vertiefung, um die Zellen durch Waschen sammeln und übertragen Sie sie auf einem 15 ml-Tube. Waschen Sie das auch mit 1 ml EGM-2 Medium, um alle weiteren Zellen zu sammeln und übertragen Sie die Wäsche aus jeder Vertiefung in die jeweiligen 15 ml Tube. Zentrifugation der Zellen bei 300 g für 5 min.
- Entfernen Sie das Medium erneut zu suspendieren und das Zellpellet in 1 ml frischem EGM-2 Medium (mit 10% FBS definiert). Erhalten der Zahl lebensfähiger Zellen eines Aliquots unter Verwendung eines Hämozytometers und Trypanblau-Ausschluss.
- Erweitern Sie die Zellen durch Impfen etwa 5000 Zellen / cm 2 auf einer Kollagen I vorbeschichtete Gewebekultur Oberflächen in EGM-2-Medien mit Medien verändern jeden zweiten Tag, bis die Zellen 80-90% Konfluenz vor Subkultivieren wieder zu nähern.
B. In-vitro-Phänotypische Charakterisierung von ECFCs: Endothelzelloberfläche Antigen-Expression eind Single Cell-Assay für Klonale Proliferationspotential
- Für endothelialen Zelloberflächen-Antigen Ausdruck, lösen Zellen mit TrypLE Express auf Zellen unter Verwendung von Methoden zur Klonierung und Expansion ECFC beschrieben zu sammeln.
- Resuspendieren Zellen in FACS-Färbung Puffer (10 x 10 6 Zellen / 1ml FACS-Puffer) fügen Sie dann FcR Blockierungsreagenz (20 ul / 10 x 10 6 Zellen), vorsichtig durchmischen und auf Eis für 10 min.
- 100 ul Aliquot dieser Zellsuspension in der Mikro-Zentrifugenröhrchen für jeden endotheliale Oberflächen-Antigen und Isotypkontrollen. Fügen Sie entsprechende Menge an Fluorochrom markiert humane monoklonale Antikörper, die endotheliale Antigene (CD31, CD144, CD146, CD105 und) oder hämatopoetische Antigene (CD45, CD14 und) erkennen lassen und auf Eis für 30 min vor Licht geschützt. Achtung: 1 x 10 6 Zellen nicht für jeden Test erforderlich. Die Autoren bereiten typischerweise 0,5 bis 1 x 10 5 Zellen / Rohr bis 2 X 10 4 erhalten analysierend Ereignisse. Außerdem folgen der Empfehlung des Herstellers für die Höhe der Antikörper an für jeden Test verwendet werden. Einige Antikörper können verlangen, Titrieren, um den optimalen Antikörper-Konzentration zu bestimmen. Alle Färbung, dass die Autoren durchgeführt haben sind einfarbige Färbung.
- Nach 30 min Inkubation auf Eis Jedes Gefäß mit hoher Geschwindigkeit auf einer Tischzentrifuge für 5 Minuten entfernen Sie dann den Überstand und resuspendieren das Zellpellet in FACS-Puffer.
- Analysieren der Proben mit einem Durchflusszytometer, um den Prozentsatz an Zellen, die positiv oder negativ für jedes Antigen Flecken zu bestimmen. ECFCs einheitlich positive Färbung für CD31, CD144, CD146 und, aber negativ für CD45 und CD14 auf den entsprechenden Isotyp Kontrollen verglichen.
- Für Einzel-Zell-Assay, um die klonale proliferative Potenzial zu untersuchen, nehmen Sie frühzeitig Durchgang (2-3)-Zellen mit TrypLE Express, um Zellen zu sammeln verwendeten Methoden entsprechen, das wurde für ECFC Klonierung und Expansion beschrieben.
- Diese Zellen zu infizierenmit Enhanced Green Fluorescent Protein (EGFP) auszudrücken Lentiviren 16 und sammeln EGFP durch Fluoreszenz-Zytometrie. Achtung: Das Arbeiten mit Lentivirus gilt als eine biologische Gefahr und alle Bio-Sicherheitsvorkehrungen sollten beachtet werden.
- Kultur ihnen wie beschrieben für die Kultivierung ECFC in der Sektion für ECFC Expansion.
- Bereiten Collagen I beschichteten 96-well Platten durch Zugabe von 50 ul Rattenschwanz Kollagen Typ I (50 ug / ml) pro Vertiefung und inkubieren Sie die Platte für die Nacht. Sammeln Sie die EGFP + ECFCs mit TrypLE Express-und resuspendieren sie in EGM-2-Medium mit einer Endkonzentration ~ 10 6 Zellen / ml.
- Verwenden FACS Vantage (Becton Dickson) oder andere vergleichbare Sortierer mit niedrigen Flussrate von 20 Zellen / Sekunde auf einen einzigen EGFP + ECFC pro Vertiefung einer 96-Well Platte zu sortieren und auf das Endvolumen auf 200 ul pro Well mit EGM-2. Verwenden einer inversen Mikroskop, um sicherzustellen, dass jede Vertiefung nur eine Zelle empfangen werden. AlternativEly, können einzelne Zellen basierend auf FSC-und SSC und Sytox nuklearen Farbstoff färben sich die Kolonien für die Zell-Scoring und Quantifizierung genutzt werden kann sortiert werden.
- Anschließend wird die Platte über einen Zeitraum von zwei Wochen mit zwei Medien ändert (200 ul EGM-2 mit Mehrkanal-Pipette) am Tag 5 und Tag 10 durchgeführt. Am Tag 14 der Kultur, waschen Sie jedes Well mit 100 ul PBS vor der Fixierung der Zellen mit 100 ul 4% Paraformaldehyd für 30 min. Für ECFCs, die nicht auszudrücken sind EGFP, fügen Sytox Reagenz, einem grün fluoreszierenden Farbstoff nukleare nach Paraformaldehyd Fixierung und Inkubation bei 4 ° C über Nacht.
- Verwendung eines Fluoreszenzmikroskops jede Position prüfen, um die Anzahl der Endothelzellen, die aus einer einzigen Zelle für 14 Tage kultiviert erweitert zu quantifizieren. Für die quantitative Analyse des Gastes Brunnen mit 2 oder mehr Endothelzellen als positiv (für Proliferation) und untersuchen sie weiter für insgesamt Endothelzellenzahl durch visuelle Auszählung mit dem Fluoreszenz-Mikroskop.
- Um anzuzeigen ter erhaltenen Daten, Vertiefungen mit einer Endothelzelle Nummer: 2 bis 50, 51-2000, und mehr als 2001, gelten als: Endothelzellen Cluster niedrigen Proliferationspotential (LPP)-ECFCs und hohe Proliferationspotential (HPP) - ECFCs sind. ECFCs zeigen komplette Hierarchie der klonale proliferative Potenzial von Endothelzellen, die zu Clustern, LPPS, und Wasserkraftwerke, wenn bei einer einzelnen Zelle Ebene für 14 Tage kultiviert. 7
C. In vivo Funktionelle Charakterisierung der ECFCs: In vivo Gefäßbildung Assay, um die ECFC das Potenzial für die Vaskulogenese Untersuchen
- Planen cellularized-Implantaten durch Berechnen der gesamten Volumen (ml) von jedem der folgenden Gel-Materialien (mit der Endkonzentration in Klammern) benötigt, um 1-ml Gel (was später halbiert werden Anspruch 2 Implantate zu erzeugen) gegossen: FBS (10 %), EBM-2 10:1 (auf das Endvolumen auf 1 ml), Natriumbicarbonat (1,5 mg / ml), NaOH (pH-Wert auf 7,4), HEPES (25 mM), fibronectin (100 pg / ml) und Kollagen I (1,5 mg / ml).
- Nach Gelmaterial Berechnung, lösen Zellen mit TrypLE Express, um Zellen zu sammeln verwendeten Methoden entsprechen, das wurde für ECFC Klonierung und Expansion beschrieben. Erhalten einer Zahl lebensfähiger Zellen eines Aliquots unter Verwendung eines Hämozytometers und Trypanblau. Übertragen 2.400.000 lebensfähige Zellen in einem 50 ml konischen Röhrchen-Pellet und die Zellen durch Zentrifugation bei 515 × g, Raumtemperatur. Gleichzeitig herzustellen Gelmatrix Lösung durch Zugabe von berechneten Volumina der HEPES, Natriumbicarbonat, EBM-2 10:1, FBS, Fibronectin und Kollagen zu einer eiskalten 50-ml konischen Röhrchen (in der Reihenfolge, wie sie aufgelistet sind). Gründlich mischen und den pH-Wert mit NaOH auf 7,4 unter Beibehaltung Lösung auf Eis.
- Verwerfen Sie den Überstand von den Zellen nach Zentrifugation und Resuspendieren des Pellets in 360 ul warmen EGM-2 und, um es hinzuzufügen pH 840 ul der Gel-Matrix-Lösung eingestellt, wodurch das Endvolumen von 1 ml Gel Implantat. Mischen Sie die Zellen in Gel-Matrix-Lösung langsam bisZellen gründlich in dem Gel suspendiert.
- Übertragen Sie diese 1 ml cellularized Gelsuspension zu einer Vertiefung einer 12-Well-Gewebekulturplatte und Inkubation für 20-30 min, bis das Gel polymerisiert. Sanft decken das Gel mit 2 ml warmem EGM-2 und über Nacht.
- Unmittelbar vor der Implantation, halbieren Sie die Nacht inkubiert Gel in zwei gleiche Stücke mit Iris-Schere und die Rückgabe der Gel-Stücke zur gleichen Kultur gut mit EGM-2 Medium.
- Verwenden Sie das Tier chirurgischen Einrichtung zu sedieren das Tier (5-6 Wochen alten NOD / SCID-Mäuse), durch Verabreichung von Isofluran-Narkose. Rasieren Sie den unteren Teil des Bauches und säubern Sie die Operationsstelle mit Alkohol-Pads und Betadin oder andere antiseptisch. Dann isolieren Sie den Bereich mit Vorhängen wie pro IACUC und institutionellen Richtlinien.
- Mit einer sterilen scharfen Schere Iris, eine ca. 5 mm Schnitt im unteren Quadranten des Bauches machen, Freilegen der subkutanen Raum zwischen Haut und Bauchmuskeln. Führen Sie mit stumpfen Dissektion durch die Hautschicht von der Bauchmuskulatur, eine 15-20 mm breite Tasche führt in den Oberbauch überlegen zu schaffen. Wiederholen ähnliches Verfahren auf ähnliche offene Tasche an der anderen Seite derselben Maus Abdomen zu schaffen.
- Legen einer Hälfte Gelstück in eine Seite der Tasche und abdominalen eine halbe Gelstück in einen anderen Teil der abdominalen Tasche durch Anheben der Hautschicht unmittelbar kaudal zum Einschnitt.
- Nach dem Einsetzen des Gels, schließen Sie alle Schnitt mit 2-3 Stichen mit 5-0 Polypropylen Nahtmaterial auf einer schneidenden Nadel. Entsprechend bezeichnen die Käfig-Karten und führen postoperative Überwachung und Analgesie nach den institutionellen und Protokoll-Anforderungen und ermöglicht 14 Tage für Zellen in diesen implantierten Gele zu De-novo-Gefäßsystem zu generieren.
- Schließlich wird die Ernte von Gel-Implantate in der Regel 14 Tage nach der Implantation Nach Tötung der Maus durchgeführt.
- Tupfer über den Bauchbereich mit Alkohol-Pads undschneiden Sie die Bauchhaut kaudal der ursprünglichen Schnittführung. Vorsichtig, sezieren Sie das Implantat durch Ausschneiden eines Hautlappen kaudal der wahrscheinlichen Aufenthaltsort des Gels. Excise das Implantat durch Schneiden am Umfang um das Gel dann in Zink-Fixativ (BD Biosciences, folgen der Empfehlung des Herstellers für optimale Ergebnisse) und es ihnen ermöglichen, für 1-2 Stunden bei Raumtemperatur zu beheben.
- Bereiten Sie die in Paraffin eingebetteten Gele unter Verwendung von Standard-Protokollen und histochemische herzustellen 5 um Abschnitte auf Glasobjektträgern dem Färben mit Hämatoxylin und Eosin, Anti-Human-CD31 oder anti-Maus-CD31 an die Gefäße in dem Gel sichtbar durchzuführen. ECFCs unterziehen de novo Vaskulogenese zu humanisierter Schiffe erzeugen in cellularized Gel-Implantaten in immundefizienten Mäusen für 14 Tage 4,8,11 eingefügt.
D. Repräsentative Ergebnisse
Mit Hilfe dieser Technik ECFC Herleitung haben wir beobachtet, Out-Wachstum von primären Kolonie Formation so früh wie Tag 5 (Abb. 1). Die Out-Wachstum ECFC Kolonien zeigten typische Kopfsteinpflaster Aussehen und gab Anlass zu> 40 Populationsverdopplungen auf langfristige Expansion nach Kolonie Pickup durch Klonen. Erweiterte Kolonien exprimiert endothelialen Antigene, nicht aber zu hämatopoetischen Antigene (Abb. 2). Wichtig ist, erscheint sie eine vollständige Hierarchie von klonalen Proliferationspotential bei einer einzelnen Zelle (Abb. 3). Darüber hinaus ausgebildet ECFCs humanisierten Blutgefäße, die mit dem Host RBCs perfundiert werden, wenn sie in immundefizienten Mäusen 4, 6, 8, 11 (4) implantiert.
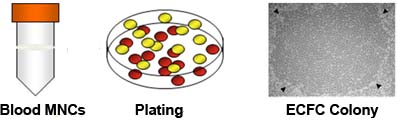
Abbildung 1. Isolierung von mononukleären Zellen (MNC) aus Nabelschnurblut und Auswachsen von endothelialen Kolonie-bildenden Zellen (ECFCs) aus kultivierten Multis. MNCs Form Buffy-Coat-Schicht während der Ficoll-Dichtegradienten Pague Trennung von Nabelschnurblut. Isolierung von Buffy coat-Schicht zur Kultur Multinationals auf Rattenschwanz Kollagen I beschichteten Platten führt zu Auswuchs ECFC Kolonie in 5 bis 14 Tagen. Der Auswuchs ECFC Kolonie (angezeigt durch Pfeilspitzen) angezeigt Kopfsteinpflastermorphologie 7.
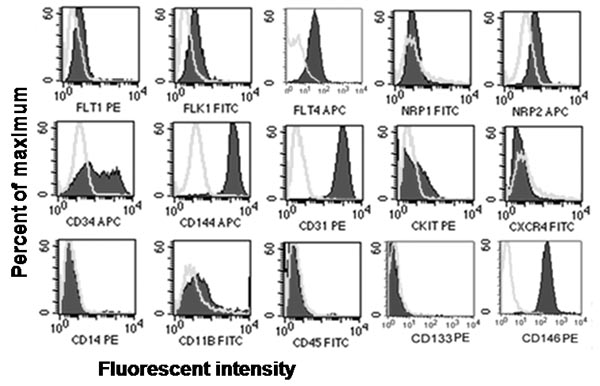
Abbildung 2. Repräsentative in vitro phänotypischen Beurteilung der Endothelzellen und hämatopoetischen Zelloberflächenantigen Expression. Immunphänotypisierung von Nabelschnurblut abgeleitete ECFCs ergab, dass ECFCs endothelialen Antigene CD31, CD34, CD144, CD146, Flt-1, Flk-1, Flt-4 und NRP2 exprimiert, aber nicht exprimieren hämatopoetischen Antigene CD45, CD14, CD11b, cKit, CXCR4 oder AC133 7, 8.
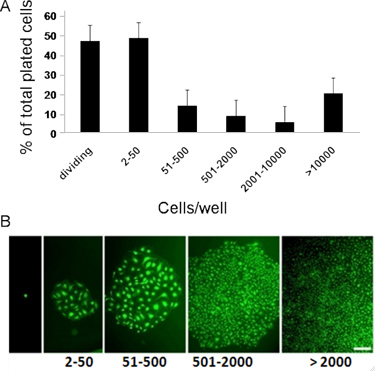
Abbildung 3. Vertreter in-vitro-Quantifizierung des klonogenen und proliferative Potenzial von CB ECFCs abgeleitet. (A) NabelschnurblutAbgeleitete ECFCs anzuzeigen klonale proliferative Potential mit einer Hierarchie von Kolonien von Clustern von 2-50 Zellen bis zu Kolonien von> 2001. (B) Mikroskopische Aufnahmen der Hierarchie der Kolonien (Kolonien mit, Sytox, einem grün fluoreszierenden Farbstoff nuklearen zu einer besseren Qualität Fotos zu machen gefärbt) erhalten nach Nabelschnurblut gewonnene ECFCs bei einer einzelnen Zelle Ebene für 14 Tage kultiviert wurden. Maßstabsbalken repräsentiert 100 um 7, 8.
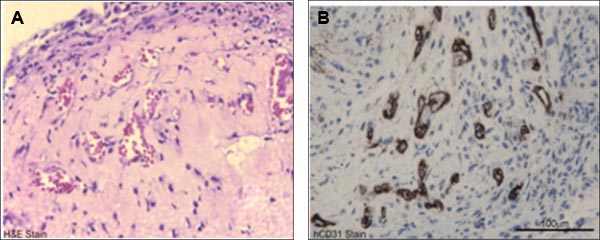
Abbildung 4. Vertreter in vivo funktionelle Charakterisierung von Nabelschnurblut gewonnenen ECFCs. A) H & E-Färbung von Nabelschnurblut abgeleitete ECFC mit cellularized-Implantate angegeben Mikrogefäßzellen (gefüllt mit Host RBCs) Bildung von Kollagen-Fibronektin-Gels nach 14 Tagen nach der Implantation. B) Anti-Human-CD31-Färbung (braune Färbung) bestätigt weiter den menschlichen Ursprungs dieser Schiffe.
Diskussion
Phänotypische und funktionelle Charakterisierung von putativen endothelialen Vorläuferzellen ist wichtig, die bona fide ECFCs die in der Lage klonal und seriell Re-Beschichtung in der Kultur zu identifizieren sind und führen zu langlebigen und funktionellen implantierbare Blutgefäße in vivo. Menschlichem Nabelschnurblut ist mit ECFCs und der Konzentration dieser zirkulierenden Zellen sinkt mit dem Altern oder Krankheiten 10 angereichert. Neuere Studien legen nahe, dass ECFC kann eine wi...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Dr. Yoder ist Berater für EndGenitor Technologies, Inc. und Mitglied des Board of Rimedion Technologies, Inc.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Heparin-Natrium zur Injektion, USP | APP Pharmaceuticals | 504031 | |
| Ficoll-Pague | Amersham Biosciences | 17-1440-03 | |
| Mischkanüle | Maersk Medical | 500.11.012 | |
| EGM-2 | Lonza | CC-3162 | |
| Definierte FBS | Hyclone | SH30070.03 | |
| TrypLE Express | Gibco | 12605 | |
| Ratten-Kollagen Typ I | BD Biosciences | 354236 | |
| Matrigel | BD Biosciences | 356234 | |
| FcR-Block | Miltenyi Biotech | 130-059-901 | |
| hCD31, FITC conjugaTed | BD Pharmingen | 555445 | |
| hCD45, FITC-konjugierten | BD Pharmingen | 555482 | |
| hCD14, FITC-konjugierten | BD Pharmingen | 555397 | |
| hCD144, PE-konjugiertem | eBioscience | 12-1449-80 | |
| hCD146, PE-konjugiertem | BD Pharmingen | 550315 | |
| hCD105, PE-konjugiertem | Invitrogen | MHCD10504 | |
| Ms IgG 1, k Antikörper, FITC-konjugierten | BD Pharmingen | 555748 | |
| Fr. IgG 1, k-Antikörper, PE-konjugiertem | BD Pharmingen | 559320 | |
| Ms IgG 2a, k Antikörper, FITC-konjugierten | BD Pharmingen | 555573 | |
| Anti-Human-CD31 | Dako | Klon JC70 / A | |
| Anti-mouse CD31 | BD Pharmingen | 553370 | |
| 0,22-um-Vakuum-Filtration Systems | Millipore | SCGPU05RE | |
| Eisessig, 17.4N | Fischer | A38-500 | |
| Antibiotika-Antimykotika | Invitrogen | 15240-062 | |
| Fötales Rinderserum (FBS) | Hyclone | SH30070.03 | |
| IHC Zink Fixativ | BD Biosciences | 550523 | |
| SYTOX Green Reagenz | Invitrogen | S33025 | |
| Cloning Zylinder, steril | Fisher Scientific | 07-907-10 |
Referenzen
- Carmeliet, P., Jain, R. K. Molecular mechanisms and clinical applications of angiogenesis. Nature. 473, 298-307 (2011).
- Asahara, T. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275, 964-967 (1997).
- Urbich, C., Dimmeler, S. Endothelial progenitor cells: characterization and role in vascular biology. Circ. Res. 95, 343-353 (2004).
- Critser, P. J., Voytik-Harbin, S. L., Yoder, M. C. Isolating and defining cells to engineer human blood vessels. Cell. Prolif. 44, 15-21 (2011).
- Matthias, M., David, N., Josef, N. From bench to bedside: what physicians need to know about endothelial progenitor cells. Am. J. Med. 124, 489-4897 (2011).
- Ingram, D. A. Vessel wall-derived endothelial cells rapidly proliferate because they contain a complete hierarchy of endothelial progenitor cells. Blood. 105, 2783-276 (2005).
- Ingram, D. A. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood. Blood. 104, 2752-2760 (2004).
- Yoder, M. C. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109, 1801-1809 (2007).
- Reinisch, A., Strunk, D. Isolation and Animal Serum Free Expansion of Human Umbilical Cord Derived Mesenchymal Stromal Cells (MSCs) and Endothelial Colony Forming Progenitor Cells (ECFCs. J. Vis. Exp. (32), e1525 (2009).
- Au, P. Differential in vivo potential of endothelial progenitor cells from human umbilical cord blood and adult peripheral blood to form functional long-lasting vessels. Blood. 111, 1302-135 (2008).
- Critser, P. J., Kreger, S. T., Voytik-Harbin, S. L., Yoder, M. C. Collagen matrix physical properties modulate endothelial colony forming cell-derived vessels in vivo. Microvasc. Res. 80, 23-30 (2010).
- Melero-Martin, J. M. Engineering robust and functional vascular networks in vivo with human adult and cord blood-derived progenitor cells. Circ. Res. 103, 194-202 (2008).
- Melero-Martin, J. M. In vivo vasculogenic potential of human blood-derived endothelial progenitor cells. Blood. 109, 4761-4768 (2007).
- Hofmann, N. A., Reinisch, A., Strunk, D. Isolation and Large Scale Expansion of Adult Human Endothelial Colony Forming Progenitor Cells. J. Vis. Exp. (32), e1524 (2009).
- Lin, Y., Weisdorf, D. J., Solovey, A., Hebbel, R. P. Origins of circulating endothelial cells and endothelial outgrowth from blood. J. Clin. Invest. 105, 71-77 (2000).
- Witting, S. R. Efficient Large Volume Lentiviral Vector Production Using Flow Electroporation. Hum. Gene. Ther. , (2011).
- Yoon, C. H. Synergistic neovascularization by mixed transplantation of early endothelial progenitor cells and late outgrowth endothelial cells: the role of angiogenic cytokines and matrix metalloproteinases. Circulation. , 112-1618 (2005).
- Dubois, C. Differential effects of progenitor cell populations on left ventricular remodeling and myocardial neovascularization after myocardial infarction. J. Am. Coll. Cardiol. 55, 2232-2243 (2010).
- Medina, R. J., O'Neill, C. L., Humphreys, M. W., Gardiner, T. A., Stitt, A. W. Outgrowth endothelial cells: characterization and their potential for reversing ischemic retinopathy. Invest. Ophthalmol. Vis. Sci. 51, 5906-5913 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten