É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Caracterização fenotípica e funcional das células endoteliais Formadoras de Colônias derivado do sangue do cordão umbilical humano
Neste Artigo
Resumo
Células endoteliais que formam colônias (ECFCs) estão circulando células endoteliais com potencial clonal proliferativa robusto que exibe intrínseco In vivo capacidade de formação. Caracterização fenotípica e funcional das células endoteliais excrescência derivados de CB são importantes para identificar e isolar Bona fide ECFCs potencial para aplicação clínica na reparação de tecidos danificados.
Resumo
Vistas de longa data de formação de novos vasos sanguíneos através de angiogênese, vasculogênese e arteriogênese foram avaliados recentemente 1. A presença de circulação de células progenitoras endoteliais (EPCs) foram primeiramente identificadas no sangue periférico humano adulto por Asahara et al. Em 1997 2 trazendo uma infusão de novas hipóteses e estratégias para a regeneração e reparação vascular. EPCs são raras, mas os componentes normais do sangue circulante de que o lar de locais de formação dos vasos sanguíneos ou remodelação vascular, e facilitar quer vasculogênese pós-natal, a angiogênese, ou arteriogênese em grande parte através da estimulação parácrina de parede do vaso existente derivadas de células 3. Nenhum marcador específico para identificar um EPC foi identificado, e no presente estado do campo é entender que tipos de células-tronco hematopoiéticas, incluindo numerosos proangiogenic e células progenitoras, células circulantes angiogênicas, TIE2 + de monócitos, cel progenitor mielóidels, tumorais macrófagos associados, e M2 macrófagos activados participar em estimular o processo angiogénico em uma variedade de sistemas de modelos animais e pré-clínicos em seres humanos em numerosos estados de doença 4, 5. Células endoteliais que formam colônias (ECFCs) são raras circulantes células endoteliais viáveis caracterizadas por potencial robusto clonal proliferativa, colônia secundária e terciária capacidade de formação sobre repique, e capacidade de formar intrínseca em vasos in vivo sobre o transplante em ratos imunodeficientes 6-8. Enquanto ECFCs foram isoladas com sucesso a partir do sangue periférico de indivíduos adultos saudáveis, o sangue do cordão umbilical (CB) de recém-nascidos saudáveis e parede do reservatório de numerosos humanos vasos arteriais e venosos 6-9, CB possui a maior freqüência de ECFCs 7 que exibição o mais robusto potencial clonal proliferativa e forma os vasos sanguíneos duráveis e funcionais in vivo 8, 10-13. Enquanto a derivação deECFC a partir de sangue periférico adulto tem sido apresentada 14, 15, aqui descrever as metodologias para a derivação, a clonagem, a expansão, e in vitro em bem como em caracterização in vivo das ECFCs do umbilical humano CB.
Protocolo
Reagentes e Soluções
EMG-2 de mídia (Lonza, Cat. No. cc-3162-2 contendo EBM meio basal e EGM-2 Suplementos kit SingleQuot, e fatores de crescimento)
EBM-2 (Lonza, Cat. No. cc-3156) suplementado com os suplementos SingleQuot inteiras kit e factores de crescimento (Lonza, Cat. No. cc-4176), 10% (v / v) de soro fetal bovino (FBS) e 1% (v / v) de penicilina (10.000 U / ml) / estreptomicina (10.000 ug / ml) / anfotericina (25 ug / ml). Armazene até 1 mês a 4 ° C. Recomendadas EGM-2 volumes a serem usados para a cultura ECFC são 500 uL / poço de placas de 24 poços, 2 ml / poço de placas de 6 poços, 2 5ml/25-cm frascos, e 10 ml/75-cm 2 frascos, a menos que especificação em contrário no protocolo.
Colágeno solução que eu
Diluir 0,575 ml de ácido acético glacial (17.4N) em 495 ml de água destilada estéril (0,02 N concentração final). Estéril de ácido acético diluído o filtro com uma vac 0,22 mícronsuum sistema de filtração. Adicionar 25 mg de colagénio da cauda de rato I do ácido diluído acético para uma concentração final de 50 ug / ml. A quantidade de colagénio adicionado irá variar dependendo da concentração de estoque de colagénio. Armazene até um mês a 4 ° C.
Preparação de colagénio I-revestidos superfícies de cultura de tecidos
O local de 1 ml de solução de colagénio I, em cada poço de uma placa de cultura de tecido de 6 poços (utilizar 300 uL / poço de placas de 24 poços, 2 3ml/25-cm frascos, e 8 ml/75-cm 2 frascos). Incubar 1 hora a durante a noite a 37 ° C. Remover o colagénio I solução e lavar superfície duas vezes, cada vez com PBS (utilizar 500 uL / poço de placas de 24 poços, 2 ml / poço de placas de 6 poços, 2 5ml/25-cm frascos, e 10 ml/75 -cm 2 frascos). Use placas imediatamente para culturas de células.
Tampão FACS coloração
Salino tamponado com fosfato (PBS) suplementado com 2% (v / v) de soro fetal bovino (FBS). Loja up de 2 semanas a 4 ° C.
A. conseqüência ECFC clonagem e Expansão
- Collect CB com heparina (10 U de heparina / ml de sangue) ou EDTA como anticoagulante e transporte para o laboratório, à temperatura ambiente e imediatamente processo (dentro de 2 horas após a entrega do lactente) da amostra para a célula mononuclear (MNC) de isolamento.
- Alíquota de 15 ml de CB para cada tubo de centrífuga de 50 ml e adicionar 20 ml de PBS a cada tubo de CB e pipeta várias vezes para misturar. Elaborar 15 ml de Ficoll-Paque em uma seringa de 20 ml e uma agulha 20G ou cânula de mistura. Coloque a ponta da cânula de mistura, na parte inferior do tubo de sangue diluído e cuidadosamente calçar 15 ml de Ficoll-Pague. Centrifugar os tubos 30 min a 740 xg, à temperatura ambiente, sem a configuração do travão de desaceleração.
- Usando uma pipeta de transferência, remover a camada nebulosa de baixa densidade EMNs localizado na interface entre o plasma de Ficoll-Paque e diluído. Dispensar as multinacionais em um cont tubo cônico de 50 mlaining 10 ml EGM-2 médio. Centrifugar a PTM 10 min a 515 xg, à temperatura ambiente, com uma configuração de alta desaceleração do travão.
- Cuidadosamente aspire e desprezar o sobrenadante. Lave as células peletizadas com EGM-2 duas vezes (10 minutos a 515 xg) e re-suspensão da PTM em EGM-2 a 1,25 x 10 7 células / ml. Preparar colagénio I revestidos 6-poços de cultura de tecidos por adição de 1 ml da cauda de rato-colagénio de tipo I (50 ug / ml) por poço e incubando a placa durante a noite. Pipetar 4 ml desta suspensão MNC em cada poço e colocar as células em 37 ° C, 5% de CO 2 incubadora humidificada. A.1.5) Após 24 horas (dia 1), lentamente remover o meio gasto (não perturbar as células fracamente aderentes) do poço com uma pipeta, adicionar lentamente 4 ml EGM-2 para o poço, e retornar placa para a incubadora . No dia 2, o meio de actualização por lentamente remoção do meio (não perturbar as células fracamente aderentes) do poço com uma pipeta e adicionando 4 ml EGM-2 para cada poço. Repita o meio de troca diária da ONUaté o dia 7 e em dias alternados até depois colônias ECFC aparecer para clonagem. Tipicamente colónias aparecem entre o dia 5 e dia 14 dias 7 (Fig. 1).
- Visualizar típicos colónias ECFC com a morfologia de paralelepípedos utilizando microscópio invertido (ampliação de 10x) e marcar os limites de colónias com um marcador na parte inferior do poço para indicar a posição de cada colónia.
- No dia 14, lavar destas colónias primárias 2 vezes com PBS e as colónias individuais utilizando cilindros de colheita de clonagem e apenas o suficiente TrypLE expressa para cobrir as células no interior dos cilindros. Depois de aspirar a lavagem final da PBS, coloque um gel estéril cilindro revestido de clonagem ao redor de cada colônia e pressione com firmeza contra a placa usando uma pinça estéril. Adicionar 2-3 gotas de quente TrypLE expressa em cada cilindro clonagem e incubar durante 3-5 minutos até que as células dentro do cilindro começam a destacar. Adicionar aproximadamente 250 meio EGM-2 uL para o centro do cilindro e pipetar cima e para baixo ao generate suspensão única célula. Transferir a suspensão de célula única a partir de cada cilindro de clonagem separadamente em um tubo de micro centrífuga-individual.
- Lava-se a área dentro do cilindro de 2-3 vezes com aproximadamente 250 meio EGM-2 uL para recolher todas as células restantes e transferir a solução de lavagem a partir de cada cilindro para dentro do tubo de micro centrífuga-respectivo. Centrifugar as células em alta velocidade (≤ xg 300) na centrífuga de mesa durante 5 min.
- Remover o sobrenadante e re-suspender o sedimento de células em 1,5 ml de meio EGM-2 fresca. Transferir a suspensão de células (contendo todas as células a partir de colónias individuais) de cada tubo em um poço de uma placa de cultura de tecido de 24 poços pré-revestidos com 500 uL da cauda de rato-colagénio I (50 ug / ml).
- Coloque dentro da incubadora para a expansão com a mídia mudar realizados em dias alternados.
- Quando as células aproximar 80-90% de confluência, remover o meio gasto, em seguida, lavar as células 2 vezes com PBS e adicionar 500 uL TrypLE médio expresso a cada poçode 24 poços da placa de cultura de tecidos. Coloque a placa dentro da incubadora por 3-5 min até que as células começam a arredondar para cima e retire. Adicionar 1 ml de AGE-2 (com 10% de FBS definido) a cada poço para recolher as células por lavagem e transferi-los para um tubo de 15 ml. Lava-se a bem com 1 ml EGM-2 médio para recolher todas as células restantes e transferir a solução de lavagem de cada poço para dentro do tubo respectivo 15 ml. Centrifugar as células a 300 xg durante 5 min.
- Remover o meio e re-suspender o sedimento de células em 1 ml de meio EGM-2 fresca (com 10% de FBS definido). Obter a contagem de células viáveis de uma alíquota usando um hemacitómetro e de exclusão de azul de tripano.
- Expandir as células por sementeira cerca de 5000 células / cm 2 para um colagénio I pré-revestidos por superfícies de cultura de tecidos de EGM-2 meios com os meios de mudar a cada dois dias até que as células se aproximar 80-90% de confluência antes sub-cultura de novo.
B. In vitro caracterização fenotípica de ECFCs: célula endotelial expressão do antígeno de superfície umensaio de célula d único para potencial proliferativo Clonal
- Para endotelial expressão do antígeno de superfície celular, retire as células com TrypLE expressa antes de recolher células usando métodos descritos para a clonagem ECFC e expansão.
- Re-suspender as células em tampão FACS coloração (10 x 10 6 células / FACS 1ml de coloração tampão), em seguida, adicionar o reagente FcR bloqueio (20 uL / 10 x 10 6 células), e misturar suavemente lugar em gelo durante 10 min.
- Alíquota de 100 ul desta suspensão de células em micro centrífuga de tubo para cada antigénio de superfície endotelial e controlos isotípicos. Adicionar quantidade apropriada de fluorocromo rotulados anticorpos monoclonais humanos que reconhecem antigénios endoteliais (CD31, CD144, CD146, CD105 e) ou antigénios hematopoiéticas (CD45, e CD14) e deixar em gelo durante 30 min protegida da luz. Cuidado: 1 x 10 6 células não são necessários para cada teste. Os autores tipicamente preparar 0,5 a 1 X 10 células / tubo 5 para se obter 2 X 10 4 analisareventos d. Além disso, seguir a recomendação do fabricante para a quantidade de anticorpo a ser utilizado para cada teste. Alguns anticorpos podem exigir titulando para determinar a concentração de anticorpo óptima. Todos coloração que os autores realizaram são manchas de cor única.
- Após 30 min de incubação em gelo, centrifugar cada tubo a alta velocidade numa centrífuga de mesa durante 5 min, em seguida, remover o sobrenadante e re-suspender o sedimento de células em tampão de FACS.
- Analisar as amostras em um citómetro de fluxo para determinar a percentagem de células que mancha positiva ou negativamente, para cada antigénio. ECFCs mancha uniformemente positivo para CD31, CD144, CD146 e, mas negativa para CD45 e CD14 em comparação com os controlos isotípicos correspondentes.
- Para o ensaio de célula única para examinar o potencial proliferativo clonal, separar passagem precoce (2-3) com células TrypLE expressa para recolher as células utilizando métodos semelhantes aos que foi descrito para a clonagem ECFC e expansão.
- Infect estas célulascom a proteína verde fluorescente melhorada (EGFP) expressando lentivírus 16 e recolher células que expressam EGFP por citometria de fluorescência. Atenção: Trabalhar com lentivírus é considerado um risco biológico e todas as precauções de biossegurança devem ser obedecidas.
- Cultura-los como descrito para ECFC cultura na seção para a expansão ECFC.
- Preparar colagénio I revestidos placas de 96 poços por adição de 50 uL colagénio do tipo cauda de rato-I (50 ug / ml) por poço e incubar a placa durante a noite. Colete as EGFP + de ECFCs usando TrypLE expressa e ressuspender-los em EGM-2 meio com concentração final ~ 10 6 células / ml.
- Use FACS Vantage (Becton Dickson) ou classificador de comparável aos outros com baixa taxa de fluxo de 20 células / segundo para classificar um único EGFP + ECFC por poço de uma placa de 96 poços e ajustar o volume final para 200 uL por poço com EGM-2. Use um microscópio invertido de fluorescência para assegurar que cada poço recebeu apenas uma célula. Alternatively, as células individuais podem ser classificados com base no FSC e SSC e corante nuclear Sytox coloração das colónias pode ser usado para marcar células e quantificação.
- Incubar a placa ao longo de um período de duas semanas com duas mudanças de meio (200 uL EGM-2 pipetador multicanais usando) realizadas no dia 5 e dia 10. No dia 14 da cultura, lavar cada poço com 100 ul de PBS antes da fixação das células com 100 uL de paraformaldeído a 4% durante 30 min. Para ECFCs que não estão expressando EGFP, adicionar Sytox reagente, um corante fluorescente verde nuclear, na sequência de fixação paraformaldeído e incubar a 4 ° C durante a noite.
- Utilizar um microscópio de fluorescência para examinar cada poço para quantificar o número de células endoteliais que se expandiram a partir de uma única célula cultivadas durante 14 dias. Para análise quantitativa, os poços pontuação com 2 ou mais células endoteliais como positivo (para a proliferação) e analise-adicional para contagem total de células endoteliais por contagem visual com um microscópio de fluorescência.
- Para exibir tobteve dados, poços com um número de células endoteliais de: 2 a 50, 51-2000 e 2001, ou mais, são considerados como: aglomerados de células endoteliais, o potencial proliferativo baixo (LPP)-ECFCs e potencial proliferativo elevado (HPP) - ECFCs respectivamente. ECFCs exibem hierarquia completa do potencial proliferativo clonal por dando origem a aglomerados endoteliais, LPPS, e UHEs quando cultivados a um nível da célula individual durante 14 dias. 7
C. In vivo Caracterização funcional de ECFCs: ensaio in vivo de formação de vasos para examinar o potencial ECFC para vasculogênese
- Preparar os implantes de gel celularizado através do cálculo do volume total (ml) de cada um dos materiais de gel seguintes (com a concentração final no parênteses) necessário para lançar uma ml de gel (que será mais tarde cortado ao meio para gerar 2 implantes): FBS (10 %), EBM-2 10:01 (ajustar o volume final para 1 ml), bicarbonato de sódio (1,5 mg / ml), NaOH (pH ajustado a 7,4), HEPES (25 mM), fibronectin (100 ug / ml), e colagénio I (1,5 mg / ml).
- Após o cálculo material de gel, separar as células com TrypLE expressa para recolher as células utilizando métodos semelhantes aos que foi descrito para a clonagem ECFC e expansão. Obter uma contagem de células viáveis de uma alíquota usando um hemacitómetro e azul de tripano. Transferir 2,4 milhões de células viáveis em um tubo de 50 ml-cónica e sedimentar as células por centrifugação a 515 xg, à temperatura ambiente. Simultaneamente, preparar gel solução de matriz por adição de volumes calculados de HEPES, bicarbonato de sódio, EBM-2 10:1, de FBS, fibronectina e colagénio para um tubo arrefecido com gelo 50 ml cónica (na mesma ordem em que são listados). Misturar bem e ajustar o pH para 7,4 com NaOH, mantendo solução em gelo.
- Descartar o sobrenadante das células após a centrifugação e re-suspender o sedimento em 360 uL quente EGM-2 e para lhe acrescentar o pH ajustado 840 uL de solução de matriz de gel, fazendo com que o volume final de gel ml implante 1. Misturar as células em gel de solução de matriz lentamente atéAs células estão completamente em suspensão na solução de gel.
- Transferir esta 1 ml de suspensão de gel celularizado para um poço de uma placa de cultura de 12 poços de tecido e incubar durante 20-30 min, até que o gel polimeriza. Suavemente cobrir o gel com 2 ml quente EGM-2 e incubar durante a noite.
- Imediatamente antes do implante, bissectar o gel durante a noite incubada em duas partes iguais, utilizando uma tesoura de íris e retornar os pedaços de gel para a mesma cultura bem contendo EGM-2 médio.
- Utilizar a instalação para animais cirúrgico para o animal sedar (5-6 semanas de idade NOD / ratinhos SCID) por meio da administração anestesia com isoflurano. Raspar a parte inferior do abdômen e limpe o local da cirurgia com compressas embebidas em álcool e anti-séptico Betadine ou outro. Em seguida, isolar a área, com cortinas conforme diretrizes IACUC e institucional.
- Usando estéreis tesoura afiada da íris para fazer uma incisão de aproximadamente 5 milímetros no quadrante inferior do abdómen, expondo o espaço subcutâneo entre a pele eo músculo abdominal. Realizar dissecção-romba através da camada dérmica da musculatura abdominal para criar uma bolsa de 15-20 mm de largura que conduz superiores no quadrante superior abdominal. A repetição do procedimento semelhante para criar bolso aberto semelhante em outro lado do abdómen do rato mesmo.
- Inserir um pedaço de gel de meia em um lado do bolso abdominal e uma outra parte da metade de gel em outro lado do bolso abdominal levantando a camada dérmica apenas caudal à incisão.
- Após a inserção dos géis, fechar cada incisão com 2-3 pontos com fio de polipropileno 5-0 em uma agulha cortante. Apropriadamente rotular os cartões de gaiolas e realizar acompanhamento pós-cirúrgico e analgesia conforme as exigências institucionais e protocolo e permitir que 14 dias para as células nestes géis implantados para gerar vasculatura de novo.
- Finalmente, a colheita de implantes de gel é tipicamente realizada 14 dias após o implante após a eutanásia no rato.
- Swab da área abdominal com compressas embebidas em álcool ecortar a pele abdominal caudal para a linha de incisão original. Cuidadosamente, dissecar para fora do implante através da excisão de uma aba de caudal pele para a localização provável do gel. Implante o Excise cortando circunferencialmente em torno do gel em seguida, coloque em fixador de zinco (BD Biosciences, seguir a recomendação do fabricante para melhores resultados) e permitir-lhes fixar por 1-2 horas à temperatura ambiente.
- Preparar os géis de parafina-incorporados usando protocolos padrão histoquímica e 5 mm de preparar em lâminas de vidro para realizar a coloração com hematoxilina e eosina, anti-CD31 humano ou rato anti-CD31 para visualizar a vasculatura dentro do gel. ECFCs sofrer de vasculogénese novo para gerar vasos humanizados em celularizado implantes de gel inserido em ratos imunodeficientes por 14 dias 4,8,11.
D. Representante Resultados
Usando esta técnica derivação ECFC temos observado o crescimento fora de forma colônia primáriaation tão cedo quanto dia 5 (Fig. 1). As colônias fora de crescimento ECFC exibiu aparência típica calçada e deu lugar a> duplicações 40 da população sobre a expansão a longo prazo após a coleta de colônias por clonagem. Colónias expandidas expressa antigénios endoteliais, mas não expressam antigénios hematopoiéticas (Fig. 2). Importante, eles exibida uma hierarquia completa do potencial proliferativo clonal a um nível única célula (Fig. 3). Além disso, ECFCs formado vasos sanguíneos humanizados que são perfundidos com RBCs hospedeiras quando implantadas em ratinhos imunodeficientes 4, 6, 8, 11 (Fig. 4).
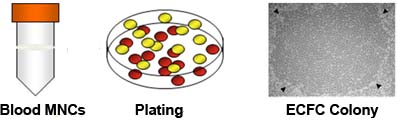
Figura 1. Isolamento de células mononucleares (PTM) de sangue do cordão umbilical e excrescência de colónia endotelial formando células (ECFCs) a partir de cultura. EMNs forma EMNs camada buffy coat durante Ficoll-Pague separação por gradiente de densidade de células de sangue de cordão. Isolamento de buffy camada de revestimento à cultura multinacionais na cauda de rato-colágeno I resultados placas revestidas em conseqüência da colônia ECFC em 5 a 14 dias. A colônia ECFC conseqüência (indicado por cabeças de seta) exibido morfologia paralelepípedos 7.
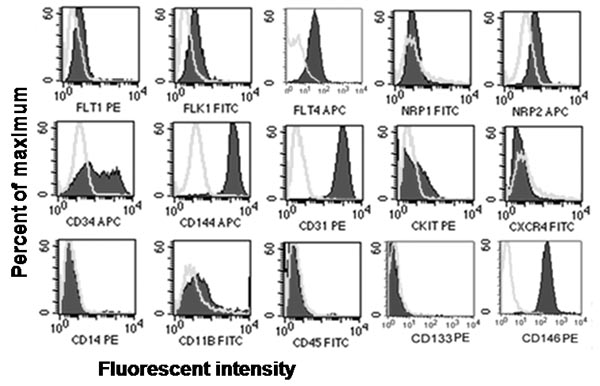
Figura 2. Representante avaliação in vitro fenotípica de endotelial e hematopoiéticas expressão de antigénios da superfície celular. Imunofenotipagem de sangue do cordão umbilical derivados ECFCs revelou que expressa antigénios ECFCs endoteliais CD31, CD34, CD144 e CD146, Flt-1, Flk-1, Flt-4, e Nrp2 mas não expressam antigénios hematopoiéticas CD45, CD14, CD11b, c-kit, ou CXCR4 AC133 7, 8.
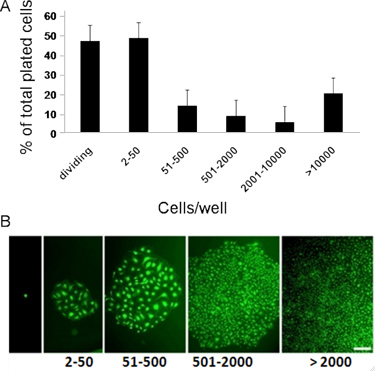
Figura 3. Representante na quantificação in vitro do clonogénico e potencial proliferativo de CB ECFCs derivadas. (A) o sangue do cordãoDerivados ECFCs exibir potencial proliferativo clonal com uma hierarquia de colônias que variam de clusters de 2-50 células até colônias de> 2001. (B) Micrografias de hierarquia de colónias (colónias coradas com, Sytox, um corante fluorescente verde nuclear para tirar fotografias de melhor qualidade) obtido após sangue do cordão umbilical derivado ECFCs foram cultivados a um nível da célula individual durante 14 dias. Barra de escala representa 100 um 7, 8.
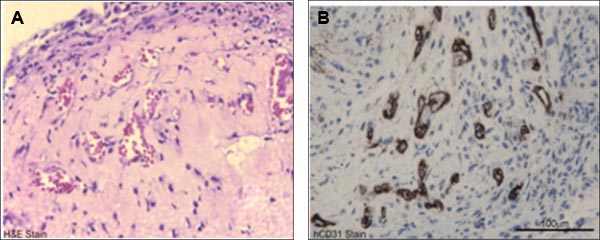
Figura 4. Representante na caracterização funcional in vivo de sangue do cordão umbilical derivados ECFCs. A) coloração H & E do sangue do cordão umbilical derivado ECFC contendo os implantes de gel celularizado indicado microvascular (cheio de hemácias de acolhimento) a formação de colágeno fibronectina-gel após 14 dias de implantação. B) Anti-CD31 humano coloração (coloração marrom) confirma a origem humana destes navios.
Discussão
Caracterização fenotípica e funcional dos putativos células progenitoras endoteliais é importante para identificar os ECFCs autênticas que são capazes de clonalmente e serialmente re-plaqueamento em cultura e dar origem a duráveis e funcional vasos sanguíneos implantáveis in vivo. O sangue do cordão umbilical humano é enriquecido com ECFCs ea concentração desses declínios células circulantes com o envelhecimento ou a doença de 10. Estudos recentes sugerem que ECF...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Dr. Yoder é consultor de Tecnologias EndGenitor, Inc. e membro do conselho de Rimedion Technologies, Inc.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Injeção de heparina sódica, USP | APP Pharmaceuticals | 504031 | |
| Ficoll-Pague | Amersham Biosciences | 17-1440-03 | |
| Cânula de mistura | Maersk Medical | 500.11.012 | |
| EGM-2 | Lonza | CC-3162 | |
| FBS definido | Hyclone | SH30070.03 | |
| TrypLE expressa | Gibco | 12605 | |
| Tipo Rat colágeno I | BD Biosciences | 354236 | |
| Matrigel | BD Biosciences | 356234 | |
| FcR Bloco | Miltenyi Biotech | 130-059-901 | |
| hCD31, FITC Conjugated | BD Pharmingen | 555445 | |
| hCD45, conjugado com FITC | BD Pharmingen | 555482 | |
| hCD14, conjugado com FITC | BD Pharmingen | 555397 | |
| hCD144, PE conjugado | eBioscience | 12-1449-80 | |
| hCD146, PE conjugado | BD Pharmingen | 550315 | |
| hCD105, PE conjugado | Invitrogen | MHCD10504 | |
| Ms IgG 1, o anticorpo k, conjugado com FITC | BD Pharmingen | 555748 | |
| Ms IgG 1, o anticorpo k, PE conjugado | BD Pharmingen | 559320 | |
| Ms IgG 2a, o anticorpo k, conjugado com FITC | BD Pharmingen | 555573 | |
| Anti-CD31 humano | Dako | clone JC70 / A | |
| Anti-mouse CD31 | BD Pharmingen | 553370 | |
| 0,22 mícrons sistema de filtração de vácuo | Millipore | SCGPU05RE | |
| Ácido acético glacial, 17.4N | Pescador | A38-500 | |
| Antibiótico-antimicótica | Invitrogen | 15240-062 | |
| Soro fetal de bovino (FBS) | Hyclone | SH30070.03 | |
| IHC zinco Fixação | BD Biosciences | 550523 | |
| Sytox reagente verde | Invitrogen | S33025 | |
| Cilindros de clonagem, estéreis | Fisher Scientific | 07-907-10 |
Referências
- Carmeliet, P., Jain, R. K. Molecular mechanisms and clinical applications of angiogenesis. Nature. 473, 298-307 (2011).
- Asahara, T. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275, 964-967 (1997).
- Urbich, C., Dimmeler, S. Endothelial progenitor cells: characterization and role in vascular biology. Circ. Res. 95, 343-353 (2004).
- Critser, P. J., Voytik-Harbin, S. L., Yoder, M. C. Isolating and defining cells to engineer human blood vessels. Cell. Prolif. 44, 15-21 (2011).
- Matthias, M., David, N., Josef, N. From bench to bedside: what physicians need to know about endothelial progenitor cells. Am. J. Med. 124, 489-4897 (2011).
- Ingram, D. A. Vessel wall-derived endothelial cells rapidly proliferate because they contain a complete hierarchy of endothelial progenitor cells. Blood. 105, 2783-276 (2005).
- Ingram, D. A. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood. Blood. 104, 2752-2760 (2004).
- Yoder, M. C. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109, 1801-1809 (2007).
- Reinisch, A., Strunk, D. Isolation and Animal Serum Free Expansion of Human Umbilical Cord Derived Mesenchymal Stromal Cells (MSCs) and Endothelial Colony Forming Progenitor Cells (ECFCs. J. Vis. Exp. (32), e1525 (2009).
- Au, P. Differential in vivo potential of endothelial progenitor cells from human umbilical cord blood and adult peripheral blood to form functional long-lasting vessels. Blood. 111, 1302-135 (2008).
- Critser, P. J., Kreger, S. T., Voytik-Harbin, S. L., Yoder, M. C. Collagen matrix physical properties modulate endothelial colony forming cell-derived vessels in vivo. Microvasc. Res. 80, 23-30 (2010).
- Melero-Martin, J. M. Engineering robust and functional vascular networks in vivo with human adult and cord blood-derived progenitor cells. Circ. Res. 103, 194-202 (2008).
- Melero-Martin, J. M. In vivo vasculogenic potential of human blood-derived endothelial progenitor cells. Blood. 109, 4761-4768 (2007).
- Hofmann, N. A., Reinisch, A., Strunk, D. Isolation and Large Scale Expansion of Adult Human Endothelial Colony Forming Progenitor Cells. J. Vis. Exp. (32), e1524 (2009).
- Lin, Y., Weisdorf, D. J., Solovey, A., Hebbel, R. P. Origins of circulating endothelial cells and endothelial outgrowth from blood. J. Clin. Invest. 105, 71-77 (2000).
- Witting, S. R. Efficient Large Volume Lentiviral Vector Production Using Flow Electroporation. Hum. Gene. Ther. , (2011).
- Yoon, C. H. Synergistic neovascularization by mixed transplantation of early endothelial progenitor cells and late outgrowth endothelial cells: the role of angiogenic cytokines and matrix metalloproteinases. Circulation. , 112-1618 (2005).
- Dubois, C. Differential effects of progenitor cell populations on left ventricular remodeling and myocardial neovascularization after myocardial infarction. J. Am. Coll. Cardiol. 55, 2232-2243 (2010).
- Medina, R. J., O'Neill, C. L., Humphreys, M. W., Gardiner, T. A., Stitt, A. W. Outgrowth endothelial cells: characterization and their potential for reversing ischemic retinopathy. Invest. Ophthalmol. Vis. Sci. 51, 5906-5913 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados