Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
High Speed Unter GHz-Spektrometer für Brillouin-Streuung Analysis
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll, um eine schnelle Brillouin-Spektrometer zu bauen. Cascading virtuell abgebildeten Phasen-Array (VIPA) Etalons erreichen eine Messgeschwindigkeit mehr als 1.000 mal schneller als herkömmliche Scan Fabry-Perot-Spektrometer. Diese Verbesserung stellt die Mittel für die Brillouin-Analyse von Gewebe und Biomaterialien bei niedrigen Leistungspegeln in vivo.
Zusammenfassung
Das Ziel des Protokolls ist es, eine parallele hoher Extinktion und hochauflösende optische Brillouin-Spektrometer zu bauen. Brillouin-Spektroskopie ist eine berührungslose Messverfahren, die verwendet werden kann, um direkte Auslesen der viskoelastischen Materialeigenschaften zu erhalten. Es ist ein nützliches Werkzeug in der Materialcharakterisierung, Strukturüberwachung und Umweltanalytik. In der Vergangenheit hat die Brillouin-Spektroskopie üblicherweise verwendeten Scan Fabry-Perot-Etalons zur Spektralanalyse durchzuführen. Dieser Prozess erfordert hohe Lichtleistung und lange Akquisitionszeiten, so dass die Technik für biomedizinische Anwendungen ungeeignet. Ein kürzlich vorgestellten neuen Spektrometers überwindet diese Herausforderung, indem zwei Vipas in einer Querachsenkonfiguration. Diese Innovation ermöglicht es Unter Gigahertz (GHz) Auflösung Spektralanalyse mit Sub-Sekunden Aufnahmezeit und Beleuchtungsleistung innerhalb der Sicherheitsgrenzen von biologischem Gewebe. Die mehrfachen neuen Anwendungen von dieser Verbesserung erleichtert sind currently in der biologischen Forschung und klinischer Anwendung erforscht.
Einleitung
Brillouin-Streuung, die zuerst von Leon Brillouin 1 1922 beschrieben, ist die unelastische Streuung von Licht aus der thermischen akustischen Moden in einer festen und aus den thermischen Dichteschwankungen in einer Flüssigkeit oder einem Gas. Die Spektralverschiebung des gestreuten Lichts, in der Regel in der Sub-GHz-Bereich, stellt Informationen über die Wechselwirkung zwischen dem einfallenden Licht und den akustischen Phononen in der Probe. Als Ergebnis kann nützliche Informationen hinsichtlich der viskoelastischen Eigenschaften des untersuchten Materials.
In seiner spontanen Version weist Brillouin-Streuung im allgemeinen Querschnitte in der Grßenordnung von Raman-Streuung, was in einem sehr schwachen Signal. Zusätzlich Brillouin-Frequenzverschiebungen sind um Größenordnungen kleiner als die Raman-Verschiebungen. Als Folge davon elastisch gestreute Licht (von Rayleigh und Mie-Streuung), Streulicht, und Back-Reflexionen an der Probe kann alle leicht überschatten die Brillouin spektrale Signatur. DaherMuss ein Brillouin-Spektrometer, um nicht nur zu erreichen Sub-GHz spektrale Auflösung, sondern auch hohe spektrale Kontrast oder vom Aussterben bedroht.
In traditionellen Brillouin Spektrometer diese Anforderungen von Raster Gittermonochromatoren optische schlagMethoden und am populärsten, Mehrfachabtastung Fabry-Perot-Interferometer 2 erfüllt. Diese Methoden messen jede spektrale Komponente der Reihe nach. Dieser Ansatz führt zu Erfassungszeiten für einzelne Brillouin Spektrum im Bereich von wenigen Minuten bis zu mehreren Stunden in Abhängigkeit von dem Gerät und auf der Probe. Das zweistufige VIPA Spektrometer aufgebaut unter Verwendung dieses Protokolls, hat die Fähigkeit, alle Spektralkomponenten innerhalb von weniger als einer Sekunde zu sammeln, während eine ausreichende Extinktion (> 60 dB) zu anderen Störsignalen 2 wirksam zu unterdrücken.
Die Integration der VIPA Etalons ist das Schlüsselelement dieses Spektrometers. Ein VIPA ist ein solides Etalon mit drei verschiedenen cFloating-Bereichen: in der vorderen Oberfläche, ermöglicht eine enge Antireflexbeschichtung Streifen das Licht, um das VIPA geben, während der Rest der Oberfläche verfügt über eine hochreflektierende (HR) Beschichtung; in der hinteren Fläche ermöglicht eine teilweise reflektierende Beschichtung ein kleiner Teil (ca. 5%) des Lichts zu übertragen sind. Wenn auf den schmalen Eingang des leicht geneigten VIPA fokussiert, wird der Lichtstrahl in Teilkomponenten mit festen Phasendifferenz innerhalb des VIPA 2 reflektiert. Interferenzen zwischen den Teilkomponenten erreicht die angestrebte hohe spektrale Dispersion. Sequentielles Ausrichten von zwei Vipas in Querachsenkonfiguration stellt spektrale Zerlegung in orthogonalen Richtungen 3. Die spektrale Dispersion in orthogonalen Richtungen räumlich trennt die Brillouin-Peaks vor unerwünschten Übersprechen, das es ermöglicht, holen nur die Brillouin-Signals ermöglicht. Abbildung 1 zeigt eine schematische Darstellung des zweistufigen VIPA-Spektrometer. Die Pfeile unterhalb der optischen Elemente zeigen die DEGreie Freiheits in dem die Translationsstufen orientiert werden sollte.

Abbildung 1. Instrumental-Setup. Eine optische Faser liefert die Brillouin-Streuung in das Spektrometer. Eine zylindrische Linse C1 (f = 200 mm) fokussiert das Licht in den Eingang des ersten VIPA (VIPA1). Eine weitere zylindrische Linse C2 (f = 200 mm) bildet die spektrale Winkeldispersion in eine räumliche Trennung in der Brennebene der C2. In dieser Ebene wird eine vertikale Maske verwendet, um den gewünschten Teil des Spektrums auszuwählen. Eine analoge Konfiguration folgt, bei 90 Grad geneigt ist. Der Strahl durch eine sphärische Linse S1 (f = 200 mm) und wird in den Eingangsschlitz des zweiten VIPA (VIPA2) konzentriert. Eine sphärische Linse S2 (f = 200 mm) erzeugt die zweidimensionale spektral getrennten Muster in ihrer Brennebene, wo eine andere horizontale Maske platziert ist. Die horrechten Maske wird auf das EMCCD Kamera über eine achromatische Linsenpaar abgebildet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Ein Bachelor-Student mit einigen Optik Kursarbeit und Grund Ausrichten Erfahrungen sollten in der Lage zu bauen und benutzen Sie diesen zweistufigen Spektrometer sein. Das Spektrometer wurde kürzlich gezeigt, mit einer Vielzahl von optischen Standard-Sonden 3,4,5 (zB Konfokalmikroskop Endoskop Spaltlampen Ophthalmoskop) kompatibel zu sein. Hier ist das Spektrometer mit einem konfokalen Mikroskop verbunden ist. Das Laserlicht wird, nachdem die Integration eines 90:10 Strahlteiler in einen Standardforschungs invertierten Mikroskopsystem ausgerichtet ist. Die Rückstreuung von Licht von der Probe wird in einer Einmodenfaser gekoppelt ist, so dass das Mikroskop konfokalen.
Protokoll
Anmerkung: Brillouin Spektralanalyse erfordert eine Einzellängsmode-Laser (~ 10 mW bei der Probe). Zum Ausrichten Zwecke, mit einem stark abgeschwächten Teil dieses Laserstrahls (<0,1 mW).
1. Initial Setup der Faser und der EMCCD (Electron Multiplizierte Charge Coupled Device) Kamera
- Identifizieren etwa 1.600 mm frei ausrichtenden Raum für das Spektrometer auf einem optischen Tisch.
- Montieren Sie das EMCCD Kamera auf das Ende des freien Ausrichten Raum.
- Verwenden Stellschrauben, um die Kamera an Beiträge anhängen. Ziehen Sie die Beiträge in der Posthalter an der gewünschten Höhe der optischen Achse. Ziehen Sie die Fachbereichs auf die optische Tisch mit Tischklemmen.
- Schalten Sie das EMCCD Kamera. Denken Sie an die Kamera Sättigung zu vermeiden.
- Installieren Sie die Kamera-Software auf Laborcomputer und schließen Sie die Kamera an den Computer an.
- Deaktivieren Sie die Verstärkung und stellen niedrigen Integrationszeit (~ 0.01 sec). Starten Sie den Erwerb EMCCD Bilder. Beobachten Sie das Kamerabilds auf dem Computerbildschirm.
- Montieren Sie den Faserkollimator ca. 1.600 mm vor der Kamera.
- Legen Sie die Faserkollimator im Faserkollimator Adapter.
- Montieren Sie den Adapter auf einem Post. Ziehen Sie die Post in eine Posthalter in der ungefähren Höhe der optischen Achse (Höhe der Kamera). Ziehen Posthalter auf optischen Tisch mit Tischklemmen.
- Ausrichten des Ausgangsstrahls entlang der optischen Achse.
- Verwenden Sie eine Stellschraube, um ein Standard-Blende an einem Pfosten zu verbinden. Ziehen Sie die Post in eine Posthalter.
- Platzieren der Blende vor dem Faserkollimator (<50 mm). Stellen Sie die Höhe der Iris, um den Strahl. Bewegen die Blende entlang der gewünschten optischen Achse, die direkt in der Kamera zeigen soll.
- Legen Sie eine optische Dichte-Filter direkt nach der Laserausgangsleistung, wenn die Kamera in Sättigung. Mithilfe der Stellschrauben Faserkollimator montieren, um den Strahl entlang der optischen Achse auszurichten. Sobald dies erreicht ist, dieStrahl sauber durch die Iris entlang der gesamten Strahlengang passieren.
- Montieren Sie eine abgestimmte Achromat Paar (f = 30 mm) vor der Kamera.
2. Horizontale Stufe des Spektrometers
- Montieren Sie die horizontale Maske.
- Verwenden Stellschrauben, um die horizontale Maske auf einen Beitrag anzuhängen. Ziehen Sie die Post in eine Posthalter. Montieren Sie die Stelleninhaber auf eine Translationsstufe, so dass die Maske, um horizontal in und aus dem Strahlengang schieben. (Figur 1)
- Verwenden Schrauben um die Translationsphase auf dem optischen Tisch, so daß die Maske scharf auf die CCD-Kamera in der Brennweite (f = 30 mm) der achromatischen Linsenpaar abgebildet anziehen.
- Halterung und Ausrichtung der sphärischen Linse S1 (f = 200 mm) 600 mm vor der horizontalen Maske.
- Verwenden Stellschrauben zu S1 auf einen Stelleninhaber zu montieren. Ziehen Sie die Post in eine Posthalter.
- Montieren Sie zwei Irisblenden wie in 1.5.1 beschrieben. Vor placing S1 im Strahlengang, legen Sie eine Blende vor und eine Blende, nachdem die gewünschte Position S1 (600 mm vor der horizontalen Maske). Einstellen der Höhe der Iris, daß der Strahl sauber durch beide hindurchtritt.
- Platzieren S1 600 mm vor der horizontalen Maske (Abbildung 1). Passen Sie Höhe und Winkel der S1 bis sowohl die Rückreflexion von der Linse und dem Out-kommenden Strahl, sauber durch die Iris übergeben. Ziehen Sie die Stelleninhaber hält S1 auf die optische Tisch mit Tischklemmen.
- Halterung VIPA2 in der Brennebene der Kugellinse (200 mm vor S1).
- Montieren Sie den VIPA Halter auf einem Pfosten mit den Schrauben mit dem Halter vorgesehen ist. Ziehen Sie die Post in eine Posthalter. Ziehen Sie die Stelleninhaber auf eine horizontale Verschiebetisch. (Figur 1)
- Zeigen VIPA2 vorsichtig in die VIPA Halter mit dem Eingangsspalt vertikal ausgerichtet. (Figur 1)
- Feineinstellung der Position of die VIPA montieren, um genau in der Brennebene S1 liegen. (Prüfen Sie, indem Sie der Strahltaille mit einer weißen Karte.)
- Verwenden Schrauben, um die Translationsstufe auf die optische Tisch und schieben VIPA2 aus dem Strahl mit der Freiheitsgrad der Translationsstufe fest.
- Halterung und Ausrichtung der sphärischen Linse S2 (f = 200 mm) 200 mm nach dem VIPA und 200 mm vor der horizontalen Maske. Folgen Sie dem in 2.2.1-2.2.3 beschriebenen Vorgehensweise. Anstelle der Befestigung der Stelleninhaber auf den optischen Tisch, montieren Sie ihn auf eine Stufe mit seinen translatorischen Freiheitsgrad entlang der optischen Achse ausgerichtet ist. (Abbildung 1) Verwenden Sie Schrauben, um die Translationsstufe auf die optische Tabelle anziehen.
- Verwenden Sie die horizontale Translationsstufe (2.3.4), die VIPA2 Eingang in den Strahlengang schieben. Beachten Sie vertikale Linien auf dem Kamerabild.
- Feineinstellung S2 mit der Translationsstufe 2.4 montiert, bis die vertikalen Linien auf dem Kamerabild angezeigtscharf.
- Passen Sie das Spektrum mit der horizontalen Neigefreiheitsgrad auf der VIPA Halter und der Translationsstufe. Verwenden Sie die horizontale-Übersetzung Freiheitsgrad zu stimmen den Eingang Position des Strahls in das Etalon. Verwenden der horizontalen Neigungsfreiheitsgrad zum Abstimmen des Eingangswinkel des Strahls in das Etalon.
- Messen Sie Finesse und Durchsatz.
- Nehmen Sie ein Bild durch Drücken der Taste F5 oder alternativ, indem Sie auf "Übernahme-Setup" in der oberen linken Ecke und wählen Sie die Option "Bild nehmen" in der Kamera-Software.
- Mit der rechten Maustaste auf das Bild und wählen Sie die Option "Liniendiagramm". Ziehen Sie den Cursor horizontal über das Bild, um ein Liniendiagramm zu erzeugen. Lassen Sie den Cursor, um die erzeugten Liniendiagramm zu beobachten.
- Verwenden Sie das Liniendiagramm, um die Finesse zu messen. Teilen Sie den Abstand zwischen zwei Spitzen, die durch ihre Halbwertsbreite (FWHM). Ziel für> 30.
- Bestimmen Sie den Durchsatz um measuring die Leistung mit einem Leistungsmesser unmittelbar vor und nach VIPA2. Zielen Sie auf> 50%.
- Tune die Eingangswinkel des Strahls in das Etalon mit dem Freiheitsgrad auf der VIPA Halter (2.6) und beobachten Sie den Trade-off zwischen Finesse und Durchsatz.
- Wenn Finesse und Durchsatz nicht zufriedenstellend sind zurück und Feineinstellung der Ausrichtung. Sicherstellen VIPA2 ist in der Brennebene S1. Wiederholen Sie die Schritte 2.3.3 -2.7.
3. Vertikale Stufe Spectrometer
- Schieben Sie den VIPA (VIPA2), in Teil 2 ausgerichtet ist, aus dem Strahl mit der Translationsstufe (2.3.4). 1-Abbildungssystem: Die horizontale Phase des Spektrometers wird nun als 1 verhalten.
- Montieren Sie die vertikale Maske.
- Verwenden Stellschrauben, um die vertikale Maske auf einen Beitrag anzuhängen. Ziehen Sie einen Beitrag zu einem rechten Winkel Beitrag Zangenadapter. Ziehen Sie einen zweiten Beitrag in die richtige Winkeladapter und steckte es in einen Stelleninhaber. Montieren Sie die Stelleninhaber auf eine vertikale Translationsstufe, allowing die Maske vertikal in und aus dem Strahlengang zu gleiten. (Figur 1)
- Verwendung Schrauben, die vertikale Translationsstufe auf den optischen Tisch, dass die vertikale Maske scharf auf die EMCCD- Kamera 200 mm vor S1 abgebildet anziehen.
- Halterung und richten Sie die Zylinderlinse C1 (f = 200 mm) 600 mm vor der vertikalen Maske.
- Schrauben Sie die Zylinderlinsenhalter auf einem Post. Ziehen Sie die Post in eine Posthalter. Vorsichtig C1 in den Linsenhalter und die Schrauben anziehen, um es zu fixieren.
- Montieren Sie zwei Irisblenden wie in 1.5.1 beschrieben. Vor dem Einsetzen C1 im Strahlengang, legen Sie eine Blende vor und eine Blende, nachdem die gewünschte Position S1 (600 mm vor der vertikalen Maske). Einstellen der Höhe der Iris, daß der Strahl sauber durch beide hindurchtritt.
- Ort C1 600 mm vor der vertikalen Maske (Abbildung 1). Die Höhe, Neigung und seitliche Position C1 bis vorsichtig einstellenSowohl der Rückreflexion von der Linse und der out-kommenden Strahl, werden auf der Iris zentriert ist. Ziehen Sie die Stelleninhaber Halte C1 auf die optische Tisch mit Tischklemmen.
- Halterung VIPA1 in der Fokusebene der Zylinderlinse (200 mm vor C1).
- Montieren Sie den VIPA Halter auf einem Post mit der Schraube mit dem Halter vorgesehen ist. Ziehen Sie die Post in eine Posthalter. Ziehen Sie die Stelleninhaber auf eine vertikale Verschiebetisch. (Figur 1)
- Zeigen VIPA1 vorsichtig in die VIPA Halter mit dem Eingangsspalt horizontal ausgerichtet. (Figur 1)
- Feineinstellung der Position der VIPA montieren, um VIPA1 genau in der Brennebene der C1 zu platzieren. (Prüfen Sie, indem Sie der Strahltaille mit einer weißen Karte.)
- Verwenden Schrauben, um die vertikale Translationsstufe auf die optische Tisch ziehen und schieben VIPA1 aus dem Strahl mit der Freiheitsgrad der Translationsstufe.
- Montieren und ausrichtenZylinderlinse C2 (f = 200 mm) 200 mm nach VIPA1 und 200 mm vor der vertikalen Maske, nach dem in 3.3.1-3.3.3 beschriebenen Vorgehensweise. Anstelle der Befestigung der Stelleninhaber auf den optischen Tisch, montieren Sie ihn auf eine Stufe mit seinen translatorischen Freiheitsgrad entlang der optischen Achse ausgerichtet ist. (Abbildung 1) Verwenden Sie Schrauben, um die Translationsstufe auf die optische Tabelle anziehen.
- Verwenden Sie die Übersetzungsstufe (3.4.4), um die VIPA1 Eingang in den Strahlengang schieben. Beobachten horizontalen Linien auf dem Bild der Kamera.
- Feineinstellung C2 mit der Translationsstufe 3.5 montiert, bis die horizontalen Linien auf dem Kamerabild erscheint scharf.
- Passen Sie das Spektrum mit der vertikalen Neigefreiheitsgrad auf der VIPA Halter und der Translationsstufe. Verwenden die Vertikal Übersetzung Freiheitsgrad zur Abstimmung der Eintrittsposition des Strahls in dem Etalon. Verwenden die Vertikalneigungsfreiheitsgrad zum Abstimmen des Eingangswinkel des Strahls in die etalam.
- Messen Sie Finesse und Durchsatz.
- Führen Sie die Schritte 2.7.1 -2.7.2 um ein Liniendiagramm vertikal über einem Bild von dem Kameradisplay zu erzeugen.
- Verwenden Sie das Liniendiagramm, um die Finesse, indem man den Abstand zwischen zwei horizontalen Linien durch ihre Halbwertsbreite (FWHM) zu messen. Ziel für> 40.
- Messen Sie den Durchsatz durch Messen der Leistung mit einem Leistungsmesser unmittelbar vor und nach VIPA1. Zielen Sie auf> 30%.
- Abstimmung der vertikalen Eingangswinkel des Strahls in dem Etalon mit dem vertikalen Neigungsfreiheitsgrad auf dem VIPA Halter (3.7). Beachten Sie die Trade-off zwischen Finesse und Durchsatz.
- Wenn Finesse und Durchsatz nicht zufriedenstellend sind zurück und Feineinstellung der Ausrichtung. Sicherstellen VIPA1 ist in der Brennebene des C1. Wiederholen Sie Schritt 3.4.3-3.8.
4. Kombination der beiden Stufen und endgültige Ausrichtung
- Schieben Sie in VIPA2. Beobachten horizontal und vertikal beabstandeten Punkten. Diese Punkte are die spektrale Signatur des Einzelfrequenz-Laser. Passen Sie die Translationsstufen der Vipas, bis die Punkte scharf.
- Messen Sie Finesse und Durchsatz des Spektrometers.
- Führen Sie die Schritte 2.7.1.-2.7.2 um ein Liniendiagramm diagonal über zwei der Laserpunkte zu erzeugen.
- Verwenden Sie das Liniendiagramm, um Finesse aus der Division des diagonalen Abstand zwischen zwei Punkten, die durch ihre Halbwertsbreite (FWHM) zu messen. Ziel für> 30.
- Erstellen Sie eine Black Box, um das Spektrometer zu umschließen.
- Verwenden Konstruktion Schienen, die Box Skelett, das die gesamte Spektrometer vom Faserkollimator zur CCD-Kamera (63 x 9 x 15 in) umschließen soll bauen.
- Decken Sie die Box Skelett mit Blackout Stoff und kleben sie fest an den Ecken. Stellen Sie sicher, dass die Masken und die Vipas leicht zugänglich sind.
- Schließen Sie die Faser zu einem optischen Standard-Sonde, wie beispielsweise ein Reflexions Konfokalmikroskop 4. Standard optische pGewänder verwendet, um rückgestreute Licht zu sammeln durchführen wird eine Brillouin-Signals.
5. Messung der Brillouin-Verschiebung
- Schließen sowohl die vertikale und die horizontale Masken, bis die Laserschrift verschwindet. Verschieben Sie die Übersetzungsstufen entsprechend.
- Aktivieren Sie die Verstärkung und die Integrationszeit der Kamera so weit wie möglich zu erhöhen, ohne Sättigung des EMCCD Kamera.
- Beachten Sie die Brillouin-Verschiebung einer Probe.
- Legen Sie eine Probe im Fokus eines konfokalen Mikroskops (oder andere optische Sonde). Die räumliche Auflösung wird auf die Objektivlinse in dem konfokalen Mikroskop abhängen. Verwenden Sie eine Kunststoffschale oder eine Küvette für Flüssigkeiten. Verwenden Methanol für die erste Messung.
- Zum Spektrometer Durchsatz, öffnen Sie eine Maske in einer Zeit, zu optimieren und zu scannen durch die Spektrometer Bestellungen durch Kippen des VIPA und Anpassung der Verschiebetisch. Finden Sie die Reihenfolge, in der das Signal am stärksten erscheint. Schließen Maske wieder, bis the Lasersignal verschwindet. Wiederholen Sie mit der anderen Maske und VIPA (in 2.6 und 3.7 beschrieben).
- Nehmen Sie eine Messung der Probe.
- Nehmen Sie ein Bild des Spektrums folgenden Schritt 2.7.1.
- Erhalten Kalibrierungsmessungen, indem sie ein Bild des Spektrums von Wasser und Glas (oder eine andere Probe mit bekannten Brillouin-Verschiebung). Speichern Sie das Bild, indem Sie auf "Datei" in der oberen linken Ecke und wählen Sie die Option "Speichern unter". Speichern Sie das Bild in "SIF" Format, wenn die Datenanalyse in der Kamera-Software durchgeführt. Speichern Sie das Bild in ".tif" Format, wenn die Datenanalyse in einem anderen Computersoftwareprogramm durchgeführt.
6. Kalibrierung und Analyse der Brillouin-Spektrum
- Bestimmen Sie die freie Spektralbereich (FSR) und der EMCCD Pixel zu optischen Frequenzumwandlungsverhältnis (PR) in der Brillouin-Spektrometer.
- Laden Sie die Daten in der Kamera-Software oder einem anderen Computacentertionalen Software-Programm.
- Folgen Sie Schritt 2.7.2 um ein Liniendiagramm über das gesamte Spektrum von Wasser Kalibrierungsbild der zu generieren.
- Montieren Sie die beiden Spitzen des Spektrums mit Lorentz-Kurven, um Spitzenpositionen in Bezug auf die Pixelposition (P Wasser-S, P Wasser-AS) zu bestimmen. Alternativ können Sie die Spitzenpositionen ausgelesen manuell, indem sie den höchsten Punkt der Gipfel.
- Wiederholen Sie Schritt 6.1.2-6.1.3 mit dem Spektrum des Glases Kalibrierbild.
- Alternativ zu 6.1.1-6.1.4, fügen Sie beide EMCCD Rahmen und passen auf alle vier Peaks auf einmal. (Figur 2)
- Berechnen Sie die PR unter Verwendung von Gleichung 1. Schließen Sie die Werte für P Wasser-AS und P Glass-AS in 6.1.3 und 6.1.4 festgelegten. Ω Glass-AS bekannt, um 29,3 GHz. In diesem Fall, da der freie Spektralbereich ist nur 20 GHz wird die Frequenzverschiebung von 9,3 GHz aliased erscheinen. Der Einfachheit halber verwenden 9.3 GHz für Ω Glass-AS. Verwenden Sie 7,46 GHz für ΩWasser-AS.

- Berechnen Sie die FSR unter Verwendung von Gleichung 2. Schließen Sie die Werte für P Glass-S, P Glass-AS und PR, in 6,16 berechnet. Verwenden Sie 9,3 GHz für Ω Glass-AS.

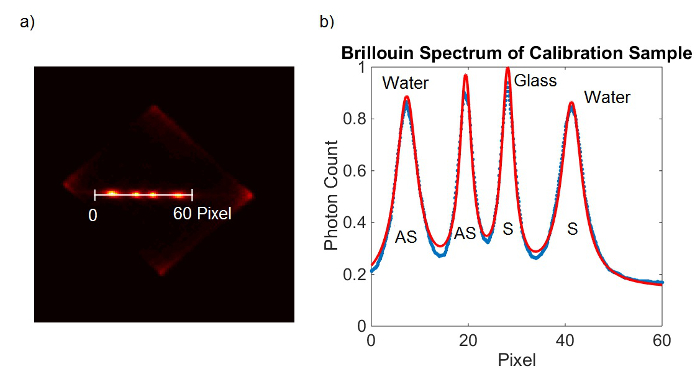
Abbildung 2. Spektrometer Kalibrierung. (A) EMCCD Kamera Rahmen aus Eichprobe erhalten. (B) Lorentz-Kurvenanpassung (rot) an die gemessenen Daten (blau). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Bestimmen Sie die Brillouin-Verschiebungein Beispiel.
- Folgen Sie Schritt 2.7.2 um einen Zeilen über das gesamte Spektrum der Probe zu erzeugen.
- Montieren Sie die beiden Spitzen des Spektrums mit Lorentz-Kurven, um Spitzenpositionen in Bezug auf die Pixelposition zu bestimmen. Alternativ können Sie die Spitzenpositionen ausgelesen manuell, indem sie den höchsten Punkt der Gipfel.
- Verwenden Sie die folgenden Gleichungen 4 und 5 und die zuvor berechneten Werte für FSR und PR, um die Brillouin-Verschiebung der Probe zu berechnen.
Ergebnisse
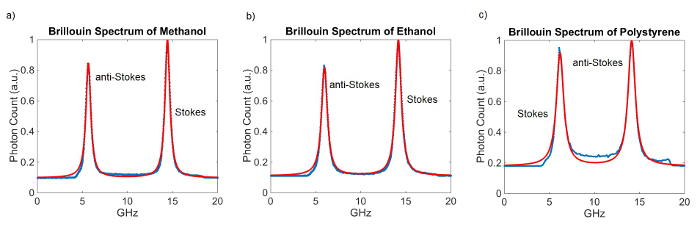
Abbildung 3 zeigt repräsentative Brillouin-Spektren und ihre Sitze für verschiedene Materialien. Die Vipas beide eine Dicke von 5 mm, die in einem FSR Ergebnisse von ungefähr 20 GHz. Die Integrationszeit für diese Messungen betrug 100 msec. 100 Messungen durchgeführt und gemittelt. Ein Kalibrierungsmessung wurde vor dem Erwerb der Spektren aufgenommen.
Diskussion
Ein wesentliches Konstruktionsmerkmal dieses Spektrometers Konfiguration ist, dass die beiden Stufen unabhängig ausgerichtet werden. Wenn ein VIPA Etalon wird aus dem optischen Weg geschoben, werden die restlichen Linsen des Spektrometers Stufe bilden ein 1: 1-Abbildungssystem, so dass die spektrale Muster von jeder Stufe wird auf die CCD-Kamera abgebildet. Daher ist es einfach, wieder auf eine der beiden Stufen zu gehen, um seine Leistung, ohne die Ausrichtung der anderen Stufe zu verbessern. Die Menge der Translation...
Offenlegungen
Giuliano Scarcelli and Seok H. Yun hold patents related to Brillouin spectroscopy technology.
Danksagungen
This work was supported in part by the National Institutes of Health (P41-EB015903, R21EY023043, K25EB015885), National Science of Foundation (CBET-0853773) and Human Frontier Science Program (Young Investigator Grant).
Materialien
| Name | Company | Catalog Number | Comments |
| OPTICS | |||
| VIPA (virtual image phase array) | LIGH MACHINERY | Quantity: 2 | |
| Bundle of Three 423 Linear Stages with SM-25 Micrometers | NEWPORT | 423-MIC | Quantity: 1 |
| SS Crossed-Roller Bearing Translation Stage, 0.5 in., 8-32, 1/4-20 | NEWPORT | 9066-X | Quantity: 1 |
| Vernier Micrometer, 13 mm Travel, 9 lb Load Capacity, 50.8 TPI | NEWPORT | SM-13 | Quantity: 1 |
| Adjustable Width Slit | NEWPORT | SV-0.5 | Quantity: 2 |
| Compact Dovetail Linear Stage, 0.20 in. Z Travel, 1.57x1.57x1.38 in. | NEWPORT | DS40-Z | Quantity: 2 |
| Slotted Base Plate, 25 or 40 mm to 65 mm Stage, 1.1 in. Range | NEWPORT | B-2B | Quantity: 2 |
| Ø1/2" Optical Post, 8-32 Setscrew, 1/4"-20 Tap, L = 2", 5 Pack | THORLABS | TR2-P5 | Quantity: 2 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrews, L = 2", 5 Pack | THORLABS | PH2-P5 | Quantity: 1 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L = 3", 5 Pack | THORLABS | PH3-P5 | Quantity: 1 |
| Imperial Lens Mount For 2" Optics, 8-32 Tap | THORLABS | LMR2 | Quantity: 2 |
| f=200.0 mm, Ø2" Achromatic Doublet, ARC: 400-700 nm | THORLABS | AC254-200-A | Quantity: 2 |
| Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Right Handed | THORLABS | KM100C | Quantity: 2 |
| Fixed Cylindrical Lens Mount, Max Optic Height: 1.60" (40.6 mm) | THORLABS | CH1A | Quantity: 2 |
| f=200.00 mm, H=30.00 mm, L=32.0 mm, N-BK7 Plano-Convex Cylindrical Lens, Antireflection Coating: 350-700 nm | THORLABS | L1653L1-A | Quantity: 2 |
| Right-Angle Post Clamp, Fixed 90° Adapter | THORLABS | RA90 | Quantity: 1 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | THORLABS | SM1A9 | Quantity: 1 |
| Studded Pedestal Base Adapter, 1/4"-20 Thread | THORLABS | PB4 | Quantity: 2 |
| Spacer, 2" x 3", 1.000" Thick | THORLABS | Ba2S7 | Quantity: 2 |
| 543 nm, f=15.01 mm, NA=0.17 FC/APC Fiber Collimation Pkg. | THORLABS | F260APC-A | Quantity: 1 |
| SM1-Threaded Adapter for Ø11 mm collimators | THORLABS | Ad11F | Quantity: 1 |
| Translating Lens Mount for Ø1" Optics, 1 Retaining Ring Included | THORLABS | LM1XY | Quantity: 1 |
| Single Mode Patch Cable, 450 - 600 nm, FC/APC, 2 m Long | THORLABS | P3-460B-FC-2 | Quantity: 1 |
| 1:1 Matched Achr. Pair, f1=30 mm, f2=30 mm, BBAR 400-700 nm | THORLABS | MAP103030-A | Quantity: 1 |
| SM1 Lens Tube…length to adjust depend on CCD, we have 3.5 inches | THORLABS | SM1LXX | Quantity: 1 |
| Base Adapters for Ø1/2" Post Holders and Ø1" Posts | THORLABS | BE1 | Quantity: 8 |
| Clamping Forks for Ø1/2" Post Holders and Ø1" Posts | THORLABS | CF125 | Quantity: 8 |
| HW-KIT5 - 4-40 Cap Screw and Hardware Kit for Mini-Series | THORLABS | HW-KIT5 | Quantity: 1 |
| D20S - Standard Iris, Ø20.0 mm Max Aperture | THORLABS | D20S | Quantity: 2 |
| FOR ENCLOSURE | |||
| 25 mm Construction Rail, L = 21" | THORLABS | XE25L21 | Quantity: 6 |
| 1" Construction Cube with Three 1/4" (M6) Counterbored Holes | THORLABS | RM1G | Quantity: 8 |
| Right-Angle Bracket for 25 mm Rails | THORLABS | XE25A90 | Quantity: 12 |
| 25 mm Construction Rail, L = 15" | THORLABS | XE25L15 | Quantity: 4 |
| 25 mm Construction Rail, L = 9" | THORLABS | XE25L09 | Quantity: 8 |
| High Performance Black Masking Tape, 2" x 60 yds. (50 mm x 55 m) Roll | THORLABS | T743-2.0 | Quantity: 1 |
| Low-Profile T-Nut, 1/4"-20 Tapped Hole, Qty: 10 | THORLABS | XE25T3 | Quantity: 1 |
| 1/4"-20 Low-Profile Channel Screws (100 Screws/Box) | THORLABS | SH25LP38 | Quantity: 1 |
| 60" (W) x 3 yds. (L) x 0.005" (T) (1.5 m x 2.7 m x 0.12 mm) Blackout Fabric | THORLABS | BK5 | Quantity: 1 |
| CAMERA, LASER and MICROSCOPE | |||
| EMCCD camera | ANDOR | iXon Ultra 897 | Quantity: 1 |
| 400 mW single mode green laser | LASER QUANTUM | torus 532 | Quantity: 1 |
| Research Inverted System Microscope | OLYMPUS | IX71 | Quantity: 1 |
Referenzen
- Brillouin, L. Diffusion de la lumiere et des rayonnes X par un corps transparent homogene; influence del'agitation thermique. Ann. Phys. (Paris) . 17, 88-122 (1922).
- Scarcelli, G., Yun, S. H. Multistage VIPA etalons for high-extinction parallel Brillouin spectroscopy. Opt. Exp. 19 (11), 10913-10922 (2011).
- Scarcelli, G. Confocal Brillouin microscopy for three-dimensional mechanical imaging. Nat. Phot. 2 (1), 39-43 (2008).
- Nichols, A. J., Evans, C. L. Video-rate Scanning Confocal Microscopy and Microendoscopy. J. Vis. Exp. (56), e3252 (2011).
- Steelman, Z., Meng, Z., Traverso, A. J., Yakovlev, V. V. Brillouin spectroscopy as a new method of screening for increased CSF total protein during bacterial meningitis. J. Biophoton. 8 (5), 1-7 (2014).
- Koski, K. J., Yarger, J. L. Brillouin imaging. Appl. Phys. Lett. 87 (6), 061903 (2005).
- Faris, G. W., Jusinski, L. E., Hickman, A. P. High-resolution stimulated Brillouin gain spectroscopy in glasses and crystals. J. Opt. Soc. Am. B. 10 (4), 587-599 (1993).
- Scarcelli, G., Yun, S. H. In vivo Brillouin optical microscopy of the human eye. Opt. Exp. 20 (8), 9197-9202 (2012).
- Scarcelli, G., Besner, S., Pineda, R., Kalout, P., Yun, S. H. In Vivo Biomechanical Mapping of Normal and Keratoconus Corneas. Jama Ophtalmol. , (2015).
- Scarcelli, G., Kim, P., Yun, S. H. In Vivo Measurement of Age-Related Stiffening in the Crystalline Lens by Brillouin Optical Microscopy. Biophys. J. 101 (6), 1539-1545 (2011).
- Antonacci, G., Foreman, M. R., Paterson, C., Török, P. Spectral broadening in Brillouin imaging. Appl. Phys. Lett. 103 (22), 221105 (2013).
- Meng, Z., Traverso, A. J., Yakovlev, V. Background clean-up in Brillouin microspectroscopy of scattering medium. Opt. Exp. 22 (5), 5410-5415 (2014).
- Reiss, S., Burau, G., Stachs, O., Guthoff, R., Stolz, H. Spatially resolved Brillouin spectroscopy to determine the rheological properties of the eye lens. Biomed. Opt. Exp. 2 (8), 2144-2159 (2011).
- Scarcelli, G., Kling, S., Quijano, E., Pineda, R., Marcos, S., Yun, S. H. Brillouin microscopy of collagen crosslinking: noncontact depth-dependent analysis of corneal elastic modulus. Invest. Ophthalmol. Vis. Sci. 54 (2), 1418-1425 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten