JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
브릴 루앙 산란 분석을위한 고속 서브 GHz의 분광계
요약
여기에서 우리는 빠른 브릴 루앙 분광계를 구축 할 수있는 프로토콜을 제시한다. 실제로 묘화 위상 어레이 계단식 (VIPA) 탈론 이상 1,000 배 빠른 전통적인 주사 패브리 페롯보다 분광계 측정 속도를 달성한다. 이러한 개선은 생체 내에서 낮은 전력 레벨에서 조직 및 생체 재료의 브릴 리언 분석하는 수단을 제공한다.
초록
이 프로토콜의 목적은 병렬 높은 흡광 고해상도 브릴 루앙 광 분광계를 구축하는 것이다. 브릴 리언 스펙트럼은 점탄성 재료 특성의 직접적인 판독 값을 얻기 위해 사용할 수있는 비접촉 측정 방법이다. 그것은 물질의 특성, 구조 모니터링 및 환경 감지에 유용한 도구가되고있다. 과거에는, 브릴 리언 스펙트럼은 일반적으로 스펙트럼 분석을 수행하는 주사 파브리 - 페롯에 탈론을 사용했다. 이 과정은 생물 의학 응용 프로그램에 적합하지 않은 기술을, 높은 조명 전력과 긴 획득 시간을 필요로한다. 최근 도입 된 새로운 분석계는 교차 축 배열 된 2 VIPAs을 이용함으로써 이러한 문제를 극복한다. 이러한 혁신은 생체 조직의 안전 한계 내에서 서브 초 획득 시간 및 조명 전력으로 서브 (기가 헤르츠)의 고해상도 스펙트럼 분석을 가능하게한다. 이 개선에 의해 촉진 여러 새로운 응용 프로그램은 CU 있습니다rrently 생물학 연구 및 임상 응용 프로그램에서 탐구되고.
서문
먼저 1922 년에 레온 브릴 루앙 (1)에 의해 설명 브릴 루앙 산란은, 고체 및 액체 또는 가스의 열 밀도 변동에서 열 음향 모드에서 빛의 비탄성 산란입니다. 일반적으로, 서브 - 헤르쯔 범위의 산란광의 스펙트럼의 시프트는, 입사광과 샘플 음향 포논 상호 작용에 대한 정보를 제공한다. 그 결과, 시험 물질의 점탄성 특성에 관한 유용한 정보를 제공 할 수있다.
그 자발 버전에서는 브릴 루앙 산란은 일반적으로 매우 약한 신호의 결과로, 라만 산란의 순서의 단면을 갖는다. 또한, 브릴 루앙 주파수 변화는 라만 변화보다 작은 크기의 주문이다. 결과적으로, 탄성, 미광, 백 반사 (레일리 또는 미 산란에서) 모든 쉽게 브릴 루앙 스펙트럼 서명을 압도 할 수있는 샘플 떨어져 빛을 산란. 금후, 브릴 루앙 분광계는 서브 GHz의에게 스펙트럼 해상도뿐만 아니라 높은 스펙트럼 대비 또는 멸종을 달성 할뿐만 아니라 필요가있다.
전통적인 브릴 루앙 분광계에서 이러한 요구 사항은 가장 널리 주사 격자 단색화, 광 비팅 방법 및, 다중 - 통과 주사 파브리 - 페로 간섭계 (2)에 의해 충족된다. 이러한 방법은 각각의 스펙트럼 성분을 순차적으로 측정한다. 이 방법은 악기와 샘플에 따라 몇 시간 몇 분에 이르기까지 하나의 브릴 리언 스펙트럼에 대한 수집 시간에 이어집니다. 이 프로토콜을 사용하여 구축 이단 VIPA 분광계는 효과적으로 다른 스퓨리어스 2를 억제하기에 충분한 소멸 (> 60dB)를 제공하면서보다 작은 초 이내에 스펙트럼 성분의 전부를 수집하는 기능을 갖는다.
VIPA 탈론의 통합이 분광기의 핵심 요소이다. VIPA는 세 가지 다른 C와 고체에 탈론입니다영역 떠 : 표면의 나머지 부분은 고 반사 (HR) 코팅을 갖추고하면서 표면에, 폭이 좁은 반사 방지막 스트립, 광 VIPA를 입력 할 수; 배면에, 부분적으로 반사 코팅은 광의 작은 부분 (~ 5 %)를 송신 할 수있다. 약간 기울어 VIPA의 좁은 입구에 집중되면, 광 빔은 2 VIPA 내의 고정 된 위상차와 하위 구성 요소에 반영 얻는다. 하위 구성 요소 간의 간섭이 갈망 높은 스펙트럼 분산을 달성한다. 교차 축 구성에 순차적으로 두 VIPAs를 정렬하면 직교 방향으로 3 스펙트럼 분산을 소개합니다. 직교 방향의 스펙트럼 분산은 공간적으로 가능 만 브릴 루앙 신호를 포착 할 수 있습니다 원치 않는 크로스 토크에서 브릴 루앙 피크를 분리한다. (1) 표시를 2 단계 VIPA 분광계의 개략적 인 그림. 광학 요소 아래 화살표를 표시 ℃에서병진 스테이지가 지향되어야하는 자유 REE.

그림 1. 기악 설치. 광섬유는 분광계에 브릴 루앙 산란을 제공합니다. 원통형 렌즈 C1 (F = 200mm)는 제 VIPA (VIPA1)의 입구에 빛을 집중한다. 다른 원통형 렌즈 C2 (F = 200mm)은 C2의 초점면에서 공간적으로 분리 된 스펙트럼 각도 소산을 매핑한다. 이 평면에서, 수직 마스크 스펙트럼의 원하는 부분을 선택하는데 사용된다. 유사한 구성이 90 도로 기울어 져, 다음과 같다. 빔은 구면 렌즈 S1 (F = 200mm)을 통과하여 제 VIPA (VIPA2)의 입구 슬릿에 집중된다. 구면 렌즈 (S2) (F = 200mm)는 다른 수평 마스크를 배치의 초점면에있는 두 개의 차원 스펙트럼 분리 패턴을 생성합니다. 호르냅 마스크가 무색 렌즈 쌍을 사용 EMCCD 카메라 상에 묘화된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
일부 광학의 과정과 기본 정렬 경험이있는 학부 학생 구축하고이 두 단계 분광계를 사용할 수 있어야합니다. 분광계 최근 표준 광학 프로브의 다양한 3,4,5- (예를 들어, 공 초점 현미경, 내시경, 세극등 검안경)와 호환하는 것으로 나타났다. 여기에서, 분석 장치는 공 초점 현미경에 접속된다. 레이저 광은 90:10 빔 스플리터를 통합 한 후 표준 연구 도립 현미경 시스템에 정렬된다. 샘플로부터의 산란 광은 공 초점 현미경을, 단일 모드 광섬유로 연결된다.
프로토콜
참고 : 브릴 루앙 스펙트럼 분석은 단일 종 모드 레이저 (~ 샘플에서 10 mW의)가 필요합니다. 목적을 정렬하기위한,이 레이저 빔 (<0.1 MW)의 강하게 감쇠 된 부분을 사용한다.
1. 초기 섬유의 설치 및 EMCCD (전자 곱한 전하 결합 소자) 카메라
- 광학 테이블에 분광계 약 1,600mm 무료 정렬 공간을 확인합니다.
- 배향 자유 공간의 끝에 EMCCD 카메라를 탑재.
- 게시물에 카메라를 부착 세트 나사를 사용합니다. 원하는 광축 높이 포스트 홀더에 게시물을 조입니다. 테이블 클램프를 사용하여 광학 테이블에 포스트 홀더를 조입니다.
- EMCCD 카메라를 켭니다. 카메라 포화를 피하기 위해 염두해야합니다.
- 실험실 컴퓨터에 카메라 소프트웨어를 설치하고 카메라를 컴퓨터에 연결합니다.
- 게인을 해제하고 낮은 적분 시간 (~ 0.01 초)을 설정합니다. EMCCD 이미지를 획득 시작합니다. 카메라 영상을 관찰컴퓨터 화면의.
- 카메라 앞에서 1,600mm에 대한 섬유 콜리메이터를 탑재합니다.
- 섬유 콜리메이터 어댑터 섬유 콜리메이터를 놓습니다.
- 게시물에 어댑터를 탑재합니다. 광축 (카메라의 높이)의 대략적인 높이에서 게시물 홀더에 게시물을 조입니다. 테이블 클램프를 사용하여 광학 테이블에 포스트 홀더를 조입니다.
- 광축을 따라 출력 빔을 맞 춥니 다.
- 게시물에 표준 조리개를 연결하는 고정 나사를 사용합니다. 포스트 홀더에 게시물을 조입니다.
- 섬유 콜리메이터 (<50mm)의 앞에 조리개를 놓습니다. 빔에 홍채의 높이를 조정합니다. 카메라에 직접 가리켜 야 원하는 광축을 따라 조리개를, 이동합니다.
- 카메라 포화 경우 레이저 출력 후 직접 광학 밀도 필터를 삽입합니다. 광축을 따라 빔을 정렬하기 위해 마운트 광섬유 콜리메이터의 조정 나사를 사용한다. 이것이 달성되면,빔은 깨끗하게 전체 빔의 경로를 따라 조리개를 통해 전달합니다.
- 카메라 앞에서 일치 무색 렌즈 쌍 (F = 30mm)를 탑재합니다.
분광계 2. 수평 단계
- 수평 마스크를 탑재합니다.
- 게시물에 수평 마스크를 부착 세트 나사를 사용합니다. 포스트 홀더에 게시물을 조입니다. 마스크와 빔 경로에서 수평으로 밀어 수 있도록 번역 무대에 포스트 홀더를 탑재합니다. (그림 1)
- 마스크가 무색 렌즈 쌍의 초점 거리 (F = 30mm)의 CCD 카메라에 급격하게 이미지화되도록 광학 테이블에 번역 단계를 강화하는 캡 나사를 사용합니다.
- 마운트와는 구면 렌즈 (S1) (F = 200mm) 수평 마스크의 전면에 600mm를 맞 춥니 다.
- 포스트 홀더에 (S1)를 탑재 세트 나사를 사용합니다. 포스트 홀더에 게시물을 조입니다.
- 1.5.1에 기술 된 바와 같이 두 개의 홍채를 탑재합니다. placi 전NG (S1)는 빔 경로에 이전 한 홍채 원하는 S1 위치로 한 홍채 (수평 마스크의 앞 600mm)를 삽입합니다. 빔이 깨끗하게 둘 다 통과하도록 창포의 높이를 조정합니다.
- (S1)을 수평 마스크의 앞 600mm (그림 1)을 놓습니다. 모두 때까지 높이와 S1의 각도를 조정, 렌즈와 아웃 오는 빔의 오프 다시 반사, 깨끗하게 붓꽃을 통해 전달합니다. 테이블 클램프를 사용하여 광학 테이블에 S1을 들고 포스트 홀더를 조입니다.
- 구면 렌즈의 초점면에 장착 VIPA2 (S1 앞 200mm).
- 홀더와 함께 제공되는 나사를 사용하여 게시물에 VIPA 홀더를 탑재합니다. 포스트 홀더에 게시물을 조입니다. 수평 이동 스테이지에 포스트 홀더를 조입니다. (그림 1)
- 수직 방향의 입구 슬릿 VIPA 홀더에 조심스럽게 VIPA2를 놓습니다. (그림 1)
- 위치 (O)를 미세 조정F VIPA은 S1의 초점면에 정확히으로 마운트합니다. (흰색 카드와 빔 허리를 추적하여 확인합니다.)
- 번역 단계의 자유도를 사용하여 빔에서 광학 테이블 및 슬라이드 VIPA2에 번역 단계를 강화하는 캡 나사를 사용합니다.
- 마운트와는 구면 렌즈 (S2) (F = 200mm) VIPA 후 200mm 수평 마스크의 전면에 200mm를 맞 춥니 다. 2.2.1-2.2.3에 설명 된 절차를 따르십시오. 대신 광학 테이블에 포스트 홀더를 부착, 광학 축을 따라 중심의 자유의 정도와 병진 무대에 마운트. (그림 1) 광학 테이블 위에 병진 단계를 강화하는 캡 나사를 사용합니다.
- 빔 경로에 VIPA2 입구를 밀어 수평 병진 단계 (2.3.4)를 사용합니다. 카메라 영상에 수직 라인을 준수하십시오.
- 카메라 이미지의 세로 선이 나타날 때까지 2.4에 장착 된 번역 단계를 사용하여 (S2)을 미세 조정날카로운.
- VIPA 홀더에 자유의 수평 기울기 정도와 병진 무대 스펙트럼을 조정합니다. 탈론으로 조정 빔의 입구 위치를 자유의 수평 번역 정도를 사용합니다. 탈론으로 조정 빔의 입력 각도를 자유의 수평 기울기 정도를 사용합니다.
- 기교 및 처리량을 측정합니다.
- 왼쪽 상단의 "획득 설치"를 클릭하고 옵션 카메라 소프트웨어에서 "이미지를 촬영"을 선택하여 대안 F5 키를 누르거나하여 이미지를 가져 가라.
- 이미지를 마우스 오른쪽 버튼으로 클릭하고 옵션 "선 그림"를 선택합니다. 선 그림을 생성하는 이미지를 가로 질러 수평으로 커서를 끕니다. 생성 된 선 그림을 관찰하기 위해 커서를 놓습니다.
- 기교를 측정하기 위해 선 그림을 사용하십시오. 반 최대 (FWHM)에서 자신의 전체 폭에 의해 두 봉우리 사이의 거리를 나눕니다. > 30 목표.
- measurin하여 처리량을 결정G 직전과 VIPA2 후 파워 미터와 전원. > 50 % 목표.
- 조정 VIPA 홀더 (2.6)에 자유의 정도에 탈론으로 빔의 입력 각도와 트레이드 오프 기교와 처리량 사이를 관찰합니다.
- 기교 및 처리량이 만족하지 않은 경우 다시 가서 정렬을 미세 조정합니다. 확인 VIPA2은 S1의 초점면에 있습니다. 반복 2.3.3 -2.7 단계를 반복합니다.
분광계 3. 수직 무대
- VIPA (VIPA2)를 밀어 번역 단계 (2.3.4)를 사용하여 빔에서, 2 부에 정렬됩니다. 1 이미징 시스템 : 분광계의 수평 단계는 지금 1로 작동합니다.
- 수직 마스크를 탑재합니다.
- 게시물에 수직 마스크를 부착 세트 나사를 사용합니다. 직각 포스트 클램프 어댑터에 게시물을 조입니다. 직각 어댑터에 두 번째 게시물을 조이고 게시물 홀더에 넣어. 수직 병진 무대, allowi에 포스트 홀더를 장착마스크를 겨 것은 및 빔 경로에서 수직으로 밀어 넣습니다. (그림 1)
- 사용 캡 나사는 수직 마스크가 EMCCD 카메라에 급격히 S1의 앞에 200mm 군데되도록 광학 테이블 위에 수직 병진 스테이지를 조입니다.
- 마운트 C1 원통형 렌즈 (F = 200mm) 수직 마스크 앞 600mm 맞추고.
- 게시물에 원통형 렌즈 홀더 나사. 포스트 홀더에 게시물을 조입니다. 조심스럽게 렌즈 홀더에 (C1)를 배치하고 제자리에 고정 나사를 조입니다.
- 1.5.1에 기술 된 바와 같이 두 개의 홍채를 탑재합니다. 빔 경로 (C1)를 배치하기 전에, 전에 한 홍채 원하는 S1 위치로 한 홍채 (수직 마스크의 앞 600mm)를 삽입합니다. 빔이 깨끗하게 둘 다 통과하도록 창포의 높이를 조정합니다.
- 장소 C1 수직 마스크의 앞 600mm (그림 1). 조심스럽게 높이, 기울기 및 C1의 측면 위치까지를 조정모두 렌즈와 밖으로 나오는 빔의 오프 다시 반사, 홍채에 중심에있다. 테이블 클램프를 사용하여 광학 테이블에 포스트 홀더 유지 (C1)를 조입니다.
- 원통형 렌즈의 초점면에서 마운트 VIPA1 (C1 앞 200mm).
- 홀더와 함께 제공되는 나사를 사용하여 게시물에 VIPA 홀더를 탑재합니다. 포스트 홀더에 게시물을 조입니다. 수직 번역 무대에 포스트 홀더를 조입니다. (그림 1)
- 가로 방향 입구 슬릿 VIPA 홀더에 조심스럽게 VIPA1를 놓습니다. (그림 1)
- VIPA의 위치 (C1)의 초점면에 정확히 VIPA1을 배치 마운트 미세 조정합니다. (흰색 카드와 빔 허리를 추적하여 확인합니다.)
- 사용 캡 나사는 광학 테이블 위에 수직 병진 단계를 강화하고, 번역 단계의 자유도를 사용하여 빔에서 VIPA1을 밀어 넣습니다.
- 마운트 및 정렬원통형 렌즈 C2 (F = 200mm) 3.3.1-3.3.3에서 설명 된 절차에 따라, VIPA1 후 200mm 및 수직 마스크 앞 200mm. 대신 광학 테이블에 포스트 홀더를 부착, 광학 축을 따라 중심의 자유의 정도와 병진 무대에 마운트. (그림 1) 광학 테이블 위에 병진 단계를 강화하는 캡 나사를 사용합니다.
- 빔 경로에 VIPA1 입구를 슬라이드로 이동 스테이지 (3.4.4)를 사용합니다. 카메라 영상에 수평 라인을 준수하십시오.
- 카메라 이미지의 수평 라인이 선명 나타날 때까지 3.5에 장착 된 번역 단계를 사용하여 C2를 미세 조정합니다.
- VIPA 홀더에 자유의 수직 기울기 정도와 병진 무대 스펙트럼을 조정합니다. 탈론으로 조정 빔의 입구 위치를 자유의 수직 변환 정도를 사용합니다. 의 문헌 선국 빔의 입력 각도를 자유 수직 틸트 정도를 사용에.
- 기교 및 처리량을 측정합니다.
- 카메라 화면의 이미지에 걸쳐 수직으로 선 그림을 생성하는 단계 2.7.1 -2.7.2을 따르십시오.
- 반값 (FWHM)에서 전체 폭만큼 자신의 두 라인 사이의 수평 거리를 나누어 피네스를 측정하는 선 그림을 사용한다. > (40)에 대한 목표.
- 직전 및 VIPA1 후 전력계와 전력을 측정함으로써 스루풋을 측정한다. > 30 % 목표.
- 조정 VIPA 홀더 (3.7)에 자유의 수직 기울기 정도에 탈론으로 빔의 수직 입력 각도. 기교 및 처리량 사이의 트레이드 오프를 관찰한다.
- 기교 및 처리량이 만족하지 않은 경우 다시 가서 정렬을 미세 조정합니다. 확인 VIPA1는 C1의 초점면에 있습니다. 단계를 반복 3.4.3-3.8.
두 단계 및 최종 정렬 4. 조합
- VIPA2에 밀어 넣습니다. 수평 및 수직 간격으로 점을 관찰한다. 이러한 점단일 주파수 레이저의 스펙트럼 특성 재. 점 선명 때까지 VIPAs의 번역 단계를 조정합니다.
- 분광계의 기교 및 처리량을 측정합니다.
- 단계에 따라 2.7.1.-2.7.2을 대각선으로 레이저 도트의 두 걸쳐 선 그림을 생성 할 수 있습니다.
- 반 최대 (FWHM)에서 자신의 전체 폭에 의해 두 점 사이의 대각선 거리를 나누어 기교를 측정하기 위해 선 그림을 사용하십시오. > 30 목표.
- 분광계를 둘러싸는 블랙 박스를 구축 할 수 있습니다.
- (에 X 15 X 9와 63) CCD 카메라에 섬유 콜리메이터에서 전체 분광계를 동봉해야 상자 골격을 구축하기 위해 건설 레일을 사용합니다.
- 정전 패브릭 상자 골격을 덮고는 구석에 꽉 테이프. 마스크와 VIPAs 쉽게 액세스 할 수 있는지 확인합니다.
- 이러한 반사 공 초점 현미경 (4)와 같은 표준 광학 프로브에 섬유를 연결합니다. 표준 광학 P후방 산란 빛을 수집하는 데 사용 가운은 브릴 루앙 신호를 수행한다.
5. 브릴 루앙 Shift 키를 측정
- 근접 모두 수직 및 수평 마스크 레이저 서명이 사라질 때까지. 따라서 번역의 단계를 이동합니다.
- 이득을 활성화하고 EMCCD 카메라 포화없이 가능한 카메라의 통합 시간을 증가시킨다.
- 시료의 브릴 리언 시프트를 관찰한다.
- 공 초점 현미경 (또는 다른 광학 프로브)의 초점에 샘플을 놓습니다. 공간 분해능은 공 초점 현미경에 사용되는 대물 렌즈에 의존 할 것이다. 플라스틱 접시 또는 액체 큐벳을 사용합니다. 첫 번째 측정을 위해 메탄올을 사용합니다.
- 한 번에 분광계 처리량 오픈 한 마스크를 최적화하고 VIPA 틸팅 및 번역 단계를 조정하여 분광계 주문을 통해 스캔합니다. 가장 강한 신호가 표시되는 순서를 찾는다. 일까지 닫기를 다시 마스크전자 레이저 신호가 사라집니다. 다른 마스크와 VIPA (2.6 및 3.7에 설명)을 반복합니다.
- 시료의 측정을.
- 단계 2.7.1 다음과 같은 스펙트럼의 이미지를 가져 가라.
- 물과 유리 (또는 알려진 브릴 루앙 변화와 다른 샘플)의 스펙트럼의 이미지를 고려하여 교정 측정을 얻습니다. 왼쪽 상단의 "파일"을 클릭하고 옵션을 "다른 이름으로 저장"을 선택하여 이미지를 저장합니다. 데이터 분석은 카메라 소프트웨어에서 수행되는 경우 "된 .sif"형식으로 이미지를 저장한다. 데이터 분석은 다른 계산하는 소프트웨어 프로그램으로 수행되는 경우 "이 .tif"형식으로 이미지를 저장한다.
6. 교정 및 분석 브릴 루앙 스펙트럼의
- 자유 스펙트럼 범위 (FSR)와 브릴 루앙 분광계 광학 주파수 변환 비율 (PR)에 EMCCD 픽셀을 결정합니다.
- 카메라 소프트웨어 또는 다른 computa에 데이터를로드적인 소프트웨어 프로그램.
- 물 보정 이미지의 스펙트럼에 걸쳐 선 그림을 생성하는 단계 2.7.2을 따르십시오.
- 화소 위치 (P-S 물, 물 P-AS)면에서의 피크의 위치를 결정하는 로렌츠 곡선 스펙트럼의 2 개의 피크를 장착한다. 또한, 피크의 가장 높은 점을 고려하여 수동으로 피크 위치를 참조하십시오.
- 유리 캘리브레이션 화상의 스펙트럼 단계를 반복 6.1.2-6.1.3.
- 또한 6.1.1-6.1.4에 모두 EMCCD 프레임을 추가하고 한 번에 네 개의 피크를 맞습니다. (그림 2)
- P 물-AS 및 P 유리 AS 6.1.3과 6.1.4의 결정에 대한 값에 식 1. 플러그를 사용하여 홍보를 계산합니다. Ω 유리 AS는 29.3 GHz의 것으로 알려져있다. 이 경우, 이후 자유 스펙트럼 범위가 9.3 기가 헤르쯔의 주파수 변위에 의해 표시 앨리어싱 20 기가 헤르쯔이다. 단순화를 위해 Ω 유리 AS 9.3 GHz의를 사용합니다. Ω에 대한 7.46 GHz의 사용물-AS.

- 6.16에서 계산 된 P 유리-S, P 유리 AS 및 홍보에 대한 값을 방정식 2. 플러그를 사용하여 FSR을 계산합니다. Ω 유리 AS 9.3 GHz의를 사용합니다.

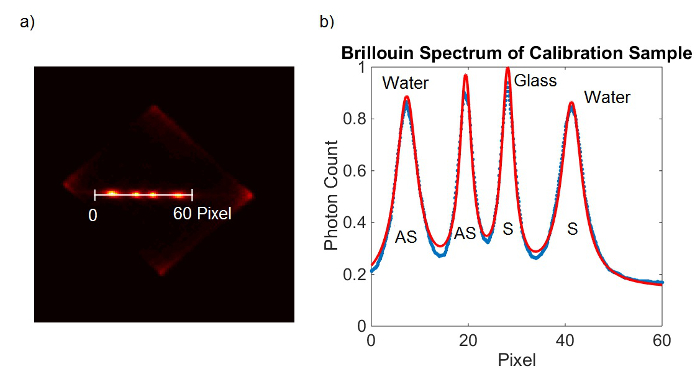
2. 분광계 교정 그림. (A) EMCCD 카메라 프레임은 보정 샘플로부터 얻어진. (B) 측정 된 데이터 (파란색)에 로렌츠 곡선 맞춤 (빨간색). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 의 브릴 루앙 변화를 결정샘플.
- 샘플의 스펙트럼에 걸쳐 라인 스캔을 생성하는 단계 2.7.2을 따르십시오.
- 화소 위치의 측면에서 피크의 위치를 결정하는 로렌츠 곡선 스펙트럼의 2 개의 피크를 장착한다. 또한, 피크의 가장 높은 점을 고려하여 수동으로 피크 위치를 참조하십시오.
- 시료의 브릴 리언 시프트를 계산하도록 FSR 및 PR은 다음 식 (4) 및 (5) 이전에 계산 된 값을 사용한다.
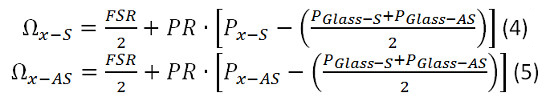
결과
그림 3은 대표적인 브릴 루앙 스펙트럼과 다른 재료에 대한 자신의 적합을 보여줍니다. VIPAs 모두 약 20 ㎓의 FSR의 결과 5mm의 두께를 갖는다. 이러한 측정을위한 통합 시간은 100 밀리 초이었다. (100) 측정을 수행하고 평균되었다. 하나의 교정 측정은 스펙트럼을 획득하기 전에 촬영했다.
토론
이 분광계 구성의 주요 설계 특징은 두 단계가 독립적으로 배향 될 수 있다는 것이다. 각 단계에서의 스펙트럼 패턴이 CCD 카메라에 결상되도록 한 촬상 시스템 : VIPA 탈론가 광로 밖으로 슬라이드하면 분광계 스테이지의 나머지 렌즈 (1)를 형성한다. 그러므로, 다른 단계의 배향에 영향을주지 않고 그 성능을 개선하는 단계 중 어느 하나에 돌아갈 간단하다. 프로토콜에서 제안하고 스테이지 병진 ?...
공개
Giuliano Scarcelli and Seok H. Yun hold patents related to Brillouin spectroscopy technology.
감사의 말
This work was supported in part by the National Institutes of Health (P41-EB015903, R21EY023043, K25EB015885), National Science of Foundation (CBET-0853773) and Human Frontier Science Program (Young Investigator Grant).
자료
| Name | Company | Catalog Number | Comments |
| OPTICS | |||
| VIPA (virtual image phase array) | LIGH MACHINERY | Quantity: 2 | |
| Bundle of Three 423 Linear Stages with SM-25 Micrometers | NEWPORT | 423-MIC | Quantity: 1 |
| SS Crossed-Roller Bearing Translation Stage, 0.5 in., 8-32, 1/4-20 | NEWPORT | 9066-X | Quantity: 1 |
| Vernier Micrometer, 13 mm Travel, 9 lb Load Capacity, 50.8 TPI | NEWPORT | SM-13 | Quantity: 1 |
| Adjustable Width Slit | NEWPORT | SV-0.5 | Quantity: 2 |
| Compact Dovetail Linear Stage, 0.20 in. Z Travel, 1.57x1.57x1.38 in. | NEWPORT | DS40-Z | Quantity: 2 |
| Slotted Base Plate, 25 or 40 mm to 65 mm Stage, 1.1 in. Range | NEWPORT | B-2B | Quantity: 2 |
| Ø1/2" Optical Post, 8-32 Setscrew, 1/4"-20 Tap, L = 2", 5 Pack | THORLABS | TR2-P5 | Quantity: 2 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrews, L = 2", 5 Pack | THORLABS | PH2-P5 | Quantity: 1 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L = 3", 5 Pack | THORLABS | PH3-P5 | Quantity: 1 |
| Imperial Lens Mount For 2" Optics, 8-32 Tap | THORLABS | LMR2 | Quantity: 2 |
| f=200.0 mm, Ø2" Achromatic Doublet, ARC: 400-700 nm | THORLABS | AC254-200-A | Quantity: 2 |
| Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Right Handed | THORLABS | KM100C | Quantity: 2 |
| Fixed Cylindrical Lens Mount, Max Optic Height: 1.60" (40.6 mm) | THORLABS | CH1A | Quantity: 2 |
| f=200.00 mm, H=30.00 mm, L=32.0 mm, N-BK7 Plano-Convex Cylindrical Lens, Antireflection Coating: 350-700 nm | THORLABS | L1653L1-A | Quantity: 2 |
| Right-Angle Post Clamp, Fixed 90° Adapter | THORLABS | RA90 | Quantity: 1 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | THORLABS | SM1A9 | Quantity: 1 |
| Studded Pedestal Base Adapter, 1/4"-20 Thread | THORLABS | PB4 | Quantity: 2 |
| Spacer, 2" x 3", 1.000" Thick | THORLABS | Ba2S7 | Quantity: 2 |
| 543 nm, f=15.01 mm, NA=0.17 FC/APC Fiber Collimation Pkg. | THORLABS | F260APC-A | Quantity: 1 |
| SM1-Threaded Adapter for Ø11 mm collimators | THORLABS | Ad11F | Quantity: 1 |
| Translating Lens Mount for Ø1" Optics, 1 Retaining Ring Included | THORLABS | LM1XY | Quantity: 1 |
| Single Mode Patch Cable, 450 - 600 nm, FC/APC, 2 m Long | THORLABS | P3-460B-FC-2 | Quantity: 1 |
| 1:1 Matched Achr. Pair, f1=30 mm, f2=30 mm, BBAR 400-700 nm | THORLABS | MAP103030-A | Quantity: 1 |
| SM1 Lens Tube…length to adjust depend on CCD, we have 3.5 inches | THORLABS | SM1LXX | Quantity: 1 |
| Base Adapters for Ø1/2" Post Holders and Ø1" Posts | THORLABS | BE1 | Quantity: 8 |
| Clamping Forks for Ø1/2" Post Holders and Ø1" Posts | THORLABS | CF125 | Quantity: 8 |
| HW-KIT5 - 4-40 Cap Screw and Hardware Kit for Mini-Series | THORLABS | HW-KIT5 | Quantity: 1 |
| D20S - Standard Iris, Ø20.0 mm Max Aperture | THORLABS | D20S | Quantity: 2 |
| FOR ENCLOSURE | |||
| 25 mm Construction Rail, L = 21" | THORLABS | XE25L21 | Quantity: 6 |
| 1" Construction Cube with Three 1/4" (M6) Counterbored Holes | THORLABS | RM1G | Quantity: 8 |
| Right-Angle Bracket for 25 mm Rails | THORLABS | XE25A90 | Quantity: 12 |
| 25 mm Construction Rail, L = 15" | THORLABS | XE25L15 | Quantity: 4 |
| 25 mm Construction Rail, L = 9" | THORLABS | XE25L09 | Quantity: 8 |
| High Performance Black Masking Tape, 2" x 60 yds. (50 mm x 55 m) Roll | THORLABS | T743-2.0 | Quantity: 1 |
| Low-Profile T-Nut, 1/4"-20 Tapped Hole, Qty: 10 | THORLABS | XE25T3 | Quantity: 1 |
| 1/4"-20 Low-Profile Channel Screws (100 Screws/Box) | THORLABS | SH25LP38 | Quantity: 1 |
| 60" (W) x 3 yds. (L) x 0.005" (T) (1.5 m x 2.7 m x 0.12 mm) Blackout Fabric | THORLABS | BK5 | Quantity: 1 |
| CAMERA, LASER and MICROSCOPE | |||
| EMCCD camera | ANDOR | iXon Ultra 897 | Quantity: 1 |
| 400 mW single mode green laser | LASER QUANTUM | torus 532 | Quantity: 1 |
| Research Inverted System Microscope | OLYMPUS | IX71 | Quantity: 1 |
참고문헌
- Brillouin, L. Diffusion de la lumiere et des rayonnes X par un corps transparent homogene; influence del'agitation thermique. Ann. Phys. (Paris) . 17, 88-122 (1922).
- Scarcelli, G., Yun, S. H. Multistage VIPA etalons for high-extinction parallel Brillouin spectroscopy. Opt. Exp. 19 (11), 10913-10922 (2011).
- Scarcelli, G. Confocal Brillouin microscopy for three-dimensional mechanical imaging. Nat. Phot. 2 (1), 39-43 (2008).
- Nichols, A. J., Evans, C. L. Video-rate Scanning Confocal Microscopy and Microendoscopy. J. Vis. Exp. (56), e3252 (2011).
- Steelman, Z., Meng, Z., Traverso, A. J., Yakovlev, V. V. Brillouin spectroscopy as a new method of screening for increased CSF total protein during bacterial meningitis. J. Biophoton. 8 (5), 1-7 (2014).
- Koski, K. J., Yarger, J. L. Brillouin imaging. Appl. Phys. Lett. 87 (6), 061903 (2005).
- Faris, G. W., Jusinski, L. E., Hickman, A. P. High-resolution stimulated Brillouin gain spectroscopy in glasses and crystals. J. Opt. Soc. Am. B. 10 (4), 587-599 (1993).
- Scarcelli, G., Yun, S. H. In vivo Brillouin optical microscopy of the human eye. Opt. Exp. 20 (8), 9197-9202 (2012).
- Scarcelli, G., Besner, S., Pineda, R., Kalout, P., Yun, S. H. In Vivo Biomechanical Mapping of Normal and Keratoconus Corneas. Jama Ophtalmol. , (2015).
- Scarcelli, G., Kim, P., Yun, S. H. In Vivo Measurement of Age-Related Stiffening in the Crystalline Lens by Brillouin Optical Microscopy. Biophys. J. 101 (6), 1539-1545 (2011).
- Antonacci, G., Foreman, M. R., Paterson, C., Török, P. Spectral broadening in Brillouin imaging. Appl. Phys. Lett. 103 (22), 221105 (2013).
- Meng, Z., Traverso, A. J., Yakovlev, V. Background clean-up in Brillouin microspectroscopy of scattering medium. Opt. Exp. 22 (5), 5410-5415 (2014).
- Reiss, S., Burau, G., Stachs, O., Guthoff, R., Stolz, H. Spatially resolved Brillouin spectroscopy to determine the rheological properties of the eye lens. Biomed. Opt. Exp. 2 (8), 2144-2159 (2011).
- Scarcelli, G., Kling, S., Quijano, E., Pineda, R., Marcos, S., Yun, S. H. Brillouin microscopy of collagen crosslinking: noncontact depth-dependent analysis of corneal elastic modulus. Invest. Ophthalmol. Vis. Sci. 54 (2), 1418-1425 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유