Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Alta velocidad Espectrómetro Sub-GHz para el Análisis de Dispersión de Brillouin
En este artículo
Resumen
Aquí se presenta un protocolo para construir un espectrómetro de Brillouin rápida. Cascading gama fase prácticamente fotografiado (VIPA) etalones alcanzar una velocidad de medición de más de 1.000 veces más rápido que el escaneo tradicional espectrómetros de Fabry-Perot. Esta mejora proporciona los medios para el análisis de Brillouin de biomateriales de tejido y a bajas niveles de potencia in vivo.
Resumen
El objetivo de este protocolo es construir una gran extinción paralelo y de alta resolución de Brillouin óptica espectrómetro. Espectroscopia de Brillouin es un método de medición sin contacto que se puede utilizar para obtener lecturas directas de las propiedades del material viscoelástico. Ha sido una herramienta útil en la caracterización de materiales, monitoreo estructural y detección del medio ambiente. En el pasado, la espectroscopia de Brillouin ha empleado generalmente de escaneo etalones Fabry-Perot para realizar el análisis espectral. Este proceso requiere alta potencia de iluminación y largos tiempos de adquisición, por lo que la técnica inadecuada para aplicaciones biomédicas. Un espectrómetro de novela recientemente introducida supera este desafío mediante el empleo de dos VIPAs en una configuración de eje transversal. Esta innovación permite el análisis espectral sub-Gigahertz (GHz) de resolución con el tiempo de adquisición de menos de un segundo y el poder de iluminación dentro de los límites de seguridad de tejido biológico. Las múltiples nuevas aplicaciones facilitados por esta mejora son currently están estudiando en la investigación biológica y la aplicación clínica.
Introducción
Dispersión de Brillouin, descrita por primera vez por Leon Brillouin 1 en 1922, es la dispersión inelástica de la luz de los modos acústicos térmicas en un sólido y de las fluctuaciones de densidad térmicas en un líquido o gas. El desplazamiento espectral de la luz dispersa, por lo general en la sub-GHz gama, proporciona información acerca de la interacción entre la luz incidente y los fonones acústicos en la muestra. Como resultado, puede proporcionar información útil sobre las propiedades viscoelásticas del material examinado.
En su versión espontánea, dispersión de Brillouin generalmente tiene secciones transversales en el orden de dispersión Raman, lo que resulta en una señal muy débil. Además, los cambios de frecuencia Brillouin son órdenes de magnitud más pequeña que los cambios Raman. Como consecuencia, elásticamente dispersa la luz (de Rayleigh o dispersión de Mie), la luz difusa, y back-reflexiones fuera de la muestra puede eclipsar fácilmente la firma espectral Brillouin. Por lo tanto, Un espectrómetro de Brillouin tiene que lograr no sólo sub-GHz resolución espectral, sino también un alto contraste espectral o la extinción.
En espectrómetros Brillouin tradicionales estos requisitos se cumplen por monocromadores escaneo-rejilla, métodos de batido ópticos y, más popularmente, el escaneo de paso múltiple Fabry-Perot interferómetros 2. Estos métodos miden secuencialmente cada componente espectral. Este enfoque conduce a tiempos de adquisición para un solo espectro de Brillouin van desde unos pocos minutos a varias horas, dependiendo del instrumento y en la muestra. El espectrómetro de VIPA en dos etapas, construido usando este protocolo, tiene la capacidad de recoger todos los componentes espectrales en menos de un segundo al tiempo que proporciona la extinción suficiente (> 60 dB) para reprimir eficazmente otras señales espurias 2.
La integración de los etalones VIPA es el elemento clave de este espectrómetro. Un VIPA es un etalón sólida, con tres c diferenteáreas flotante: en la superficie frontal, una tira de revestimiento antirreflectante estrecha permite que la luz entre en el VIPA, mientras que el resto de la superficie cuenta con un recubrimiento (HR) altamente reflectante; en la superficie posterior, un revestimiento parcialmente reflectante permite que una pequeña porción (~ 5%) de la luz a transmitir. Cuando se centró en la estrecha entrada del VIPA ligeramente inclinada, el haz de luz se refleja en sub-componentes con diferencia de fase fija dentro del VIPA 2. La interferencia entre los componentes sub logra la alta dispersión espectral aspirado. Alineación de dos VIPAs secuencialmente en la configuración del eje transversal introduce dispersión espectral en direcciones ortogonales 3. La dispersión espectral en direcciones ortogonales separa espacialmente los picos de Brillouin de la diafonía no deseada, lo que hace posible recoger sólo la señal de Brillouin. La Figura 1 muestra un esquema del espectrómetro de VIPA dos etapas. Las flechas debajo de los elementos ópticos indican los gradosree de la libertad en el que las etapas de traslación deben orientarse.

Figura 1. Configuración instrumental. Una fibra óptica proporciona la dispersión de Brillouin en el espectrómetro. Una lente cilíndrica C1 (f = 200 mm) enfoca la luz en la entrada de la primera VIPA (VIPA1). Otra lente cilíndrica C2 (f = 200 mm) mapea la dispersión angular espectral en una separación espacial en el plano focal de C2. En este plano, una máscara vertical se utiliza para seleccionar la parte deseada del espectro. Una configuración análoga sigue, inclinado a 90 grados. El haz pasa a través de una lente esférica S1 (f = 200 mm) y se centra en la ranura de entrada de la segunda VIPA (VIPA2). Una lente esférica S2 (f = 200 mm) crea el patrón espectralmente separadas en dos dimensiones en su plano focal, donde se coloca otra máscara horizontal. El hormáscara hori- se forma la imagen en la cámara EMCCD usando un par de lentes acromático. Por favor haga clic aquí para ver una versión más grande de esta figura.
Un estudiante universitario con algunos cursos de óptica y la experiencia básica de alineación debe ser capaz de construir y utilizar este espectrómetro de dos etapas. El espectrómetro se ha demostrado recientemente para ser compatible con una variedad de sondas ópticas estándar 3,4,5 (por ejemplo, un microscopio confocal, endoscopio, oftalmoscopio con lámpara de hendidura). Aquí, el espectrómetro está conectado a un microscopio confocal. La luz láser se alinea en una investigación microscopio invertido sistema estándar después de la integración de un divisor de haz de 90:10. La luz de retrodispersión de la muestra está acoplado a una fibra monomodo, haciendo que el confocal microscopio.
Protocolo
Nota: el análisis espectral Brillouin requiere un láser de un solo modo longitudinal (~ 10 mW en la muestra). Para propósitos de alineación, usar una porción fuertemente atenuada de este haz de láser (<0,1 mW).
1. Configuración inicial de la fibra y el EMCCD (Electron Multiplied Charge Coupled Device) Cámara
- Identificar unos 1.600 mm de espacio libre para alinear el espectrómetro en una mesa óptica.
- Monte la cámara EMCCD al final del espacio libre de alineación.
- Utilice tornillos de fijación para sujetar la cámara a los puestos. Apriete los puestos de titulares de los puestos a la altura del eje óptico deseado. Apriete los titulares de los puestos en la mesa óptica utilizando pinzas de mesa.
- Encienda la cámara EMCCD. Tenga en cuenta para evitar la saturación de la cámara.
- Instalar software de la cámara en el ordenador de laboratorio y conectar la cámara al ordenador.
- Desactivar la ganancia y ajuste de bajo tiempo de integración (~ 0,01 seg). Iniciar la adquisición de imágenes EMCCD. Observe la imagen de la cámaras en la pantalla de ordenador.
- Monte el colimador de fibra sobre 1.600 mm delante de la cámara.
- Coloque el colimador de fibra en el adaptador de fibra colimador.
- Monte el adaptador en un poste. Apriete el poste en un titular del puesto a la altura aproximada del eje óptico (altura de la cámara). Apriete titular del puesto en la mesa óptica utilizando pinzas de mesa.
- Alinear el haz de salida a lo largo del eje óptico.
- Utilice un tornillo de fijación para conectar un iris estándar a un poste. Apriete el poste en un titular del puesto.
- Coloque el iris delante del colimador de fibra (<50 mm). Ajuste la altura del iris a la viga. Mueva el iris a lo largo del eje óptico deseado, que deben apuntar directamente a la cámara.
- Inserte un filtro de densidad óptica directamente después de la salida del láser si se satura la cámara. Utilice los tornillos de ajuste del colimador de fibra de montaje para alinear el haz a lo largo del eje óptico. Una vez logrado esto, laviga limpiamente pasar a través del iris a lo largo de la trayectoria del rayo entero.
- Montar un par coincidente de la lente acromática (f = 30 mm) delante de la cámara.
2. Etapa horizontal del Espectrómetro
- Monte la máscara horizontal.
- Utilice tornillos de fijación para sujetar la máscara horizontal en un poste. Apriete el poste en un titular del puesto. Montar el soporte de poste en una etapa de traslación, permitiendo la máscara para deslizarse horizontalmente dentro y fuera de la trayectoria del haz. (Figura 1)
- Utilice tornillos para apretar la etapa de traslación sobre la mesa óptico tal que la máscara se forma la imagen bruscamente sobre la cámara CCD a la distancia focal (f = 30 mm) del par lente acromática.
- Montar y alinear la lente esférica S1 (f = 200 mm) 600 mm por delante de la máscara horizontal.
- Utilice tornillos de fijación para montar S1 en un titular del puesto. Apriete el poste en un titular del puesto.
- Montar dos iris como se describe en 1.5.1. Antes placing S1 en la trayectoria del haz, inserte uno de iris antes y un iris después de la posición deseada S1 (600 mm delante de la máscara horizontal). Ajustar la altura de los iris de tal manera que el haz limpiamente pasa a través de ambos.
- Coloque S1 600 mm por delante de la máscara horizontal (Figura 1). Ajuste la altura y el ángulo de S1 hasta que ambos, el reflejo de marcha atrás de la lente y el haz de salir, pasar limpiamente a través de los iris. Apriete el soporte posterior celebración S1 sobre la mesa óptica utilizando pinzas de mesa.
- Monte VIPA2 en el plano focal de la lente esférica (200 mm por delante del S1).
- Monte el soporte de VIPA en un post con los tornillos suministrados con el soporte. Apriete el poste en un titular del puesto. Apriete el titular del puesto en una etapa de traslación horizontal. (Figura 1)
- Coloque VIPA2 cuidadosamente en el soporte de VIPA con la rendija de entrada orientada verticalmente. (Figura 1)
- Fino-ajustar la posición of montar el VIPA que ser exactamente en el plano focal de S1. (Marque trazando la cintura del haz con una tarjeta blanca.)
- Utilice tornillos para apretar la etapa de traslación sobre la mesa y se deslizan VIPA2 salida óptica de la viga con el grado de libertad de la etapa de traslación.
- Montar y alinear la lente esférica S2 (f = 200 mm) 200 mm después de la VIPA y 200 mm delante de la máscara horizontal. Siga el procedimiento descrito en 2.2.1-2.2.3. En lugar de colocación del soporte del poste sobre la mesa óptica, montarlo sobre una etapa de traslación con su grado de orientada a lo largo del eje óptico libertad. (Figura 1) Utilice los tornillos para apretar la etapa de traslación sobre la mesa óptica.
- Utilice la etapa de traslación horizontal (2.3.4) para deslizar la entrada VIPA2 en la trayectoria del haz. Observe las líneas verticales en la imagen de la cámara.
- Ajuste con precisión S2 usando la etapa de traslación montada en 2.4 hasta que aparezcan las líneas verticales en la imagen de la cámaraagudo.
- Ajuste el espectro con el grado de inclinación horizontal de la libertad en el soporte de VIPA y la etapa de traslación. Utilice el grado-traslación horizontal de la libertad para ajustar la posición de entrada del haz en el etalón. Utilice el grado de inclinación horizontal de la libertad para ajustar el ángulo de entrada de la viga en el etalón.
- Mida finura y rendimiento.
- Tome una imagen pulsando F5 o bien haciendo clic en "Configuración de adquisición" en la esquina superior izquierda y seleccionando la opción "tomar una imagen" en el software de la cámara.
- Haz clic derecho sobre la imagen y selecciona la opción "trama". Arrastre el cursor horizontalmente a través de la imagen para generar un gráfico de línea. Suelte el cursor para observar el esquema lineal generada.
- Utilice el diagrama de puntos para medir la finura. Divida la distancia entre dos picos por su anchura a media altura (FWHM). Trate de> 30.
- Determinar el rendimiento por measuring el poder con un medidor de potencia inmediatamente antes y después VIPA2. Trate de> 50%.
- Sintonice el ángulo de entrada de la viga en el elemento de ajuste con el grado de libertad en el soporte de VIPA (2.6) y observar el equilibrio entre elegancia y rendimiento.
- Si finura y el rendimiento no es satisfactorio volver y poner a ajustar la alineación. Asegúrese de VIPA2 está en el plano focal de S1. Repita los pasos 2.3.3 -2.7.
3. Etapa vertical del Espectrómetro
- Deslice el VIPA (VIPA2), alineados en la parte 2, de la viga usando la etapa de traslación (2.3.4). La etapa horizontal del espectrómetro ahora se comportará como una 1: sistema de imagen 1.
- Monte la máscara vertical.
- Utilice tornillos de fijación para sujetar la máscara vertical sobre un poste. Apriete un post en un adaptador de pinza posterior ángulo recto. Apretar un segundo puesto en el adaptador de ángulo recto y ponerlo en un titular del puesto. Monte el titular del puesto en vertical traslacional etapa, allowing de la máscara se deslice verticalmente dentro y fuera de la trayectoria del haz. (Figura 1)
- Utilice tornillos de tapa para apretar la etapa de traslación vertical sobre la mesa óptica de tal manera que la máscara vertical es fotografiada fuertemente en la cámara EMCCD 200 mm por delante del S1.
- Montar y alinear la lente cilíndrica C1 (f = 200 mm) 600 mm por delante de la máscara vertical.
- Atornille el soporte de la lente cilíndrica en un poste. Apriete el poste en un titular del puesto. Coloque cuidadosamente C1 en el soporte de la lente y apriete los tornillos para fijarla en su lugar.
- Montar dos iris como se describe en 1.5.1. Antes de colocar C1 en la trayectoria del haz, insertar uno iris antes y un iris después de la posición S1 deseada (600 mm por delante de la máscara vertical). Ajustar la altura de los iris de tal manera que el haz limpiamente pasa a través de ambos.
- Place C1 600 mm delante de la máscara vertical (Figura 1). Ajuste cuidadosamente la altura, inclinación y posición lateral de C1 hastatanto, el reflejo de marcha atrás de la lente y el haz de salir, se centran en el iris. Apriete el titular del puesto de retención C1 sobre la mesa óptica utilizando pinzas de mesa.
- Monte VIPA1 en el plano focal de la lente cilíndrica (200 mm por delante del C1).
- Monte el soporte de VIPA en un post con el tornillo suministrado con el soporte. Apriete el poste en un titular del puesto. Apriete el titular del puesto en una etapa de traslación vertical. (Figura 1)
- Coloque VIPA1 cuidadosamente en el soporte de VIPA con la rendija de entrada orientado horizontalmente. (Figura 1)
- Fino-ajustar la posición de la VIPA montaje para colocar VIPA1 exactamente en el plano focal de C1. (Marque trazando la cintura del haz con una tarjeta blanca.)
- Utilice tornillos de tapa para apretar la etapa de traslación vertical sobre la mesa óptica y deslice VIPA1 fuera del haz con el grado de libertad de la etapa de traslación.
- Monte y alinee elC2 lente cilíndrica (f = 200 mm) 200 mm después de VIPA1 y 200 mm por delante de la máscara vertical, siguiendo el procedimiento descrito en 3.3.1-3.3.3. En lugar de colocación del soporte del poste sobre la mesa óptica, montarlo sobre una etapa de traslación con su grado de orientada a lo largo del eje óptico libertad. (Figura 1) Utilice los tornillos para apretar la etapa de traslación sobre la mesa óptica.
- Utilice la etapa de traducción (3.4.4) para deslizar la entrada VIPA1 en la trayectoria del haz. Observe las líneas horizontales en la imagen de la cámara.
- Ajuste con precisión C2 utilizando la etapa de traslación montada en 3.5 hasta que las líneas horizontales en la imagen de la cámara aparecen agudo.
- Ajuste el espectro con el grado de inclinación vertical de la libertad en el soporte de VIPA y la etapa de traslación. Utilice el grado-traslación vertical de la libertad para ajustar la posición de entrada del haz en el etalón. Utilice el grado de inclinación vertical de la libertad para ajustar el ángulo de entrada del haz en la colen.
- Mida finura y rendimiento.
- Siga los pasos 2.7.1 -2.7.2 para generar una trama de línea vertical a través de una imagen de la pantalla de la cámara.
- Utilice el diagrama de puntos para medir la finura dividiendo la distancia entre dos líneas horizontales por su anchura a media altura (FWHM). Trate de> 40.
- Mida el rendimiento mediante la medición de la potencia con un medidor de potencia inmediatamente antes y después VIPA1. Trate de> 30%.
- Sintonice el ángulo de entrada vertical de la viga en el elemento de ajuste con el grado de inclinación vertical de la libertad en el soporte de VIPA (3,7). Observe el equilibrio entre elegancia y rendimiento.
- Si finura y el rendimiento no es satisfactorio volver y poner a ajustar la alineación. Asegúrese de VIPA1 está en el plano focal de C1. Repita el paso 3.4.3-3.8.
4. La combinación de las dos etapas y la alineación final
- Deslice en VIPA2. Observe puntos horizontal y verticalmente espaciados. Estos puntos unare la firma espectral del láser de una sola frecuencia. Ajuste las etapas de traslación de los VIPAs hasta que los puntos están en un enfoque nítido.
- Mida la delicadeza y el rendimiento del espectrómetro.
- Siga los pasos 2.7.1.-2.7.2 para generar una trama de línea diagonal a través de dos de los puntos láser.
- Utilice el diagrama de puntos para medir la finura dividiendo la distancia diagonal entre dos puntos por su anchura a media altura (FWHM). Trate de> 30.
- Construir una caja de negro para encerrar el espectrómetro.
- Utilice carriles de construcción para construir el esqueleto de caja, que debe encerrar todo el espectrómetro desde el colimador de fibra a la cámara CCD (63 x 9 en en x 15 in).
- Cubra el esqueleto caja con Blackout Tela y cinta con fuerza en las esquinas. Asegúrese de que las máscaras y los VIPAs son fácilmente accesibles.
- Conectar la fibra a una sonda óptica estándar, tal como un microscopio confocal de reflectancia 4. P óptica Standardtúnicas utilizadas para recoger la luz retrodispersada llevarán una señal de Brillouin.
5. La medición del desplazamiento Brillouin
- Cerrar tanto la vertical y la horizontal máscaras, hasta la firma de láser desaparece. Mueva las etapas de traducción en consecuencia.
- Activar la ganancia y aumentar el tiempo de integración de la cámara tanto como sea posible sin saturar la cámara EMCCD.
- Observe el cambio de Brillouin de una muestra.
- Coloque una muestra en el foco de un microscopio confocal (u otra sonda óptica). La resolución espacial dependerá de la lente del objetivo utilizado en el microscopio confocal. Use un plato de plástico o una cubeta para líquidos. Utilice Metanol para la primera medición.
- Para optimizar el rendimiento del espectrómetro, abra una máscara a la vez y escanear a través de las órdenes del espectrómetro por la inclinación del VIPA y el ajuste de su etapa de traducción. Encuentra el orden en que aparece la señal más fuerte. Cerrar máscara de nuevo hasta THseñal de láser e desaparece. Repita con la otra máscara y VIPA (descrito en 2.6 y 3.7).
- Tomar una medición de la muestra.
- Tome una imagen del espectro siguiente paso 2.7.1.
- Obtener mediciones de calibración mediante la adopción de una imagen del espectro de agua y de vidrio (u otra muestra conocida con desplazamiento de Brillouin). Guarda la imagen haciendo clic en "Archivo" en la esquina superior izquierda y seleccionando la opción "Guardar como". Guarda la imagen en formato ".sif" si el análisis de los datos se lleva a cabo en el software de la cámara. Guarda la imagen en formato ".tif" si el análisis de los datos se realiza en otro programa de software computacional.
6. Calibración y Análisis de Brillouin Spectrum
- Determinar el rango espectral libre (FSR) y el píxel EMCCD ratio de conversión de frecuencia óptica (PR) en el espectrómetro de Brillouin.
- Cargue los datos en el software de la cámara u otro Computaprograma de software cional.
- Siga el paso 2.7.2 para generar un diagrama de puntos en todo el espectro de la imagen de calibración de agua.
- Montar los dos picos del espectro con curvas lorentzianos para determinar posiciones de los picos en términos de posición de píxel (P Agua-S, P Agua-AS). Alternativamente, dio lectura a las posiciones de los picos manualmente tomando el punto más alto de los picos.
- Repita el paso 6.1.2-6.1.3 con el espectro de la imagen de calibración de vidrio.
- Como alternativa a 6.1.1-6.1.4, agregue ambos marcos EMCCD y colocar los cuatro picos a la vez. (Figura 2)
- Calcular la PR utilizando la ecuación 1. Conecte los valores de P de agua-AS y P-cristal como se determina en 6.1.3 y 6.1.4. Ω Glass-AS es conocido por ser 29,3 GHz. En este caso, puesto que el rango espectral libre está a sólo 20 GHz que aparecerá alias con el desplazamiento de frecuencia de 9,3 GHz. Para simplificar utilizar 9,3 GHz para Ω Glass-AS. Utilice 7.46 GHz para ΩAgua-AS.

- Calcular el FSR usando la ecuación 2. Conecte los valores de P Glass-S, P Glass-AS y PR, calculado en 6,16. Utilice 9,3 GHz para Ω Glass-AS.

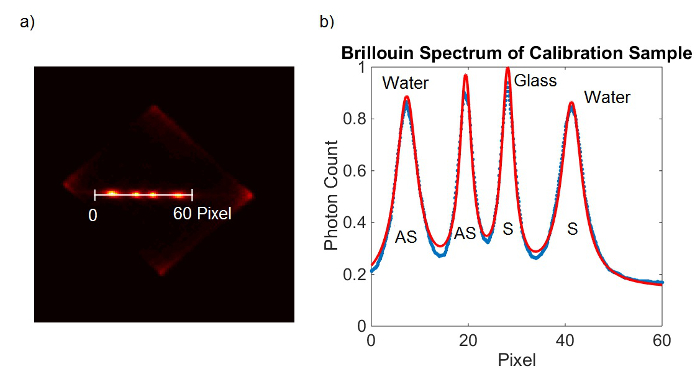
Figura 2. calibración del espectrómetro. Marco (A) de la cámara EMCCD obtiene a partir de la muestra de calibración. (B) ajuste de curva de Lorentz (rojo) para los datos medidos (Azules). Haga clic aquí para ver una versión más grande de esta figura.
- Determinar el cambio de Brillouinun ejemplo.
- Siga el paso 2.7.2 para generar un barrido de línea en todo el espectro de la muestra.
- Montar los dos picos del espectro con curvas lorentzianos para determinar posiciones de los picos en términos de posición de píxeles. Alternativamente, dio lectura a las posiciones de los picos manualmente tomando el punto más alto de los picos.
- Use las siguientes ecuaciones 4 y 5 y los valores calculados previamente para FSR y PR para calcular el cambio de Brillouin de la muestra.
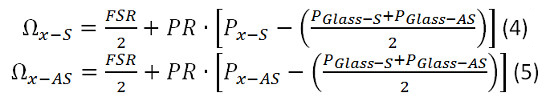
Resultados
La Figura 3 muestra los espectros de Brillouin representativa y sus ajustes para diferentes materiales. Los VIPAs ambos tienen un espesor de 5 mm que resulta en una FSR de aproximadamente 20 GHz. El tiempo de integración para estas mediciones fue de 100 mseg. 100 mediciones se tomaron y se promediaron. Una medición de calibración se tomó antes de la adquisición de los espectros.
Discusión
Una característica clave del diseño de esta configuración es que espectrómetro de las dos etapas se pueden alinear de forma independiente. Cuando un etalón VIPA se desliza fuera de la trayectoria óptica, las lentes restantes de la etapa de formar un espectrómetro de 1: sistema de imagen 1, de modo que el patrón espectral de cada etapa se forma la imagen sobre la cámara CCD. Por lo tanto, es sencillo volver a cualquiera de las etapas para mejorar su rendimiento sin afectar a la alineación de la otra etapa. El c...
Divulgaciones
Giuliano Scarcelli and Seok H. Yun hold patents related to Brillouin spectroscopy technology.
Agradecimientos
This work was supported in part by the National Institutes of Health (P41-EB015903, R21EY023043, K25EB015885), National Science of Foundation (CBET-0853773) and Human Frontier Science Program (Young Investigator Grant).
Materiales
| Name | Company | Catalog Number | Comments |
| OPTICS | |||
| VIPA (virtual image phase array) | LIGH MACHINERY | Quantity: 2 | |
| Bundle of Three 423 Linear Stages with SM-25 Micrometers | NEWPORT | 423-MIC | Quantity: 1 |
| SS Crossed-Roller Bearing Translation Stage, 0.5 in., 8-32, 1/4-20 | NEWPORT | 9066-X | Quantity: 1 |
| Vernier Micrometer, 13 mm Travel, 9 lb Load Capacity, 50.8 TPI | NEWPORT | SM-13 | Quantity: 1 |
| Adjustable Width Slit | NEWPORT | SV-0.5 | Quantity: 2 |
| Compact Dovetail Linear Stage, 0.20 in. Z Travel, 1.57x1.57x1.38 in. | NEWPORT | DS40-Z | Quantity: 2 |
| Slotted Base Plate, 25 or 40 mm to 65 mm Stage, 1.1 in. Range | NEWPORT | B-2B | Quantity: 2 |
| Ø1/2" Optical Post, 8-32 Setscrew, 1/4"-20 Tap, L = 2", 5 Pack | THORLABS | TR2-P5 | Quantity: 2 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrews, L = 2", 5 Pack | THORLABS | PH2-P5 | Quantity: 1 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L = 3", 5 Pack | THORLABS | PH3-P5 | Quantity: 1 |
| Imperial Lens Mount For 2" Optics, 8-32 Tap | THORLABS | LMR2 | Quantity: 2 |
| f=200.0 mm, Ø2" Achromatic Doublet, ARC: 400-700 nm | THORLABS | AC254-200-A | Quantity: 2 |
| Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Right Handed | THORLABS | KM100C | Quantity: 2 |
| Fixed Cylindrical Lens Mount, Max Optic Height: 1.60" (40.6 mm) | THORLABS | CH1A | Quantity: 2 |
| f=200.00 mm, H=30.00 mm, L=32.0 mm, N-BK7 Plano-Convex Cylindrical Lens, Antireflection Coating: 350-700 nm | THORLABS | L1653L1-A | Quantity: 2 |
| Right-Angle Post Clamp, Fixed 90° Adapter | THORLABS | RA90 | Quantity: 1 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | THORLABS | SM1A9 | Quantity: 1 |
| Studded Pedestal Base Adapter, 1/4"-20 Thread | THORLABS | PB4 | Quantity: 2 |
| Spacer, 2" x 3", 1.000" Thick | THORLABS | Ba2S7 | Quantity: 2 |
| 543 nm, f=15.01 mm, NA=0.17 FC/APC Fiber Collimation Pkg. | THORLABS | F260APC-A | Quantity: 1 |
| SM1-Threaded Adapter for Ø11 mm collimators | THORLABS | Ad11F | Quantity: 1 |
| Translating Lens Mount for Ø1" Optics, 1 Retaining Ring Included | THORLABS | LM1XY | Quantity: 1 |
| Single Mode Patch Cable, 450 - 600 nm, FC/APC, 2 m Long | THORLABS | P3-460B-FC-2 | Quantity: 1 |
| 1:1 Matched Achr. Pair, f1=30 mm, f2=30 mm, BBAR 400-700 nm | THORLABS | MAP103030-A | Quantity: 1 |
| SM1 Lens Tube…length to adjust depend on CCD, we have 3.5 inches | THORLABS | SM1LXX | Quantity: 1 |
| Base Adapters for Ø1/2" Post Holders and Ø1" Posts | THORLABS | BE1 | Quantity: 8 |
| Clamping Forks for Ø1/2" Post Holders and Ø1" Posts | THORLABS | CF125 | Quantity: 8 |
| HW-KIT5 - 4-40 Cap Screw and Hardware Kit for Mini-Series | THORLABS | HW-KIT5 | Quantity: 1 |
| D20S - Standard Iris, Ø20.0 mm Max Aperture | THORLABS | D20S | Quantity: 2 |
| FOR ENCLOSURE | |||
| 25 mm Construction Rail, L = 21" | THORLABS | XE25L21 | Quantity: 6 |
| 1" Construction Cube with Three 1/4" (M6) Counterbored Holes | THORLABS | RM1G | Quantity: 8 |
| Right-Angle Bracket for 25 mm Rails | THORLABS | XE25A90 | Quantity: 12 |
| 25 mm Construction Rail, L = 15" | THORLABS | XE25L15 | Quantity: 4 |
| 25 mm Construction Rail, L = 9" | THORLABS | XE25L09 | Quantity: 8 |
| High Performance Black Masking Tape, 2" x 60 yds. (50 mm x 55 m) Roll | THORLABS | T743-2.0 | Quantity: 1 |
| Low-Profile T-Nut, 1/4"-20 Tapped Hole, Qty: 10 | THORLABS | XE25T3 | Quantity: 1 |
| 1/4"-20 Low-Profile Channel Screws (100 Screws/Box) | THORLABS | SH25LP38 | Quantity: 1 |
| 60" (W) x 3 yds. (L) x 0.005" (T) (1.5 m x 2.7 m x 0.12 mm) Blackout Fabric | THORLABS | BK5 | Quantity: 1 |
| CAMERA, LASER and MICROSCOPE | |||
| EMCCD camera | ANDOR | iXon Ultra 897 | Quantity: 1 |
| 400 mW single mode green laser | LASER QUANTUM | torus 532 | Quantity: 1 |
| Research Inverted System Microscope | OLYMPUS | IX71 | Quantity: 1 |
Referencias
- Brillouin, L. Diffusion de la lumiere et des rayonnes X par un corps transparent homogene; influence del'agitation thermique. Ann. Phys. (Paris) . 17, 88-122 (1922).
- Scarcelli, G., Yun, S. H. Multistage VIPA etalons for high-extinction parallel Brillouin spectroscopy. Opt. Exp. 19 (11), 10913-10922 (2011).
- Scarcelli, G. Confocal Brillouin microscopy for three-dimensional mechanical imaging. Nat. Phot. 2 (1), 39-43 (2008).
- Nichols, A. J., Evans, C. L. Video-rate Scanning Confocal Microscopy and Microendoscopy. J. Vis. Exp. (56), e3252 (2011).
- Steelman, Z., Meng, Z., Traverso, A. J., Yakovlev, V. V. Brillouin spectroscopy as a new method of screening for increased CSF total protein during bacterial meningitis. J. Biophoton. 8 (5), 1-7 (2014).
- Koski, K. J., Yarger, J. L. Brillouin imaging. Appl. Phys. Lett. 87 (6), 061903 (2005).
- Faris, G. W., Jusinski, L. E., Hickman, A. P. High-resolution stimulated Brillouin gain spectroscopy in glasses and crystals. J. Opt. Soc. Am. B. 10 (4), 587-599 (1993).
- Scarcelli, G., Yun, S. H. In vivo Brillouin optical microscopy of the human eye. Opt. Exp. 20 (8), 9197-9202 (2012).
- Scarcelli, G., Besner, S., Pineda, R., Kalout, P., Yun, S. H. In Vivo Biomechanical Mapping of Normal and Keratoconus Corneas. Jama Ophtalmol. , (2015).
- Scarcelli, G., Kim, P., Yun, S. H. In Vivo Measurement of Age-Related Stiffening in the Crystalline Lens by Brillouin Optical Microscopy. Biophys. J. 101 (6), 1539-1545 (2011).
- Antonacci, G., Foreman, M. R., Paterson, C., Török, P. Spectral broadening in Brillouin imaging. Appl. Phys. Lett. 103 (22), 221105 (2013).
- Meng, Z., Traverso, A. J., Yakovlev, V. Background clean-up in Brillouin microspectroscopy of scattering medium. Opt. Exp. 22 (5), 5410-5415 (2014).
- Reiss, S., Burau, G., Stachs, O., Guthoff, R., Stolz, H. Spatially resolved Brillouin spectroscopy to determine the rheological properties of the eye lens. Biomed. Opt. Exp. 2 (8), 2144-2159 (2011).
- Scarcelli, G., Kling, S., Quijano, E., Pineda, R., Marcos, S., Yun, S. H. Brillouin microscopy of collagen crosslinking: noncontact depth-dependent analysis of corneal elastic modulus. Invest. Ophthalmol. Vis. Sci. 54 (2), 1418-1425 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados