É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Alta velocidade Spectrometer Sub-GHz para Brillouin Scattering Análise
Neste Artigo
Resumo
Aqui apresentamos um protocolo para construir um espectrómetro de Brillouin rápida. Cascata matriz fase praticamente fotografada (Vipa) etalons alcançar uma velocidade de medição mais de 1.000 vezes mais rápido do que de digitalização tradicional espectrômetros Fabry-Perot. Este melhoramento proporciona os meios para análise de Brillouin de tecido e biomateriais em níveis baixos de potência in vivo.
Resumo
O objetivo deste protocolo é para construir um alto-extinção paralela e de alta resolução espectrômetro de Brillouin óptica. Espectroscopia de Brillouin é um método de medida sem contacto, que pode ser utilizado para se obter as leituras directas de propriedades do material viscoelástico. Tem sido uma ferramenta útil na caracterização de materiais, monitoramento estrutural e sensoriamento ambiental. No passado, a espectroscopia de Brillouin tem geralmente empregue digitalização etalons Fabry-Perot para realizar a análise espectral. Este processo requer alta potência de iluminação e longos tempos de aquisição, tornando a técnica inadequada para aplicações biomédicas. Um romance espectrômetro recentemente introduzido supera este desafio, empregando dois VIPAs em uma configuração de eixo transversal. Esta inovação permite (GHz) Resolução análise espectral-Gigahertz sub com tempo de aquisição de sub-segundo e poder iluminação dentro dos limites de segurança de tecido biológico. As novas aplicações múltiplas facilitados por esta melhoria são currently sendo exploradas na pesquisa biológica e aplicações clínicas.
Introdução
Dispersão de Brillouin, primeiro descrito por Leon Brillouin 1 em 1922, é a dispersão elástica de luz a partir dos meios térmicos acústicos em forma de um sólido e a partir das flutuações térmicas de densidade em um líquido ou gás. O desvio espectral da luz difusa, geralmente na gama de sub-GHz, fornece informações sobre a interacção entre a luz incidente e as fonões acústicas da amostra. Como um resultado, ele pode fornecer informação útil sobre as propriedades viscoelásticas do material examinado.
Na sua versão espontânea, geralmente a dispersão de Brillouin tem secções transversais da ordem de dispersão de Raman, resultando num sinal muito fraco. Além disso, as mudanças de freqüência de Brillouin são ordens de grandeza menor do que mudanças Raman. Como conseqüência, elasticamente espalhados luz (de Rayleigh ou espalhamento Mie), a luz difusa, e back-reflexões fora da amostra pode facilmente ofuscar a assinatura espectral Brillouin. Conseqüentemente, Um espectrômetro de Brillouin precisa não só alcançar sub-GHz resolução espectral, mas também alto contraste espectral ou extinção.
Em espectrômetros de Brillouin tradicionais cumprimento desses requisitos, por monocromadores-grade de digitalização, métodos de espancamento ópticos, e, mais popularmente, a digitalização de várias passagens Fabry-Perot interferômetros 2. Estes métodos medir cada componente espectral em seqüência. Esta abordagem conduz a tempos de aquisição de um espectro de Brillouin única que varia de alguns minutos a várias horas, dependendo do instrumento e na amostra. O espectrômetro VIPA em duas fases, construído usando este protocolo, tem a capacidade de recolher todos os componentes espectrais dentro de menos de um segundo, proporcionando extinção suficiente (> 60 dB) para suprimir eficazmente outros sinais espúrios 2.
A integração dos etalons Vipa é o elemento-chave deste espectrômetro. Um VIPA é um étalon sólido com três diferentes cáreas flutuantes: na superfície da frente, uma tira de revestimento anti-reflexão estreita permite que a luz entre na VIPA, enquanto que o resto da superfície apresenta um (RH) de revestimento altamente reflector; na superfície traseira, um revestimento parcialmente reflector permite que uma pequena porção (~ 5%) de que a luz seja transmitida. Quando focado na entrada estreita do VIPA ligeiramente inclinada, o feixe de luz se reflete em sub-componentes com diferença de fase estável no VIPA 2. Interferência entre as sub componentes alcança a alta dispersão espectral aspirado. Alinhando dois VIPAs sequencialmente em configuração de eixo transversal apresenta dispersão espectral em direcções ortogonais 3. A dispersão espectral em direcções ortogonais espacialmente separa os picos de Brillouin de diafonia não desejada, o que faz com que seja possível pegar apenas o sinal de Brillouin. A Figura 1 mostra uma representação esquemática do espectrómetro de duas fases VIPA. As setas abaixo dos elementos ópticos indicar as degree de liberdade em que devem ser orientados os estágios de translação.

Figura 1. Configuração Instrumental. Uma fibra óptica proporciona o espalhamento de Brillouin no espectrómetro. Uma lente cilíndrica C1 (F = 200 mm) foca a luz para a entrada do primeiro VIPA (VIPA1). Outra lente cilíndrica C2 (F = 200 mm) mapeia a dispersão angular espectral para uma separação espacial no plano focal de C2. Neste plano, uma máscara vertical é utilizado para seleccionar a parte desejada do espectro. Uma configuração análoga segue, inclinado em 90 graus. O feixe passa através de uma lente esférica S1 (f = 200 mm) e é focada na abertura de entrada da segunda VIPA (VIPA2). Uma lente esférica S2 (f = 200 mm) cria o padrão separadas espectralmente bidimensional no seu plano focal, onde outro horizontal máscara é colocado. O hormáscara izontal é fotografada na câmara EMCCD utilizando um par de lente acromática. Por favor clique aqui para ver uma versão maior desta figura.
Um estudante de graduação com alguns cursos óptica e experiência básica de alinhamento deve ser capaz de construir e usar este espectrômetro de dois estágios. O espectrómetro foi recentemente mostrado para ser compatível com uma variedade de sondas ópticas 3,4,5 padrão (por exemplo, microscópio confocal, endoscópio, oftalmoscópio com lâmpada de fenda). Aqui, o espectrómetro está ligado a um microscópio confocal. A luz de laser está alinhado em um sistema de investigação microscópio invertido padrão depois de integrar um divisor de feixe 90:10. A luz de retroespalhamento a partir da amostra é acoplado a uma fibra de modo único, fazendo com que o microscópio confocal.
Protocolo
Nota: a análise espectral de Brillouin requer um único laser de modo longitudinal (~ 10 mW na amostra). Para fins de alinhamento, utilizar uma porção fortemente atenuada desta feixe de laser (<0,1 mW).
1. Configuração inicial de fibra ea EMCCD (Electron Multiplied Charge Coupled Device) Camera
- Identificar cerca de 1.600 mm Área de alinhamento gratuito para o espectrômetro em uma mesa óptica.
- Montar a câmara EMCCD no final do espaço livre de alinhamento.
- Use parafusos de fixação para fixar a câmera a postos. Aperte os lugares em detentores de postos na altura do eixo óptico desejado. Aperte os detentores de postos sobre a mesa óptica usando grampos de mesa.
- Ligue a câmera EMCCD. Esteja atento para evitar a saturação câmera.
- Instale o software da câmera no computador do laboratório e conectar a câmera ao computador.
- Desativar o ganho de inserção baixa e tempo de integração (~ 0,01 seg). Começar a adquirir imagens EMCCD. Observe a imagem da câmaras na tela do computador.
- Montar o colimador fibra de cerca de 1.600 mm em frente da câmera.
- Colocar o colimador fibra no adaptador de fibra colimador.
- Monte o adaptador em um post. Aperte o cargo em um suporte de pós à altura aproximada do eixo óptico (altura da câmera). Aperte o suporte pós sobre a mesa óptica usando grampos de mesa.
- Alinhar o feixe de saída ao longo do eixo óptico.
- Use um parafuso de ajuste para conectar um padrão de íris a um poste. Aperte o cargo em um suporte post.
- Coloque a íris em frente do colimador fibra (<50 mm). Ajustar a altura da íris ao feixe. Mova a íris ao longo do eixo óptico desejado, que deve apontar diretamente para a câmera.
- Insira um filtro de densidade óptica directamente após a saída do laser se os ácidos gordos saturados de câmera. Use os parafusos de ajuste do colimador fibra de montagem para alinhar o feixe ao longo do eixo óptico. Quando isto for alcançado, ofeixe vai passar limpa através da íris ao longo do caminho do feixe inteiro.
- Montar um par correspondente lente acromática (f = 30 mm), em frente da câmara.
2. Horizontal Fase de Spectrometer
- Monte a máscara horizontal.
- Use parafusos de fixação para fixar a máscara horizontal em um post. Aperte o cargo em um suporte post. Montar o suporte de pós para um estágio de translação, permitindo que a máscara para deslizar horizontalmente dentro e para fora do caminho do feixe. (Figura 1)
- Use parafusos de fixação para apertar o estágio de translação na mesa óptica de tal modo que a máscara é criada uma imagem acentuadamente para a câmara CCD na distância focal (f = 30 mm) a par da lente acromática.
- E alinhar a montagem de lente esférica S1 (f = 200 mm) de 600 mm para a frente da máscara horizontal.
- Use parafusos de fixação para montar S1 em um suporte de pós. Aperte o cargo em um suporte post.
- Monte duas íris como descrito no 1.5.1. Antes Placing S1 no caminho do feixe, inserir uma íris antes e uma íris após a posição desejada S1 (600 mm à frente da máscara horizontal). Ajustar a altura das íris de tal modo que o feixe de forma limpa passa através de ambos.
- Coloque S1 600 mm à frente da máscara horizontal (Figura 1). Ajuste a altura eo ângulo de S1 até que ambos, o reflexo de volta fora da lente e do feixe-vindo, limpa passar através das íris. Aperte o suporte de pós segurando S1 na mesa óptica usando grampos de mesa.
- Mount VIPA2 no plano focal da lente esférica (200 mm à frente do S1).
- Montar o suporte do VIPA em um post com os parafusos fornecidos com o titular. Aperte o cargo em um suporte post. Aperte o titular do lugar em uma fase de tradução horizontal. (Figura 1)
- Coloque VIPA2 cuidadosamente no porta-VIPA com a entrada de fenda orientada verticalmente. (Figura 1)
- Fine-ajustar a posição of a VIPA montar a ser exatamente no plano focal de S1. (Confira traçando a cintura do feixe com um cartão branco.)
- Use parafusos de fixação para apertar o estágio de translação sobre a mesa e deslizar VIPA2 óptica para fora do feixe utilizando o grau de liberdade do estágio de translação.
- E alinhar a montagem de lente esférica S2 (f = 200 mm) de 200 mm, após o VIPA e 200 mm para a frente da máscara horizontal. Siga o procedimento descrito no 2.2.1-2.2.3. Em vez de fixar o suporte de pós sobre a mesa óptica, montá-lo em um estágio de translação com o seu grau de liberdade orientada ao longo do eixo óptico. (Figura 1) Use os parafusos de fixação para apertar o estágio de translação sobre a mesa óptica.
- Use o estágio de translação horizontal (2.3.4) para deslizar a entrada VIPA2 no caminho do feixe. Observe as linhas verticais na imagem da câmara.
- Fine-ajustar S2 usando o estágio de translação montado em 2.4 até que as linhas verticais na imagem da câmara aparecerafiado.
- Ajuste o espectro com o grau horizontal-tilt de liberdade no suporte do VIPA eo estágio de translação. Use o grau horizontal-tradução de liberdade para ajustar a posição de entrada do feixe no etalon. Use o grau horizontal-tilt de liberdade para ajustar o ângulo de entrada do feixe no etalon.
- Meça finesse e taxa de transferência.
- Tome uma imagem pressionando F5 ou, em alternativa, clicando em "setup aquisição" no canto superior esquerdo e escolhendo a opção "take imagem" no software da câmera.
- Botão direito do mouse sobre a imagem e escolha a opção "enredo". Arraste o cursor horizontalmente através da imagem para gerar um gráfico de linha. Solte o cursor para observar o gráfico de linha gerado.
- Use o gráfico de linha para medir a finesse. Dividir a distância entre dois picos por sua largura total à meia altura (FWHM). Apontar para> 30.
- Determine a taxa de transferência por measuring o poder com um medidor de energia imediatamente antes e depois VIPA2. Apontar para> 50%.
- Sintonize o ângulo de entrada do feixe no etalon com o grau de liberdade no suporte VIPA (2.6) e observar o trade-off entre finesse e taxa de transferência.
- Se finesse e taxa de transferência não são satisfatórios voltar e fino-ajustar o alinhamento. Certifique-se de VIPA2 está no plano focal de S1. Repita as etapas 2.3.3 -2.7.
3. Vertical Stage do Spectrometer
- Deslize a VIPA (VIPA2), alinhados na parte 2, fora do feixe usando o estágio de translação (2.3.4). A fase horizontal do espectrómetro de agora irá se comportar como um 1: 1 sistema de imagem.
- Monte a máscara vertical.
- Use parafusos de fixação para fixar a máscara vertical sobre um post. Aperte um post em um adaptador de pós braçadeira ângulo direito. Aperte um segundo post no adaptador de ângulo direito e colocá-lo em um suporte de pós. Montar o titular do lugar em um estágio de translação verticais, allowing a máscara para deslizar verticalmente dentro e para fora do caminho do feixe. (Figura 1)
- Use parafusos da tampa para apertar o estágio de translação vertical sobre a mesa óptica de tal modo que a máscara vertical é fotografada acentuadamente na câmara EMCCD 200 mm à frente da S1.
- Montagem e alinhar a lente cilíndrica C1 (F = 200 mm) de 600 mm para a frente da máscara vertical.
- Parafuso do suporte cilíndrico lente, a um post. Aperte o cargo em um suporte post. Com cuidado, coloque C1 no suporte da lente e aperte os parafusos para fixá-lo no lugar.
- Monte duas íris como descrito no 1.5.1. Antes de colocar C1 no caminho do feixe, inserir uma íris antes e uma íris após a posição desejada S1 (600 mm à frente da máscara vertical). Ajustar a altura das íris de tal modo que o feixe de forma limpa passa através de ambos.
- Ponto C1 600 mm à frente da máscara vertical (Figura 1). Cuidadosamente ajustar a altura, inclinação e posição lateral de C1 atétanto, a reflexão de volta fora da lente e do feixe-vindo, estão centradas sobre a íris. Aperte o suporte pós exploração C1 na mesa óptica usando grampos de mesa.
- Mount VIPA1 no plano focal da lente cilíndrica (200 mm à frente do C1).
- Montar o suporte do VIPA em um post com o parafuso fornecido com o titular. Aperte o cargo em um suporte post. Aperte o titular do lugar em uma fase de tradução vertical. (Figura 1)
- Coloque VIPA1 cuidadosamente no porta-VIPA com a entrada de fenda orientada horizontalmente. (Figura 1)
- Fine-ajustar a posição da VIPA montagem para colocar VIPA1 exatamente no plano focal de C1. (Confira traçando a cintura do feixe com um cartão branco.)
- Use parafusos da tampa para apertar o estágio de translação vertical sobre a mesa óptica e deslize VIPA1 fora do feixe utilizando o grau de liberdade do estágio de translação.
- Montar e alinhar oC2 lente cilíndrica (f = 200 mm) a 200 mm após VIPA1 e 200 mm para a frente da máscara verticais, seguindo o procedimento descrito no 3.3.1-3.3.3. Em vez de fixar o suporte de pós sobre a mesa óptica, montá-lo em um estágio de translação com o seu grau de liberdade orientada ao longo do eixo óptico. (Figura 1) Use os parafusos de fixação para apertar o estágio de translação sobre a mesa óptica.
- Use a fase de tradução (3.4.4) para deslizar a entrada VIPA1 no caminho do feixe. Observar linhas horizontais na imagem da câmara.
- Fine-ajustar C2 usando o estágio de translação montado em 3.5 até que as linhas horizontais na imagem da câmara aparecem nítidas.
- Ajuste o espectro com o grau de inclinação vertical de liberdade no suporte do VIPA eo estágio de translação. Use o grau vertical-tradução de liberdade para ajustar a posição de entrada do feixe no etalon. Use o grau de inclinação vertical de liberdade para ajustar o ângulo de entrada do feixe no etalligar.
- Meça finesse e taxa de transferência.
- Siga as etapas 2.7.1 -2.7.2 para gerar um gráfico de linha verticalmente através de uma imagem de tela da câmera.
- Use o gráfico de linha para medir a finesse dividindo-se a distância entre duas linhas horizontais por sua largura à meia altura (FWHM). Apontar para> 40.
- Medir a taxa de transferência através da medição da potência com um medidor de energia imediatamente antes e depois VIPA1. Apontar para> 30%.
- Ajustar o ângulo de entrada vertical do feixe para o étalon com o grau de inclinação vertical de liberdade no suporte VIPA (3.7). Observe o trade-off entre finesse e taxa de transferência.
- Se finesse e taxa de transferência não são satisfatórios voltar e fino-ajustar o alinhamento. Certifique-se de VIPA1 está no plano focal de C1. Repita o passo 3.4.3-3.8.
4. A combinação das duas fases e alinhamento final
- Deslize em VIPA2. Observar pontos horizontalmente e verticalmente espaçadas. Estes pontos dere a assinatura espectral do laser de frequência única. Ajuste os estágios de translação dos VIPAs até os pontos estão no foco afiado.
- Meça finesse e throughput do espectrômetro.
- Siga os passos 2.7.1.-2.7.2 para gerar um gráfico de linha em diagonal dois dos pontos laser.
- Use o gráfico de linha para medir finesse dividindo a distância diagonal entre dois pontos pela sua largura à meia altura (FWHM). Apontar para> 30.
- Criar uma caixa preta para colocar o espectrômetro.
- Use trilhos de construção para construir o esqueleto caixa, que deve incluir todo o espectrômetro do colimador fibra para a câmara CCD (63 em x 9 em x 15 polegadas).
- Cubra o esqueleto caixa com Blackout Tecido e gravá-lo apertado nos cantos. Certifique-se de que as máscaras e os VIPAs são facilmente acessíveis.
- Ligar a fibra com uma sonda óptica padrão, tais como um microscópio confocal de reflectância 4. P ótico padrãovestes usadas para coletar a luz back-espalhados vai levar um sinal de Brillouin.
5. Medindo a Mudança Brillouin
- Máscaras de perto tanto a verticais e horizontais até a assinatura do laser desaparece. Mova os estágios de translação em conformidade.
- Activar o ganho e aumentar o tempo de integração da câmara, tanto quanto possível, sem saturar a câmara EMCCD.
- Observe a mudança de Brillouin de uma amostra.
- Colocar a amostra no centro de um microscópio confocal (ou outra sonda óptica). A resolução espacial dependerá da lente objectiva utilizada no microscópio confocal. Usar um prato de plástico ou uma cuvete para líquidos. Use Metanol para a primeira medição.
- Para otimizar a taxa de transferência espectrômetro, aberto uma máscara de cada vez e percorrer as ordens espectrômetro pela inclinação do VIPA e ajustar sua fase de tradução. Localizar a ordem pela qual o sinal é exibido o mais forte. Fechar máscara novamente até thsinal de laser e desaparece. Repetir com a outra máscara e VIPA (descrito em 2.6 e 3.7).
- Realizar uma medição de amostra.
- Pegue uma imagem do espectro passo seguinte 2.7.1.
- Obter medições de calibração, tomando uma imagem do espectro da água e do vidro (ou outra amostra com mudança de Brillouin conhecido). Salve a imagem clicando em "Arquivo" no canto superior esquerdo e escolha a opção "salvar como". Guardar a imagem no formato ".sif" se a análise de dados é realizada no software da câmara. Salve a imagem em formato "tif" se a análise dos dados é realizado em outro programa computacional.
6. Calibração e Análise do Espectro de Brillouin
- Determine o intervalo livre espectral (FSR) eo pixel EMCCD a taxa de conversão de frequência óptica (PR) no espectrómetro de Brillouin.
- Carregar os dados no software da câmera ou de outra computaprograma de software cional.
- Siga o passo 2.7.2 para gerar um gráfico de linha em todo o espectro da imagem calibração água.
- Encaixe os dois picos do espectro com curvas lorentzianas para determinar as posições de pico em termos de posição pixel (P Água-S, P Água-AS). Alternativamente, ler as posições de pico manualmente, tendo o ponto mais alto dos picos.
- Repetir o passo 6.1.2-6.1.3 com o espectro da imagem de calibrao de vidro.
- Como alternativa para 6.1.1-6.1.4, adicione ambos os quadros EMCCD e caber todos os quatro picos ao mesmo tempo. (Figura 2)
- Calcule o PR usando a equação 1. Conecte os valores para P Água-AS e P Glass-como determinado em 6.1.3 e 6.1.4. Ω-AS vidro é conhecido por ser 29,3 GHz. Neste caso, uma vez que a faixa espectral livre é de apenas 20 GHz ele aparecerá alias com o deslocamento de 9,3 GHz de frequência. Para simplificar utilizar 9,3 GHz para Ω Glass-AS. Utilize 7.46 GHz para ΩÁgua-AS.

- Calcule o FSR usando a equação 2. Ligue os valores para P vidro-S, P Glass-AS e PR, calculadas em 6,16. Use 9,3 GHz para Ω Glass-AS.

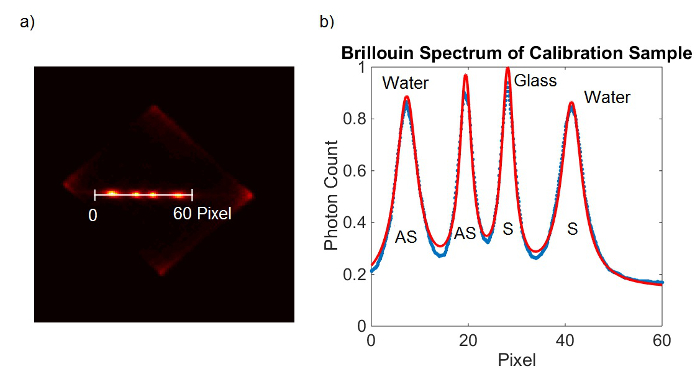
Figura 2. calibração Spectrometer. Estrutura (A) câmera EMCCD obtidos a partir de amostra de calibração. (B) Lorentzian ajuste de curva (vermelha) para os dados medidos (azul). Por favor clique aqui para ver uma versão maior desta figura.
- Determinar a mudança de BrillouinUma amostra.
- Siga o passo 2.7.2 para gerar uma varredura de linha em todo o espectro da amostra.
- Encaixe os dois picos do espectro com curvas lorentzianas para determinar as posições de pico em termos de posição pixel. Alternativamente, ler as posições de pico manualmente, tendo o ponto mais alto dos picos.
- Use as seguintes equações 4 e 5 e os valores previamente calculados para FSR e PR para calcular a mudança de Brillouin da amostra.
Resultados
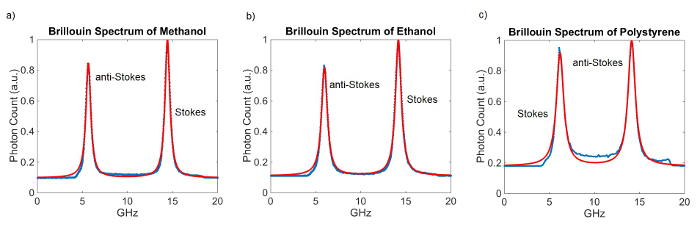
A Figura 3 mostra os espectros de Brillouin representativa e seus ajustes para materiais diferentes. Os VIPAs têm ambos uma espessura de 5 mm, o que resulta numa FSR de cerca de 20 GHz. O tempo de integração para estas medições foi de 100 ms. 100 medições foram tomadas e média. Uma medida de calibração foi feita antes de adquirir os espectros.
Discussão
Uma característica chave deste projeto espectrómetro de configuração é que as duas fases pode ser alinhada de modo independente. Quando um étalon VIPA é feita deslizar para fora do percurso óptico, as lentes restantes da fase espectrómetro de formar uma mistura 1: 1 sistema de imagem, de modo que o padrão espectral de cada estágio é fotografada para a câmara CCD. Portanto, é fácil de voltar para qualquer uma das etapas a melhorar o seu desempenho, sem afectar o alinhamento da outra fase. O conjunto de est...
Divulgações
Giuliano Scarcelli and Seok H. Yun hold patents related to Brillouin spectroscopy technology.
Agradecimentos
This work was supported in part by the National Institutes of Health (P41-EB015903, R21EY023043, K25EB015885), National Science of Foundation (CBET-0853773) and Human Frontier Science Program (Young Investigator Grant).
Materiais
| Name | Company | Catalog Number | Comments |
| OPTICS | |||
| VIPA (virtual image phase array) | LIGH MACHINERY | Quantity: 2 | |
| Bundle of Three 423 Linear Stages with SM-25 Micrometers | NEWPORT | 423-MIC | Quantity: 1 |
| SS Crossed-Roller Bearing Translation Stage, 0.5 in., 8-32, 1/4-20 | NEWPORT | 9066-X | Quantity: 1 |
| Vernier Micrometer, 13 mm Travel, 9 lb Load Capacity, 50.8 TPI | NEWPORT | SM-13 | Quantity: 1 |
| Adjustable Width Slit | NEWPORT | SV-0.5 | Quantity: 2 |
| Compact Dovetail Linear Stage, 0.20 in. Z Travel, 1.57x1.57x1.38 in. | NEWPORT | DS40-Z | Quantity: 2 |
| Slotted Base Plate, 25 or 40 mm to 65 mm Stage, 1.1 in. Range | NEWPORT | B-2B | Quantity: 2 |
| Ø1/2" Optical Post, 8-32 Setscrew, 1/4"-20 Tap, L = 2", 5 Pack | THORLABS | TR2-P5 | Quantity: 2 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrews, L = 2", 5 Pack | THORLABS | PH2-P5 | Quantity: 1 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L = 3", 5 Pack | THORLABS | PH3-P5 | Quantity: 1 |
| Imperial Lens Mount For 2" Optics, 8-32 Tap | THORLABS | LMR2 | Quantity: 2 |
| f=200.0 mm, Ø2" Achromatic Doublet, ARC: 400-700 nm | THORLABS | AC254-200-A | Quantity: 2 |
| Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Right Handed | THORLABS | KM100C | Quantity: 2 |
| Fixed Cylindrical Lens Mount, Max Optic Height: 1.60" (40.6 mm) | THORLABS | CH1A | Quantity: 2 |
| f=200.00 mm, H=30.00 mm, L=32.0 mm, N-BK7 Plano-Convex Cylindrical Lens, Antireflection Coating: 350-700 nm | THORLABS | L1653L1-A | Quantity: 2 |
| Right-Angle Post Clamp, Fixed 90° Adapter | THORLABS | RA90 | Quantity: 1 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | THORLABS | SM1A9 | Quantity: 1 |
| Studded Pedestal Base Adapter, 1/4"-20 Thread | THORLABS | PB4 | Quantity: 2 |
| Spacer, 2" x 3", 1.000" Thick | THORLABS | Ba2S7 | Quantity: 2 |
| 543 nm, f=15.01 mm, NA=0.17 FC/APC Fiber Collimation Pkg. | THORLABS | F260APC-A | Quantity: 1 |
| SM1-Threaded Adapter for Ø11 mm collimators | THORLABS | Ad11F | Quantity: 1 |
| Translating Lens Mount for Ø1" Optics, 1 Retaining Ring Included | THORLABS | LM1XY | Quantity: 1 |
| Single Mode Patch Cable, 450 - 600 nm, FC/APC, 2 m Long | THORLABS | P3-460B-FC-2 | Quantity: 1 |
| 1:1 Matched Achr. Pair, f1=30 mm, f2=30 mm, BBAR 400-700 nm | THORLABS | MAP103030-A | Quantity: 1 |
| SM1 Lens Tube…length to adjust depend on CCD, we have 3.5 inches | THORLABS | SM1LXX | Quantity: 1 |
| Base Adapters for Ø1/2" Post Holders and Ø1" Posts | THORLABS | BE1 | Quantity: 8 |
| Clamping Forks for Ø1/2" Post Holders and Ø1" Posts | THORLABS | CF125 | Quantity: 8 |
| HW-KIT5 - 4-40 Cap Screw and Hardware Kit for Mini-Series | THORLABS | HW-KIT5 | Quantity: 1 |
| D20S - Standard Iris, Ø20.0 mm Max Aperture | THORLABS | D20S | Quantity: 2 |
| FOR ENCLOSURE | |||
| 25 mm Construction Rail, L = 21" | THORLABS | XE25L21 | Quantity: 6 |
| 1" Construction Cube with Three 1/4" (M6) Counterbored Holes | THORLABS | RM1G | Quantity: 8 |
| Right-Angle Bracket for 25 mm Rails | THORLABS | XE25A90 | Quantity: 12 |
| 25 mm Construction Rail, L = 15" | THORLABS | XE25L15 | Quantity: 4 |
| 25 mm Construction Rail, L = 9" | THORLABS | XE25L09 | Quantity: 8 |
| High Performance Black Masking Tape, 2" x 60 yds. (50 mm x 55 m) Roll | THORLABS | T743-2.0 | Quantity: 1 |
| Low-Profile T-Nut, 1/4"-20 Tapped Hole, Qty: 10 | THORLABS | XE25T3 | Quantity: 1 |
| 1/4"-20 Low-Profile Channel Screws (100 Screws/Box) | THORLABS | SH25LP38 | Quantity: 1 |
| 60" (W) x 3 yds. (L) x 0.005" (T) (1.5 m x 2.7 m x 0.12 mm) Blackout Fabric | THORLABS | BK5 | Quantity: 1 |
| CAMERA, LASER and MICROSCOPE | |||
| EMCCD camera | ANDOR | iXon Ultra 897 | Quantity: 1 |
| 400 mW single mode green laser | LASER QUANTUM | torus 532 | Quantity: 1 |
| Research Inverted System Microscope | OLYMPUS | IX71 | Quantity: 1 |
Referências
- Brillouin, L. Diffusion de la lumiere et des rayonnes X par un corps transparent homogene; influence del'agitation thermique. Ann. Phys. (Paris) . 17, 88-122 (1922).
- Scarcelli, G., Yun, S. H. Multistage VIPA etalons for high-extinction parallel Brillouin spectroscopy. Opt. Exp. 19 (11), 10913-10922 (2011).
- Scarcelli, G. Confocal Brillouin microscopy for three-dimensional mechanical imaging. Nat. Phot. 2 (1), 39-43 (2008).
- Nichols, A. J., Evans, C. L. Video-rate Scanning Confocal Microscopy and Microendoscopy. J. Vis. Exp. (56), e3252 (2011).
- Steelman, Z., Meng, Z., Traverso, A. J., Yakovlev, V. V. Brillouin spectroscopy as a new method of screening for increased CSF total protein during bacterial meningitis. J. Biophoton. 8 (5), 1-7 (2014).
- Koski, K. J., Yarger, J. L. Brillouin imaging. Appl. Phys. Lett. 87 (6), 061903 (2005).
- Faris, G. W., Jusinski, L. E., Hickman, A. P. High-resolution stimulated Brillouin gain spectroscopy in glasses and crystals. J. Opt. Soc. Am. B. 10 (4), 587-599 (1993).
- Scarcelli, G., Yun, S. H. In vivo Brillouin optical microscopy of the human eye. Opt. Exp. 20 (8), 9197-9202 (2012).
- Scarcelli, G., Besner, S., Pineda, R., Kalout, P., Yun, S. H. In Vivo Biomechanical Mapping of Normal and Keratoconus Corneas. Jama Ophtalmol. , (2015).
- Scarcelli, G., Kim, P., Yun, S. H. In Vivo Measurement of Age-Related Stiffening in the Crystalline Lens by Brillouin Optical Microscopy. Biophys. J. 101 (6), 1539-1545 (2011).
- Antonacci, G., Foreman, M. R., Paterson, C., Török, P. Spectral broadening in Brillouin imaging. Appl. Phys. Lett. 103 (22), 221105 (2013).
- Meng, Z., Traverso, A. J., Yakovlev, V. Background clean-up in Brillouin microspectroscopy of scattering medium. Opt. Exp. 22 (5), 5410-5415 (2014).
- Reiss, S., Burau, G., Stachs, O., Guthoff, R., Stolz, H. Spatially resolved Brillouin spectroscopy to determine the rheological properties of the eye lens. Biomed. Opt. Exp. 2 (8), 2144-2159 (2011).
- Scarcelli, G., Kling, S., Quijano, E., Pineda, R., Marcos, S., Yun, S. H. Brillouin microscopy of collagen crosslinking: noncontact depth-dependent analysis of corneal elastic modulus. Invest. Ophthalmol. Vis. Sci. 54 (2), 1418-1425 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados