Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
High Speed Sous-GHz spectromètre pour Brillouin Scattering Analyse
Dans cet article
Résumé
Nous présentons ici un protocole pour construire un spectromètre de Brillouin rapide. Cascade réseau de phase virtuellement représenté (VIPA) étalons atteindre une vitesse de mesure plus de 1000 fois plus rapide que le balayage traditionnel spectromètres de Fabry-Perot. Cette amélioration fournit les moyens d'analyse de Brillouin de tissu et des biomatériaux à de faibles niveaux de puissance in vivo.
Résumé
L'objectif de ce protocole est de construire un haut-extinction parallèle et haute résolution Brillouin optique spectromètre. Spectroscopie de Brillouin est une méthode de mesure sans contact qui peut être utilisée pour obtenir des lectures directes des propriétés des matériaux visco-élastique. Il a été un outil utile dans la caractérisation des matériaux, la surveillance et la détection de l'environnement structurel. Dans le passé, la spectroscopie de Brillouin est habituellement utilisé balayage étalons de Fabry-Pérot pour effectuer une analyse spectrale. Ce processus nécessite une puissance d'éclairage élevée et temps d'acquisition longues, ce qui rend la technique inadaptée pour des applications biomédicales. Un roman spectromètre récemment introduit surmonte ce défi en utilisant deux VIPAs dans une configuration axe transversal. Cette innovation permet (GHz) analyse spectrale de résolution de sous-Gigahertz avec un temps d'acquisition inférieur à la seconde et de la puissance d'éclairage dans les limites des tissus biologiques de sécurité. Les nouvelles de multiples applications facilitées par cette amélioration sont currently explorée dans la recherche biologique et l'application clinique.
Introduction
Diffusion Brillouin, d'abord décrit par Léon Brillouin 1 en 1922, est la diffusion inélastique de la lumière à partir des modes acoustiques thermiques dans un solide et des fluctuations de densité thermique dans un liquide ou un gaz. Le décalage spectral de la lumière diffusée, généralement dans la sous-gamme GHz, fournit des informations sur l'interaction entre la lumière incidente et les phonons acoustiques dans l'échantillon. En conséquence, il peut fournir des informations utiles en ce qui concerne les propriétés viscoélastiques du matériau examiné.
Dans sa version spontané, la diffusion Brillouin a généralement des sections transversales de l'ordre de la diffusion Raman, résultant en un signal très faible. En outre, les changements de fréquence de Brillouin sont des ordres de grandeur plus faible que les changements Raman. En conséquence, élastique lumière diffusée (de Rayleigh ou la diffusion de Mie), la lumière parasite et de back-off réflexions de l'échantillon peuvent tous facilement éclipser la signature spectrale Brillouin. Par conséquent, Un spectromètre de Brillouin a besoin non seulement d'obtenir des sous-GHz résolution spectrale mais aussi contraste spectral haute ou l'extinction.
Dans spectromètres de Brillouin traditionnels, ces exigences sont remplies par monochromateurs de balayage-réseau, les méthodes de battage optiques, et, plus couramment, interféromètres numérisation multiple-pass Fabry-Perot 2. Ces méthodes mesurent chaque composante spectrale séquentiellement. Cette approche conduit à des temps d'acquisition pour un unique spectre de Brillouin allant de quelques minutes à plusieurs heures, en fonction de l'instrument et sur l'échantillon. Le VIPA spectromètre à deux étages, construit en utilisant ce protocole, a la capacité de rassembler tous les composants spectraux en moins d'une seconde, tout en offrant l'extinction suffisante (> 60 dB) pour supprimer efficacement les autres signaux parasites 2.
L'intégration des étalons VIPA est l'élément clé de ce spectromètre. Un VIPA est un étalon solide avec trois c différentezones flottantes: dans la surface avant, une bande de revêtement anti-reflet étroite permet à la lumière d'entrer dans le VIPA, tandis que le reste de la surface dispose d'un (HR) revêtement hautement réfléchissant; dans la surface arrière, un revêtement partiellement réfléchissant permet à une petite partie (environ 5%) de la lumière à transmettre. Lorsque focalisé sur l'entrée étroite de la VIPA légèrement incliné, le faisceau de lumière se réfléchit en sous-composants avec différence de phase fixe dans le VIPA 2. Les interférences entre les sous-composantes réalise la dispersion spectrale élevée aspiré. Aligner deux VIPAs séquentiellement en configuration axe transversal introduit dispersion spectrale dans des directions orthogonales 3. La dispersion spectrale dans des directions orthogonales dans l'espace séparant les pics de Brillouin de la diaphonie indésirable, ce qui rend possible de récupérer uniquement le signal de Brillouin. La figure 1 présente un schéma de la VIPA spectromètre à deux étages. Les flèches ci-dessous les éléments optiques indiquent les degree de liberté dans lequel doivent être orientés les stades traductionnelles.

Figure 1. configuration instrumentale. Une fibre optique offre la diffusion Brillouin dans le spectromètre. Une lentille cylindrique C1 (f = 200 mm) focalise la lumière dans l'entrée de la première VIPA (VIPA1). Une autre lentille cylindrique C2 (f = 200 mm) mappe la dispersion angulaire spectrale en une séparation spatiale dans le plan focal de C2. Dans ce plan, un masque vertical est utilisé pour sélectionner la partie souhaitée du spectre. Une configuration analogue suit, incliné à 90 degrés. Le faisceau passe à travers une lentille sphérique S1 (f = 200 mm) et se concentre dans la fente d'entrée de la deuxième VIPA (VIPA2). Une lentille sphérique S2 (f = 200 mm) crée le motif bidimensionnel spectralement séparée dans son plan focal, où un autre masque horizontal est placé. L'hormasque izontal est imagé sur la caméra EMCCD utilisant une paire de lentilles achromatiques. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Un étudiant de premier cycle avec quelques cours de l'optique et de l'expérience de base d'alignement devrait être en mesure de construire et d'utiliser ce spectromètre à deux étages. Le spectromètre a été récemment montré pour être compatible avec une grande variété de sondes optiques standard 3,4,5 (par exemple, un microscope confocal, endoscope, la lampe à fente ophtalmoscope). Ici, le spectromètre est connecté à un microscope confocal. La lumière laser est aligné dans un système de recherche inversée microscope standard après avoir intégré un diviseur de faisceau 90:10. La lumière de rétrodiffusion à partir de l'échantillon est couplé dans une fibre monomode, rendant le microscope confocal.
Protocole
Note: l'analyse spectrale Brillouin nécessite un laser monomode longitudinal (~ 10 mW à l'échantillon). À des fins d'alignement, en utilisant une portion fortement atténuée de ce faisceau laser (<0,1 mW).
1. Configuration initiale de fibres et de l'EMCCD (Electron Charge Coupled Device Multiplié) Caméra
- Identifier environ 1600 mm d'espace libre d'alignement pour le spectromètre sur une table optique.
- Monter la caméra EMCCD à la fin de l'espace libre d'alignement.
- Utilisez les vis de réglage pour fixer la caméra à des postes. Serrer les messages dans les titulaires de poste à la hauteur de l'axe optique désirée. Serrer les titulaires des postes sur la table optique en utilisant des pinces de table.
- Allumez la caméra EMCCD. Soyez attentif pour éviter la saturation de la caméra.
- Installez le logiciel de l'appareil photo sur l'ordinateur de laboratoire et connecter l'appareil photo à l'ordinateur.
- Désactiver le gain et mettre bas temps d'intégration (~ 0,01 sec). Commencer à acquérir des images EMCCD. Observez l'image de la caméras sur l'écran d'ordinateur.
- Monter le collimateur de fibre autour de 1.600 mm à l'avant de la caméra.
- Placez le collimateur de fibre dans l'adaptateur de collimation de fibre.
- Montez l'adaptateur sur un poteau. Serrer le poste dans un support de poste à la hauteur approximative de l'axe optique (hauteur de la caméra). Serrer titulaire du poste sur table optique en utilisant des pinces de table.
- Aligner le faisceau de sortie le long de l'axe optique.
- Utilisez une vis de réglage pour connecter un iris standard pour un poste. Serrer le poste dans un support de poste.
- Placer l'iris en avant du collimateur de fibre (<50 mm). Réglez la hauteur de l'iris à la poutre. Déplacez l'iris long de l'axe optique désirée, qui doit pointer directement dans la caméra.
- Insérer un filtre de densité optique directement après la sortie du laser si les acides gras saturés de la caméra. Les vis de réglage du collimateur de fibre de montage pour aligner le faisceau le long de l'axe optique. Une fois que ceci est réalisé, lafaisceau sera proprement passer à travers l'iris le long de la trajectoire du faisceau entier.
- Monter une paire de lentilles achromatique identifié (f = 30 mm) en face de la caméra.
2. Horizontal Stade de spectromètre
- Monter le masque horizontal.
- Utilisez les vis de réglage pour fixer le masque horizontale sur un poteau. Serrer le poste dans un support de poste. Monter le support sur un poste de phase de translation, ce qui permet de glisser le masque horizontalement dans et hors de la trajectoire du faisceau. (Figure 1)
- Utilisez les vis pour serrer l'étape de translation sur la table optique tels que le masque est fortement imagé sur la caméra CCD à la distance focale (f = 30 mm) de la paire de lentilles achromatiques.
- Monter et aligner la lentille sphérique S1 (f = 200 mm) de 600 mm à l'avant du masque horizontale.
- Utilisez les vis de réglage pour monter S1 sur un titulaire du poste. Serrer le poste dans un support de poste.
- Montez deux iris comme décrit dans 1.5.1. Avant placing S1 dans la trajectoire du faisceau, insérer un iris avant et une iris après la position désirée S1 (600 mm à l'avant du masque horizontale). Régler la hauteur des iris de telle sorte que le faisceau passe à travers proprement deux d'entre eux.
- Placez S1 600 mm à l'avant du masque horizontale (Figure 1). Ajustez la hauteur et l'angle de S1 jusqu'à ce que les deux, la réflexion marche arrière de la lentille et le faisceau sur-venir, passer proprement à travers les iris. Serrer le titulaire du poste tenant S1 sur la table optique en utilisant des pinces de table.
- VIPA2 mont dans le plan focal de la lentille sphérique (200 mm en avant de S1).
- Montez le support VIPA sur un poteau à l'aide des vis fournies avec le support. Serrer le poste dans un support de poste. Serrer le titulaire du poste sur une platine de translation horizontale. (Figure 1)
- Placez VIPA2 attentivement dans le support VIPA avec la fente d'entrée orienté verticalement. (Figure 1)
- Beaux-ajuster la position of monter le VIPA pour être exactement dans le plan focal de S1. (Vérifiez en traçant la taille du faisceau avec une carte blanche.)
- Utilisez les vis pour serrer l'étape de translation sur la table et glisser VIPA2 optique hors du faisceau en utilisant le degré de liberté de la scène de translation.
- Monter et aligner la lentille sphérique S2 (f = 200 mm) de 200 mm après la VIPA et 200 mm à l'avant du masque horizontale. Suivez la procédure décrite dans 2.2.1-2.2.3. Au lieu de fixer le titulaire du poste sur la table optique, le monter sur une scène de translation avec son degré de liberté orienté le long de l'axe optique. (Figure 1) Utilisez les vis pour serrer l'étape de translation sur la table optique.
- Utiliser l'étage de translation horizontale (2.3.4) à l'entrée de glisser VIPA2 dans le trajet du faisceau. Respecter les lignes verticales sur l'image de la caméra.
- Beaux-S2 ajuster en utilisant l'étape de translation monté dans 2.4 jusqu'à ce que les lignes verticales sur l'image de la caméra apparaissentpointu.
- Réglez le spectre avec le degré d'inclinaison horizontale de la liberté sur le support VIPA et le stade de translation. Utilisez le degré de liberté horizontal traduction pour régler la position d'entrée du faisceau dans l'étalon. Utilisez le degré de liberté horizontal inclinaison pour ajuster l'angle du faisceau d'entrée dans l'étalon.
- Mesurer la finesse et le débit.
- Prenez une image en appuyant sur F5 ou bien en cliquant sur "configuration de l'acquisition» dans le coin supérieur gauche et en choisissant l'option «prendre l'image" dans le logiciel de la caméra.
- Faites un clic droit sur l'image et choisissez l'option "de la parcelle de ligne". Faites glisser le curseur horizontalement sur l'image pour générer un tracé de ligne. Relâchez le curseur pour observer le tracé de la ligne générée.
- Utilisez le tracé de la ligne pour mesurer la finesse. Diviser la distance entre deux sommets par leur largeur à mi-hauteur (FWHM). Visez> 30.
- Déterminer le débit par measuring le pouvoir avec un compteur de puissance immédiatement avant et après VIPA2. Visez> 50%.
- Ajuster l'angle d'entrée du faisceau dans l'étalon avec le degré de liberté sur le support VIPA (2,6) et observer le compromis entre finesse et le débit.
- Si la finesse et le débit ne sont pas satisfaisants revenir en arrière et fine ajuster l'alignement. Assurez-vous que VIPA2 se trouve dans le plan focal de S1. Répétez les étapes 2.3.3 -2.7.
3. Vertical Stade de spectromètre
- Faites glisser le VIPA (VIPA2), aligné dans la partie 2, sur le faisceau en utilisant l'étape de translation (2.3.4). La phase horizontale du spectromètre va maintenant se comporter comme un mélange 1: 1 d'imagerie.
- Monter le masque vertical.
- Utilisez les vis de réglage pour fixer le masque vertical sur un poste. Serrer un poste dans un adaptateur poste de pince à angle droit. Serrer un deuxième poste dans l'adaptateur à angle droit et le mettre dans un titulaire du poste. Montez le titulaire du poste sur un vertical translationnelle étape, allowing du masque de coulisser verticalement dans et hors du trajet du faisceau. (Figure 1)
- Utilisez des vis de chapeau à resserrer l'étape de translation verticale sur la table optique tels que le masque vertical est imagé fortement sur la caméra EMCCD 200 mm à l'avant du S1.
- Monter et aligner la lentille cylindrique C1 (f = 200 mm) 600 mm à l'avant du masque vertical.
- Vissez le support de lentille cylindrique sur un poste. Serrer le poste dans un support de poste. Placez délicatement C1 dans le support de lentille et serrez les vis pour le fixer en place.
- Montez deux iris comme décrit dans 1.5.1. Avant de placer C1 dans la trajectoire du faisceau, insérer un iris avant et une iris après la position désirée S1 (600 mm à l'avant du masque vertical). Régler la hauteur des iris de telle sorte que le faisceau passe à travers proprement deux d'entre eux.
- Lieu C1 600 mm en avant du masque vertical (figure 1). Ajustez soigneusement la hauteur, l'inclinaison et la position latérale de C1 jusqu'àà la fois, la réflexion marche arrière de la lentille et le faisceau sur-venir, sont centrés sur les iris. Serrer le titulaire du poste maintien C1 sur la table optique en utilisant des pinces de table.
- VIPA1 mont dans le plan focal de la lentille cylindrique (200 mm en avant du C1).
- Montez le support VIPA sur un poteau à l'aide de la vis fournie avec le support. Serrer le poste dans un support de poste. Serrer le titulaire du poste sur une platine de translation verticale. (Figure 1)
- Placez VIPA1 attentivement dans le support VIPA avec la fente d'entrée orienté horizontalement. (Figure 1)
- Beaux-ajuster la position de la VIPA montage pour placer VIPA1 exactement dans le plan focal de C1. (Vérifiez en traçant la taille du faisceau avec une carte blanche.)
- Utilisez des vis de chapeau à resserrer l'étape de translation verticale sur la table optique et glissent VIPA1 hors du faisceau en utilisant le degré de liberté de la scène de translation.
- Monter et aligner lelentille cylindrique C2 (f = 200 mm) 200 mm après VIPA1 et 200 mm à l'avant du masque vertical, suivant la procédure décrite dans 3.3.1-3.3.3. Au lieu de fixer le titulaire du poste sur la table optique, le monter sur une scène de translation avec son degré de liberté orienté le long de l'axe optique. (Figure 1) Utilisez les vis pour serrer l'étape de translation sur la table optique.
- Utiliser l'étage de translation (3.4.4) à l'entrée de glisser VIPA1 dans le trajet du faisceau. Respecter les lignes horizontales sur l'image de la caméra.
- Ajustez avec C2 en utilisant l'étape de translation monté dans 3,5 jusqu'à ce que les lignes horizontales sur l'image de la caméra apparaissent forte.
- Réglez le spectre avec le degré d'inclinaison verticale de la liberté sur le support VIPA et le stade de translation. Utilisez le degré de liberté vertical traduction pour régler la position d'entrée du faisceau dans l'étalon. Utilisez le degré de liberté vertical inclinaison pour ajuster l'angle du faisceau d'entrée dans l'alsur.
- Mesurer la finesse et le débit.
- Suivez les étapes 2.7.1 -2.7.2 pour générer un tracé de ligne verticalement à travers une image de l'écran de l'appareil.
- Utilisez le tracé de la ligne pour mesurer la finesse en divisant la distance entre deux lignes horizontales par leur largeur à mi-hauteur (FWHM). Visez> 40.
- Mesurer le débit par mesure de la puissance avec un mesureur de puissance immédiatement avant et après VIPA1. Visez> 30%.
- Ajuster l'angle d'entrée verticale du faisceau dans l'étalon avec le degré d'inclinaison verticale de la liberté sur le support VIPA (3,7). Observez le compromis entre finesse et le débit.
- Si la finesse et le débit ne sont pas satisfaisants revenir en arrière et fine ajuster l'alignement. Assurez-vous que VIPA1 est dans le plan focal de la C1. Répétez l'étape 3.4.3-3.8.
4. Combinaison des deux étapes et l'alignement final
- Glissez dans VIPA2. Respecter les points horizontalement et verticalement espacées. Ces points unere la signature spectrale du laser à fréquence unique. Réglez les étapes de translation des VIPAs jusqu'à ce que les points sont au point.
- Mesurer la finesse et le débit du spectromètre.
- Suivez les étapes 2.7.1.-2.7.2 pour générer un tracé de ligne diagonale à travers deux des points laser.
- Utilisez le tracé de la ligne pour mesurer la finesse en divisant la distance en diagonale entre deux points par leur largeur à mi-hauteur (FWHM). Visez> 30.
- Construire une boîte noire pour enfermer le spectromètre.
- Utilisation des rails de construction pour construire le squelette boîte, qui doit entourer la totalité du spectromètre de collimateur de fibre de la caméra CCD (63 in x 9 in x 15 in).
- Couvrir la boîte squelette avec Blackout tissu et du ruban adhésif étanche dans les coins. Veiller à ce que les masques et les VIPAs sont facilement accessibles.
- Se connecter la fibre optique à une sonde standard, tel qu'un microscope confocal réflectance 4. P optique standardrobes utilisés pour collecter la lumière diffusée en retour porteront un signal de Brillouin.
5. mesure du décalage Brillouin
- Fermer la fois le vertical et l'horizontal masques jusqu'à la signature laser disparaît. Déplacez les stades de la traduction en conséquence.
- Activer le gain et augmenter le temps d'intégration de la caméra, autant que possible sans saturer la caméra EMCCD.
- Observez le changement de Brillouin d'un échantillon.
- Placer un échantillon dans la mise au point d'un microscope confocal (ou une autre sonde optique). La résolution spatiale dépend de la lentille d'objectif utilisée dans le microscope confocal. Utilisez un plat en plastique ou une cuvette pour les liquides. Utilisation du methanol pour la première mesure.
- Pour optimiser le débit du spectromètre, ouvert un masque à la fois et parcourir les ordres du spectromètre en inclinant le VIPA et en ajustant sa phase de traduction. Trouver l'ordre dans lequel apparaît le signal le plus fort. Fermer masque nouveau jusqu'à ce que esignal laser e disparaît. Répéter l'opération avec l'autre masque et VIPA (décrit dans 2.6 et 3.7).
- Prendre une mesure de l'échantillon.
- Prenez une image du spectre après l'étape 2.7.1.
- Obtenir des mesures d'étalonnage en prenant une image du spectre de l'eau et le verre (ou autre échantillon avec connue changement de Brillouin). Enregistrez l'image en cliquant sur «Fichier» dans le coin supérieur gauche et en choisissant l'option "enregistrer sous". Enregistrer l'image en format ".sif" si l'analyse des données est effectuée dans le logiciel de la caméra. Enregistrez l'image en format ".tif" si l'analyse des données est effectuée dans un autre logiciel de calcul.
6. étalonnage et d'analyse du spectre Brillouin
- Déterminer la gamme spectral libre (FSR) et le EMCCD pixel optique ratio de conversion de fréquence (PR) dans le spectromètre de Brillouin.
- Charger les données dans le logiciel de la caméra ou un autre Computalogiciel tional.
- Suivez l'étape 2.7.2 pour générer un tracé de ligne à travers le spectre de l'image d'étalonnage de l'eau.
- Monter les deux pics du spectre avec des courbes de Lorentz pour déterminer les positions de pointe en termes de position de pixel (P eau-S, P Eau-AS). Alternativement, lire les positions des pics manuellement en prenant le point sur les sommets les plus élevés.
- Répétez l'étape 6.1.2-6.1.3 avec le spectre de l'image d'étalonnage de verre.
- Alternativement à 6.1.1-6.1.4, ajouter les deux cadres EMCCD et monter tous les quatre sommets à la fois. (Figure 2)
- Calculer la PR en utilisant l'équation 1. Branchez les valeurs de P eau-AS et P Glass-déterminée 6.1.3 et 6.1.4. Verre Ω-AS est connu pour être de 29,3 GHz. Dans ce cas, puisque la gamme spectrale libre est à seulement 20 GHz, il apparaîtra alias avec le décalage de fréquence de 9,3 GHz. Pour plus de simplicité utiliser 9,3 GHz pour Ω Glass-AS. Utilisez 7.46 GHz pour ΩEau-AS.

- Calculer la FSR en utilisant l'équation 2. Branchez les valeurs P verre-S, P Glass-AS et PR, calculées 6.16. Utilisez 9,3 GHz pour Ω Glass-AS.

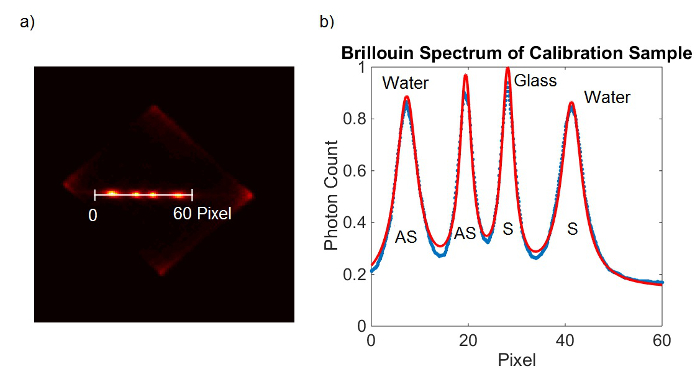
Figure 2. calibration du spectromètre. Cadre (A) de la caméra EMCCD obtenu à partir de l'échantillon d'étalonnage. (B) courbe d'ajustement de Lorentz (rouge) pour les données mesurées (en bleu). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Déterminer le décalage Brillouin deun échantillon.
- Suivez l'étape 2.7.2 pour générer un balayage de ligne à travers le spectre de l'échantillon.
- Monter les deux pics du spectre avec des courbes de Lorentz pour déterminer les positions de pointe en termes de position de pixel. Alternativement, lire les positions des pics manuellement en prenant le point sur les sommets les plus élevés.
- Utilisez les équations suivantes 4 et 5 et les valeurs précédemment calculées pour FSR et PR pour calculer le déplacement de Brillouin de l'échantillon.
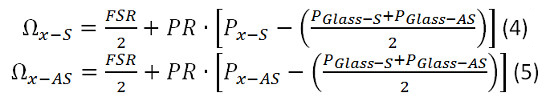
Résultats
La figure 3 montre les spectres de Brillouin représentatif et leurs accès pour les différents matériaux. Les VIPAs les deux ont une épaisseur de 5 mm ce qui entraîne une FSR de l'ordre de 20 GHz. Le temps d'intégration pour ces mesures était de 100 ms. 100 mesures ont été prises et une moyenne. Une mesure d'étalonnage a été prise avant d'acquérir les spectres.
Discussion
Une des principales caractéristiques de la conception de cette configuration de spectromètre est que les deux étapes peuvent être alignés de façon indépendante. Quand un étalon VIPA est glissé hors du trajet optique, les lentilles restantes de la phase de spectromètre forment un mélange 1: 1 d'imagerie, de sorte que le motif spectral de chaque étage est imagée sur la caméra CCD. Par conséquent, il est facile de revenir à l'une des étapes pour améliorer ses performances sans affecter l'align...
Déclarations de divulgation
Giuliano Scarcelli and Seok H. Yun hold patents related to Brillouin spectroscopy technology.
Remerciements
This work was supported in part by the National Institutes of Health (P41-EB015903, R21EY023043, K25EB015885), National Science of Foundation (CBET-0853773) and Human Frontier Science Program (Young Investigator Grant).
matériels
| Name | Company | Catalog Number | Comments |
| OPTICS | |||
| VIPA (virtual image phase array) | LIGH MACHINERY | Quantity: 2 | |
| Bundle of Three 423 Linear Stages with SM-25 Micrometers | NEWPORT | 423-MIC | Quantity: 1 |
| SS Crossed-Roller Bearing Translation Stage, 0.5 in., 8-32, 1/4-20 | NEWPORT | 9066-X | Quantity: 1 |
| Vernier Micrometer, 13 mm Travel, 9 lb Load Capacity, 50.8 TPI | NEWPORT | SM-13 | Quantity: 1 |
| Adjustable Width Slit | NEWPORT | SV-0.5 | Quantity: 2 |
| Compact Dovetail Linear Stage, 0.20 in. Z Travel, 1.57x1.57x1.38 in. | NEWPORT | DS40-Z | Quantity: 2 |
| Slotted Base Plate, 25 or 40 mm to 65 mm Stage, 1.1 in. Range | NEWPORT | B-2B | Quantity: 2 |
| Ø1/2" Optical Post, 8-32 Setscrew, 1/4"-20 Tap, L = 2", 5 Pack | THORLABS | TR2-P5 | Quantity: 2 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrews, L = 2", 5 Pack | THORLABS | PH2-P5 | Quantity: 1 |
| Ø1/2" Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L = 3", 5 Pack | THORLABS | PH3-P5 | Quantity: 1 |
| Imperial Lens Mount For 2" Optics, 8-32 Tap | THORLABS | LMR2 | Quantity: 2 |
| f=200.0 mm, Ø2" Achromatic Doublet, ARC: 400-700 nm | THORLABS | AC254-200-A | Quantity: 2 |
| Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Right Handed | THORLABS | KM100C | Quantity: 2 |
| Fixed Cylindrical Lens Mount, Max Optic Height: 1.60" (40.6 mm) | THORLABS | CH1A | Quantity: 2 |
| f=200.00 mm, H=30.00 mm, L=32.0 mm, N-BK7 Plano-Convex Cylindrical Lens, Antireflection Coating: 350-700 nm | THORLABS | L1653L1-A | Quantity: 2 |
| Right-Angle Post Clamp, Fixed 90° Adapter | THORLABS | RA90 | Quantity: 1 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | THORLABS | SM1A9 | Quantity: 1 |
| Studded Pedestal Base Adapter, 1/4"-20 Thread | THORLABS | PB4 | Quantity: 2 |
| Spacer, 2" x 3", 1.000" Thick | THORLABS | Ba2S7 | Quantity: 2 |
| 543 nm, f=15.01 mm, NA=0.17 FC/APC Fiber Collimation Pkg. | THORLABS | F260APC-A | Quantity: 1 |
| SM1-Threaded Adapter for Ø11 mm collimators | THORLABS | Ad11F | Quantity: 1 |
| Translating Lens Mount for Ø1" Optics, 1 Retaining Ring Included | THORLABS | LM1XY | Quantity: 1 |
| Single Mode Patch Cable, 450 - 600 nm, FC/APC, 2 m Long | THORLABS | P3-460B-FC-2 | Quantity: 1 |
| 1:1 Matched Achr. Pair, f1=30 mm, f2=30 mm, BBAR 400-700 nm | THORLABS | MAP103030-A | Quantity: 1 |
| SM1 Lens Tube…length to adjust depend on CCD, we have 3.5 inches | THORLABS | SM1LXX | Quantity: 1 |
| Base Adapters for Ø1/2" Post Holders and Ø1" Posts | THORLABS | BE1 | Quantity: 8 |
| Clamping Forks for Ø1/2" Post Holders and Ø1" Posts | THORLABS | CF125 | Quantity: 8 |
| HW-KIT5 - 4-40 Cap Screw and Hardware Kit for Mini-Series | THORLABS | HW-KIT5 | Quantity: 1 |
| D20S - Standard Iris, Ø20.0 mm Max Aperture | THORLABS | D20S | Quantity: 2 |
| FOR ENCLOSURE | |||
| 25 mm Construction Rail, L = 21" | THORLABS | XE25L21 | Quantity: 6 |
| 1" Construction Cube with Three 1/4" (M6) Counterbored Holes | THORLABS | RM1G | Quantity: 8 |
| Right-Angle Bracket for 25 mm Rails | THORLABS | XE25A90 | Quantity: 12 |
| 25 mm Construction Rail, L = 15" | THORLABS | XE25L15 | Quantity: 4 |
| 25 mm Construction Rail, L = 9" | THORLABS | XE25L09 | Quantity: 8 |
| High Performance Black Masking Tape, 2" x 60 yds. (50 mm x 55 m) Roll | THORLABS | T743-2.0 | Quantity: 1 |
| Low-Profile T-Nut, 1/4"-20 Tapped Hole, Qty: 10 | THORLABS | XE25T3 | Quantity: 1 |
| 1/4"-20 Low-Profile Channel Screws (100 Screws/Box) | THORLABS | SH25LP38 | Quantity: 1 |
| 60" (W) x 3 yds. (L) x 0.005" (T) (1.5 m x 2.7 m x 0.12 mm) Blackout Fabric | THORLABS | BK5 | Quantity: 1 |
| CAMERA, LASER and MICROSCOPE | |||
| EMCCD camera | ANDOR | iXon Ultra 897 | Quantity: 1 |
| 400 mW single mode green laser | LASER QUANTUM | torus 532 | Quantity: 1 |
| Research Inverted System Microscope | OLYMPUS | IX71 | Quantity: 1 |
Références
- Brillouin, L. Diffusion de la lumiere et des rayonnes X par un corps transparent homogene; influence del'agitation thermique. Ann. Phys. (Paris) . 17, 88-122 (1922).
- Scarcelli, G., Yun, S. H. Multistage VIPA etalons for high-extinction parallel Brillouin spectroscopy. Opt. Exp. 19 (11), 10913-10922 (2011).
- Scarcelli, G. Confocal Brillouin microscopy for three-dimensional mechanical imaging. Nat. Phot. 2 (1), 39-43 (2008).
- Nichols, A. J., Evans, C. L. Video-rate Scanning Confocal Microscopy and Microendoscopy. J. Vis. Exp. (56), e3252 (2011).
- Steelman, Z., Meng, Z., Traverso, A. J., Yakovlev, V. V. Brillouin spectroscopy as a new method of screening for increased CSF total protein during bacterial meningitis. J. Biophoton. 8 (5), 1-7 (2014).
- Koski, K. J., Yarger, J. L. Brillouin imaging. Appl. Phys. Lett. 87 (6), 061903 (2005).
- Faris, G. W., Jusinski, L. E., Hickman, A. P. High-resolution stimulated Brillouin gain spectroscopy in glasses and crystals. J. Opt. Soc. Am. B. 10 (4), 587-599 (1993).
- Scarcelli, G., Yun, S. H. In vivo Brillouin optical microscopy of the human eye. Opt. Exp. 20 (8), 9197-9202 (2012).
- Scarcelli, G., Besner, S., Pineda, R., Kalout, P., Yun, S. H. In Vivo Biomechanical Mapping of Normal and Keratoconus Corneas. Jama Ophtalmol. , (2015).
- Scarcelli, G., Kim, P., Yun, S. H. In Vivo Measurement of Age-Related Stiffening in the Crystalline Lens by Brillouin Optical Microscopy. Biophys. J. 101 (6), 1539-1545 (2011).
- Antonacci, G., Foreman, M. R., Paterson, C., Török, P. Spectral broadening in Brillouin imaging. Appl. Phys. Lett. 103 (22), 221105 (2013).
- Meng, Z., Traverso, A. J., Yakovlev, V. Background clean-up in Brillouin microspectroscopy of scattering medium. Opt. Exp. 22 (5), 5410-5415 (2014).
- Reiss, S., Burau, G., Stachs, O., Guthoff, R., Stolz, H. Spatially resolved Brillouin spectroscopy to determine the rheological properties of the eye lens. Biomed. Opt. Exp. 2 (8), 2144-2159 (2011).
- Scarcelli, G., Kling, S., Quijano, E., Pineda, R., Marcos, S., Yun, S. H. Brillouin microscopy of collagen crosslinking: noncontact depth-dependent analysis of corneal elastic modulus. Invest. Ophthalmol. Vis. Sci. 54 (2), 1418-1425 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon