Method Article
Planung, Verpackung und Lieferung von hohen Titern CRISPR Retro und Lentiviren über stereotaktische Injektion
In diesem Artikel
Zusammenfassung
Der CRISPR / Cas9 System bietet das Potenzial, um gezielte Genom Bearbeitung zugänglich und erschwinglich für die wissenschaftliche Gemeinschaft. Dieses Protokoll soll zeigen, wie Viren zu schaffen, die ein Gen von Interesse unter Verwendung des CRISPR / Cas9 System Knockout wird, und sie dann stereotaxically in die erwachsenen Maus Gehirn zu injizieren.
Zusammenfassung
Replication defective lentiviruses or retroviruses are capable of stably integrating transgenes into the genome of an infected host cell. This technique has been widely used to encode fluorescent proteins, opto- or chemo-genetic controllers of cell activity, or heterologous expression of human genes in model organisms. These viruses have also successfully been used to deliver recombinases to relevant target sites in transgenic animals, or even deliver small hairpin or micro RNAs in order to manipulate gene expression. While these techniques have been fruitful, they rely on transgenic animals (recombinases) or frequently lack high efficacy and specificity (shRNA/miRNA). In contrast, the CRISPR/Cas system uses an exogenous Cas nuclease which targets specific sites in an organism's genome via an exogenous guide RNA in order to induce double stranded breaks in DNA. These breaks are then repaired by non-homologous end joining (NHEJ), producing insertion and deletion (indel) mutations that can result in deleterious missense or nonsense mutations. This manuscript provides detailed methods for the design, production, injection, and validation of single lenti/retro virus particles that can stably transduce neurons to express a fluorescent reporter, Cas9, and sgRNAs to knockout genes in a model organism.
Einleitung
Auf der Grundlage einer normalen Physiologie und Krankheitspathologie untersuchen, besteht ein Bedarf an genau Genexpression in Modellorganismen manipulieren. Für Säugetiermodellorganismen, wird dies auf die Schaffung und Entwicklung von transgenen Mäusen weitgehend zentriert, wobei ein genetisches Element von Interesse von Websites durch eine Rekombinase erkannt flankiert wird. Dies kann in einer ortsspezifischen Manipulation dieser Gene flankiert führen. Zwar ist dies eine erfolgreiche Strategie gewesen ist, ist es an der Zeit und ressourcenintensiv; beispielsweise eine dreifache transgenes Tier zu schaffen, die eine floxed Gen, Cre-Rekombinase, und ein Cre-Reportergens erfordert mehrere Paarungen und Validierung ausdrücken würde. Im Gegensatz dazu , codierend die stereotaxische Injektion von replikationsdefekte virale Partikel ein fluoreszierendes Protein und das Rekombinase - Gen in ein floxed Tier erfordert keine komplexe Genotypisierung oder Zuchtstrategien 1. Wenn ein fluoreszierendes Protein und Cre exprimierenden Virus weiter ist mit einem zweiten Virus enco coinjiziertding ein anderes fluoreszierendes Protein, dann stellt dies eine Kontrolle im Gewebe für die gezielte genetische Manipulation. Während diese Strategie immer noch die Verwendung von Knock-in Tieren erfordert, viral vermittelter RNA basierte Strategien umgehen die Notwendigkeit für transgene Tiere. Zum Beispiel können stereotaktische Injektion von replikationsdefizienten Viren, die ein fluoreszierendes Protein und eine kurze haarnadel RNA (shRNA) kodieren verwenden die endogenen RNAi-Maschinerie der Zelle in einem starken Reduktion des Transkripts eines Gens von Interesse zu führen. Allerdings produzieren shRNA Strategien subtile Gen knock-downs oft zu bescheiden zellulären Phänotypen 2. Während ein knock-down physiologisch für heterozygote Gen Dysfunktion relevant mehr sein kann, die im Vergleich verringerte Robustheit zu einem Knock-out ist für phänotypische Entdeckung neuer Gene nicht ideal.
Eine dritte Technik, die vor kurzem entstanden ist, die CRISPR (Clustered regelmäßig auf Abstand Short Palindromic Repeat) / Cas9 (CRISPR-assoziiertenProtein 9) System beruht auf der Expression von sowohl einer kleinen exogene RNA und DNA Schneid Enzyms. Das CRISPR / Cas9 System wurde aus dem prokaryotischen Immunsystem angepasst , die ein Verfahren zur Identifizierung von Fremd entwickelt, eindringende DNA von Viren und zum Abbau über die Cas9 Enzyms 3,4 - Targeting. Diese leistungsstarke Genom Schnitttechnik kann zur Erstellung von gezielten Deletionen, Insertionen und Mutationen verwendet werden; und das folgende Protokoll wird darlegen , wie Deletionen in einem Gen von Interesse zu machen , um seine Expression in vivo KO. Das Cas9 Enzym muss mit einer Führung RNA homolog zu der Region von Interesse und angrenzend an ein Gerüst RNA exprimiert werden. Knockout eines Gens unter Verwendung dieser Technik erfordert bei einer Stelle von Interesse Cas9 auf eine bestimmte Region im Genom unter Verwendung von synthetischen Führungs RNAs (sgRNA) und induziert Doppelstrangbrüche (DSBs) Targeting. Diese DSBs werden dann durch die endogene Zellreparaturmaschinerie über nicht-homologous end-joining (NHEJ), die le repariertAnzeige an indels , dass Mutationen Missense oder Unsinn erzeugen kann und somit einen Verlust von funktionellen Proteinexpression 5 erstellen. Da dieses System genomische Veränderungen produziert, es erfordert nur die transiente Expression des Cas9 und sgRNA. Jedoch ist es wünschenswert, eine stabile Fluoreszenzindikatorzellen und deren Nachkommen in dieser Weise manipuliert zu identifizieren.
Lenti- und Retroviren haben den Vorteil der DNA von Interesse in die Wirtszellen stabil zu integrieren, die langfristigen Ausdruck erhalten und sind bis auf die Tochterzellen während der Mitose übergeben. Dieses Protokoll beschreibt die Konstruktion und Herstellung von zwei Arten von replikationsdefekten, hohe Titer-Retroviren: das menschliche Immunschwäche-Virus abgeleitet lentivirale Partikel (Lentivirus) sowie auf Basis von murinen Maloney-Leukämie-Virus (Retrovirus). Während diese beiden Viren stabile Lage sind, unterstützen großer Transgene exprimieren, können die retroviralen Partikel nur in das Genom integrieren duRing Zellteilung mit dem Abbau der Kernhülle und kann daher als Werkzeug Zellen zu markieren und Geburtstermin 6 verwendet werden. Während Lentiviren für einen Ruf haben relativ niedrige Titer 7 ist, diese Methode, einschließlich der Verwendung von Coffein 8 während der viralen Sammlung produziert routinemßig Titern von 10 9 und 10 10 Partikel / ml. Ein weiterer Vorteil der lenti- und Retroviren ist die Toleranz für sehr große Einsätze. Die folgende Sammlung von Protokollen beschreibt das Verfahren für die lenti oder Retrovirus Gestaltung kodieren ein fluoreszierendes Reporter, sgRNAs und Cas9 das CRISPR / Cas9 System zu verwenden, DNA sowie exprimieren ein fluoreszierendes Protein zu modifizieren.
Maus stereotaxische Neurochirurgie ist ein wertvolles Verfahren für Viren in vivo zu studieren Morphologie, Funktion und Konnektivität von infizierten Neuronen einzuspritzen. Virusinfektion in Neuronen können verwendet werden, um Expressionsspiegel über einen längeren Zeitraum von tim manipulierene, wie beispielsweise während der Entwicklung, und die Expression kann präzise durch die Verwendung von verschiedenen Arzneimittel induzierbare Systeme und spezifische Cre-Expression angetrieben gesteuert werden. Diese besondere Protokoll beschreibt, wie ein Virus zu injizieren eine sgRNA und Cas9 exprimieren im Gehirn eines erwachsenen Maus ein Gen von Interesse KO. Mäuse erholen sich sehr schnell von diesem Verfahren und die Expression des viralen Transgen kann innerhalb von 48 Stunden nach der Injektion zu sehen. Jedoch Fluorophor Ausdruck erscheint im Laufe von Wochen zu erhöhen, in einer nahezu maximalen Niveaus von 3 Wochen nach der Infektion resultiert. Mäuse, die virale stereotaktische Injektion unterziehen kann Verhalten, Elektrophysiologie oder morphologischen Untersuchungen verwendet werden. Insgesamt ist der Zweck dieser Verfahren zu demonstrieren, wie im erwachsenen Gehirn der Maus mit stereotaktischen Operation und ein Virus die Expression eines bestimmten sgRNA und Cas9 ein Gen Knockout.
Protokoll
Ethikerklärung: Alle Protokolle, die von der Dartmouth Institutional Biosafety und Institutional Animal Care und Use Committee Review Boards genehmigt.
1. Protokoll einen Leitfaden Strand (sgRNA) für CRISPR / Cas9 Retrovirus für die Gestaltung
HINWEIS: Es gibt viele Non-Profit-Websites, die verwendet werden können, sgRNAs zur Erzeugung eines Gens von Interesse zu zielen (https://benchling.com/ und http://crispr.mit.edu/). Das Ziel des Protokolls ist die Konzeption und einzelsträngige Oligos von einem kommerziellen Anbieter zu bestellen, die miteinander geglüht werden. Diese geglühten oligo in das PXL Transfervektor ligiert werden. Siehe zusätzliche Video 1 ein Beispiel für die Gestaltung sgRNAs Verwendung Benchling.
- Verwenden Sie eine Website, die sich auf sgRNAs entwerfen.
HINWEIS: Zum Beispiel aus der Nähe der Beginn des Gens von Interesse in die Website eine Codierung / exonische Sequenz Eingabe wird eine 20-Nukleotid sgRNA erzeugen. Verwenden, um die 20-Nukleotid-Sequenz sgRNA die Sense- und Antisense-Oligo zu entwerfens, die die sgRNA zu erstellen bestellt werden. - Nach dem sgRNA Erzeugung, kopieren Sie diese Sequenz in ein Textverarbeitungsprogramm. Fügen Sie einen G (Guanin) zu Beginn des 20 - Nukleotid - Sequenz sgRNA in dem Dokument , wenn es nicht bereits beginnen mit einem (dh G-20 - Nukleotid sgRNA Sequenz). Dies ist notwendig, um gute Transkription von der U6-Promotor zu gewährleisten.
- Dokumentieren Sie die reverse Komplement dieser nun 20-21 Nukleotidsequenz. Für den Lese Oligo, add "CACC" an das 5' - Ende der Sequenz in dem Dokument (dh CACC-G-20 - Nukleotid sgRNA Sequenz). Dieser Überhang wird verwendet werden, um die Sequenz in den Vektor zu ligieren PXL.
- Für die Antisense-Oligo, fügen AAAC an das 5'-Ende. Verwenden Sie diese Überhang die Sequenz in der PXL Vektor zu ligieren.
- Besorgen Sie sich die Sense- und Antisense-Oligos. Nachdem die Oligos erhalten, stellen 100 uM Aktien DNAse freie Wasser. Mischen Sie 10 ul jeder der 100 & mgr; M Sense- und Antisense-Oligos mit 4 μl 10x NEB-Puffer 2 und 16 & mgr; l Wasser.
HINWEIS: Sie haben keine Seite Reinigung oder 5'phosphorylation müssen (wie die Bbsl Hänge sind nicht kompatible kohäsive Enden).- Bringen Sie 200 ml Wasser zum Kochen in einem 500-ml-Becher, dann das Rohr schweben diese Mischung in einem Schaum "Floater" Halter enthält. Lassen Sie das Wasser langsam abkühlen von 95 ° C für 2 Stunden bei Raumtemperatur.
- Verdünnen Sie das jetzt geglüht-Oligo Mix 1: 1000 in sterilem Wasser und verwenden Sie sofort in der folgenden Unterbindung oder lagern Sie die restlichen Reaktion bei -20 ° C.
- Digest PXL, ein PX330 Vektor-Derivat mit der BbsI Restriktionsenzym bei 37 ° C für 2 Stunden. Verwenden Sie eine 40 & mgr; l-Reaktion, die 2 ug PXL, 4 ul 10x NEB-Puffer 2, 1 ul BBS1 und als Rest Wasser. Thema der verdauten-PXL zu Routine-Gel Reinigung eines kommerziellen Kits verwenden. Stellen Sie sicher, dass die Ausbeute von ~ 8,5 kB Produkt.
- Unter Verwendung eines kommerziellen Ligationskits, ligieren 1 & mgr; l des 1: 1,000geglüht-Oligos mit 50 ng verdauten und gelgereinigt-PXL. Wandeln Sie die Ligierungsproduktes in kompetente Rekombination defizienten E. coli (NEB 5-alpha, Subklonierung Effizienz). Bildschirm, um die Trans auf das Vorhandensein der richtigen Führung durch Plasmid-DNA-Sequenzierung.
- Digest der U6, Guide-Strang und RNA Gerüstelemente (sgRNA) aus PXL mit BstB1 und Pac1 Restriktionsenzymen und abzubinden in das fluoreszierende Protein-T2A-Cas9 viralen Rückgrat mit den gleichen Restriktionsenzymen verdaut. Wandeln Sie die Ligierungsproduktes (NEB 5-alpha maximale Effizienz). Das fluoreszierende Protein-T2A-Cas9 viralen Rückgrat Plasmide sind geringer Kopien Plasmide und damit geringer Kopien Protokolle verwendet werden müssen.
HINWEIS: Eine zweite sgRNA kann in ähnlicher Weise durch PacI Verdauung eines anderen PXL Führungsstrang-Plasmid und ligiert in die Pac1 eingeführt werden verdaut und Kälberdarm-Phosphatase virale Rückgrat bereits mit dem ersten Führungsstrang behandelt. Phosphatasebehandlung des viralen Transfer-Plasmid wird dazu beitragen,die Anzahl der Transformanten aus der Selbstligation von Plasmiden reduzieren nicht die zweite Führung enthält. - Sequenz überprüfen Sie die endgültige Plasmid und Maxi-Prep mit dem Nucleobond Xtra Maxi Prep-Kit und verpacken sie in ein Virus mit dem folgenden "Protokoll für Retro / Lentivirale Produktion - CaPO 4-Methode".
2. Bereiten Sie 293FT / 293GP-Zellen für die Transfektion (Retro / Lentivirale Produktion - CaPO 4-Methode)
- (Tag 1) tauen schnell 1 Fläschchen Zellen pro 10 cm Zellkulturplatte in einem 37 ° C Wasserbad. Für lentiviralen Verpackung verwenden 293FT Zellen. Für retrovirale Verpackungs verwenden 293GP (gag / pol) Zellen.
- Pipette alle der aufgetauten-Zellen aus dem Kryo - Röhrchen in einem 15 ml konischen Röhrchen und 2 ml vorgewärmte CO 2 äquilibriert-complete Iscove modifiziertem Dulbecco-Medium.
- Zentrifuge Zellen 5 min bei 500 · g pelletiert. Den Überstand aspirieren und Zellpellet in 10 ml abgeschlossen istBucht des Dulbecco-Medium modifiziert. Platte der Zellen auf einer 10 cm Zellkulturschale. Inkubieren der Zellen über Nacht bei 37 ° C in einem 5% Kohlendioxid-Inkubator.
- (Tag 2) 24 Stunden nach dem Plattieren Änderungsmedien auf der Platte durch die vorhandenen Medien Absaugen und Zugabe von 10 ml vorgewärmtes Iscove modifiziertem Dulbecco-Medium zu der Platte.
- (Tag 3-4) 24-48 Stunden nach der Medienwechsel und sobald die Zellen konfluieren, teilen Sie die Zellen bis zu einer Konfluenz von 2,5-3,0 x 10 6 Zellen / Platte (10 cm - Platte).
- Um die Zellen zu spalten, aspirieren die Medien und waschen Sie die Platte mit 5 ml PBS. 1 ml 0,25% Trypsin auf die Platte und Inkubation bei 37 ° C, bis die Zellen die Platte abheben. Mit 0,5 ml Iscove modifiziertem Dulbecco-Medium, die 0,25% Trypsin-Reaktion zu neutralisieren und die Zellen in einem 1,5 ml-Röhrchen pipettieren.
- Drehen Sie die Zellen bei 500 xg für 5 min. Resuspendieren der Zellen in 1 ml Iscove modifiziertem Dulbecco-Medium. verdünnen Sie 1081; l der Zellen in 90 & mgr; l PBS. Zählen Sie die Zellen unter Verwendung von entweder einer Zählkammer oder automatisierten Zellzähler. Re-Platte 2,5-3,0 x 10 6 Zellen / Platte mit komplettem Iscove modifiziertem Dulbecco-Medium.
HINWEIS: Die Zellen werden ~ 50% konfluent 24-34 Stunden nach der Plattierung. Transfizieren der Zellen, wenn sie ~ 50% konfluent sind.
3. (Tag 5) CaPO 4 Transfektion und Viral Teilchensammelbauteil
- Ändern, um die Medien 2 Stunden vor der Transfektion durch die vorhandenen Medien Absaugen und Zugabe von 10 ml vorgewärmtes Iscove modifiziertem Dulbecco-Medium. Stellen Sie sicher, dass es genau 10 ml Medium in 10-cm-Platte ist.
- Bereiten Sie die Transfektionsreagenzien für 2 Gerichte mit 2, 5 ml Rundboden Polystyrol-Röhrchen. Beschriften Sie die erste Röhre "DNA" und das zweite Rohr "2X HBS". Stellen Sie die Konzentration der DNA auf 1 ug / ul in Tris-EDTA bei pH 7,4.
- Für Lentiviren, fügen Sie langsam 20 ul Transfervektor (der Viral - Konstrukt von Interesse), 13 & mgr; l CMVdelta8.9, 9 ul VSV-g, 860 & mgr; l der Molekularbiologie H 2 O und 100 & mgr; l 2,5 M CaCl 2 zu dem ersten Rohr ( "DNA") , während kontinuierlich Klopfen auf dem Rohr zu mischen.
- Für Retroviren, lassen Sie den CMVdelta8.9 Plasmid. Hinzufügen 20 ul Transfervektors, 15 ul VSV-g, 860 & mgr; l Molecular Biology Grade H 2 O und 100 & mgr; l 2,5 M CaCl 2 zu dem Rohr markierten "DNA".
- 1 ml 2x HEPES-gepufferter Kochsalzlösung (pH 7,0; pH dies absolut kritisch ist) auf das Rohr mit "2X HBS".
- die 1 ml Inhalt der "DNA" Rohr auf die "2X HBS" Rohr, ein Tropfen auf einmal langsam hinzufügen. Kontinuierlich tippen Sie auf die "2X HBS" Rohr mit dem Zeige- oder Mittelfinger, während der Inhalt der "DNA" Röhre hinzugefügt wird. Beachten Sie offensichtlich CaPO 4 Vesikel nach jedem Tropfen. Inkubieren des Rohres im Dunkeln für 30 min bei Raumtemperatur.
- 1 ml der Transfektion in langsamen Tröpfchen zu je 10 cm Zellplatte, dann brüten über Nacht bei 37 ° C.
- (Tag 6) Ersetzen Medien mit 8 ml Iscove modifiziertem Dulbecco-Medium + 0,5% FBS und 40 mg Koffein / 100 ml Medium. Wenn der Transfervektor einen Fluoreszenzmarker enthält, dann Fluorophor Ausdruck deutet auf eine erfolgreiche Transfektion.
- (Tag 7) Sammle die Medien die Viruspartikel durch die Verwendung einer serologischen 10 ml-Pipette und abzugeben in ein 50 ml konisches Röhrchen enthält. Speichern die 50 ml konischen Röhrchen bei 4 ° C. In 8 ml 0,5% FBS Medien zu jeder Platte.
- (Tag 8) Wieder sammeln, um die Medien, die die Viruspartikel enthalten, und verbinden sich mit der Ernte des Vortages in der 50 ml konischen Röhrchen.
4. Konzentration und Reinigung des Virus
- Machen Sie eine 5 - fach Polyethylenglykol 6000 - Lösung durch Zugabe von 40% Polyethylenglykol 6000 und 1,5 M NaCl 2 O bis DDH Autoclave die Lösung aufder Flüssigkeitskreislauf für 45 min bei 121 ° C. mischen Sie langsam die Lösung beim Abkühlen.
HINWEIS: Die Lösung wird trüb beginnen und dann klar geworden, wie es abkühlt. - Zentrifugation der 50 ml konischen Röhrchen beide Sammlungen von viralen Überstand bei 2.000 × g für 10 min enthält, um unlösliche Material zu pelletieren. Reinige den viralen Medium durch Filtrieren durch ein 0,45 & mgr; m geringer Proteinbindung Spritzenfilter (PES oder PVDF).
- Hinzufügen 5x Polyethylenglycol 6000-Lösung, um Medien (Die Endkonzentration sollte 8% Polyethylenglycol 6000 und 0,3 M NaCl werden). Mischen Sie durch die mehrfaches Invertieren (nicht vortexen). Inkubieren der viralen enthaltenden Polyethylenglykollösung bei 4 ° C für 12 oder mehr Stunden, remixing gelegentlich.
- (Tag 9) Zentrifugieren der viralen haltigen Polyethylenglykollösung bei 2.500 × g für 45 min. Entfernen und den Überstand verwerfen und Spin wieder für 2 min. Wieder entfernen und den Überstand verwerfen.
- Das Pellet durch Zugabe von 320 & mgr; lsterile phosphatgepufferte Kochsalzlösung (die 320 & mgr; l beträgt 1/100 des ursprünglichen Volumens von viralen gesammelt haltigen Medien) und über Nacht bei 4 ° C inkubieren. Optional resuspendieren für 30 min auf einer Wippe das Pellet bei Raumtemperatur.
- Nachdem das Pellet erneut suspendiert, aliquoten das Virus (5-10 & mgr; l pro 0,5 ml-Röhrchen) und gefrier Aliquots bei -80 ° C (Auftauen oder Lagerung bei 4 ° C dramatisch den Titer verringern einfrieren).
- Titer der Viren unter Verwendung von Standardprotokollen, dh, führen Sie eine Verdünnungsreihe auf einer 6-Well - Platte von HEK293T - Zellen und manuell fluoreszierende Kolonien 48 Stunden später zählen.
5. Prüfung der Wirksamkeit des CRISPR Virus
HINWEIS: Sequence-Klone mit den folgenden Schritten von NHEJ repariert zu testen, für die Herstellung von Doppelstrangbrüchen der Maus Neuro2A Zellen. Dies hat den Vorteil gegenüber Vermesser Assays, dass es verwendet werden kann, um den Prozentsatz von Zellen zu bestimmen, die geändert wurden und die Naturder indels von NHEJ führt.
- Mantel eine 3,5 cm Zellkulturschale mit einem gelatinösen Proteingemisch, wie Matrigel 1:50 verdünnt in Iscove modifiziertem Dulbecco-Medium und Inkubation für 30 min bei 37 ° C. Saugen Sie das gallertartig Proteinmischung und die Platte die Neuro2A Zellen.
- Nachdem die Neuro2A Zellen 50% Konfluenz erreichen, bei einer Multiplizität der Infektion von 10 die CRISPR Lentivirus oder Retrovirus - addieren (dh 10 virale Partikel pro Zelle).
HINWEIS: Neuro2A Zellen nicht als amiable auf eine Infektion sind, wie HEK293-Zellen sind, wodurch eine einzelne Infektion wird in 100% der Zellen zur Folge haben mit der lentivirus infiziert. Ferner befällt das Retrovirus nur teilende Zellen und wird daher auch in 100% Infektion führen. Um eine nahezu 100% Infektionsrate, Zugabe des Virus zu erreichen, kann an mehreren Tagen wiederholt werden, Aufteilen der Zellen nach Bedarf. Alternativ können fluoreszierende positive Zellen isoliert werden unter Verwendung von fluoreszenzaktivierter Zellsortierung. the effektivste Weg, um eine 100% Infektionsrate mit Lentiviren zu erreichen, ist eine einzige Infektion durch FACS Isolierung gefolgt auszuführen. Für ein Retrovirus, führen 4-Runden der Infektion 24 Stunden auseinander und folgen Sie durch FACS Isolierung 100% Infektion zu gewährleisten. - die Zellen für 1 Woche, erweitern Sie die Zellen in der Nähe Einmündung auf einer 10 cm Platte, aspirieren die Medien und waschen Sie die Platte mit 5 ml phosphatgepufferter Salzlösung Nach infizieren. 1 ml 0,25% Trypsin und Inkubation bei 37 ° C, bis die Zellen die Platte abheben. Mit 0,5 ml Iscove modifiziertem Dulbecco-Medium, die 0,25% Trypsin-Reaktion zu neutralisieren und um die Zellen in ein 1,5-ml-Röhrchen pipettiert und die Zellen bei 500 · g für 5 min pelletieren.
- Zur Isolierung DNA, 100 & mgr; l von 50 mM Kaliumhydroxid, erneut zu suspendieren, die Zellen, und Inkubation bei 95 ° C für 5 min. Neutralisieren der Lösung unter Verwendung von 10 ul 1 M Tris, pH = 8,0.
- PCR-Amplifikation der Region der genomischen Region durch die CRISPR sgRNA gezielte flankierendemit ~ 300 ng der DNA isoliert 5.5 in Schritt eine High - Fidelity PCR Master - Mix 4 verwendet wird .
- Führen Sie die PCR-Reaktion auf einem 2,5% Agarose-Gel und Gel-Reinigung des entsprechend dimensionierten Fragment ein Gel Purification Kit wie ein Gel DNA Recovery-Kit. Ligieren in einen Vektor Klonen PCR wie pGEM-T-easy und Transformation in kompetente Zellen 9.
- 24 Stunden später, 2 ml LB - Brühe in einem 15 ml - Rundbodenröhrchen sowie das entsprechende Antibiotikum (Ampicillin, Neomycin, etc.). Impfen das Rohr mit einer Einzelkolonie von einer sterilen Pipettenspitze oder eine Schleife mit einer einzigen Kolonie von der LB-Platte auszuwählen. Erweitern und die Kolonie wachsen durch das Rohr bei 250 Upm und 37 ° C für 24 h Schütteln. Wiederholen Sie dies für so viele Kolonien wie gewünscht.
- Mit einem Mini-Prep - Kit, isolieren DNA aus dem E. coli und die Sequenz mit Primern , entworfen , um die Fläche des Gens durch den sgRNA , um gezielt zu verstärken , die Cas9 Zielregion des Mausgenoms zu analysieren.
6. stereotaktische Injektion Protokoll für die erwachsenen Maus
- Bereiten Sie sich für Chirurgie
HINWEIS: Es ist wichtig, sterile Bedingungen während Überleben Operationen zu halten. Dies wird in diesem Protokoll durch Wärme Sterilisieren der Chirurgie Werkzeuge erreicht, betadine mit der Injektionsstelle zu sterilisieren, und das Hinzufügen von antibiotischen Salbe auf die Einschnittstelle, nachdem es geschlossen ist. Es ist auch wichtig, sterile Handschuhe sowie eine gründlich sterilisiert, gewidmet OP-Bereich zu verwenden.- Hitze sterilisieren chirurgische Werkzeuge vor entweder durch Autoklavieren zu verwenden oder einem mit heißer Perle Sterilisator. Bereiten Sie Erholung Kammer und OP-Bereich durch Drehen auf Heizkissen Körpertemperatur während der Operation und Genesung zu halten. Montieren Sie den Bohrer zu schaffen, Löcher in den Schädel für die Injektion verwendet.
- Legen Sie 4 ul Virus in Injektionsnadel durch das Virus direkt aus dem sterilen PCR-Röhrchen zurückziehen. Entfernen Sie kurz die virale aliquoten aus Eis. Pflegen Sie den Virusin der Spritze bei Raumtemperatur für nicht mehr als 1 Stunde vor der Injektion.
7. stereotaktische Injektion
- Bestätigen Sie, dass die Belüftung des Operationsraum offen ist die Luftzirkulation zu gewährleisten. Bereiten Sie die Maus für die Operation, indem sie mit 4% Isofluran in einer Induktionskammer anesthetizing. Nach Anästhesie, rasieren, den Kopf auf die Injektionsstelle vorzubereiten.
- Platzieren Sie die Maus in der stereotaktischen Instrument mit einer Pinzette Zunge nach unten zu bewegen und auf die Seite. Legen Sie die Beißwulst in den Mund, bis die Zähne in den Schlitz fallen, dann die Ohrstangen sichern. Sicherzustellen, dass der Körper der Maus auf dem Heizkissen ist und die Nase ist in dem Nasenkonus liegt. Direkte 4% Isofluran in die Nase Kegel. Bestätigen Anästhesie durch den Fuß mit einer Pinzette Kneifen und dafür zu sorgen, dass es keine Startlereflexes ist.
- Künstliche Tränen die Augen zu schmieren. Fertigstellen der Vorbereitung der Injektionsstelle durch den rasierten Kopf mit abwechselnden Runden von pov AbtupfenIdone-Jod und Lidocain.
- Mit einem Skalpell geschnitten kleinen Schnitt entlang Zentrum der Kopfhaut. Trocknen Sie den Schädel mit einem Tupfer und Wasserstoffperoxid bei Bedarf helfen zu Bregma visualisieren.
- Mit einem Binokular, suchen Bregma auf dem Schädel und legen Sie die Bohrerspitze auf Bregma. Null (oder Datensatz) die digitalen stereotaktischen Koordinaten auf der x, y und z-Ebenen.
- Um sicherzustellen, dass der Kopf waagerecht auf der rostralen y-Achse nach kaudal, legen Sie den Bohrer auf Lambda und die Kopfhöhe, so dass die z-Koordinate in etwa gleich beide Bregma und Lambda ist.
- Um sicherzustellen, dass der Kopf waagerecht auf der x-Achse, legen Sie die Bohrkrone y = 1/2 Lambda. Sicherzustellen, dass die z-Koordinate gleich 1 mm auf jeder Seite (x = +/- 1 mm) der sagittalen Naht. Stellen Sie den Schädel, wenn es einen Unterschied in der z-Koordinate auf 1mm nach links und rechts von Lambda.
- Setzen Sie den Bohrer über die gewünschten Koordinaten. Für den Gyrus dentatus, verwenden Sie die Koordinatesy = -1.9 vom Bregma und x = +/- 1,1. Vor dem Bohren der Isofluran auf 2% zu senken, dann langsam und vorsichtig, durch den Schädel bohren.
- Nach dem Bohren alle Löcher, bringen Sie den ausgefüllten Spritze auf das Instrument stereotaxische. Optisch zentriert die Spritze über das Loch und Null die z an der Schädel koordinieren.
- die Spritze tiefste z-Tiefe langsam absenken. Für den Gyrus dentatus, sind die Z-Tiefen -2,5, -2,4 und -2,3. Beginnen Injektion mit einer Rate von 0,25 ul / min eine stereotaxische Injektor.
- Nach der Injektion bei niedrigsten Z-Tiefe abgeschlossen ist, warten Sie 1 min, dann auf die nächste erhöhen koordinieren und wieder Injektion beginnen. Weiter dieses Muster, bis alle z-Injektion Koordinaten injiziert werden. Warten Sie 2 Minuten, bevor Sie die Spritze nach der letzten Injektion zu entfernen.
HINWEIS: keine negativen Auswirkungen auf das Gewebe wurden durch Einspritzen von bis zu 2 & mgr; l Virus pro Hemisphäre im Gehirn der Maus festgestellt.
- Nach der Injektion bei niedrigsten Z-Tiefe abgeschlossen ist, warten Sie 1 min, dann auf die nächste erhöhen koordinieren und wieder Injektion beginnen. Weiter dieses Muster, bis alle z-Injektion Koordinaten injiziert werden. Warten Sie 2 Minuten, bevor Sie die Spritze nach der letzten Injektion zu entfernen.
- Wiederholen Injektion für andere Bohrungen.
- Nach der Injektion mit der Maus aus dem Gerät entfernen und stereotaxische die Kopfhaut mit 6-0 Seidenfäden vernäht. Anwenden Lidocain und eine antibakterielle Creme auf die Wunde.
- Injizieren 0,8-1,0 ml Kochsalzlösung + Ketoprofen (3-5 mg / kg) über IP-Route Schmerzen zu verwalten. Dann legen Sie die Maus in beheizte Rückgewinnungskammer. Nicht das Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedergewonnen hat. Nicht das Tier an die Firma von anderen Tieren zurück, bis sie vollständig erholt hat.
- In den Tagen nach der Operation, wiegen die Maus täglich und weiche Nahrung und Leckereien zur Verfügung stellen. Prüfen Sie Wunde und beachten Sie den allgemeinen Zustand / Verhalten.
- Nach stereotaktische Injektion kann die Mäuse für Stück prep Elektro 1 oder durchbluteten und ihre Gehirne entfernt, in Scheiben geschnitten und gefärbt über Immunhistochemie für die Analyse 10 eingeschläfert werden.
Ergebnisse
Nach dem "Protokoll zur Auslegung eines Führer Strand (sgRNA) für CRISPR / Cas9 Retrovirus", Oligos eine bestimmte Zielsequenz eingefügt werden in die PXL Klonierungsvektor stromabwärts des HU6 Promotor und stromabwärts einer Führungs RNA Gerüst unter Verwendung der BbsI Klonierungsstellen (Abbildung 1, Schritt 1). Diese sgRNA wird dann aus PXL ausgeschnitten und in die pRubi Rückgrat eingefügt unter Verwendung der BstBI und PacI Seiten (1, Schritt 2). Schließlich cloniert weiteres sgRNA in PXL kann in pRubi-Guide1 (Abbildung 1, Schritt 3), Targeting einen anderen Bereich des Gens und die Erhöhung der Chancen eines knockout über NHEJ stromabwärts von der ersten Führung angeordnet werden. Die Überprüfung der korrekten Konstrukte sollten durch Sequenzanalyse bestimmt werden. Sobald dieses Konstrukt hergestellt wird, kann es zu einem Virus, das das "Protokoll für Retro / Lentivirale Produktion- CaPO 4-Methode" nach verpackt werden. Erfolgreiche Verpackung wird durch eine Infektion des Virus in HEK293-Zellen, um bestätigten die v titriertirus. Wenn es kein Fluorophor Ausdruck ist dann gab es wahrscheinlich ein Fehler bei der Verpackung des Virus.
2 ist ein repräsentatives Ergebnis von 2 - Retroviren, ein GFP exprimieren und das andere exprimierenden mCherry, koinjiziert in den Gyrus dentatus der neonatalen Maus (7 Tage alt) und abzubildenden 21 Tage nach der Injektion. Markierung von Neuronen mit mCherry oder GFP ermöglicht morphologische Beurteilung verschiedener genetischer Manipulationen in demselben Gewebe, wobei ein Virus einen CRISPR / Cas9 vermittelten KO und der andere ein Kontrollvirus exprimieren kann, exprimieren ausschließlich ein Fluorophor. Stereotaktische Injektion ermöglicht eine präzise anatomische Selektivität wie durch die diskrete Infektion der beabsichtigten Koordinaten gezeigt, Gyrus dentatus. Wenn Hirnschnitten für eine Infektion zu analysieren, ist es wichtig, das umgebende Gewebe zu halten, bis es, dass die korrekte anatomische Region bestimmt ist, infiziert war. Wenn es keine Anzeichen einer Infektion ist, dann ist es möglich, dass die Injektion erfolgte in einer benachbarten Region eind können in den umliegenden Abschnitte identifiziert werden. Es kann auch hilfreich sein, die Nadelbahn zu finden, die genaue Injektionsbereich zu finden. VSVg pseudotypisierten Viren aus den Rändern des Gyrus dentatus selten verteilt , wenn sie in vivo injiziert werden , und neigen dazu , entlang der rostral / kaudal Achse infizierenden Zellen entlang der gesamten Gyrus dentatus zu verteilen, wie es durch 3D - Rekonstruktion analysiert (Abbildung 3).
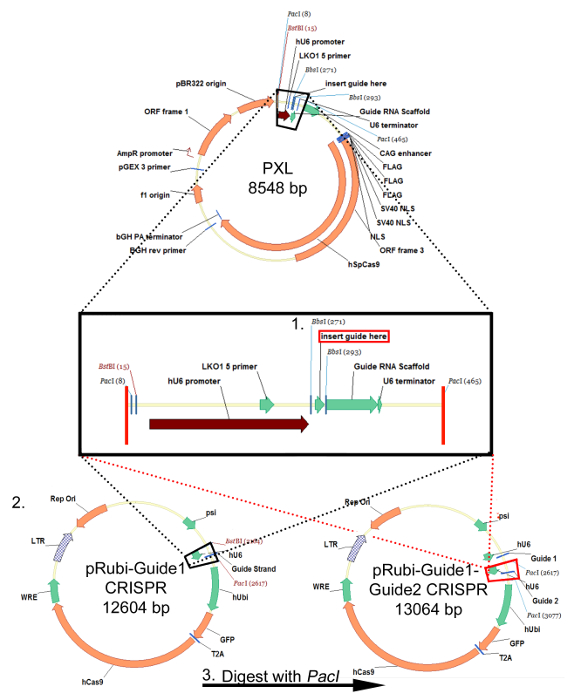
Abb . 1: Klonierungsstrategie für die retroviralen pRubi-Guide1-Guide2-CRISPR Plasmid Diese Strategie ist identisch für die FU-basierten lentiviralen Plasmide. sgRNA Oligos sind geglüht und eingefügt in PXL die Klonierungsstellen BsbI verwenden. Nach der Sequenzierung , um sicherzustellen , dass der sgRNA erfolgreich in PXL eingeführt wird, verdauen das Plasmid mit BstBI und PacI. Der Einsatz, der fallen gelassen wird aus (Black Box) wird dann in das virale zurück b geklonteine (schwarze gepunktete Linien) pRubi-Guide1 CRISPR. Ein zweiter sgRNA kann auch in PXL eingeführt werden und verdaut , um die PacI Enzym verwendet. Diese wird dann in den CRISPR Vektor pRubi-Guide1 geklont (rot gestrichelte Linien) die PacI - Stelle mit. Das resultierende Plasmid enthält dann beide Führungsstränge sowie die notwendigen viralen Elemente, Förderer und Fluorophore. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
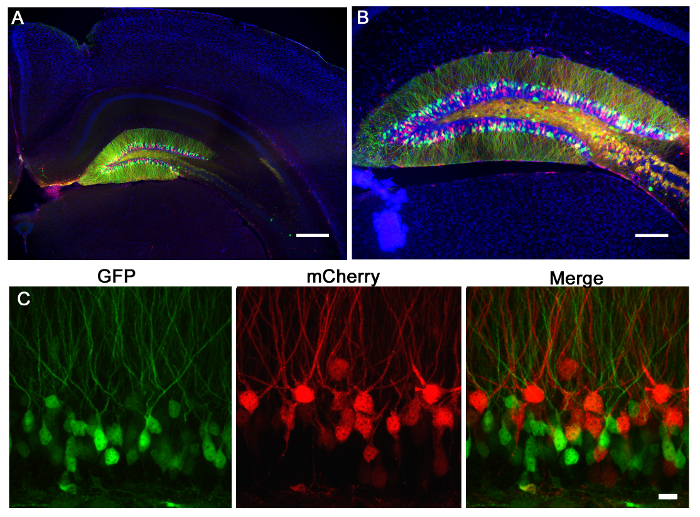
Fig . 2: Retrovirale Injektion der Maus Gyrus dentatus exprimierenden Retroviren mCherry (rot) oder GFP (grün) wurden in den Gyrus dentatus einer p7 Maus injiziert. 21 Tage später wurden die Mäuse perfundiert und die Gehirne geschnitten und gefärbt für GFP und mCherry. (A) Ein 5 - fach Weitfeld - Fluoreszenzbild zeigt die prNTSCHEIDUNG der dentatus Injektion Gyrus und die Spezifität des Gyrus dentatus Körner Kennzeichnung Neuronen. Die Morphologie des Hippocampus kann über die Dapi (blau) Färbung sichtbar. Maßstabsbalken misst 200 um. (B) Ein 10fach Weitfeld - Fluoreszenzbild zeigt , dass diese hohen Titer Lentiviren eine große Anzahl von Zellen , deren Morphologie infizieren kann über Fluorophor Ausdruck zugegriffen werden. Maßstabsbalken misst 100 & mgr; m. (C) Viren GFP oder mCherry exprimieren , wurden Co-Injections in die Gyrus dentatus. Mit einem System von Retroviren, kann man ein Virus verwenden, um eine genetische Manipulation von GFP markiert machen und eine andere Manipulation durch mCherry markiert, und dann einzelne oder additive Änderungen beurteilen aufgrund jedes Virus. Maßstabsbalken misst 10 & mgr; m.
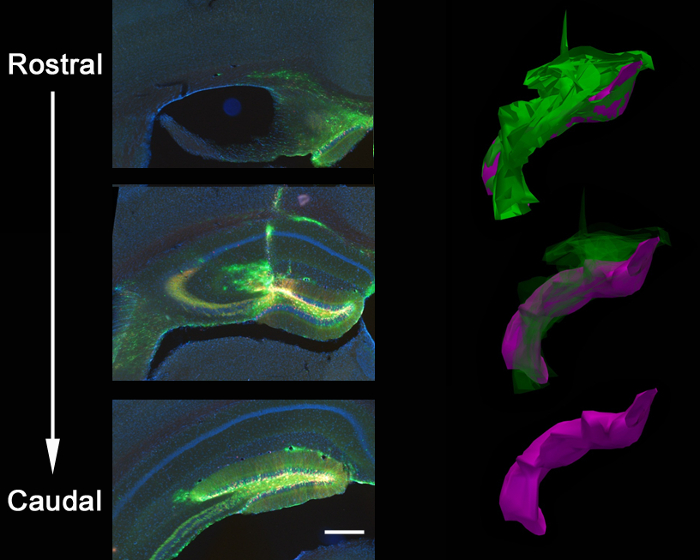
Abb . 3: Anatomische Ausbreitung von lentiviralen Injektion Stereotaktische Koinjektion eines GFP-shPten Virus und einem mCherry Kontrollvirus in das Gehirn eines Erwachsenen Pten loxP / + Maus führte zu einer Ausbreitung des Virus entlang der gesamten rostral / Schwanzachse des Gyrus dentatus des Hippocampus. Dies wird in einer 3D - Rekonstruktion des Ausmaßes der Injektion gezeigt , in dem geschlossene Konturen der viralen Ausbreitung über 21 serielle Abschnitte zurückgeführt wurden (Z = 50 & mgr; m / section) unter Verwendung von Rekonstruktionssoftware. Die Konturzeichnungen wurden dann ausgerichtet, die 3D-Bilder für die Volumen Quantifizierung zu erzeugen. Insgesamt virale Verbreitung ist in grün (Volumen = 54730800 & mgr; m 3) und gezähnt lokalisierte Ausbreitung wird gezeigt in lila (Volumen = 27275200 & mgr; m 3). Das Virus breitet sich entlang der Nadelbahn und das Corpus callosum an der Kreuzung der Nadelbahn zusätzlich die rostral / Schwanzachse des Gyrus dentatus zu füllen. Maßstabsbalken misst 200 um.
les / ftp_upload / 53783 / 53783video1frame.jpg "/>
Supplemental Video 1. Design von sgRNAs retroviralen und lentiviralen Rückgrat zu klonen in.
In dieser Syntheseführung RNA (sgRNA) Ausführungsbeispiel wird die genomische Sequenz von Maus CHD8 von NCBI heruntergeladen. Das Startcodon und Exon-Struktur werden dann in Vector NTI visualisiert. Dies ermöglicht es uns, die genomische Region um das erste Codierexon zu kopieren und diese Sequenz in Benchling eingeben. Benchling ermöglicht es uns, alle potentiellen sgRNAs in der Region zu visualisieren. Ferner wird nach der genomischen Region angibt, wir Eingang haben, zeigen Benchling wird uns die On-Target und Off-Target-Scores für jede Führungs RNA. Der Benutzer kann dann wählen Sie die Führung RNA mit den höchsten On- und Off-Target - Scores. Bitte hier klicken , um dieses Video anzusehen. (Rechtsklick zum Download bereit .)
Diskussion
Es gibt einige wichtige Schritte, die wichtig für eine erfolgreiche virale Verpackungs sind. Zellgesundheit ist entscheidend vor und während der Transfektion, als ungesund Zellen wird die Menge des Virus produziert erheblich reduzieren. Wenn die Transfektionseffizienz und Verpackungs erfolgreich sind, dann werden 100% der Zellen sollte das Fluorophor exprimieren und die Zellen sollten eine funktionelle Syncytium bilden. In Schritt 3.2.4 wird das Rohr Klopfen notwendig hochtitrige Transfektion effizient, und der pH-Wert der HEPES-gepufferter Kochsalzlösung muß exakt sein. Die Maxi-Preps, die die Plasmide, die für die virale Verpackung produzieren muss extrem rein sein. Bis zu diesem Punkt ist es hilfreich, die endgültige DNA Elution zu Ethanol ausfällen und in Tris-EDTA-Puffer erneut suspendieren. Es ist auch sehr wichtig, die Menge an Serum zu 2% oder weniger in den Medien zu verringern, dass das Coffein an Tag 6 zugegeben wird (Schritt 3.4) vor viral Sammlung. Wenn das Serum nicht reduziert wird, dann ist die endgültige gereinigte Virus wird eine unerwünschte Menge an Serum enthalten protein. Die Verwendung von Polyethylenglykol 6000, wenn die viralen Partikel Ausfällen schließt die Notwendigkeit Ultrazentrifugation. Es ist auch wichtig zu beachten, dass die Cas9 CRISPR Viren enthalten typischerweise einen Titer etwa 10-fach weniger als Viren nur ein Fluorophor enthält.
Für die Operation stereotaxische ermöglicht die Verwendung von inhalativen Anästhesie eine schnelle und präzise Kontrolle oder das Bewusstsein des Tieres im Vergleich zu injizierbaren Anästhetika und ermöglicht Anästhesie über einen größeren Altersbereich. Es ist sehr wichtig, dass die chirurgischen Instrumente sauber und steril zu halten und reproduzierbare Ausrichtung erfordert eine genaue Positionierung des Kopfes. Stellen Sie sicher, dass kein Nicken oder Rollen des Kopfes in der stereotaktischen Instrument ist und dass der Schädel fühlt sich fest an seinem Platz. Es kann sinnvoll sein, den Schädel zu ermöglichen, zu trocknen, um die Nähte zu finden, die Koordinaten stereotaxische zu bestimmen. Auch sollte die Rate und das Volumen für jeden werden stereotaktischen Koordinaten empirisch ermittelt.
Diese Technik ist die Begrenzung, dass die Ausbreitung eines Retrovirus lenti- oder eingeschränkt ist, insbesondere im Vergleich zu den adeno-assoziierten Viren (AAV) .Daher Diese Viren sind wertvoll, wenn ein diskretes Hirnregion Infizieren, aber nicht für die Gesamt Infektion mit AAV für Verhaltensanalyse bei Tieren angewandt werden. Die Verwendung von Coffein in diesem Protokoll erhöht die Titer dieser Viren, aber sie sind immer noch nicht so hoch wie die in AAV Verpackung erreicht Titer. Auch die stabile Integration ist nur ein Vorteil von Fluorophor Ausdruck, als CRISPR / Cas9 stabile genomische Bearbeitungen sogar bildet, wenn transient und es ist möglich, dass die laufende Ausdruck des Cas9 und sgRNA kann schließlich Zielwirkungen ab. Die transiente Expression der CRISPR / Cas9 System mit AAV ausreichend genomische Veränderungen zu erzeugen, die im gesamten Zellteilungen propagiert werden, jedoch Fluorophore Ausdruck wird nicht aufrechterhalten werden.
Erstellung von lenTi- und Retroviren die CRISPR / Cas9 System verwendet wird verleihen die Fähigkeit, jede neue Gen in einer Vielzahl von Organismen zu zielen. Die Effizienz des Gen-Bearbeitung wird in der Folge der Führungs RNA Targeting des Cas9 Spaltung abhängt. Es hat sich gezeigt, dass indels enthalten zwischen 10% und 80% der Klone empirisch bestimmt nach der Sequenzierung Neuro2A Zellen infiziert. Es ist derzeit nicht bekannt, ob indel Frequenzen berechnet in Neuro2A Zellen reflektiven von denen sind in Neuronen. Anleiten RNA-Design-Software wie Benchling umfassen nun einen "on-target" Punktzahl in der Lage sein kann, den Wirkungsgrad eines gegebenen Zielsequenz vorherzusagen. Inwieweit solche "On-Target" Scores sind zuverlässige Bedürfnisse empirisch in Neuronen und anderen Zelltypen als CRISPR-Cas9 System bestimmt werden wird breiter umgesetzt.
Lentivirus-basierte transgenen Tierproduktion wurde mit Berichten variabel erfolgreich, dass die Lentivirus geliefert Transgene si gewordenlenced 11. CRISPR vermittelte Gen Bearbeitung von DNA kann durch die Keimbahn weitergegeben werden, um ganze Tiermodelle erzeugen. Somit können stabile genomische Bearbeitung trotz des Silencing von viralen Auslieferungs Fluorophore und Cas9 Transgene erreichbar sein. Dies kann eine effiziente Plattform für die gezielte genomische Veränderungen bieten. Die virale Lieferung des CRISPR / Cas9-System, während nicht transgenen Organismen erfordern, ist komplementär zu diesen Techniken. Zum Beispiel die Injektion solcher viralen Partikel in eine Verbindung transgenen Tier, das Cre und Cre induzierbar Transgene abhängige Opto- oder chemo genetischen Ausdruck sollten komplexe Studien über den Zusammenhang zwischen genetischen Manipulationen und neuronale Aktivität erleichtern. Ein zweites Beispiel ist diese Cas9 / sgRNA viralen Teilchen in eine bedingte knockout in einem Versuch, zu liefern, für die Gen-Gen-Interaktionen zu screenen. Schließlich ist eine weitere spannende Route dieser Forschung das Screening von Phänotypen und therapeutischen Verbindungen in Patienten gewonnenen Zellen, denenwerden verwendet, um genetische Netzwerke zu validieren und zu entdecken, die bei verschiedenen Erkrankungen gestört werden.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der NINH unterstützt gewähren R01MH097949 und die Autism Speaks Pilot Grants 7359 zu BWL und der Norris Cotton Cancer Center Optical Imaging Geteilt Instrumentation Grants P30CA023108.
Materialien
| Name | Company | Catalog Number | Comments |
| List of Cell Culture Reagents | |||
| 293FT cell line | Life Technologies | R700-07 | For Lentivirus |
| 293GP cell line | Clontech | 631458 | For Retrovirus |
| Iscove's Modification of DMEM (IMDM) | Corning | 10-016-CV | Complete IMDM with 10% FBS, 1% NEAA, 1% L-Gln, and 1% P/S |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| MEM Nonessential Amino Acids (NEAA) | Corning | 25-025-CI | |
| L-Glutamine solution, 100x (L-Gln) | Corning | 25-005-CI | |
| Pennicillin/Streptomycin solution, 100x (P/S) | Corning | 30-002-CI | |
| Polystyrene 10 cm plate | USA Scientific | CC7682-3394 | |
| Trypsin EDTA 1x | Corning | 25-053-CI | |
| List of Transfection Reagents | |||
| 5 ml polystyrene tubes | Fisher Scientific | 352054 | |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Scientific | C69-500 | Make a 2.5 M solution in ddH2O |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-3 | |
| HEPES | Fisher Scientific | BP2939-100 | |
| Sodium phosphate dibasic (Na2HPO4) | Fisher Scientific | S369-500 | |
| 2x HEPES Buffered Saline (HBS) | 500 ml: 8.2 g NaCl, 5.95 g HEPES, 0.106 g Na2HPO4, pH 7.01 (exact!) | ||
| Caffeine | Sigma-Aldrich | C0750-5G | |
| 0.22 µM syringe filter unit | EMD Millipore | SLGV033RS | |
| 0.45 µM syringe filter unit | EMD Millipore | SLHP033RS | |
| 60 cc L/L Syringe | Med-Vet International | MV60CCLL | |
| 50 ml Conical Tube | Corning | 352098 | |
| polyethylene glycol 6000 (PEG 6000) | Millipore | 528877 | |
| (10x) Phosphate Buffered Saline (PBS) | National Diagnostics | CL-253 | |
| 0.5 ml microcentrifuge tubes | USA Scientific | 1605-0000 | |
| Matrigel | Fisher Scientific | CB-40230A | |
| 6-well plate | Fisher Scientific | 353046 | |
| Paraformaldehyde | Fisher Scientific | AC41678-5000 | |
| Donor Horse Serum | Cellgro | 35-030-CV | |
| TritonX-100 | Sigma-Aldrich | X100-500ML | |
| 10 ml serological pipette | Fisher Scientific | 357551 | |
| anti-GFP, rabbit, 488 conjugate | Invitrogen | A21311 | |
| Stereotaxic Surgery Reagents | |||
| Vet-Syringe vet use T.B. Syringe only 1 cc Luer slip T.B. 100/bx | Med-Vet International | 1CCVLS | |
| Isoflurane | |||
| Stainless Steel Scalpel Blades, #10, 100-pk | Med-Vet International | JOR580S | |
| artificial tear ointment | Med-Vet International | RXPARALUBE-O | |
| PVP PrepSolution | Med-Vet International | HPIV108208H | |
| normal saline | Med-Vet International | DYND500MLSH | |
| cotton tipped applicators | Med-Vet International | CTA6 | |
| Triple antibiotic ointment | Med-Vet International | RXTRIP-OI15 | |
| MONOJECT® Needles Soft Pack 25 g x 5/8" | Med-Vet International | 25058 | |
| 6-0 silk sutures | Med-Vet International | MV-711 | |
Referenzen
- Williams, M. R., DeSpenza, T., Li, M., Gulledge, A. T., Luikart, B. W. Hyperactivity of newborn Pten knock-out neurons results from increased excitatory synaptic drive. J Neurosci. 35 (3), 943-959 (2015).
- Luikart, B. W., et al. Pten knockdown in vivo increases excitatory drive onto dentate granule cells. J Neurosci. 31 (11), 4345-4354 (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 32 (4), 347-355 (2014).
- Luikart, B. W., et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus. PLoS One. 6 (5), e19077 (2011).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Fricano, C. J., et al. Fatty acids increase neuronal hypertrophy of Pten knockdown neurons. Front Mol Neurosci. 7, 30 (2014).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiol Genomics. 31 (2), 159-173 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten