Method Article
디자인, 포장, 높은 역가 CRISPR 레트로와 렌티 배달 정위 주입을 통해
요약
CRISPR / Cas9 시스템은 과학계를 대상으로 게놈 편집에 액세스하고 저렴한 만들 수있는 가능성을 제공합니다. 이 프로토콜은 CRISPR / Cas9 시스템을 사용하여 관심의 유전자를 녹아웃 한 다음 성인 마우스 뇌에 stereotaxically을 주입합니다 바이러스를 만드는 방법을 설명하기위한 것입니다.
초록
Replication defective lentiviruses or retroviruses are capable of stably integrating transgenes into the genome of an infected host cell. This technique has been widely used to encode fluorescent proteins, opto- or chemo-genetic controllers of cell activity, or heterologous expression of human genes in model organisms. These viruses have also successfully been used to deliver recombinases to relevant target sites in transgenic animals, or even deliver small hairpin or micro RNAs in order to manipulate gene expression. While these techniques have been fruitful, they rely on transgenic animals (recombinases) or frequently lack high efficacy and specificity (shRNA/miRNA). In contrast, the CRISPR/Cas system uses an exogenous Cas nuclease which targets specific sites in an organism's genome via an exogenous guide RNA in order to induce double stranded breaks in DNA. These breaks are then repaired by non-homologous end joining (NHEJ), producing insertion and deletion (indel) mutations that can result in deleterious missense or nonsense mutations. This manuscript provides detailed methods for the design, production, injection, and validation of single lenti/retro virus particles that can stably transduce neurons to express a fluorescent reporter, Cas9, and sgRNAs to knockout genes in a model organism.
서문
정상적인 생리 질환 병리의 기초 연구를 정밀 모델 유기체에서 유전자 발현을 조작 할 필요가있다. 관심있는 유전 요소는 재조합 효소 인식 부위와 측면으로 접하고, 상기 포유 동물 모형 유기체이 크게 제작 및 형질 전환 마우스의 개발에 집중되어있다. 이것은 이러한 측면 유전자의 사이트 특정 조작 될 수 있습니다. 이 성공적인 전략되었지만, 시간 및 리소스 집약적이고; 예를 들어, floxed 유전자 Cre 호텔의 재조합 효소 및 Cre 호텔 리포터 유전자를 발현 것 트리플 형질 전환 동물을 만드는 것은 여러 교배 및 검증을 필요로한다. 대조적으로, 복제의 정위 주사는 floxed 유전자 동물에 형광 단백질 및 재조합 효소를 코딩하는 결함 바이러스 입자는 복합 유전형 또는 사육 한 전략을 필요로하지 않는다. 바이러스 발현 형광 단백질 및 Cre 호텔 경우 또한, 제 ENCO 바이러스와 공동 주입딩 다른 형광 단백질, 이것은 표적 유전자 조작을위한 내부 - 조직 제어를 제공한다. 이 전략은 여전히 녹아웃 동물의 사용을 필요로하지만, 급속도로 매개되는 RNA 기반 전략은 형질 전환 동물에 대한 필요성을 회피. 예를 들어, 형광 단백질과 짧은 헤어핀 RNA (shRNA를)를 인코딩 복제 결핍 바이러스의 정위 주사는 관심의 유전자의 전사의 강력한 감소가 발생하는 세포의 내생의 RNAi 기계를 사용할 수 있습니다. 그러나, shRNA를 전략은 종종 겸손 세포의 표현형이 발생 미묘한 유전자 노크 다운을 생산하고 있습니다. 노크 다운 더 생리 학적 이형 유전자 장애에 대한 관련 될 수 있지만, 그 감소 견고성이 노크 아웃에 비해이 새로운 유전자의 표현형 발견에 적합하지 않습니다.
최근에 등장했습니다 세 번째 기술 관련 CRISPR-(정기적으로 Interspaced 짧은 팔린 드롬 반복 클러스터)를 CRISPR / Cas9은 (단백질 9) 시스템은, 작은 외래 RNA 및 DNA 절단 효소의 발현 양에 의존한다. CRISPR / Cas9 시스템은 외국 식별 바이러스로부터 DNA를 침입하고 Cas9 효소 3,4를 통해 열화를 대상으로하는 방법을 진화 원핵 면역 시스템에서 적응했다. 이 강력한 게놈 편집 기술은 표적 결실, 삽입 및 돌연변이를 만드는 데 사용될 수있다; 다음과 같은 프로토콜은 생체 내에서 발현을 녹아웃하기 위해 관심의 유전자에 삭제를하는 방법을 간략하게 설명합니다. Cas9 효소는 발판 RNA와 관심 영역에 상동과 인접 가이드 RNA로 표현해야합니다. 이 기술을 이용하여 유전자의 녹아웃 합성 RNA를 가이드 (sgRNA)를 사용하여 게놈의 특정 영역에 Cas9 타겟팅 및 관심 부위에서 이중 가닥 나누기 (DSBs)을 유발 요구한다. 이 DSBs 후 비 동종 최종 합류 (NHEJ)하는 제작을 통해 내생 세포 수리 기계 수리된다과오 또는 넌센스 돌연변이를 생성 할 수 있으므로 기능성 단백질 식 (5)의 손실을 만들 수 있습니다 삽입과 삭제에 광고. 본 시스템은 게놈 변경을 생성하기 때문에, 단지 Cas9 및 sgRNA의 일시적인 발현을 필요로한다. 안정 형광 표시기가 이와 같이 조작 된 세포 및 그 자손을 식별하기 위해 그러나 바람직하다.
레트로 바이러스 및 렌티 안정적으로 장기간의 발현 및 유사 분열 동안 유지 딸세포까지 전달되는 숙주 세포에 관심 DNA를 통합하는 이점을 갖는다. 이 프로토콜 설계 및 결함 복제 고역가 레트로 바이러스의 두 종류의 생산을 설명 인간 면역 결핍 바이러스 유래의 렌티 바이러스 입자 (렌티)과 말로 뮤린 백혈병 바이러스 (레트로 바이러스)에 기초하여 이들. 이러한 바이러스의 양이 안정한 큰 유전자의 발현을 지원할 수 있지만, 레트로 바이러스 입자는 게놈 내로 통합 할 수 뒤따라서 핵 봉투의 저하와 함께 반지 세포 분열은 레이블을 도구 및 출생 날짜 셀 (6)로 사용할 수 있습니다. 렌티 바이러스는 바이러스를 수집하는 동안 카페인 (8)의 사용을 포함하여 상대적으로 낮은 역가 7,이 방법론 인 명성을 가지고 있지만, 통상적으로 10 9 10 10 입자 / ml의의 역가를 생성합니다. 렌티 및 레트로 바이러스의 또 다른 이점은 매우 큰 인서트에 대한 내성이다. 다음 프로토콜 모음 형광 리포터는 sgRNAs 및 Cas9은 DNA를 변경뿐만 아니라 형광 단백질을 발현하는 CRISPR / Cas9 시스템을 이용하는 코딩하는 렌티을 설계 또는 레트로 바이러스에 대한 절차를 설명.
마우스 정위 신경 외과는 형태, 기능, 감염된 신경 세포의 연결을 연구하기 위해 생체 내에서 바이러스를 주입하기위한 유용한 방법이다. 신경 세포의 바이러스 감염이 팀 장기간에 걸쳐 발현을 조작하기 위해 사용될 수있다이러한 개발에 걸쳐 같은 즉, 표현은 정확하게 다양한 약물 유도 시스템 및 특정 Cre 호텔 구동 식의 사용에 의해 제어 될 수있다. 이 특정 프로토콜은 성인 쥐의 뇌에 대한 관심의 유전자를 녹아웃하는 sgRNA 및 Cas9를 발현하는 바이러스를 주입하는 방법에 대해 설명합니다. 마우스는 48 시간 후 분사 내에서 볼 수있는 바이러스 성 유전자의 절차와 표현에서 매우 신속하게 복구 할 수 있습니다. 그러나, 형광 발현 3 주 후 감염에 의해 근처 최대 수준의 결과 주간의 과정을 통해 증가가 나타납니다. 바이러스 정위 주사를 거쳐 마우스 동작, 전기 생리학 또는 형태 학적 연구에 사용할 수있다. 전반적으로, 이러한 절차의 목적은 정위 수술 특정 sgRNA 및 Cas9를 발현하는 바이러스를 사용하여 성인 마우스 뇌 유전자 녹아웃 방법을 설명한다.
프로토콜
윤리 정책 : 모든 프로토콜은 다트머스 기관 바이오 안전성 및 기관 동물 관리 및 사용위원회 검토 보드에 의해 승인되었다.
CRISPR / Cas9 레트로 바이러스에 대한 가이드 스트랜드 (sgRNA)를 설계 1. 프로토콜
참고 : (https://benchling.com/ 및 http://crispr.mit.edu/) 관심의 유전자를 대상으로 sgRNAs를 생성하는 데 사용할 수있는 많은 비영리 웹 사이트가있다. 이 프로토콜의 설계 목표는 서로 어닐링 상업적 공급 업체로부터 단일 가닥 올리고를 주문하는 것이다. 이 어닐링은 올리고 PXL 전송 벡터에 라이 게이션 될 것이다. Benchling를 사용하여 설계 sgRNAs의 예를 들어 보충 비디오 1을 참조하십시오.
- sgRNAs를 설계 전용 웹 사이트를 사용합니다.
참고 : 예를 들어, 웹 사이트에 관심있는 유전자의 시작 근처에서 부호화 / 엑손 서열을 입력하면 20 뉴클레오티드 sgRNA를 생성한다. 센스 및 안티센스 올리고 설계를 20 sgRNA 뉴클레오티드 서열을 사용하여sgRNA를 만들 것을 명령한다의. - sgRNA를 생성 한 후, 워드 프로세서로이 순서를 복사합니다. 이미 한 (즉, G-20 염기 sgRNA 순서)로 시작하지 않을 경우 문서의 20 염기 sgRNA 시퀀스의 시작 부분에 G (구아닌)를 추가합니다. 이것은 U6 프로모터 오프 우수한 전사를 보장 할 필요가있다.
- 이 지금은 20 ~ 21 염기 서열의 역 보완을 문서화. 센스 올리고 들어, 문서 (즉, CACC-G-20 염기 sgRNA 순서)의 순서의 5 '말단에 "CACC"를 추가합니다. 이 돌출부는 PXL 벡터에 서열을 결찰하는데 사용된다.
- 안티센스 올리고 들어, 5 '말단에 AAAC를 추가합니다. PXL 벡터에 순서를 결찰이 오버행을 사용합니다.
- 센스 및 안티센스 올리고를 얻습니다. 올리고를 수신 한 후, DNase를 무료로 물을 사용하여 100 μm의 주식을합니다. 4 μ와 함께 10 ㎕를 100 μM 센스 및 안티센스 올리고 각 믹스배 NEB 버퍼 2, 물 16 μL의 L.
참고 :합니다 (발현 벡터는 BbsI의 오버행이 호환되지 않는 응집력 끝이기 때문에) 그들은 페이지 정화 또는 5'phosphorylation 필요하지 않습니다.- 다음 발포체 "부유물"홀더의 혼합물을 포함하는 튜브를 플로트, 500㎖의 비이커에 종기에 200 ml의 물을 준비한다. 실온에서 2 시간 동안 95 ° C에서 천천히 시원한 물을 수 있습니다.
- 멸균 수에 1000을 다음 내고 즉시 사용 또는 -20 ° C에서 나머지 반응을 저장 : 지금 어닐링-올리고 믹스 1을 희석.
- 다이제스트 PXL, 2 시간 동안 37 ° C에서 발현 벡터는 BbsI 제한 효소와 벡터 PX330 유도체. PXL의 2 μg의, Bbs1와 균형의 물을 10 배 NEB 버퍼 2, 1 μL의 4 μl를 포함하는 40 ㎕의 반응을 사용합니다. 상용 키트를 사용하여 일상 젤 정화에 소화-PXL 대상으로 할 수 없다. 수율은 8.5 킬로바이트 제품이 ~ 있는지 확인합니다.
- 1000 : 상용 라이 게이션 키트를 사용하여, (1) 1 μl를 결찰소화 겔 정제-PXL의 50 NG와 어닐링-올리고. E. 능력 결핍 재조합로 결찰 생성물을 변환 대장균 (NEB 5-α, 서브 클로닝 효율). 플라스미드 DNA 시퀀싱하여 정확한 가이드의 존재에 대한 형질 전환 체를 선별.
- BstB1 및 PAC1 제한 효소를 사용 PXL 밖으로 U6, 가이드 가닥 및 RNA 지지체 요소 (sgRNA)를 소화하고 동일한 제한 효소로 분해 형광 단백질-T2A Cas9 바이러스 골격 내로 결찰. 결찰 생성물 (NEB 5- 알파 최대 효율) 변화. 형광 단백질-T2A Cas9 바이러스 골격 플라스미드 적은 카피 플라스미드이며, 따라서 적은 카피 프로토콜이 사용되어야한다.
참고 : 두 번째 sgRNA 마찬가지로 다른 PXL 가이드 가닥 플라스미드의 PACI 소화에 의해 도입과 PAC1로 결찰 할 수는 소화와 송아지 장 포스는 이미 제 1 가이드 가닥을 포함하는 바이러스 백본을 처리 하였다. 바이러스 전송 플라스미드의 포스 파타 아제 치료는 도움이 될 것입니다상기 제 2 가이드를 포함하지 않는 플라스미드자가 결찰에서 형질 전환 체의 수를 감소시킨다. - 순서는 Nucleobond 엑스트라 맥시 준비 키트를 사용하여 최종 플라스미드와 맥시 준비를 확인하고 다음 "레트로 / 렌티 바이러스 생산을위한 프로토콜 - CaPO4 방법"을 사용하여 바이러스로 패키지.
2. 형질에 대한 293FT / 293GP 세포를 준비 (레트로 / 렌티 바이러스 생산 - CaPO4 방법)
- (주 1) 신속하게 37 ° C의 물을 욕조에 10cm 세포 배양 접시 당 세포의 1 병을 해동. 렌티 바이러스 포장, 293FT 세포를 사용합니다. 레트로 바이러스 포장, 293GP (개그 / POL) 세포를 사용합니다.
- 15 ML 원뿔 관에 크라이 관에서 해동 세포의 모든 피펫과 미리 예열 CO 2 평형을 완성 Iscove의 수정 된 둘 베코의 중간 2 ㎖ 추가 할 수 있습니다.
- 500 XG에 5 분 동안 원심 분리기 세포 펠릿합니다. 뜨는을 대기음하고 완전한인가 10ml에 세포 펠렛을 재현 탁코브의는 둘 베코의 중간을 수정. 10cm의 세포 배양 접시에 세포를 접시. 5 % 이산화탄소 배양기에서 37 ℃에서 하룻밤 동안 세포를 인큐베이션.
- (주 2) 도금 후 24 시간은, 기존의 미디어를 흡입하고 판에 미리 예열 Iscove의 수정 된 둘 베코의 중간 10 ㎖를 추가하여 접시에 미디어를 변경합니다.
- 24 ~ 48 시간 미디어 변경 후 및 세포 번 (하루 3-4) 합류가 / 판 (10cm 플레이트) 2.5-3.0 × 10 6 세포의 포화 상태로 세포를 분리.
- 셀을 분할하려면 미디어를 기음과 PBS 5 ㎖로 접시를 씻으십시오. 접시에 0.25 % 트립신 1 ML을 추가하고 세포가 판을 들어 올릴 때까지 37 ° C에서 품어. 0.25 % 트립신 반응을 중화하고 1.5 ML 튜브에 세포를 피펫에 Iscove의 수정 된 둘 베코의 중간의 0.5 ML을 추가합니다.
- 5 분 동안 500 XG에서 세포를 스핀. Iscove 개변 둘 베코 배지 1 ㎖로 세포를 재현 탁. (10)를 희석(81), PBS의 90 μL 세포의 리터. 혈구 또는 자동 세포 계수기를 사용하여 세포를 카운트. 전체 Iscove의 수정 된 둘 베코의 중간에 다시 판 2.5-3.0는 × 10 6 세포 / 판.
참고 : 세포를 도금 후 50 %의 합류 24-34 시간을 ~ 일 것이다. 그들은 ~ 50 % 융합 일 때 세포를 형질.
3. (5 일) CaPO4 형질 감염 및 바이러스 성 입자 컬렉션
- 기존의 미디어를 흡입하고 미리 예열 Iscove의 수정 된 둘 베코의 중간 10 ㎖를 추가하여 이전에 형질 전환에 미디어 2 시간을 변경합니다. 10 센티미터 판 미디어 10ml를 정확히이 있는지 확인하십시오.
- 2, 5 ㎖의 둥근 바닥 폴리스티렌 튜브를 사용하여 2 요리에 대한 형질 전환 시약을 준비합니다. 제 1 튜브 "DNA"및 제 2 튜브 "2X HBS를"레이블. pH가 7.4에서 트리스 - EDTA에 / μl를 1μg하는 DNA의 농도를 조정합니다.
- 렌티 바이러스를 들어, 천천히 이동 벡터의 20 μL (비라 추가관심 L 구조체) CMVdelta8.9 13 μL, VSV-G 9 μL, 분자 생물학 등급 H 2 O 860 μL, 제 1 튜브 ( "DNA") 2.5 M CaCl2를 100 ㎕ 연속적으로 탭핑하면서 튜브에 혼합합니다.
- 레트로 바이러스의 경우, CMVdelta8.9 플라스미드를 생략합니다. "DNA"로 표시된 튜브에 20 μl를 전송 벡터, 15 μL의 VSV-g, 860 ㎕의 분자 생물학 학년 H 2 O, 100 ㎕의 2.5 M CaCl2를 추가합니다.
- 배 HEPES 완충 식염수 1 ㎖ 추가 (산도 7.0,이 pH가 절대적으로 중요하다) "2X HBS"로 표시된 튜브.
- 천천히 "2X HBS"관에 한 번에 한 방울을 "DNA"튜브의 1 ml의 내용을 추가한다. 은 "DNA"튜브의 내용을 추가하는 동안 지속적으로 인덱스 또는 중간 손가락으로 "2X HBS"튜브를 누릅니다. 각 드롭 후 알 카포 4 소포를 관찰한다. 실온에서 30 분 동안 어두운 데에서 인큐베이션 튜브.
- 하룻밤에 37 ° C를 부화 후, 각 10cm 셀 판에 느린 방울의 형질의 1 ML을 추가합니다.
- (주 6) Iscove의 수정 된 둘 베코의 중간 + 0.5 % FBS 8 mL 및 40 mg의 카페인 / 100 ㎖ 미디어와 미디어를 교체합니다. 전송 벡터는 형광 마커를 포함하면, 형광 발현이 성공적으로 형질을 나타냅니다.
- (주 7)은 10 ㎖의 혈청 피펫을 사용하여 바이러스 입자를 함유하는 매체를 수집하고, 50 ㎖ 원뿔형 튜브에 분주. 4 ° C에서 50 ML 원뿔 튜브를 저장합니다. 각각의 판에 0.5 % FBS 매체의 8 ML을 추가합니다.
- (주 8) 또, 바이러스 입자를 함유하는 매체를 수집하고 50 ㎖ 원뿔형 튜브에 전날 수확 결합.
4. 농도 및 바이러스 정제
- 이 O. DDH을 40 % 폴리에틸렌 글리콜 6000 및 1.5 M의 NaCl을 첨가하여 5 배의 폴리에틸렌 글리콜 6000 용액을 의 솔루션을 압력솥121 ℃에서 45 분 동안 액체 사이클. 냉각 할 때 천천히 솔루션을 섞는다.
참고 :이 솔루션은 흐린 시작하고 냉각하는 것에 분명해질 것이다. - 불용성 물질을 펠렛하기 위해 10 분 동안 2,000 XG에 바이러스 상등액 모두 모음을 함유하는 50 ml의 원추형 원심 분리 튜브. 0.45 μm의 낮은 단백질 결합 주사기 필터 (PES 또는 PVDF)를 통해 필터링하여 바이러스 미디어를 정화.
- 5 배 폴리에틸렌 글리콜에게 미디어 6000 솔루션을 추가 (최종 농도는 8 % 폴리에틸렌 글리콜 6000 및 0.3 M NaCl을해야한다). 튜브를 여러 번 (안 소용돌이을) 반전 섞는다. 때때로 리믹스 12 시간 이상 4 ℃에서 바이러스 함유 폴리에틸렌 글리콜 용액을 인큐베이션.
- (주 9) 원심 분리기 45 분 동안 2,500 XG에 바이러스가 포함 폴리에틸렌 글리콜 솔루션입니다. 제거하고 상층 액을 버리고 2 분간 다시 스핀. 다시 제거하고 상층 액을 버린다.
- 320 μL를 첨가하여 펠렛을 재현 탁멸균 인산 완충 생리 식염수는 하룻밤에 4 ° C를 품어 (320 μL은 1/100 수집 된 바이러스 함유 미디어의 원래 볼륨의 일이다). 선택적으로, 30 분간 로커에 상온에서 펠렛을 재현 탁.
- 펠렛을 다시 중단 한 후, 나누어지는 바이러스 (5 ~ 10 ㎕를 0.5 ml의 당 관) 및 -80 ° C (극적으로 역가를 줄일 4 ° C에서 해동 또는 저장 동결)에서 분취 액을 동결.
- 즉, 표준 프로토콜을 사용하여 바이러스 역가, HEK293T 세포를 6 웰 플레이트에서 일련의 희석을 수행하여 수동으로 48 시간 후 형광 콜로니를 카운트.
CRISPR 바이러스 5. 시험 효능
참고 : 다음 단계를 사용하여 순서 클론 마우스 Neuro2A 세포를 사용 NHEJ 수리 이중 가닥 나누기의 생산을 테스트합니다. 이는 변형 된 세포의 비율 및 성질을 결정하는 데 사용될 수 있다는 점에서 측량 분석 위에 이점을 갖는다NHEJ으로 인한 삽입과 삭제의.
- 이러한 매트 리겔과 같은 젤라틴 코트 단백질 혼합물 3.5 cm 세포 배양 접시 Iscove 개변 둘 베코 배지 1:50 희석하고, 37 ° C에서 30 분 동안 배양한다. 젤라틴 단백질 혼합물을 기음과 Neuro2A 세포를 접시.
- Neuro2A 세포가 50 %의 합류에 도달 한 후, 10의 감염의 다양성에 CRISPR의 Lentivirus 또는 레트로 바이러스를 추가 (즉, 셀 당 10 바이러스 입자).
참고 : HEK293 세포이기 때문에 Neuro2A 세포가 감염으로 붙임성없는, 따라서 하나의 감염은 세포가 렌티 바이러스에 감염되고 100 %가 발생하지 않습니다. 또한, 레트로 바이러스는 세포를 분할 감염 때문에도 100 % 감염 발생하지 않습니다. 감염의 거의 100 %의 비율을 달성하기 위해, 바이러스의 첨가는 필요에 따라 세포를 분리, 여러 날에 반복 될 수있다. 대안 적으로, 형광 양성 세포는 형광 활성화 세포 정렬을 이용하여 분리 될 수있다. 일렌티 바이러스와 100 % 감염률을 달성하기 위해 예를 가장 효과적인 방법은 FACS 분리 하였다 단일 감염을 수행한다. 레트로 바이러스의 경우, 24 시간 떨어져 감염의 4 라운드를 수행하고 100 % 감염을 보장하기 위해 FACS 분리에 의해 따릅니다. - 1 주간 세포를 감염 후, 10 센티미터 접시에 가까운 합류로 세포를 확장하여 미디어를 대기음, 인산염 완충 식염수 5 ㎖로 접시를 씻으십시오. 0.25 % 트립신 1 ML을 추가하고 세포가 판을 들어 올릴 때까지 37 ° C에서 품어. 0.25 % 트립신 반응을 중화하고 1.5 ML 튜브에 세포를 피펫하고 5 분 동안 500 XG에서 세포를 펠렛 Iscove의 수정 된 둘 베코의 중간의 0.5 ML을 추가합니다.
- 세포를 다시 정지하고 95 부화 50 mM의 수산화 칼륨을 100 μL를 추가 DNA를 분리 5 분 동안 C를 °. 1 M 트리스, pH는 8.0의 10 μL를 사용하여 상기 용액을 중화.
- PCR은 CRISPR sgRNA의 대상이 게놈 영역을 측면 영역을 증폭사용 ~ DNA를 300 ng의 높은 충실도 PCR 마스터 믹스 4를 사용 단계 5.5입니다.
- 이러한 겔 DNA 복구 키트로서 2.5 % 아가 로스 겔 겔 겔 정제 키트를 사용하여 적절한 크기의 단편을 정제에 대한 PCR 반응을 실행. 을 pGEM-T 쉬운 등의 PCR 클로닝 벡터에 결찰하고 유능한 세포를 9로 변환.
- 24 시간 후, 15 mL의 둥근 바닥 튜브뿐만 아니라 적절한 항생제 (암피실린, 네오 마이신 등)에 LB 배지 2 ㎖를 추가한다. LB 플레이트에서 하나의 식민지를 선택 멸균 피펫 팁 또는 루프를 사용하여 개별 식민지 튜브를 접종한다. 확장하고 250 RPM, 24 시간 동안 37 ° C에서 튜브를 흔들어 식민지를 성장. 원하는만큼의 식민지에 대해 반복합니다.
- 미니 프렙 키트를 사용하여 E.로부터 DNA를 분리 콜라이 마우스 게놈 Cas9 대상 영역을 분석하기 위해 sgRNA 의해 표적 유전자의 영역을 증폭하기위한 프라이머 서열.
성인 마우스 6. 정위 주입 프로토콜
- 수술 준비
참고 : 그것은 생존 수술시 무균 상태를 유지하는 것이 중요하다. 이는 주입 부위를 소독 betadine를 사용하여 수술 도구를 살균하고 닫은 후 절개 부위에 항생제 연고를 추가 열에 의해서이 프로토콜에서 달성된다. 이는 멸균 장갑뿐만 아니라 충분히 멸균 수술 전용 영역을 사용하는 것도 중요하다.- 열 소독 수술 도구 고압 증기 멸균 또는 사용 뜨거운 구슬 살균기 중 하나에 의해 사용하기 전에. 수술 및 복구하는 동안 체온을 유지하기 위해 가열 패드를 켜서 복구 실 및 수술 영역을 준비합니다. 주입을위한 두개골에 구멍을 만드는 데 사용되는 드릴을 조립합니다.
- 로드 멸균 PCR 튜브에서 직접 바이러스를 회수하여 주사 바늘로 바이러스의 4 μL. 간단히 얼음에서 바이러스 성 나누어지는을 제거합니다. 바이러스를 유지주사 전에 더 이상 1 시간 동안 실온에서 주사기이다.
7. 정위 주입
- 수술 제품군에 환기가 적절한 공기 흐름을 보장하기 위해 열려 있는지 확인합니다. 유도 챔버에서 4 % 이소 플루 란으로 마취로 수술 마우스를 준비합니다. 마취 후, 주사 부위를 준비 면도 헤드.
- 혀를 아래로 이동 핀셋을 사용하여 측면에 정위 장비에서 마우스를 놓습니다. 치아가 다음 슬롯에 드롭 귀 막대를 고정 할 때까지 입에 물린 줄을 삽입합니다. 마우스의 몸이 가열 패드에 있고 코는 코 콘에 위치해 있는지 확인합니다. 코 콘에 직접 4 % 이소 플루 란. 핀셋으로 발을 곤란하게하고 더 놀라게 반사가 없음을 확인하여 마취를 확인합니다.
- 눈을 윤활 인공 눈물을 적용합니다. 마침 POV의 교류 원으로 면도 헤드를 보라고하여 주사 부위를 준비Idone은 요오드와 리도카인.
- 메스를 사용하여 두피의 중심을 따라 작은 절개를 잘라. 브레 그마를 시각화하기 위해 필요한 경우 면봉과 과산화수소와 두개골을 건조.
- 해부 범위를 사용하여 두개골에 브레 그마를 찾아 브레 그마에 드릴 팁을 배치합니다. 제로 (또는 기록)은 X, Y 및 Z 평면에서 디지털 정위 좌표.
- 헤드 Y 축 꼬리 지느러미하는 입쪽의 레벨이되도록하기 위하여, 람다에 드릴 용 비트를 배치하고, Z 좌표는 브레 그마 및 람다 모두 대략 동일하도록 헤드 수평.
- 헤드가 x 축에 수평이되도록하기 위해, Y = 1/2 람다에 드릴 용 비트를 배치했다. 는 z 좌표 있는지 확인하는 것은 시상 봉합의 각면 (X = +/- 1mm)에 1mm에서 동일하다. 에 차이가있는 경우 두개골을 조정 왼쪽과 람다의 오른쪽에 1mm에서 z는 좌표입니다.
- 원하는 좌표를 통해 훈련을 놓습니다. 치아 이랑 (dentate gyrus)의 경우, 좌표 사용하십시오싸이는 브레 그마 및 X = +/- 1.1에서 -1.9을 =. 드릴링하기 전에, 다음, 천천히, 조심스럽게 두개골을 드릴, 2 %로 이소 플루 란을 낮 춥니 다.
- 모든 구멍을 천공 한 후, 정위 기기에 충전 된 주사기를 부착합니다. 시각적으로 구멍을 통해 주사기 센터와 z는 두개골 좌표 제로.
- 천천히 깊은 Z-깊이 주사기를 내립니다. 치아 이랑 (dentate gyrus)의 경우, Z 깊이는 -2.5, -2.4 및 -2.3이다. 정위 인젝터를 사용하여 0.25 μL / 분의 속도로 주사를 시작한다.
- 주입이 가장 낮은 Z-깊이를 완료 한 후, 다음 좌표 다음에 올리고 다시 주입을 시작, 1 분을 기다립니다. 모든 Z-주입 좌표가 주입 될 때까지이 패턴을 계속합니다. 마지막 주사 후 주사기를 제거하기 전에 2 분을 기다립니다.
참고 : 어떤 부작용이 마우스 뇌의 반구 당 바이러스의 2 μL까지 주입하여 조직에 언급되지 않았다.
- 주입이 가장 낮은 Z-깊이를 완료 한 후, 다음 좌표 다음에 올리고 다시 주입을 시작, 1 분을 기다립니다. 모든 Z-주입 좌표가 주입 될 때까지이 패턴을 계속합니다. 마지막 주사 후 주사기를 제거하기 전에 2 분을 기다립니다.
- 다른 구멍 구멍 반복 주입.
- 주입 후, 정위 악기에서 마우스를 제거하고 6-0 실크 봉합과 두피를 봉합. 리도카인과 상처에 항균 크림을 적용합니다.
- 통증을 관리하는 IP 경로를 통해 0.8-1.0 ml의 생리 식염수 + 케토 프로 펜 (3-5 ㎎ / ㎏)을 주입한다. 가열 복구 챔버에 마우스를 놓습니다. 이 흉골 드러 누움을 유지하기 위해 충분한 의식을 회복 할 때까지 무인 동물을 두지 마십시오. 완전히 회복 될 때까지 다른 동물의 회사에 동물을 반환하지 않습니다.
- 수술 다음 날에, 매일 마우스의 무게와 부드러운 음식과 간식을 제공합니다. 상처를 확인하고 일반 조건 / 태도를 확인합니다.
- 정위 주사 후, 마우스를 슬라이스 준비 전기 생리학 1 안락사 또는 관류 뇌 제거, 분리 및 분석 10 면역 염색을 통해 할 수있다.
결과
특정 시퀀스를 대상으로 올리고 하류 hU6 프로모터의 PXL 클로닝 벡터에 삽입하고, 발현 벡터는 BbsI 복제 사이트를 사용하여 가이드 RNA 지지체의 하류에있다 "CRISPR / Cas9 레트로 바이러스에 대한 가이드 스트랜드 (sgRNA)를 설계하기위한 프로토콜의"다음 (그림 1, 단계 1). 이 sgRNA 다음 PXL로부터 절단하고 BstBI 및 PACI 위치 (도 1, 단계 2)를 사용하여 pRubi 백본에 삽입된다. 마지막으로, 다른 sgRNA이 유전자의 또 다른 영역을 대상으로하고 NHEJ 통해 녹아웃 가능성을 증가 pRubi-Guide1 (도 1, 단계 3)에서 제 1 가이드의 하류에 배치 될 수 PXL로 클로닝. 정확한 구문 검증은 서열 분석에 의해 결정되어야한다. 이 구조가 만들어지면, 그것은 "/ 역 렌티 바이러스 생산 - CaPO4 메소드 프로토콜"다음 바이러스로 패키지 될 수있다. 성공적인 패키징은 V 역가를 위하여 HEK293 세포로의 바이러스 감염에 의해 확인irus. 더 형광 발현이없는 경우, 아마도 바이러스 포장 중에 오류가 있었다.
그림 2는 2 레트로 바이러스, 하나의 표현 GFP 다른 표현 mCherry의 대표 결과, (7 일짜리) 신생아 마우스의 치아 이랑에 공동 주입 및 이십일일에게 주입 후 몇 군데. mCherry 또는 GFP와 신경 세포의 표지는 단독으로 형광을 표현하는 하나의 바이러스가 CRISPR을 표현할 수 같은 조직에서 다양한 유전자 조작의 형태 학적 평가 / Cas9 매개 KO 다른 제어 바이러스를 할 수 있습니다. 정위 주입은 의도 된 좌표의 치아 이랑의 개별 감염에 의해 입증 된 바와 같이 정확한 해부학 적 선택을 할 수 있습니다. 감염 뇌 부분을 분석 할 때, 정확한 해부학 적 부위 감염되었다고 결정될 때까지 주변 조직을 유지하는 것이 중요하다. 감염의 징후가 없다면, 주입 인접 영역 발생 가능성이D는 주변 부분에서 식별 될 수있다. 또한 정확한 주입 영역을 찾기 위해 바늘 트랙을 찾는 것이 도움이 될 수있다. 생체 내 주입, 전체 치아 이랑 함께 주동이 / 꼬리 축 감염 세포를 따라 확산하는 경향이 때 3D 재구성 (그림 3)에 의해 분석으로 VSVG의 pseudotyped 바이러스는 거의 이가있는 이랑의 여백 밖으로 확산되지 않습니다.
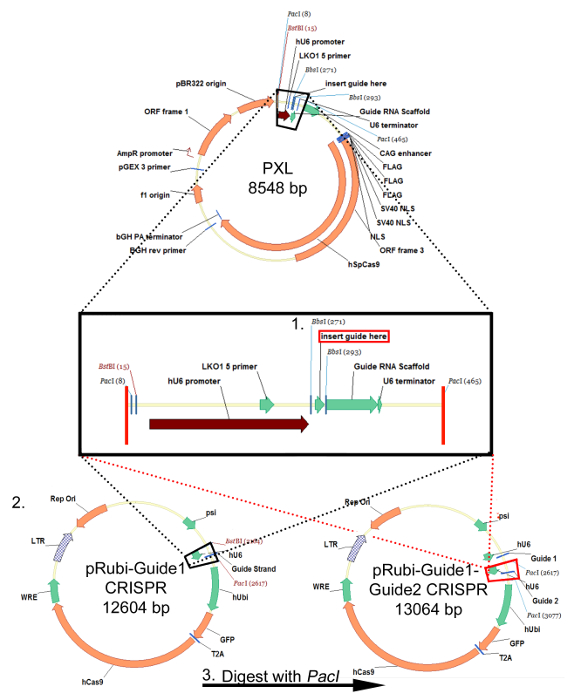
그림 1 :. 레트로 바이러스 pRubi-Guide1 - Guide2-CRISPR 플라스미드에 대한 복제 전략이 전략은 FU 기반 렌티 바이러스 플라스미드 동일합니다. sgRNA 올리고는 어닐링과 BsbI 복제 사이트를 사용하여 PXL에 삽입됩니다. 순서는 sgRNA가 성공적으로 PXL에 삽입되도록 한 후, BstBI 및 PACI와 플라스미드를 소화. (블랙 박스) 탈락되는 삽입 한 후 바이러스 다시 B로 복제됩니다하나 pRubi - Guide1 CRISPR를 (검은 색 점선). 두번째 sgRNA 또한 PXL 삽입 및 PACI 효소를 사용하여 분해 될 수있다. 이것은 다음 PACI 사이트를 사용하여 pRubi-Guide1의 CRISPR 벡터 (빨간 점선)에 복제됩니다. 생성 된 플라스미드는 가이드 가닥뿐만 아니라 필요한 바이러스 성 요소, 프로모터 및 형광 모두 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
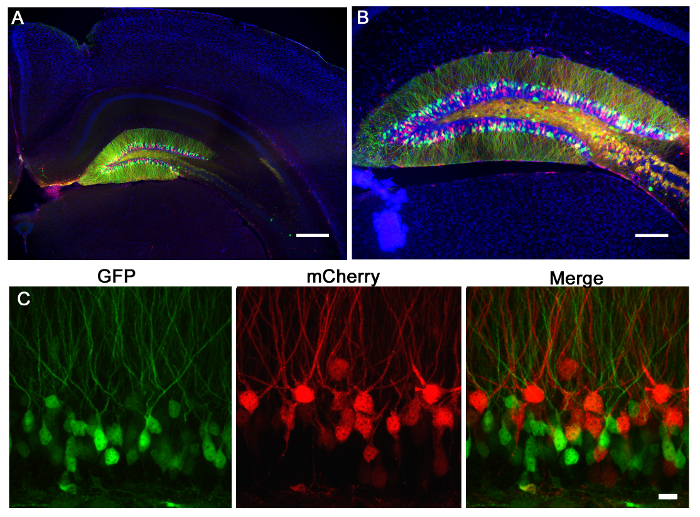
그림 2 :. mCherry (빨간색) 또는 GFP (녹색)를 발현하는 마우스 치아 이랑의 레트로 바이러스 주입 레트로 바이러스는 P7 마우스의 치아 이랑에 주입 하였다. 이십일일 나중에 마우스를 관류하고 뇌 단면 및 GFP 및 mCherry에 대한 염색 하였다. (A) 5 배 넓은 필드 형광 이미지는 홍보를 보여줍니다이가 이랑 주입 ecision 및 라벨 치아 이랑의 과립 신경 세포의 특이성. 해마의 형태는 DAPI (블루) 염색을 통해 알 수있다. 스케일 바는 200 μm의를 측정한다. (B) 10 배 넓은 필드 형광 화상이 고역가 렌티 바이러스는 그 형태 형광 발현을 통해 액세스 할 수있는 다수의 셀을 감염 것을 보여준다. 스케일 바는 100 μm의를 측정한다. GFP 또는 mCherry을 표현 (C) 바이러스는 치아 이랑에 공동 주입 하였다. 레트로 바이러스의 시스템을 사용하여, 하나는 GFP 및 mCherry로 표시된 다른 조작에 의해 표시된 하나의 유전자 조작을 한 바이러스를 사용하고, 각 인한 바이러스 단일 또는 첨가제 변화를 평가할 수있다. 스케일 바는 10 μm의를 측정한다.
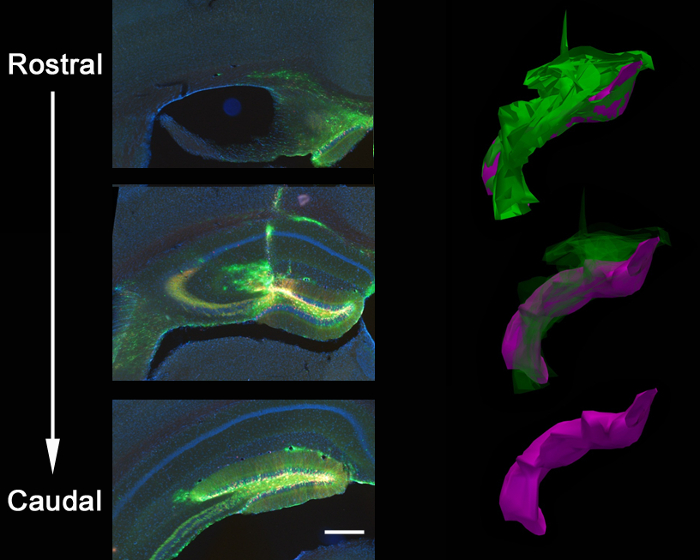
그림 3 :. 렌티 바이러스 주입의 해부학 적 확산 정위 공사 출 GFP-shPten 바이러스 및 성인의 두뇌로의 mCherry 제어 바이러스의 PTEN에 loxP / + 마우스 해마의 치아 이랑의 전체 주동이 / 꼬리 축을 따라 바이러스 확산의 결과. 이것은 바이러스의 확산 윤곽 재구성 소프트웨어를 사용하여 21 직렬 섹션 (Z = 50 ㎛의 / 제)를 통해 추적 하였다 폐쇄되는 주입의 범위의 3D 재구성에 나타낸다. 윤곽 트레이싱은 다음 볼륨 정량의 3D 이미지를 생성하기 위해 정렬했다. 전체 바이러스의 확산은 녹색으로 표시됩니다 (볼륨 = 54730800 μm의 3) 이가 지역화 확산은 (= 27,275,200 μm의 3 볼륨) 보라색에 표시됩니다. 바이러스는 니들 트랙 및 치아 이랑 (dentate gyrus)의 입쪽 / 꼬리 축 충전 이외에 니들 트랙 교차 뇌량 따라 퍼진다. 스케일 바는 200 μm의를 측정한다.
레 / ftp_upload / 53783 / 53783video1frame.jpg "/>
보충 비디오 sgRNAs 1. 디자인은 레트로 바이러스와 렌티 바이러스 백본으로 복제합니다.
이 합성 가이드 RNA (sgRNA) 디자인 예제에서는 마우스 CHD8의 게놈 서열은 NCBI에서 다운로드됩니다. 개시 코돈 및 엑손 구조이어서 벡터 NTI 시각화된다. 이것은 우리가 제 1 코딩 엑손 주변의 게놈 영역을 복사 Benchling으로이 순서를 입력 할 수 있습니다. Benchling은 우리 지역의 모든 잠재적 sgRNAs를 시각화 할 수 있습니다. 또한, 우리가 입력이 게놈 영역을 표시 한 후, Benchling은 우리에게 각 가이드 RNA의 대상 및 오프 목표 점수를 표시합니다. 사용자는 다음 가장 높은 온 - 오프 목표 점수 가이드 RNA를 선택할 수 있습니다. 이 동영상을 보려면 여기를 클릭하십시오. (다운로드 마우스 오른쪽 버튼으로 클릭합니다.)
토론
성공적인 바이러스 성 포장에 중요한 몇 가지 중요한 단계가 있습니다. 비정상 세포가 크게 발생 바이러스의 양을 감소하므로 셀 상태는 이전과 트랜시 중요하다. 형질 포장이 성공적이라면, 셀의 100 %가 형광을 표현해야하고, 세포는 기능 syncytium을 형성한다. 단계 3.2.4 튜브를 탭하면 효율적 고역가 형질 전환에 필요하고, HEPES 완충 생리 식염수의 pH가 정확해야한다. 바이러스 성 포장에 필요한 플라스미드를 생산하는 맥시 준비합니다 매우 순수해야합니다. 이 점, 상기 최종 용출 DNA를 침전시키고 에탄올 트리스 EDTA 버퍼에 일시 중지 다시 유용하다. 이는 카페인이 바이러스 컬렉션 전날 6 (스텝 3.4)에 첨가되어있는 배지에서 2 % 이하로하는 혈청의 양을 줄이기 위해 매우 중요하다. 혈청이 감소되지 않은 경우, 최종 정제 된 바이러스 혈청 PROT의 바람직하지 않은 양을 포함EIN. 폴리에틸렌 글리콜 바이러스 입자를 침전 6000의 사용은 초 원심 분리의 필요성을 제외한다. Cas9의 CRISPR 포함 된 바이러스는 일반적으로 단독으로 형광을 포함하는 바이러스보다 배 이하 (10) 주변의 역가를 참고하는 것도 중요합니다.
정위 수술 흡입 마취제의 사용은 주 사용 마취제에 비해 신속하고 정확한 제어 또는 동물의 의식을 허용하고 큰 연령대 통해 마취를 허용한다. 깨끗하고 무균 수술 악기를 유지하는 것이 매우 중요하며, 재생 가능한 타겟팅은 머리의 정확한 위치를 필요로한다. 정위 악기와 두개골이 제자리에 단단히 느낌이 머리의 어떤 피칭 또는 롤링이없는 것을 확인합니다. 또한 두개골의 정위 좌표를 결정하는 봉합사를 찾기 위해 건조되도록하는 것이 유용 할 수있다. 또한, 정위 좌표 각각에 대해 레이트 및 부피는 경험적으로 결정되어야한다.
이 기술은 (AAVs) .Therefore 아데노 - 관련 바이러스에 비해 때 렌티 또는 레트로 바이러스의 확산이 특히 제한되는 이산 뇌 영역에 감염 될 때, 이러한 바이러스는 가치가 있지만, 전체 감염 AAVs과 연관되지 않은 것을 제한하고 동물 행동 분석에 사용됩니다. 이 프로토콜 카페인의 사용은 크게 이러한 바이러스의 역가를 증가 시키지만 여전히 AAV 포장에서 얻어지는 적정량만큼 높지 않다. 또한, 일시적으로 형질 때 CRISPR / Cas9 안정 게놈 편집도 형성으로 안정적인 통합 형광 발현의 장점이 있고이 가능하다 진행중인 결국 목표 효과를 생성 할 수있다 Cas9 및 sgRNA의 발현을. AAVs와 CRISPR / Cas9 시스템은 세포 분열에 전파되는 게놈 변화를 생성하기에 충분한 과도 발현은, 그러나, 형광 발현이 유지되지 않을 것이다.
렌의 창조ti- 및 CRISPR / Cas9 체계를 이용하여 레트로 바이러스는 다양한 유기체의 모든 신규 유전자를 타겟팅하는 능력을 부여한다. 유전자 편집의 효율 Cas9 절단 타겟팅 가이드 RNA의 순서에 의존 할 것으로 보인다. 경험적으로 시퀀싱 Neuro2A 세포를 감염 후 10 % 내지 클론의 80 %가 삽입과 삭제를 포함하는 것으로 결정되었다. Neuro2A 세포에서 산출 INDEL 주파수 뉴런에서 그들의 반사 여부 현재 알려져 있지 않다. 이러한 Benchling 같은 안내 RNA 디자인 소프트웨어는 주어진 표적 서열의 효율을 예측할 수있다 「온 대상 "점수를 포함한다. 예 : "온 대상"점수가 더 광범위하게 구현된다 경험적으로 CRISPR-Cas9 시스템과 같은 신경 세포와 다른 세포 유형으로 결정되는 신뢰할 수있는 요구에 어떤 정도.
렌티 바이러스 기반의 형질 전환 동물 생산은 렌티 바이러스-전달 유전자는 경기도가 있다는 보고서를 가변적으로 성공했다11 lenced. DNA의 CRISPR 매개 유전자 편집 전체 동물 모델을 생성하기 위해 세균 라인을 통해 전달 될 수있다. 따라서, 안정적인 게놈 편집 바이러스-전달 형광체 및 Cas9의 유전자의 침묵에도 불구하고 달성 할 수있다. 이 대상으로 게놈 변경에 대한 효율적인 플랫폼을 제공 할 수있다. CRISPR / Cas9 시스템의 바이러스 전달, 트랜스 제닉 생물을 요구하지 않는 반면, 이들 기술들에 상보 적이다. 예를 들어, inducibly 유전자 조작과 신경 활동 사이의 관계에 복잡한 연구를 촉진한다 Cre 호텔과 Cre 호텔 의존 opto- 또는 화학 - 유전 형질 전환 유전자를 발현하는 화합물 형질 전환 동물에 이러한 바이러스 입자를 주입. 두 번째 예는 유전자 - 유전자 상호 작용을 선별하기위한 시도 조건부 녹아웃에이 Cas9 / sgRNA 바이러스 입자를 제공하는 것입니다. 마지막으로,이 연구의 또 다른 흥미로운 경로는 환자 유래 세포의 표현형 및 치료 화합물의 선별,하는 수이다확인하고 다양한 질환 파쇄 유전자 네트워크를 탐색하는데 사용될 수.
공개
저자는 공개 아무것도 없어.
감사의 말
이 작품은 R01MH097949을 부여 NINH에서 지원하고, 자폐증은 BWL와 노리스 코튼 암 센터의 광학 이미징 공유 계측 그랜트 P30CA023108에 파일럿 그랜트 7359을 말한다.
자료
| Name | Company | Catalog Number | Comments |
| List of Cell Culture Reagents | |||
| 293FT cell line | Life Technologies | R700-07 | For Lentivirus |
| 293GP cell line | Clontech | 631458 | For Retrovirus |
| Iscove's Modification of DMEM (IMDM) | Corning | 10-016-CV | Complete IMDM with 10% FBS, 1% NEAA, 1% L-Gln, and 1% P/S |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| MEM Nonessential Amino Acids (NEAA) | Corning | 25-025-CI | |
| L-Glutamine solution, 100x (L-Gln) | Corning | 25-005-CI | |
| Pennicillin/Streptomycin solution, 100x (P/S) | Corning | 30-002-CI | |
| Polystyrene 10 cm plate | USA Scientific | CC7682-3394 | |
| Trypsin EDTA 1x | Corning | 25-053-CI | |
| List of Transfection Reagents | |||
| 5 ml polystyrene tubes | Fisher Scientific | 352054 | |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Scientific | C69-500 | Make a 2.5 M solution in ddH2O |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-3 | |
| HEPES | Fisher Scientific | BP2939-100 | |
| Sodium phosphate dibasic (Na2HPO4) | Fisher Scientific | S369-500 | |
| 2x HEPES Buffered Saline (HBS) | 500 ml: 8.2 g NaCl, 5.95 g HEPES, 0.106 g Na2HPO4, pH 7.01 (exact!) | ||
| Caffeine | Sigma-Aldrich | C0750-5G | |
| 0.22 µM syringe filter unit | EMD Millipore | SLGV033RS | |
| 0.45 µM syringe filter unit | EMD Millipore | SLHP033RS | |
| 60 cc L/L Syringe | Med-Vet International | MV60CCLL | |
| 50 ml Conical Tube | Corning | 352098 | |
| polyethylene glycol 6000 (PEG 6000) | Millipore | 528877 | |
| (10x) Phosphate Buffered Saline (PBS) | National Diagnostics | CL-253 | |
| 0.5 ml microcentrifuge tubes | USA Scientific | 1605-0000 | |
| Matrigel | Fisher Scientific | CB-40230A | |
| 6-well plate | Fisher Scientific | 353046 | |
| Paraformaldehyde | Fisher Scientific | AC41678-5000 | |
| Donor Horse Serum | Cellgro | 35-030-CV | |
| TritonX-100 | Sigma-Aldrich | X100-500ML | |
| 10 ml serological pipette | Fisher Scientific | 357551 | |
| anti-GFP, rabbit, 488 conjugate | Invitrogen | A21311 | |
| Stereotaxic Surgery Reagents | |||
| Vet-Syringe vet use T.B. Syringe only 1 cc Luer slip T.B. 100/bx | Med-Vet International | 1CCVLS | |
| Isoflurane | |||
| Stainless Steel Scalpel Blades, #10, 100-pk | Med-Vet International | JOR580S | |
| artificial tear ointment | Med-Vet International | RXPARALUBE-O | |
| PVP PrepSolution | Med-Vet International | HPIV108208H | |
| normal saline | Med-Vet International | DYND500MLSH | |
| cotton tipped applicators | Med-Vet International | CTA6 | |
| Triple antibiotic ointment | Med-Vet International | RXTRIP-OI15 | |
| MONOJECT® Needles Soft Pack 25 g x 5/8" | Med-Vet International | 25058 | |
| 6-0 silk sutures | Med-Vet International | MV-711 | |
참고문헌
- Williams, M. R., DeSpenza, T., Li, M., Gulledge, A. T., Luikart, B. W. Hyperactivity of newborn Pten knock-out neurons results from increased excitatory synaptic drive. J Neurosci. 35 (3), 943-959 (2015).
- Luikart, B. W., et al. Pten knockdown in vivo increases excitatory drive onto dentate granule cells. J Neurosci. 31 (11), 4345-4354 (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 32 (4), 347-355 (2014).
- Luikart, B. W., et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus. PLoS One. 6 (5), e19077 (2011).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Fricano, C. J., et al. Fatty acids increase neuronal hypertrophy of Pten knockdown neurons. Front Mol Neurosci. 7, 30 (2014).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiol Genomics. 31 (2), 159-173 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유