Method Article
Einrichtung eines Setup-Hochdurchsatz-Screening für kleine Moleküle, die Modulate c-di-GMP-Signalisierung in
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt das Hochdurchsatz - Assay, der für antibakterielle Wirkstoffforschung und Verbindung Tests erfolgreich etabliert Screening großer Bibliotheken kleiner Moleküle auf ihre potentielle Fähigkeit zur Manipulation zellulärer Ebene von zyklischen di-GMP in Pseudomonas aeruginosa, ein neues leistungsfähiges Werkzeug zur Verfügung gestellt hat.
Zusammenfassung
Bakterielle Resistenz gegen herkömmliche Antibiotika hat die Forschung Versuche gefahren in kürzlich entdeckten Regulationswege neue Wirkstoff-Targets zu identifizieren. Regulationssysteme, die intrazellulären zyklischen GMP-di (c-di-GMP) als second messenger verwenden sind eine solche Klasse von Ziel. c-di-GMP ist ein Signalmolekül in fast allen Bakterien gefunden, die eine breite Palette von Prozessen einschließlich Antibiotika-Resistenz, die Biofilmbildung und Virulenz zu regulieren wirkt. Das Verständnis, wie c-di-GMP Kontrollen Aspekte von antibiotikaresistenten Biofilmentwicklung Signalgebung hat Ansätze vorgeschlagen, wobei eine Veränderung der zellulären Konzentrationen des Nukleotids oder Unterbrechung dieser Signalwege zu einer verminderten Bildung von Biofilmen oder erhöhte Empfindlichkeit der Biofilme gegenüber Antibiotika führen. Wir beschreiben einen einfachen Hochdurchsatz Bioreporter Protokoll, bezogen auf das grün fluoreszierende Protein (GFP), deren Expression unter der Kontrolle des c-di-GMP responsiven Promotor CDRA, Um schnell screenen für kleine Moleküle mit dem Potential , c-di-GMP zellulärer Ebene in Pseudomonas aeruginosa (P. aeruginosa) zu modulieren. Dieses einfache Protokoll kann nach oben von 3.500 Verbindungen innerhalb von 48 Stunden screenen und hat die Fähigkeit, mehrere Mikroorganismen angepasst werden.
Einleitung
Die rasante Entwicklung der bakteriellen Resistenz gegen klinisch wichtigen Antibiotika ist eines der wichtigsten Anliegen derzeit weltweit der Gesundheitsberufe gegenüber. Dieses Versagen der traditionellen Antibiotika hat eine neue Suche nach chemischen Materie angetrieben, der 1 mit bakteriellen Prozessen beteiligt sind in der Virulenz und den Krankheitsverlauf eingreifen können. Ein solches Regelungssystem , das die intrazelluläre Second Messenger nutzt zyklisches di-GMP (c-di-GMP) hat vor kurzem ein Ziel mit viel versprechenden Gültigkeit 2-4 werden. Es wurde festgestellt , dass diese globale second messenger Signalmolekül viele Funktionen , einschließlich Antibiotika - Resistenz, Adhäsion, Biofilmbildung und die Krankheit 2-4 reguliert.
Es versteht sich nun, dass der Zellebene von c-di-GMP in der Bakterienzelle, die durch Synthese und Abbau kontrolliert wird, wodurch zwei Moleküle GTP verwendet, c-di-GMP durch GGDEF domain-containing diguanylate Cyclasen (DGCS) wh zu synthetisierenereas c-di-GMP Abbau durch Phosphodiesterasen (PDEs) katalysiert wird, die entweder eine EAL oder eine HD-GYP Domäne (zusammengefasst in (3, 5)) aufweisen. Proteine enthalten diese Domänen enthalten oft andere Signalisierungsdomänen, was darauf hindeutet , daß ihre Aktivität in c-di-GMP Umsatz geregelt wird entweder direkt oder indirekt durch Umwelt- oder zelluläre cues 3,5. Folglich c-di-GMP Signalisierungsfunktionen des Erfassungs verschiedener Umweltreize zu Modifikationen in bakteriellen Phänotyp zu verbinden. c-di-GMP übt seine regulierende Wirkung bei Bakterien auf der Ebene der Transkription, post-Transkription und post-Übersetzung durch verschiedene Mechanismen 4.
Ein wesentlicher Einfluss von c-di-GMP in vielen Bakterienzellen ist bei der Bestimmung von bakteriellen 'Lifestyle' und insbesondere bei der Steuerung von Übergängen zwischen motile planktonischen Zellen und sessile an Oberflächen oder organisiert anhaftenden Zellen in den vielzelligen Strukturen von Biofilmen 3,5. In der Regel hohe zelluläreNiveaus von c-di-GMP mit Biofilmbildung und Seßhaftigkeit verbunden sind , während niedrige zellulärer Ebene 3,5 - Motilität und Virulenzfaktors Synthese in vielen bakteriellen Krankheitserregern fördern. So könnte eine genauere Kenntnisse über die Funktionsweise von c-di-GMP-Signal leisten Strategien zur Hemmung der Bildung von Biofilmen und Virulenz in bakteriellen Erregern. Dies ist eine schwierige Aufgabe , da die meisten bakteriellen Genomen zahlreiche Proteine mit GGDEF, EAL und / oder HD-GYP Domänen (beispielsweise P. aeruginosa hat über 40 - Proteine) und mehrere Effektoren 6,7 kodieren.
Doch selbst mit dieser Komplexität, deuten neuere Belege dafür , dass Strategien c-di-GMP - Signalisierung zu manipulieren , um entweder zu verhindern entwickelt werden können Antibiotika - resistenten Infektionen zu entwickeln oder sie dem Immunsystem oder effiziente Behandlung durch die gleichzeitige Verabreichung von klassischen Antibiotika 2 anfällig machen. Im Einklang mit dieser ist es, dass die künstliche Abnahme experimentell nachgewiesen wordender intrazellulären c-di-GMP in in vitro -grown P. aeruginosa führt zur Bildung von Biofilmen verringert und eine erhöhte Anfälligkeit gegen antimikrobielle Substanzen, während P. aeruginosa -developed Biofilmen auf Silikonimplantate, in die Bauchhöhle von Mäusen liegt, können in ähnlicher Weise 8-11 dispergiert werden.
Hier beschreiben wir ein Hochdurchsatz, fluoreszenzbasierten Reportertest kleine Moleküle zu screenen , die potentiell die zellulären c-di-GMP Ebenen in P. modulieren aeruginosa (Abbildung 1). Der Test basiert auf der Messung c-di-GMP zellulärer Ebene eine zuvor entwickelte GFP reporter , dessen Expression unter Verwendung transkriptionell an das c-di-GMP-responsive Promotor CDRA 12 verbunden ist. Dieses Protokoll beschreibt die Methode zur Expression des Reporterkonstrukts in dem P. aeruginosa Stamm von Interesse, Verbundplattenherstellung, Kultur Inokulation in 384-Well - Platten, Wachstumsbedingungen, wie wirll als Details in Bezug auf die Datenerhebung, Verwaltung und Analyse (Abbildung 1). Insgesamt wird dieses Protokoll Forscher unterstützen , um potenziell neue Verbindungen Targeting c-di-GMP identifizieren in Bakterien Signalisierung und für den Einsatz in der Forschung darauf abzielen, die Biologie von P. Verständnis aeruginosa.
Protokoll
Hinweis: Die Verfahren zur Klonierung und Transformation des gereinigten c-di-GMP - Reporter - Plasmid werden an anderer Stelle 12 diskutiert.
1. Erzeugung von GFP Tagged c-di-GMP - Reporter P. aeruginosa - Stamm
- Beimpfen von 5 ml LB-Medium (LB) Medium mit einer einzelnen Kolonie von P. aeruginosa und unter Schütteln bei 200 UpM über Nacht bei 37 ° C inkubieren.
- Transfer 2 ml der Übernachtkultur in 200 ml frischem LB-Medium in einem 1-Liter-Kolben und Inkubation bei 37 ° C bei 200 Umdrehungen pro Minute unter Schütteln.
- Überwachen der optischen Dichte bei 600 nm (OD 600) alle 30 Minuten durch eine 1 ml Probe aus dem Kolben nehmen und untersuchen mit einem Spektralphotometer (wie zuvor 12 beschrieben).
- Wenn die OD 600 erreicht zwischen 0,3-0,5, stellen 40 ml der Kultur in ein 50 ml konisches Zentrifugenröhrchen.
- Pelletieren Sie die Zellen von bei 4 ° C bei 8000 rpm für 10 min zentrifugiert, der Überstand verworfen und re-die Zellen in 40 ml eiskaltem, steril, 300 mM Saccharose-Lösung.
- Pellet die Zellen ein zweites Mal durch Zentrifugieren als 1,5 in Schritt beschrieben und resuspendieren in 20 ml eiskaltem, steril, 300 mM Saccharose-Lösung.
- Pellet die Zellen ein letztes Mal durch Zentrifugieren als 1,5 in Schritt beschrieben und resuspendieren in 400 ul eiskaltem, steril, 300 mM Saccharose-Lösung.
Anmerkung: Die Zelldichte an diesem Punkt sollte etwa 1 x 10 11 koloniebildenden Einheiten pro Milliliter (CFU / ml) sein. - Kühlen Sie die Zellen auf Eis für 30 min, wonach sie für die Elektroporation bereit sind.
- 1 ul einer 0,2 ug / ul pCdrA :: gfp C Plasmid 12 - Lösung zu 40 & mgr; l P. aeruginosa elektrokompetenten Zellen oben in einem 1,5 ml Mikrozentrifugenröhrchen vorbereitet , die auf Eis vorgekühlt wurde. Mischen Sie die Suspension und Transfer in ein vorgekühltes, 2 mm Elektrodenabstand, Elektroporationsküvette.
Hinweis: pCdrA :: gfp C: pUCP22Not-P cdra -RBSII- gfp (Mut3) -T 0 -T 1, Amp r Gm r, die ein fluoreszierendes Auslesen der intrazellulären Ebene von c-di-GMP in P. gibt aeruginosa - Stämmen wurde entwickelt und validiert von Rybtke et al. 12. - Entfernen Sie die Feuchtigkeit auf der Außenseite der Küvette mit Seidenpapier und legen Sie die Küvette in die Probenkammer des -Elektroporator. Impuls mit einer Spannung von 2,5 kV, die Kapazität von 25 uF und Widerstand von 200 Ω.
- Entfernen Sie die Küvette und 1 ml LB-Medium. Dann übertragen die Zellen in ein steriles 1,5 ml Mikrozentrifugenröhrchen und Inkubieren für 2 Stunden bei 37 ° C mit Schütteln bei 200 Upm.
- Verbreiten 10 ul, 50 ul und 100 ul-Aliquots der Kultur auf sterilem LB-Agarplatten mit Ampicillin ergänzt (bei einer Konzentration von 100 ug / ml) und Inkubieren der Platten bei 37 ° C über Nacht.
- Bestätigen Sie die GFP-Expression (excitatiauf bei 485 nm, Emission bei 520 nm) von der Platte unter einem Fluoreszenzmikroskop mit einem Standard-GFP-Kanal zu prüfen und eine einzige Kolonie holen zu impfen 5 ml LB. Inkubieren über Nacht, wie in Schritt 1.1 beschrieben. Mischen Sie 0,5 ml der Übernachtkultur mit 0,5 ml 50% Glycerin in einem 2 ml mit Schraubverschluss Rohr und bei -80 ° C.
2. Herstellung der Starterkultur zur Beimpfung
- Zwei Tage vor dem Bildschirm, die Platte , die P. aeruginosa - Stamm (mit dem pCdrA :: gfp C - Plasmid) aus dem -80 ° C Lager auf eine LB-Agar - Platte (mit Ampicillin in einer Konzentration von 100 ug / ml ergänzt) , indem Sie vorsichtig die Bakterien über die Platte Ausbreiten einer sterilen Inokulation mit Schleife. Die Platte über Nacht bei 37 ° C.
- Am Abend vor der Vorführung eine einzige Kolonie von P. impfen aeruginosa von der Platte in 10 ml LB - Medium in einem tu (mit Ampicillin in einer Konzentration von 100 ug / ml ergänzt)und die Vorkultur über Nacht bei 37 ° C unter Schütteln bei 200 rpm inkubiert.
- Am Tag des Bildschirms vorbereiten, eine Subkultur aus der Nacht Vorkultur von zunächst mit frischem LB - Medium bis zu einer OD 600 von 1,0 verdünnt und dann weiter mit 5% LB bis zu einer OD 600 von 0,04 (Verhältnis von 1:25) Verdünnen .
Hinweis: Das Gesamtvolumen des inokulierten Mediums auf der Anzahl von Platten hängt getestet werden. 5% LB wird durch Verdünnen von 100% LB mit phosphatgepufferter Salzlösung (PBS) auf die gewünschte Konzentration hergestellt. Wichtig ist , ermöglicht es dem Medium (5% LB) konstitutive Aktivierung von pCdrA :: gfp C in P. aeruginosa. - Fügen eine sterile Magnetrührstab in den Behälter und rühre die Kultur bei minimaler Geschwindigkeit auf einem Magnetrührer für 30 min bei Raumtemperatur, so dass die Bakterien an die Medien zu akklimatisieren, bevor sie in 384-well Platten ausgegeben werden.
3. Inokulation und Inkubation der 384-Well-Platten, dieKleine Moleküle
Hinweis: Die Sterilität und gute aseptischer Techniken in den folgenden Schritten an erster Stelle stehen.
- Um die positive Kontrolle (100% ige Hemmung) vorzubereiten, fügen Sie 20 ul Tobramycinsulfat (25 mg / ml) auf 10 ml (ausreichend für bis zu 12 Platten) der Subkultur hergestellt in Schritt 2.3 und vorsichtig mischen. Pipette 40 ul der positiven Kontrollkultur in die Vertiefungen A23 - P23 (Abbildung 2).
- Um die negative Kontrolle (0% Hemmung) vorzubereiten, fügen Sie 30 ul Dimethylsulfoxid (DMSO) bis 10 ml (ausreichend für bis zu 12 Platten) der Subkultur hergestellt in Schritt 2.3 und vorsichtig mischen. Pipette 40 ul der Negativkontrollkultur in Vertiefungen A24 - P24 (Abbildung 2).
- P22 (Figur 2) - für jede der Platten mit den kleinen Molekülen ausgestanzt, mit einem Volumen von 40 & mgr; l der verdünnten Übernachtkulturen (beschrieben in Schritt 2.3) in die Vertiefungen A1 inokulieren.
Hinweis: Diese erreicht werden kann, einen Flüssigkeitshandler rob mitot. Aufgrund der heterogenen Eigenschaften von Bakterienkulturen, ist es wichtig, eine kontinuierliche und mßigem Rühren aufrechtzuerhalten Bakterien konsistent verteilt in den Medien zu halten, während Abgabe. Um dies zu tun, halten Sie die akklimatisiert Kultur aus Schritt Rühren 2,4 magnetisch bei der Abgabe. - Verschließen Sie die Platten mit einer luftdurchlässigen Deckeldichtung und Inkubation für 6 Stunden bei 37 ° C.
Hinweis: Die luftdurchlässige Dichtung ist entscheidend unveränderliche Bedingungen in allen 384 Vertiefungen zu erhalten und die mögliche Entwicklung von Sauerstoff-Gradienten über die Platte zu umgehen.
4. Messung des Wachstums (OD 600) und intrazellulärer c-di-GMP - Ebene (GFP)
- Etwa 30 Minuten vor dem spektrophotometrische Messung, vorwärmen den Plattenleser auf 37 ° C Kondensation zu vermeiden.
- die luftdurchlässige Abdeckung Dichtung vorsichtig entfernen, bevor das Lesen. Messung der optischen Dichte bei einer Wellenlänge von 600 nm mit einer Einstellung von 10 Blitzen pro Vertiefung undeine Einschwingzeit von 0,2 sec.
- Vor der Messung der Fluoreszenz, machen eine automatische Verstärkungs und Fokuseinstellung basiert auf gut A24 (Negativkontrolle) und den Verstärkungszielwert bei 75% (Abbildung 2) eingestellt.
- Von der Leser Steuerungssoftware Platte, klicken Sie auf Start Messung und klicken Sie auf '' Focus und Gain-Einstellung / Platte-IDs '' Registerkarte.
- Auswählen '' Fokuseinstellung '' und '' Kanal A '' auf der rechten Seite auf dem Fenster.
- Auswählen '' Gain-Einstellung '' und '' Selected gut '', und geben Sie in '' 75 '' als '' Zielwert ''. Schließlich wählen gut A24 in der Plattenlayout vor dem Klick auf, 'die Anpassung starten'. Sobald die Einstellung durchgeführt wird, klicken Sie auf '' Messung starten '.
- Messen der Fluoreszenz des GFP-Reporter bei einer Anregungs- / Emissionsmaxima von 485/520 nm mit einer Einstellung von 10 Blitzen pro Vertiefung und einem settling Zeit von 0,2 sec.
- Sammeln von Daten von allen untersuchten Platten. Hinweis: Die Datenwerte werden automatisch als Standard durch die Plattenleser Steuersoftware gespeichert.
- Ansicht Lesungen auf dem "Mars" Symbol in der Steuerungssoftware Klicken auf die statistische Analyse-Paket zu öffnen.
- Abrufen von Daten durch "Doppelklick" auf der Platte Anzahl von Interesse, die Daten für die Analyse zuzugreifen.
5. Datenanalyse
- Bewerten Sie die Gleichmäßigkeit und Reproduzierbarkeit des Tests robust z 'Analyse, die die am häufigsten verwendeten Qualitätsmetriken für High-Throughput-Screens gemeldet ist. Berechnen robust z 'mit der Formel:
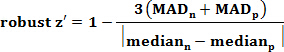
Wobei MAD (Median Abweichungsabsolut) eine Schätzung der Standardabweichung ist, p ist die positive Kontrolle (100% Hemmung) , und n ist die negative Kontrolle (0% Hemmung) sowohl OD 600 und GFP verte. Hinweis: Ein Assay mit einem robusten z 'Wert (berechnet für sowohl OD 600 und GFP Rohdaten) größer oder gleich 0,5 als ausgezeichneter Test angesehen wird. - Berechnen% Hemmung des Wachstums unter Verwendung der Formel:
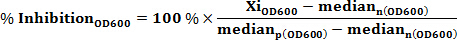
Wo Xi OD600 ist die iterierte OD 600 - Wert jedes gut Probe. % Inhibition OD600> 0, Wachstumsinhibitor; % Hemmung OD600 <0, Wachstumsförderer. - Beurteilen Sie die% Hemmung der intrazellulären Ebene von c-di-GMP unter Verwendung der Formel (die Änderung in willkürlichen Fluoreszenzintensität Einheiten sind für die Änderung der Zelldichte korrigiert):
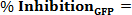
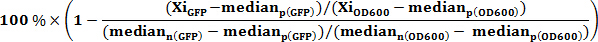
Wo Xi GFP ist der iterativen GFP Wert jeder Vertiefung Probe. % Inhibition GFP> 0, c-di-GMP - Inhibitor; % &# 160; Inhibition GFP <0, c-di-GMP - Promotor. - Stellen Sie einen Schwellenwert für die Kollisionserkennung bei 3 MAD vom Median (Median ± 3 MAD), aus der Probe berechnet und Auslesen jeder Platte, eine normale Verteilung von Datenpunkten übernehmen. Hinweis: jedoch eine ± 50% ige Hemmung abgeschnittene kann für mehr reproduzierbare und genaue Dosis-Wirkungs-Assays ausgewählt werden, wenn erforderlich.
Ergebnisse
Der hier beschriebene Ansatz ermöglicht es einem einzelnen Forscher effizient und erfolgreich einen Durchschnitt von 3.500 Verbindungen innerhalb eines Zeitraums von 48 Stunden durchmustern. Eine Übersicht über die Screening - Protokoll mit hohem Durchsatz ist als Flussdiagramm in Abbildung 1 dargestellt. Für den aktuellen Artikel, wir eine Regel-of-five - konformen Substanzbibliothek für potentielle c-di-GMP - modulierende Verbindungen in einer Endkonzentration von 600 & mgr; M gescreent . Jedoch gibt es viele im Handel erhältliche arzneimittelähnliche und nicht-Medikament wie Verbindung Sets, die in dem Assay verwendet werden konnte. Diese Sätze können Bakterien orientierte Verbindungen oder zufällige gepoolten Verbindungen sein, aber jede Bibliothek würde physikochemischen ausgesagt haben Eigenschaften und Merkmale zugeordnet, wie der Satz hier gescreent, die polare funktionelle Gruppen und mehrere Chiralitätszentren hatte. In diesem Protokoll werden die Bakterien in die Platte zusammen mit Verbindungen inokuliert, ein Antibiotikum positive Kontrolle und einer DMSO-VehikelSteuerung entsprechend dem Layout in Fig. 2 gezeigten Abbildung 3 sind die Ergebnisse des primären Screenings durch eine einzelne Bibliotheksplatte exemplifiziert darstellt. Representative OD 600 und GFP Rohdaten werden in 3A und 3B gezeigt. Ein Farbverlauf Heatmap, mit heißem (rot) zu kühlen (grün) Farben zu hohe OD 600 / GFP Werte , die niedrig ist , wurde auf die gut - Werte angezeigt . Die Wärmekarten wurden in einem Tabellenkalkulations - Software erzeugt , indem ein 3-Farbskala bedingte Formatierung von der niedrigsten OD 600 / GFP Spanning Anwendung auf den höchsten OD 600 / GFP Auslesen Auslesen auf. Niedrige OD 600 und GFP - Werte in Bezug auf die DMSO negative Kontrolle entsprechen einer Hemmung des Wachstums und der c-di-GMP - Niveaus beziehungsweise, während hohe Werte in Bezug auf die DMSO negative Kontrolle auf eine Förderung entsprechen in Wachstum und c-di-GMP - Niveaus bzw. . Die robuste z 'Werte für OD 600 und GFP are berechnet in dem Protokoll gemäß der Formel (5.1). Da sie beide über 0,5 (0,694 und 0,761 jeweils) sind, wurde der Assay Qualität robust und die Daten gehalten wurde weiter analysiert. Die% Wachstumshemmung (OD 600) und die intrazelluläre c-di-GMP Ebene (GFP) werden durch die Formeln im Protokoll berechnet (5.2, 5.3). Repräsentative Daten sind in 4A und 4B gezeigt. Ein Farbverlauf Heatmap, mit heißem (rot) zu kühlen (grün) Farben zu hoch% Hemmung anzeigt niedrig, wurde auf die gut-Werte angezeigt. Ein Streudiagramm der% Hemmung (OD 600 / GFP) aus einzelnen Vertiefungen auf dem primären Bildschirm basiert jeweils in 5A und 5B für OD 600 und GFP - Daten aufgezeichnet. A ± 50% cut-off (mit gepunkteten Linien angedeutet) zur Kollisionserkennung ausgewählt. Mögliche Treffer basierend auf diesem Cut-off sind mit roten Punkten gekennzeichnet. Zwei Arten von Verbindungen von Interesse kann daus dem Assay iscerned. Hits identifiziert in 5A sind Verbindungen , die das Wachstum von Bakterien hemmen, während Hits in 5B identifizierten Verbindungen sind , die möglicherweise die Fähigkeit besitzen , auf die intrazellulären Spiegel von c-di-GMP modulieren. Zwei Verbindungen wurden als repräsentative Treffer für diesen Assay identifiziert. Es handelt sich um die Verbindung A, ein potenzieller Wachstumshemmer und die Verbindung B ein Potential c-di-GMP-Inhibitor. Verbindung A entspricht gut F8 in den 3 und 4 und hatte eine 72,5% ige Hemmung des Wachstums. Es gab eine erwartete entsprechende Hemmung in zyklischen di-GMP Ebenen. Verbindung B entspricht und K3 in den 3 und 4 und hatte eine 61% ige Hemmung in zyklischen di-GMP Niveaus ohne Änderung Wachstum. Auswahltrefferverbindungen wurden getestet weiterhin durch eine 10-Punkt-Dosis-Wirkungs-Assay mit einer oberen Konzentration von 2 mM und zweifache Verdünnungsreihe. IC 50 -Werte werden berechnet auf der Basis der Dosis-Wirkungs-Kurven (6A und B).
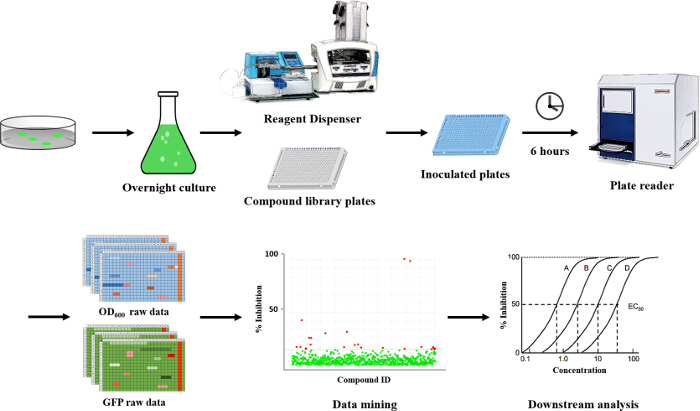
Abbildung 1. Übersicht: High-Throughput - Setup für das Screening kleiner Moleküle auf ihr Potential zur Modulation der zellulären Niveaus von c-di-GMP in P. aeruginosa. Diese Übersicht zeigt einen Schritt- für -Schritt - Darstellung des Protokolls in diesem Test verwendet. Eine Bakterienkolonie von P. aeruginosa wird über Nacht in einem LB - Starterkultur gewachsen. Verwendung eines Reagenzspender werden die Zellen inokuliert in 384-Well-Platten, die die ausgewählten Verbindungen enthält. Die Platten werden 6 Stunden inkubiert, wonach die OD 600 und GFP - Werte gemessen werden. Mit Hilfe dieser Auslesungen, Verbindungen , die die zellulären Niveaus von c-di-GMP beeinflussen identifiziert werden können. Bitte klicken Sie hier anzuschauenGrößere Version der Figur.
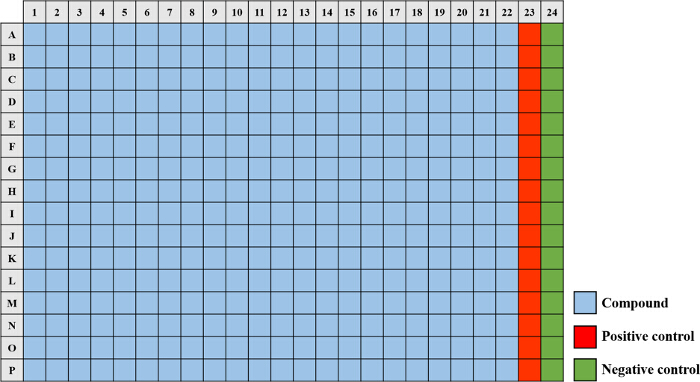
. Abbildung 2. Eine 384-Well - Platte Karte verwendet für das kleine Molekül Screening Assay Die Verbindungen aus der Bibliothek (hellblau) werden in die Vertiefungen A1 portioniert - P22. Die "positive Kontrolle" (rot), bestehend aus einer Endkonzentration von 50 ug / ml Tobramycinsulfat in Vertiefungen A23 hinzugefügt wird - P23 und die "negative Kontrolle" (grün) zu einer Endkonzentration von 1% DMSO hinzugefügt wird zu den Vertiefungen A24 enthaltend - P24. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
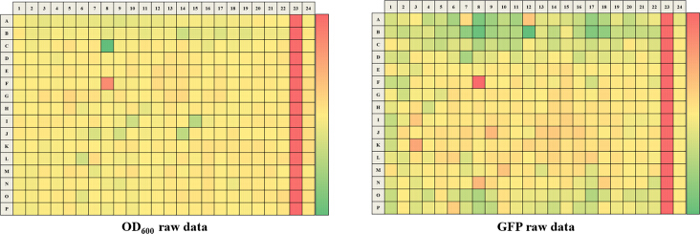
Abbildung 3. Repräsentative Ergebnisse für eine 384-Well - Abschirmblech. Repräsentativer Rohdaten für OD 600 (A) und GFP (B). Ein Farbverlauf Heatmap, mit heißem (Rot: OD 600 = 0,65 oder GFP = 250.000) abkühlen (Grün: OD 600 = 0,10 oder GFP = 40.000) Farben anzeigt , niedrig zu hohe Werte hat auf die gut Werte angewendet worden. Wells , die niedriger OD 600 / GFP Messwerte in Bezug auf die DMSO negative Kontrolle haben wird dazu neigen , in rot zu sein , während Vertiefungen , die höhere OD 600 / GFP Messwerte in Bezug auf die DMSO - Kontrolle haben wird grün zu neigen. Bitte hier klicken , um eine , um zu vergrößern Version dieser Figur.
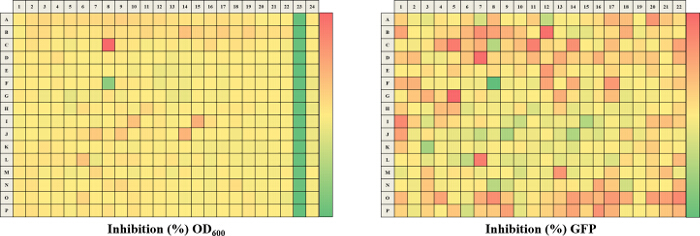
Abbildung 4. Repräsentative Ergebnisse für prozentuale Hemmung für eine 384-Well - Platte berechnet. Die analysierte% ige Hemmung Daten werden für beide der OD 60 dargestellt0 (A) und GFP (B) Auslesungen. Ein Farbverlauf Heatmap, mit heißem (Rot: OD 600 = -150% oder GFP = -20%) zu kühlen (Grün: OD 600 = 100% oder GFP = 100%) Farben anzeigt , niedrig bis hoch Hemmwerte, wurde auf die auch Werte angezeigt. Kleine Moleküle, die möglicherweise hemmen das Wachstum und die intrazelluläre c-di-GMP wird dazu neigen , in grün zu sein , während kleine Moleküle , die möglicherweise das Wachstum zu fördern und die intrazelluläre c-di-GMP - Niveaus in rot zu sein neigen. Bitte hier klicken um eine größere Version zu sehen dieser Figur.
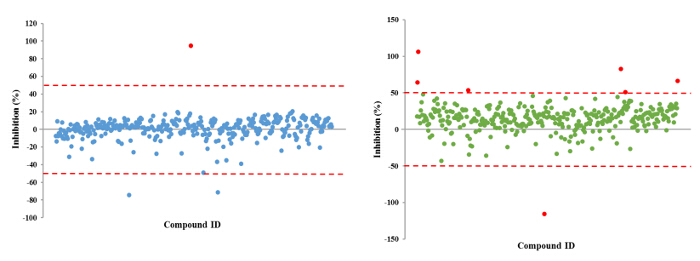
Abbildung 5. Repräsentative Streudiagramme für% Hemmung (OD 600 / GFP) , erhalten von jeder getesteten Kleinmolekül. Jedes kleine Molekül wird von einem Punkt und der% Hemmung Verteilung vertretenfür jede der OD 600 (A) und GFP (B) Auslesungen dargestellt ist. A ± 50% cut-off ist für Hit-Identifizierung ausgewählt. Mögliche Treffer werden rot hervorgehoben. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
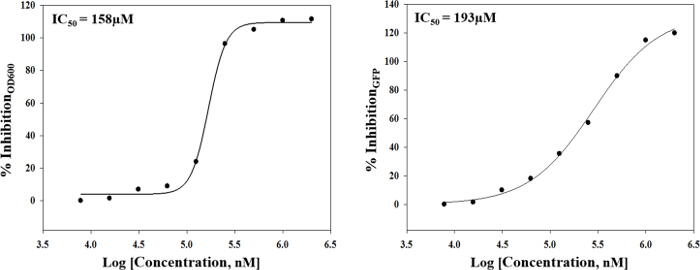
Abbildung 6. Repräsentative Ergebnisse aus einer Dose -. Response - Assay Zwei Verbindungen (potentiellen Wachstumsinhibitor A und das Potenzial c-di-GMP - Inhibitor B) aus früheren Bildschirmen identifiziert werden in einem 10 - Punkte - getesteten Dosis-Wirkungs-Assay mit einem Top-Konzentration von 2 mM und zweifache Verdünnungsreihe. Montage eines Vier-Parameter logistische Funktion auf die Daten ergab IC 50 -Werte von 158 & mgr; M und 193 & mgr; M auf. Please Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Um die Behandlung von bakteriellen Infektionen zu verbessern, ist es klar, dass ein besseres Verständnis der bakteriellen Verhalten auf molekularer Ebene Regulierungs erforderlich. Das hier beschriebene Verfahren wird für Biologen, Biochemikern und Klinikern von Vorteil sein, die kleine Moleküle zu entdecken möchten, die das Potenzial haben, mit zellulären Konzentrationen von c-di-GMP in Bakterien zu manipulieren oder zu stören. Das Verfahren nutzt eine kürzlich entwickelte GFP Bioreporter zellulärer Ebene von c-di-GMP in P. zu überwachen aeruginosa 12. Diese Bioreporter wurde bestätigt und gezeigt allem nicht das Wachstum des Stammes zu beeinflussen, verwendet bei Kultivierung in 5% LB in PBS. Die Verwendung eines Ganzzell - Bildschirm kleine Moleküle zu identifizieren , die c-di-GMP Niveaus in vivo verändert windet die Hauptschwierigkeiten der zielbasierten Wirkstoffforschung in Bezug auf die Molekül Penetration durch die Bakterienmembranen, insbesondere durch die von Gram-negativen Bakterien . Wichtig ist, ter Assay scheint sehr robust als robuste z 'Wert konstant über 0,5 wurde in allen Bildschirmen bisher beobachtet. Screening unter Verwendung dieses Protokolls wird eine Reihe von kleinen Molekülen offenbaren die Hemmung und / oder intrazellulärem c-di-GMP Ebenen in P. Förderung aeruginosa. Darüber hinaus hat dieser Assay auch das Potenzial , bakterizide oder bakteriostatische Verbindungen zu identifizieren , in einer Abnahme der Auslese OD 600 ergibt.
Obwohl nicht im Protokollabschnitt erörtert, gibt es mehrere wichtige Überlegungen für die Herstellung des Experiments. Es ist wichtig, im Auge zu behalten, dass die GFP Bioreporter auf einem Plasmid basiert. Obwohl der Reporter - Plasmid in P. sehr stabil zu sein , ist bekannt , aeruginosa, kann es nach einer kontinuierlichen Wieder Plattierung verloren, daher die Notwendigkeit der Verwendung von frisch plattierten Stämme von einem -80 ° C Glycerolstammlösung und die Expression Fluoreszenz Überprüfung ist von entscheidender Bedeutung. Es ist auch sehr wertvolles einheitlichen Wachstumsbedingungen während des gesamten Bildschirms zu haltenda etwaige Schwankungen in diesen Bedingungen haben könnte Auswirkungen auf den Bildschirm Knock-on. Dazu gehören bestimmte machen, dass die Medien und Antibiotika in batch premade sind und im Verlauf des Bildschirms verwendet. Bakterienkulturen nicht wachsen (basierend auf OD 600 Auslesungen) in einer einheitlichen Art und Weise ist ein häufiges Problem für die meisten High-Throughput - Bildschirme dieser Art. Dies kann zurückzuführen sein Effekte Kante oder eine nicht-homogene Bakterienkultur in die Platten zu verzichten. Für den ehemaligen, um sicherzustellen, eine gasdurchlässige Dichtung wird während der Inkubation verwendet lebenswichtig ist. Während bei letzterem die Flüssigkeitshandhabungsrohr mit einem Volumen der Kultur mindestens dreimal das Totvolumen des Schlauchs Priming selbst empfohlen. Es ist entscheidend, den Magnetrührer bei minimaler Geschwindigkeit zu halten, während der Abgabe. Während die Überwachung und Speicherung der 384-Well-Platten für ein stetiges Wachstum im Laufe der Experimente ist von größter Bedeutung, eine Situation zu vermeiden, die das Stapeln von Platten während der Inkubation, wie es un verursachen könnenSauerstoff-Gradienten zu einer Schrägstellung führt im Wachstumsmuster wollte. Es ist auch wichtig, um sicherzustellen, dass das Fahrzeug DMSO als negative Kontrolle verwendet wird, nicht negativ auf das Wachstum des Stammes von Interesse zu beeinflussen. Viele dieser Probleme mit Wachstum verbunden sind, können durch die Durchführung einer Mock-Bildschirm mit dem Bakterienstamm von Interesse vor dem Screening vermieden werden. Zur Interpretation der Daten auch die Berücksichtigung Verdienste gegeben, dass c-di-GMP Hemmung Ergebnisse berechnet werden durch die Änderung in willkürlichen Fluoreszenzintensitätseinheiten, die für die Veränderung der Zelldichte korrigiert werden müssen. In diesem Sinne unterschiedlichen mathematischen Formeln zur Beurteilung der Datenausgang aus diesen Experimenten auch berücksichtigt werden sollte. Zum Beispiel könnte eine Verbindung erscheinen als c-di-GMP-Inhibitor, aber tatsächlich ein Wachstumsinhibitor oder umgekehrt, erfordert umsichtige Interpretation identifiziert hits.
Es gibt mehrere Nachteile und Einschränkungen, die bei der Entwicklung und Durchführung dieser berücksichtigt werden müssenHochdurchsatz-Zell-basierten Bildschirm. Beispielsweise in einem Bildschirm verwendet, die bio-reporter Funktionen auf ein indirektes Maß der zellulären c-di-GMP Ebenen eine Fluoreszenzsonde, deren Detektionseigenschaften unter Verwendung von potentiell von kleinen Molekülen beeinflusst werden. Eine tangentiale Punkt ist die Tatsache, dass der Assay auf Zellbasis keine Informationen bezüglich der Mechanismus hinter der Veränderungen der Konzentrationen an intrazellulärem c-di-GMP verleiht. Daher müssen wichtige Beobachtungen aus Experimenten bestätigt werden, um einen Hochleistungs-Flüssigkeitschromatographie-Massenspektrometrie-Ansatz, der als der "Goldstandard" Verfahren zur Messung von intrazellulärem c-di-GMP Schwankungen in Bakterien betrachtet wird. Darüber hinaus können unsere Verfahren nur Informationen über das Verhalten von Bakterien in vitro gezüchtet bereitzustellen, wie Bakterienzellen in Zusammenhang mit dem Wirt (in vivo) gezüchtet schnell ihre Aktivitäten ändern aufgrund dieser Umgebung. Darüber hinaus bedeutet das Verfahren ein GFP Bioreporter der Verwendung der Bildschirm erfolgt nichtAuch der physiologische Status der Bakterienzellen in Betracht. Jedoch könnte das Protokoll zu mikroskopischen Überwachung der einzelnen Vertiefungen im Verlauf des Bildschirms angepaßt werden.
Auch bei diesen Überlegungen und Einschränkungen wird dieser Assay mit hohem Durchsatz ist immer noch ein robustes Bildschirm für kleine Moleküle, die mit intrazellulären c-di-GMP-Niveaus zu stören. Da viele mikrobielle Spezies einschließlich vieler bakterieller Erreger haben, um zu kennzeichnen, die Modulation der intrazellulären c-di-GMP Ebenen unser Protokoll könnte angewendet werden, um diverse Bakterienarten und erweitert auf die Untersuchung von komplexeren Multispezies Bakterien Modelle untersucht worden. Der Test kann leicht für andere Bakterienarten optimiert werden, indem die Wachstumsbedingungen zu ändern, oder können andere Ausgaben angepasst werden zu lesen, indem unterschiedliche bioreporters verwenden. Unterschiedliche Inkubationszeiten können in Abhängigkeit von der Wachstumsphase von Interesse angewendet werden. Wenn jedoch durch Stoßen Skalierung nach oben oder zu erhöhen, ist es importan t im Auge zu behalten, dass die Bakterien noch während des Platten Vorbereitungen wachsen und Auslese Messungen. Deshalb wird empfohlen, maximal 15 Platten zu einem Zeitpunkt, zu screenen, die dieses Protokoll verwenden. Darüber hinaus ermöglichen Verwendung von Platten mit mehr als 384 Vertiefungen können nicht gleichmäßiges Wachstum und erfordert eine weitere Optimierung. Verwendung einer elektronischen Pipette anstelle eines Liquid-Handling-Roboters, wenn die Anzahl von Platten Verkleinerung, kann es sinnvoller sein, manuell zu inokulieren. Es ist klar, dass dieses Protokoll verwendet werden könnten, kleine Moleküle zu untersuchen, die Biofilme zerstreuen, da anti-Biofilm-Verbindungen mit c-di-GMP-Signalisierung stören. Das Protokoll könnte auch verschiedene Aspekte der bakteriellen Physiologie zu verstehen, werden saniert. Da die c-di-GMP-Signalisierung ist weit verbreitet in den meisten Bakterien, indem die Physiologien dieser Organismen zu studieren unter Verwendung dieses Protokolls können wir verschiedene chemische Reize zu identifizieren, um zu bestimmen, ob ihre Arbeitsmechanismen erfordern c-di-GMP-Signalisierung.
_content "> Zusammenfassend ist die Robustheit und Flexibilität der in diesem Protokoll vorgestellte Ansatz wird die Identifizierung von chemischen Modulatoren von c-di-GMP Signalgebung in vielen biologischen Systemen unterstützen.Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank the Tolker-Nielsen lab for their generous donation of reporter constructs used to develop the screen. We also thank members of the Ryan laboratory for their helpful comments and critical reading of the manuscript. The work of the authors has been supported in part by grants awarded by the Wellcome Trust (WT100204AIA senior fellowship grant to R.P.R. and 093714/Z/10/Z PhD scholarship to K.N.R.).
Materialien
| Name | Company | Catalog Number | Comments |
| Lysogeny Broth (Lennox) | Sigma Aldrich | L3022-1KG | |
| Sucrose | Sigma Aldrich | S0389-1KG | |
| Lysogeny Broth with Agar (Lennox) | Sigma Aldrich | L2897-1KG | |
| Ampicillin sodium | Sigma Aldrich | A0166-25G | |
| Glycerol | Sigma Aldrich | G5516-1L | |
| Phosphate Buffered Saline, pH 7.4 | Life technologies | 10010-056 | |
| Tobramycin sulfate | Sigma Aldrich | T1783-100MG | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | 276855-250ML | |
| Genesys 10S UV-Vis spectrophotometer | Thermoscientific | 840-208100 | |
| 2 mm gap electroporator cuvette | Bio-Rad | 1652092 | |
| BioRad GenePulser XCell electroporator | Bio-Rad | 1652662 | |
| Leica Fluorescent Stereomicroscope | Leica Microsystems | MZ16FA | |
| BRAND magnetic stirring bar, PTFE, cylindrical with pivot ring (sterilize by autoclaving before use) | Sigma Aldrich | Z328952-10EA | |
| 384-well, white-walled, clear-bottom plates | Greiner | 781098 | |
| Multidrop Combi reagent dispenser | Thermo Scientific | 5840300 | |
| Multidrop Combi tubing | Thermo Scientific | 24073290 | |
| VIAFLO II 16-channel electronic pipette | Integra Biosciences | 4642 | |
| 100 ml sterile disposable reagent reservoirs | Fisher Scientific | 12399175 | |
| AeraSeal air-permeable membranes | Sigma Aldrich | MKBQ1886 | |
| Pherastar plate reader (Software version: 4.00 R4, Firmware version: 1.13) | BMG Labtech | Pherastar FS |
Referenzen
- Lewis, K. Recover the lost art of drug discovery. Nature. 485, 439-440 (2012).
- Caly, D. L., Bellini, D., Walsh, M. A., Dow, J. M., Ryan, R. P. Targeting Cyclic di-GMP Signaling: A Strategy to Control Biofilm Formation? Curr Pharm Design. 21, 12-24 (2015).
- Hengge, R. Principles of c-di-GMP signaling in bacteria. Nat Rev Microbiol. 7, 263-273 (2009).
- Ryan, R. P., Tolker-Nielsen, T., Dow, J. M. When the PilZ don't work: effectors for cyclic di-GMP action in bacteria. Trend Microbiol. 20, 235-242 (2012).
- Romling, U., Galperin, M. Y., Gomelsky, M. Cyclic di-GMP: the First 25 Years of a Universal Bacterial Second Messenger. Microbiol Mol Biol Rev. 77, 1-52 (2013).
- Boyd, C. D., GA, O. 'T. oole Second Messenger Regulation of Biofilm Formation: Breakthroughs in Understanding c-di-GMP Effector Systems. Ann Rev Cell Dev Biol. 28, 439-462 (2012).
- Ryan, R. P., et al. HD-GYP domain proteins regulate biofilm formation and virulence in Pseudomonas aeruginosa. Environ Microbiol. 11, 1126-1136 (2009).
- Christensen, L. D., et al. Clearance of Pseudomonas aeruginosa Foreign-Body Biofilm Infections through Reduction of the Cyclic Di-GMP Level in the Bacteria. Infection and Immunity. 81, 2705-2713 (2013).
- Chua, S. L., et al. Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles. Nat Comm. 5, (2014).
- Sambanthamoorthy, K., et al. Identification of Small Molecules That Antagonize Diguanylate Cyclase Enzymes To Inhibit Biofilm Formation. Antimicrob Agents Chemother. 56, 5202-5211 (2012).
- Sambanthamoorthy, K., et al. Identification of small molecules inhibiting diguanylate cyclases to control bacterial biofilm development. Biofouling. 30, 17-28 (2014).
- Rybtke, M. T., et al. Fluorescence-Based Reporter for Gauging Cyclic Di-GMP Levels in Pseudomonas aeruginosa. App Environ Microbiol. 78, 5060-5069 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten