Method Article
Licht-vermittelte Bildung und Musterung von Hydrogelen für Zellkulturanwendungen
In diesem Artikel
Zusammenfassung
We describe a sequential process for light-mediated formation and subsequent biochemical patterning of synthetic hydrogel matrices for three-dimensional cell culture applications. The construction and modification of hydrogels with cytocompatible photoclick chemistry is demonstrated. Additionally, facile techniques to quantify and observe patterns and determine cell viability within these hydrogels are presented.
Zusammenfassung
Klicken Chemien wurden für die Verwendung in zahlreichen Biomaterialien Anwendungen, einschließlich der Arzneimittelabgabe, Tissue Engineering und Zellkultur untersucht. Insbesondere Licht vermittelte Klick-Reaktionen, wie photoinitiierte Thiol-En und Thiol-Alkin-Reaktionen, leisten räumlich-zeitliche Kontrolle über Materialeigenschaften und die Konstruktion von Anlagen mit einem hohen Maß an Benutzer gerichtet Eigenschaft Kontrolle ermöglichen. Herstellung und Modifizierung der Hydrogel-basierte Biomaterialien die Präzision durch Licht und der Vielseitigkeit von diesen Thiol-X Photoclick Chemien angeboten lieferte verwenden, sind von wachsendem Interesse, insbesondere für die Kultur von Zellen in gut definierten, biomimetische Mikroumgebungen. Hier beschreiben wir Methoden zur photoencapsulation von Zellen und die anschließende Photopatterning biochemischer Signale innerhalb Hydrogelmatrices mit vielseitig und modularen Bausteinen polymerisiert durch eine Thiol-En-Photoclick-Reaktion. Insbesondere wird ein Ansatz für die Zusammenarbeit vorgestelltnstructing Hydrogele aus Allyloxycarbonyl (Alloc) -funktionalisierten Peptid Vernetzungen und anhängenden Peptideinheiten und Thiol-funktionalisierten Poly (ethylenglycol) (PEG), die in Gegenwart von Lithium acylphosphinate Photoinitiator und cytocompatible Dosen von langwelligen ultravioletten (UV) Licht rasch polymerisieren. Facile Techniken Photostrukturierungs zu visualisieren und die Konzentration von Peptiden hinzugefügt quantifizieren beschrieben. Darüber hinaus werden Methoden zur Einkapselung von Zellen etabliert, insbesondere humanen mesenchymalen Stammzellen und ihre Lebensfähigkeit und Aktivität zu bestimmen. Während die Bildung und die anfängliche Strukturierung von Thiol-alloc Hydrogele hier gezeigt sind, können diese Techniken allgemein auf eine Reihe von anderen Licht und radikalisch initiierte Materialsysteme gemusterten Substraten zu erzeugen (beispielsweise Thiol-norbornen, Thiol-acrylat) angewendet werden.
Einleitung
Klicken Chemien sind in der Gestaltung von Materialien für eine Vielzahl von biomedizinischen Anwendungen zunehmend verwendet werden, einschließlich Arzneimittelabgabe, Tissue Engineering und kontrollierte Zellkultur aufgrund ihrer selektiven, effizient und oft cytocompatible Reaktivitäten. 1-3 Photoclick Chemien , die Licht verwenden , um auszulösen oder initiieren Reaktionen (beispielsweise Azid-Alkin, 4 Thiol-en, 5 und Tetrazol-Alken 6) sind von besonderem Interesse für die Bildung oder Modifikation von Biomaterialien. Schnelle Raten unter milden Bedingungen und Kontrolle , wann und wo sie stattfinden , mit Licht , diese Reaktionen machen gut geeignet für Anwender gerichtete Steuerung von Biomaterial Eigenschaften in Gegenwart von Zellen. 7,8 Insbesondere Thiol-En - Photoclick- Chemie verwendet wurden , zu erzeugen Hydrogel-basierte Biomaterialien mit robusten mechanischen Eigenschaften 5,9 und für die Einkapselung von einer Vielzahl von Zelltypen, einschließlich, aber nichtt begrenzt, humanen mesenchymalen Stammzellen (hMSCs), Fibroblasten, Chondrozyten und Pankreaszellen mit Versprechen für die Zellkultur und Lieferung. 10,11 Ferner haben diese Chemien für die räumliche Musterung biochemischer Signale verwendet worden Schlüsselaspekte der nachzuahmen nativen Zellmikroumgebungen und entsprechende Zell-Matrix - Interaktionen erleichtern, einschließlich der Haftung, Differenzierung und Invasion. 3,12
Für den Bau von Thiol-En - Hydrogele mit Licht, Peptide Cysteine (Thiol) , die gemeinsam umgesetzt werden , mit funktionalisierten Polymeren mit Acrylaten oder Norbornene ( 'en') für eine schnelle, photoinitierte Polymerisation unter cytocompatible Bedingungen. 13 Der Ausbau dieser Toolbox haben wir versucht zu etablieren Verfahren zur Bildung von Hydrogelen mit neuen vielseitig und leicht zugängliche Bausteine, die eine minimale synthetische Verarbeitung erforderlich oder waren zu ihren breiten Einsatz als synthetische extrazelluläre Matrix im Handel erhältlich.14 Im einzelnen Peptide wurden modifiziert mit Allyloxycarbonyl (Alloc) -geschützten Lysine: eine für Anhänger, Integrin-bindenden Gruppen Zelladhäsion zu fördern [K (Alloc) GWGRGDS = Pep1Alloc] oder zwei für nicht abbaubare oder zell abbaubare Vernetzungen [K ( alloc) RGKGRKGK (alloc) G oder KK (alloc) GGPQGIWGQGK (alloc) K = Pep2Alloc jeweils]. Mit diesen Sequenzen wurden die Bedingungen für eine rasche Reaktion eingestellt (1-5 min) mit vierarmige thiol-modifizierten Poly (ethylenglycol) (PEG4SH) unter Verwendung cytocompatible Dosen von langwelligen UV - Licht (10 mW / cm 2 bei 365 nm) und der Photoinitiator Lithium-phenyl-2,4,6-trimethylbenzoylphosphinate (LAP). Die resultierenden Hydrogele waren stabil unter Zellkulturbedingungen für Wochen. Um Zellgetriebenen Abbau und Umbau, ein enzymatisch spaltbare Peptid innerhalb der Gel - Vernetzungen eingebaut wurde (dh GPQGIWGQ), 15 und Modell Primärzelle, humanen mesenchymalen Stammzellen (hMSCs) blieb hoch rentabel nach der Verkapselung ermöglichen und during Kultur innerhalb dieser Matrizen. Ferner wurden Peptide räumlich innerhalb dieser Materialien strukturiert und hMSCs lebensfähig bleiben und metabolisch aktiv unter Photopatterning Bedingungen. Alternate pendant Peptidsequenzen, hier nicht dargestellt (zB IKVAV, YIGSR, GFOGER, etc.), können ebenfalls in Matrices eingearbeitet werden , um weitere Zell - Wechselwirkungen mit der umgebenden Mikroumgebung zu sondieren. Diese Ergebnisse sind vielversprechend für die Anwendung dieser Hydrogel-basierten Materialien für die dreidimensionale (3D) Zellkultur und Lieferung zu studieren und direkten Zell-Matrix-Interaktionen für eine Vielzahl von Zelltypen.
Hierin Zellen Methoden photoencapsulate und anschließend photopattern biochemische Signale innerhalb des Hydrogels System vorgeschlagen werden dargestellt (Abbildung 1). Techniken zu beobachten und zu quantifizieren , werden diese photopatterns auch gezeigt: vor allem, i) die quantitative und qualitative Verwendung von Assay Ellman'schen die modifica zu bestimmention von freien Thiolen innerhalb gemusterten Substraten und ii) dem komplementären qualitative Verwendung fluoreszierender Peptide (AF488Pep1Alloc) , diese Muster in drei Dimensionen zu beobachten. Des weiteren Tests zur Rentabilität (Live / Dead Lebensfähigkeit / Zytotoxizität-Färbung) und die metabolische Aktivität bestimmen (MTS, 3- (4,5-Dimethylthiazol-2-yl) -5- (3-carboxymethoxyphenyl) -2- (4-sulfophenyl) -2H-Tetrazolium) vorgestellt, so dass Benutzer die cytocompatibility von photoencapsulation und Photopatterning Bedingungen für verschiedene Zelllinien innerhalb Hydrogelmatrices bestimmen können. Während das Protokoll für eine facile lichtbasierten Photoclick Hydrogelsystem gezeigt wird, können die Techniken auf zahlreiche andere radikalisch initiierte Hydrogelsysteme für photoencapsulation und Photostrukturierungs in Gegenwart von Zellen angewendet werden.
Protokoll
1. Herstellung von Materialien für Hydrogelierung
- Synthesize Anhänger (Pep1Alloc, AF488Pep1Alloc) und Vernetzungs Peptide (Pep2Alloc) durch Standard - Festphasen - Peptidsynthese (SPPS) Techniken und Thiol-funktionalisierten Polymeren durch dreistufiges Verfahren für Endgruppenmodifizierung (PEG4SH). 14,16 Alternativ kaufen PEG4SH (M n ~ 20 kDa), Pep1Alloc und Pep2Alloc im Handel.
- Synthesize den Photoinitiator (LAP) durch die zweistufige Reaktion beschrieben. 14,17 Führen Syntheseschritte (1.2.1-1.2.11) in einer Abzugshaube und seien Sie vorsichtig beim Umgang mit Chemikalien (Schutzhandschuhe tragen, Kleidung und Brillen) . LAP können auch im Handel erworben werden.
- Trocknen Sie alle Glaswaren im Ofen (> 2 h, 80 ° C).
- Fügen Sie einen Rührstab in einen leeren Single-Hals-Rundkolben (100 ml) und Abdeckung mit einem Septum.
- Sichern Sie den Kolben auf einem Magnetrührstab Heizplatte mit einem Ringständer und Klemme.
- ichnsert eine Nadel (18 G) durch das Septum und verlassen das äußere Ende zur Atmosphäre hin offen. Legen Sie eine zweite Nadel in einer inerten Gasleitung befestigt ist. Öffnen Sie die Inertgas Leitung (zB Argon oder Stickstoff) und spülen Kolben für 10-15 min.
HINWEIS: Das System wird kontinuierlich mit Inertgas, Argon oder Stickstoff gespült, während der Reaktion. - Transfer 1,5 g (~ 1,4 ml) dimethyl phenylphosphonit (Vorsicht) in den Kolben einer Spritze mit Nadel durch das Septum zu durchstechen. Schalten Sie die Rührplatte (mittlere Geschwindigkeit) und achten Sie darauf, dass der Inhalt spritzen nicht auf die Seiten des Kolbens.
- Hinzufügen, 1,6 g (~ 1,46 ml) 2,4,6-trimethylbenzoyl Chlorid (Vorsicht) tropfenweise zu dem Kolben, der dimethyl phenylphosphonit, eine Spritze mit einer Nadel, das Septum zu durchstechen.
- Decken Sie das Reaktionsgefäß mit einer Folie vor Licht zu schützen und rühre 18 Stunden unter Argon oder Stickstoff.
- Am nächsten Tag zu erhöhen, die Höhe des Kolbens am Rührer ein Ölbad zu platzieren, einnb vorsichtig den Kolben in das Ölbad senken. Erhitzen Sie das Bad und den Kolben auf 50 ° C während magnetisches Rühren gehalten wurde.
- Man löst 3,05 g Lithiumbromid in 50 ml 2-Butanon. Heben Sie den Kolben aus dem Ölbad und fügen Sie die Lithium-Bromid-Lösung in den Rundkolben, der kurz das Septum Entfernung in den Kolben zu gießen.
- Der Kolben wird wieder mit dem Septum (ACHTUNG: Septum wird immer noch eine Nadel haben, die zu den Argonlinien und einer Nadel zu entlüften), senken Sie den Kolben zurück in erhitztes Ölbad, und lassen Sie die Reaktion für 10 Minuten, um fortzufahren. Ein fester Niederschlag bilden.
- Nach 10 Minuten, schalten Sie den Kolben aus Hitze Argon, zu entfernen, und lassen Sie die Mischung für 4 Stunden (abgedeckt mit einer Folie zum Ausruhen vor Licht zu schützen als ein lichtempfindlicher Initiator hergestellt worden ist. Entlüftungs Nadel aufbewahren.
- Gießen Produkt in einen Glasfrittentrichter oder Trichter mit geeigneten Filterpapier ausgekleidet. Rinse Filtrat 3 mal mit je 50 ml 2-Butanon zu reMove nicht umgesetztem Lithiumbromid.
- Dry (zuerst auf Benchtop und dann im Vakuum Exsikkator) und analysieren Produkt durch 1 H - NMR in D 2 O. Charakteristischen Peaks bei 1,8-1,9 (6H, s), 2.1-2.2 (3H, s), 6,7-6,8 (2H, s), 7,3-7,4 (2H, m), 7,4-7,5 (1H, m) und 7,5 -7.7 (2H, m). 14,17
- Verwenden Sie eine Tabelle das Volumen und die Konzentration jeder Stammlösung (PEG4SH, Pep1Alloc, Pep2Alloc, LAP) zu berechnen , die vorbereitet werden müssen , um Hydrogele zu machen (Tabelle 1). Um nicht strukturierten Gele, sicherzustellen, dass [SH] = [Alloc], so dass alle reaktiven Gruppen während der Polymerisation verbraucht werden. Wenn Photostrukturierungs von Gelen geplant ist, umfassen eine überschüssige Menge an Thiol - funktionelle Gruppen während der Gelbildung bezogen auf Stöchiometrie (zB 0,2-5 mM, [SH]> [Alloc]) für die spätere Umsetzung mit Pep1Alloc.
HINWEIS: Die Gele sollte größer als 5 Gewichtsprozent enthalten (wt%) PEG4SH schnelle Polymerisation, um sicherzustellen, (innerhalb von 5 min). Jedoch niedriger Gew% -Bereichs kann geprüft werden , ob die Anwendung für Hydrogele mit niedrigeren Moduli nennt (zB <0,5 kPa); Polymerisation sollte entsprechend für diese niedrigen wt% Zusammensetzungen geprüft und eingestellt werden. In ähnlicher Weise kann Pep1Alloc Konzentration für verschiedene Anwendungen eingestellt werden (beispielsweise 0,2-5 mM) wie für Thiol-funktionalisierte Peptide in der Literatur berichtet. 18-21 LAP Konzentration um 0,067 wt% empfohlen wird (2,2 mm) oder weniger, wie beschrieben, als höhere Konzentrationen können die Lebensfähigkeit der Zellen zu verringern. - Stocklösungen von Pep1Alloc, Pep2Alloc, PEG4SH und LAP unter sterilen Bedingungen für die Zellkultur , die auf Berechnungen in der Tabelle 1.
- Für Pep1Alloc und Pep2Alloc, individuell die Gesamtmasse der Pep1Alloc und Pep2Alloc aus der Peptidsynthese wiegen und in steriler Phosphat gepufferter Kochsalzlösung (PBS) mit 1% Penicillin / Streptomycin (PS) und 0,5 & mgr; g / ml Fungizon (FZ) aufzulösen. Typische Konzentrationen von vorbereiteten Stammlösungen Bereich20-100 mg / ml des Peptids. Mischen Sie diese Bestände zu erzielen Gele mit abschließender moduli relevant für Weichteilanwendungen (E-Modul ~ 0,5-5 kPa). 22,23 aliquotieren und bei -20 ° C bis zur Verwendung.
- Für PEG4SH, wiegen PEG4SH in ein steriles Mikrozentrifugenröhrchen und lösen sich in PBS + PS + FZ. Typische Konzentrationen dieser Stammlösung Bereich von 250 bis 430 mg / ml (20-30% PEG4SH nach Gewicht).
- Für LAP, LAP in ein steriles Mikrozentrifugenröhrchen wiegen und in PBS + PS + FZ zu einer Endkonzentration von 7,5 mg / ml auflösen.
HINWEIS: Die Vorbereitung frische Lösungen von PEG4SH und LAP für jede Verkapselung oder Gel Experiment empfohlen konsistente Polymerisationszeiten zu gewährleisten.
- Bereiten Sie Sterile Spritzenspitze Formen für Hydrogele bilden.
- Schneiden Sie vorsichtig die Spitzen weg von 1 ml Spritzen mit einer Rasierklinge und anschließend die Kolben aus der Spritze Wellen entfernen.
- Unterzutauchen der Spritzen Wellen und Kolben in 70% Ethanol für 15 min eind in einem sterilen Zellkultur Haube zum Trocknen (30 min). Wenn überschüssige Tropfen Ethanol innerhalb Spritze Welle bleiben, verwenden Sie den Kolben, sie drücken aus.
- Bereiten Sie sterile Glas Slide Formen für Hydrogele bilden.
- Soak Glasobjektträger (ein Vielfaches von 2) und Gummidichtungen (0,254 mm dick, 2 kleine Stücke als Beilagen verwendet, gestanzt ein Rechteck mit Scheiben aus, oder quadratische Rahmenform) in 70% Ethanol für 15 Minuten, und in sterile Zellkultur Haube trocknen.
- Coat Hälfte der sterilisierten Objektträger mit Anti-Haftbeschichtung gemäß Hersteller Richtungen Haftung der Oberseite des Gels auf der Gleitfläche zu verhindern (beispielsweise , wenn es 4 gleitet sind, 2 Folien werden beschichtet mit anti-Klebstoff). Diese dienen als die Oberseite des Glasschiebeform.
- Kalibrieren Sie die Lampe für Spritze oder Objektträger aus Glas Formen.
HINWEIS: Bei diesen Experimenten wurde eine Quecksilber-Bogenlampe mit einem externen Filteradapteranordnung und 365 nm Außenfilter verwendet wurde. Andere Lampes , die entsprechenden Intensitäten der langwelligen UV - Licht erzeugen kann verwendet werden , wie von anderen berichtet. 24-27- Bringen Sie eine Kollimationslinse zum Ende des flüssigkeitsgefüllten Lichtleiter relativ gleichmäßige Lichtintensität in allen Proben zu gewährleisten. Bei Bedarf stellen Sie den Abstand des Lichtleiters von der Probe (n) eine Punktgröße zu erreichen, die Proben von Interesse abdecken wird.
- Legen Sie eine Schnittspritzenform in einer Mikrorohrhalter (Spritzenform in vertikaler Position halten). Halten Sie die Radiometers auf der Höhe der Spritzenspitze , wo die Proben gehalten werden und stellen Verschluss (% offen) eine Lichtintensität von 10 mW / cm 2 bei 365 nm zu erreichen. Notieren Sie sich die geänderten Einstellungen für die spätere Verwendung.
- Ein Glasschiebeform auf die Oberseite einer sterilen Oberfläche (zB die Spitze eines Pipettenspitze Kastens innerhalb eines Biosicherheitsschrank). Halten Sie den Radiometers Detektor auf der Höhe des Glasschiebeform und stellen Sie Blende (% offen) mit einer Lichtintensität von 10 zu erreichen, mW / cm 2 bei 365 nm. Notieren Sie sich die geänderten Einstellungen für die spätere Verwendung.
2. Hydrogelierung und Photopatterning
- Herstellung von nicht-gemusterten Hydrogelen.
HINWEIS: An diesem Punkt in dem Protokoll, wenn Hydrogele in Zellkulturanwendungen verwendet werden sollen, sollten alle nachfolgenden Schritte unter sterilen Bedingungen in einem sterilen Gehäuse oder Haube durchgeführt werden.- Mischen Sie Stammlösungen von PEG4SH, Pep2Alloc, Pep1Alloc, LAP und PBS + PS + FZ entsprechend der Tabellenkalkulation (siehe Tabelle 1 Beispiel). Pipette, um die resultierenden Gelvorläufers Lösung kräftig selbst, um sicherzustellen, der Lösung zu mischen.
- Bereiten Sie dicke Hydrogele in Spritzenspitzen geformt durch Pipettieren 10-20 ul der Gel-Precursor-Lösung (PEG / Pep / LAP / PBS) in die Spitze einer sterilen, schneiden Spritze. Machen Sie eine einzelne Gel pro Spritze, etwa 0,5 bis 1,5 mm dick auf das Volumen und die Spritze Durchmesser.
Hinweis: Größere Mengen untersucht werden können, basierend aufdie gewünschte Gelgröße wo obere Grenzwerte für Diffusionsbeschränkungen für Pep1Alloc existieren basieren kann während Photostrukturierung und / oder Nährstoffe / Abfälle zu / von eingekapselten Zellen während der Zellkultur. - Bereiten dünnen Hydrogele in Glasobjektträger Formen durch die Gummidichtung Plazieren (0,254 mm dick), um die Ränder der unbeschichteten Glasträger. Pipette 5-10 ul Gel-Vorläuferlösung auf die nicht-beschichteten Glasobjektträger und legen Sie den Objektträger aus Glas, beschichtet mit antiadhäsiven (einzelne oder mehrere 5-10 ul Gele können durch Pipettieren einen oder mehrere Punkte aus Lösung auf eine einzelne Folie hergestellt werden) auf der Oberseite der Gellösung (größere Gele, bis zu der Größe des Glasobjektträger, kann in Abhängigkeit von der Endanwendung getroffen werden). Sichern Sie sich die Objektträger aus Glas mit kleinen Binder Clips zu stabilisieren.
- Platz Formen unter der Lampe und stellen Sie die Lampenintensität (zB% Verschluss geöffnet) zu erreichen , 10 mW / cm 2 an der Geloberfläche für Spritzenspitze Formen oder Glasträger Formen auf Basis von Messungen in Schritt 1.7.2 und1.7.3 sind.
- Anwenden Licht für 1 bis 5 min eine vollständige Polymerisation von Gelen zu ermöglichen. Verwenden Sie eine kürzere Polymerisationszeit für Gele mit höheren PEG4SH Gehalt (8 Gew% oder mehr beträgt, 1 min) und mehr für Gele mit niedriger PEG4SH Gehalt (5-8 Gew%, 3-5 min) zur Erzeugung vollständig polymerisiert Hydrogele mit Moduli innerhalb der Bereich der Weichgewebe (0,5-5 kPa).
- Ort Gele aus Spritzenspitze Formen in eine sterile nicht-behandelten 48-Well-Platte und Ort Glasobjektträger in eine sterile Schüssel.
- Spülen 3 x 15 min mit Zellkulturmedium oder einem geeigneten Puffer (zB PBS + PS + FZ, Ellman-Reaktionspuffer) , basierend auf geplanten Experimenten, wie im Folgenden beschrieben.
- Herstellung von Patterned Hydrogele.
- Mischen Sie Stammlösungen von PEG4SH, Pep2Alloc, LAP und PBS + PS + FZ entsprechend der Tabellenkalkulation, so dass freie Thiole (0,2-5 mM) für die spätere Umsetzung mit Pep1Alloc. Pipette, um die Vorläuferlösung kräftig selbst, um sicherzustellen, der Lösung zu mischen.
- Bereiten Sie dick und dünn Hydrogele wie in den Schritten 2.1.2 bis 2.1.6 angelegt.
HINWEIS: Stellen Sie keine Gele in einem Wachstumsmedium vor der Photostrukturierung. Freie Thiole können durch Spezies in dem Wachstumsmedium (zB Disulfidbildung mit Thiol-haltigen Proteinen) und wird nicht zulassen , Strukturieren des Gels , ohne zusätzliche Verarbeitungsschritte (zB Reduktion von Disulfidbindungen) verbraucht werden. - Bereiten Sie Lösungen von Pep1Alloc (Endkonzentration ~ 3-20 mg / ml) und 2,2 mM LAP.
- Abdecken vorgeformte Gele mit Pep1Alloc / LAP-Lösung und Inkubation für 1 Stunde bei 37 ° C.
- Überschüssiges Pep1Alloc / LAP Lösung. Wenn Gele in einer Spritzenspitze geformt wurden, mit einem Spachtel vorsichtig die Gele aus der 48-Well-Platte übertragen, in der sie in ein steriles Glasträger zur Strukturierung werden inkubiert werden.
- Legen Sie eine Fotomaske mit dem gewünschten Muster direkt auf der Spritzen- und Objektträger aus Glas geformten Gele. Stellen Sie sicher, dass die gedruckte Teil der Maske das Gel berührt für eine optimale pattern Treue (dh sollte Maske richtig gelesen und Emulsionsseite sein nach unten). Platz Proben unter der Lampe und bestrahlen für 1 min mit den Lampeneinstellungen verwendet für Glasobjektträger (Schritt 1.7.3).
- Nach Strukturierung Ort Gele in eine sterile, 48-Well nicht Gewebekultur behandelten Platte und Ort Glas Gele-Spritze geformt Einschub geformt, die auf die Glasobjektträger in eine sterile Schale eingehalten werden.
- Spülen 3 x 15 min mit Zellkulturmedium oder einem geeigneten Puffer (zB PBS + PS + FZ, Ellman-Reaktionspuffer) , basierend auf geplanten Experimenten.
3. Visualisieren und Quantifizierung von Photopatterning
- Ellman-Assay zum Nachweisen und Quantifizieren freie Thiole in photostrukturiert Hydrogelen.
- Bereiten Ellman-Reaktionspuffer, Cystein Arbeitslösung, Standards und Ellman-Reagens wie nachstehend beschrieben.
- Für Ellman-Reaktionspuffer, lösen sich 2,4 g Natriumhydrogenphosphat (Na 2 HPO4) und 74,4 mg Ethylendiamintetraessigsäure (EDTA) in 200 ml DIH 2 O (0,1 M Na 2 HPO 4, 1 mM EDTA). Den pH - Wert auf 7,5-8 mit Lösungen von Natriumhydroxid (NaOH) oder Phosphorsäure (H 3 PO 4).
- Für Cysteine Arbeitslösung lösen sich 5,27 mg Cystein in 15 ml Reaktionspuffer (2 mM Cystein).
- Für Cysteine Standards, Cystein Arbeitslösung in Reaktionspuffer auf eine Endkonzentration von 2, 1,5, 1,25, 1, 0,75, 0,5, 0,25 und 0 mM Cystein verdünnen.
- Für Ellman-Reagenz lösen 4 mg Ellman-Reagens in 1 ml Reaktionspuffer. Beschallen vollständig das Reagenz des Ellman aufzulösen.
- Quantifizierung der Konzentration von freien Thiolen in Gelen mit Ellman-Assay (Abbildung 2).
HINWEIS: 'Thin' 5 ul Hydrogele, zwischen Glasplättchen geformt, sind in der unten beschriebenen Verfahren und empfahl eine schnelle Diffusion von Ellman-Reagenz t zu ermöglichenurch das Gel (dh benötigt das Reagenz eine längere Zeit durch dicke Gele zu diffundieren).- Bestimmen die gequollenen Gelvolumen "dünn" 5 ul Gelen (V S) auf der Grundlage der volumetrischen Quellverhältnis, Q.
- Machen Sie drei 20 ul 'dick' Gele mit Spritze Formen. Platz Gele in Ellman-Reaktionspuffer für 24 Stunden und anschließend wiegen (Gleichgewicht gequollenen Masse, M S). Lyophilisieren die Gele und anschließend wiegen (Trockenmasse, M D).
- Unter Verwendung der gemessenen Massen für dicke Gele, die Berechnung der Volumenquellverhältnis von 28 Q = 1 + ρ Polymer / ρ Lösungsmittel (M S / M D -1) wobei ρ Polymer = 1,07 g / cm 3 für PEG, 29 ρ Lösungsmittel = 1,0 g / cm 3 für PBS / H 2 O.
- Berechnen Sie die theoretische Trockenmasse des Gels für Ellman-Assay verwendet werden (hier: 5 ul "dünn" Gele sind in der Regel uSED), durch die Massen der einzelnen Komponenten summiert PEG4SH, Pep1Alloc und Pep2Alloc (M D = M PEG4SH + M + M Pep1Alloc Pep2Alloc). Beispielsweise ein 5 & mgr; l Gel 10 Gew% enthält PEG4SH enthält etwa 0,000535 g PEG , wie durch M PEG4SH berechnet = 0,005 cm 3 x 1,07 g / cm 3 x 0,10. Pep1Alloc und Pep2Alloc Massen können in ähnlicher Weise berechnet werden , basierend auf Gewichts-% in Lösung (siehe die Tabelle für Werte), p ≈ 1,0 g / cm 3 für diesen wäßrigen Lösungen übernehmen.
HINWEIS: Die Gele auch getrocknet und stattdessen gewogen werden, um die theoretischen Trockenmasse zu berechnen. Es kann jedoch konsequent die Trockenmasse der dünnen, 5 ul Gele messen schwierig sein, zu. - Basierend auf der vorhergesagten Trockenmasse und dem Wert Q bestimmt von 'dick' Gele, die Berechnung der vorhergesagten geschwollene Masse M S für die "dünne" Gel (Gleichung in Schritt 3.1.2.1.1). Es sei angenommen, daß ρ ≈ 1,0 g / cm 3 ist , dann V S ≈ M S. Verwenden Sie diese berechnet V S quantitative Ellman-Test durchzuführen.
HINWEIS: Das obige Verfahren wird empfohlen, V s für geschwollene Gele als "dünn" 5 ul Gele sind schwierig zu übertragen zum Wiegen bestimmen.
- Bilden dünne Hydrogele zur Strukturierung, wie in Abschnitt 2.2 (5 ul Volumen) beschrieben. Insbesondere machen Gele mit einem Überschuss an freien Thiolen und "Muster" die Hälfte dieser Proben mit Pep1Alloc einen klaren Deck das gesamte Gel mit Licht (zB 6 insgesamt Gele mit einem Überschuss an Thiol zu überfluten mit aussetzen: 3 unmodifizierten nicht'patterned 'und 3' gemustert').
HINWEIS: Für diesen Test "gemustert" Gele Flut ohne eine Photomaske Licht ausgesetzt sind. Diese Methode wird verwendet, um die Gesamtzahl der freien Thiole in der gesamten Gelprobe verbraucht zu bestimmen und zu zeigen, wie wirksam freie Thiole können mit dem Peptid modifiziert werden. Aus diesen Informationendie Anzahl der freien Thiole während der Strukturierung mit einem Photomaske verbraucht kann basierend auf der Geldicke und Musterbereich (Bereiche belichtet) vorhergesagt werden. - Place 'gemustert' und nicht-'patterned 'Gelen in Vertiefungen einer 48-Well-Platte und Spülen 3 x 15 min mit Ellman-Reaktionspuffer Diffusion von nicht umgesetzten Spezies zu ermöglichen, aus dem Gel und Quellgleichgewicht auftreten.
- Fügen Sie zusätzliche Ellman-Reaktionspuffer zu den gespülten Gele , so dass V s mit Reaktionspuffer ein Vielfaches von 20 & mgr; l ist. Wenn beispielsweise die vorhergesagte V S 15 & mgr; l ist, werden 5 & mgr; l Reaktionspuffer (20 ul), und wenn die vorhergesagte V S 30 & mgr; l, mit 10 & mgr; l Reaktionspuffer (40 ul).
- Pipettieren die Cystein - Standards in einzelne Vertiefungen (nicht haltigen Gelen) einer 96-Well - Platte in Vielfachen von 20 & mgr; l in Abhängigkeit von dem Volumen in dem vorhergehenden Schritt verwendet wird (dh wenn der vorherige Schritt hatte V S + extra Reaktions bUffer = 40 & mgr; l, dann werden 40 ul jeder Standard auf einzelne leere Brunnen).
- Verdünnen Ellman-Reagenz in Reaktionspuffer ( ein Vielfaches von 180 & mgr; l Reaktionspuffer + 3,6 ul Ellman-Reagenz, zB 183,6 für 20 & mgr; l oder 367,2 ul für 40 & mgr; l in Schritt 3.1.2.5).
- In verdünnter Ellman-Reagenz in Vertiefungen, die Standards und Proben. Für 20-ul-Proben, fügen Sie zu jeder Vertiefung 183,6 ul-Lösung. Doppel diese Menge an verdünntem Reagenz des Ellman für 40 & mgr; l-Proben (oder maßstäblich auf die Größe der Probe entsprechend basiert).
- Inkubieren oder legen Sie auf einem Schüttler für 1 Stunde und 30 min (bei Raumtemperatur) oder bis die Farbe der Lösung die Farbe der Gele durch visuelle Inspektion übereinstimmt ausreichende Diffusion des gelben 2-Nitro-5-Thiobenzoat Dianion (TNB, um sicherzustellen, 2-), die bei der Reaktion von Ellman-Reagenz mit freien Thiolen, aus dem Gel erzeugt wird.
- Nehmen Sie 100 ul Lösung von Proben und standards aufnehmen und in Vertiefungen einer 96-Well-Platte.
- Lesen Sie die Absorption bei 405 nm auf einem Plattenleser.
- Um die Daten, zeichnen Sie die Standardkurve (Proben aus Schritt 3.1.1.3) (Absorption gegen Konzentration) und passen eine lineare Funktion verarbeiten. Mit Hilfe der linearen Funktion, um die Konzentration von freien Thiolen in der "verdünnt Gel-Lösung (Gel + Reaktionspuffer) kann basierend auf Absorptionswerte berechnet werden. Schließlich unter Berücksichtigung der "Verwässerung" mit Reaktionspuffer, bestimmen die freie Thiol-Konzentration in den Gelen ohne Reaktionspuffer. (Beispielsweise , wenn 15 ul Gel mit 5 & mgr; l Reaktionspuffer verdünnt, multipliziere mit 20/15).
- Bestimmen die gequollenen Gelvolumen "dünn" 5 ul Gelen (V S) auf der Grundlage der volumetrischen Quellverhältnis, Q.
- Visualisierung von photopatterns mit Ellman-Reagens (3A).
- Soak dünne Hydrogele gemustert mit Pep1Alloc in Ellman-Reaktionspuffer für 1 Stunde.
- Entfernen Puffer überschüssige Reaktion vorsichtig mit einem Tuch um die Ränder des Hydrogels abwischen.
- Pipette Ellman-Reagenz direkt auf der Oberfläche des Gels. Unmittelbar Bild auf einem Lichtmikroskop mit 10facher oder Stereomikroskop mit einer Farbkamera.
Hinweis: Die Gele müssen sofort abgebildet werden , da Visualisierungsmuster innerhalb von 5 Minuten , wie das gelbe TNB 2- Ion durch Spaltung von Ellman-Reagenz bei der Reaktion mit Thiolen in nicht strukturierten Gebiet erzeugt zerstreuen diffundiert im gesamten Gel. Nicht strukturierte Bereiche erscheinen schwach gelb mit dem bloßen Auge; für eine bessere Auflösung und kleinere Muster, Vergrößerung (beispielsweise Verwendung eines Mikroskops) erforderlich.
- Bereiten Ellman-Reaktionspuffer, Cystein Arbeitslösung, Standards und Ellman-Reagens wie nachstehend beschrieben.
- Visualisierung von Photopatterns mit fluoreszierenden Peptide (3B).
- Für Muster mit höherer Auflösung oder in drei Dimensionen zu visualisieren, photopattern eine AF488 modifizierten Pep1Alloc (oder ähnliches fluoreszierendes Peptid) zu den Gelen in Schritt 2.2.
- Bild auf einem Fluoreszenzmikroskop. Ein konfokales Mikroskop kann hier verwendet werden, z-st zu nehmenack Bilder des Gels, so dass das Muster in der x- beobachtet werden kann, y- und z-Ebenen.
HINWEIS: Bei Fluoreszenz, Gelen muß vor Licht geschützt werden, um die Stabilität des AF488 Fluorophor und maximale Fluoreszenz zu gewährleisten. Gele müssen nicht sofort abgebildet werden, da das fluoreszierende Peptid ziemlich stabil, wenn von Licht (Speicher in einem Behälter in Folie bei 4 ° C verpackt) geschützt.
4. Zellverkapselung in Hydrogele und Photopatterning
- Das Sammeln und Vorbereiten Zellen für die Verkapselung.
- Nach Standard sterilen Kulturverfahren Säugerzelle, trypsinize und Zellen von Interesse von den Platten zu sammeln. Um das Trypsin mit Wachstumsmedium Quench nach der Ablösung auftritt (zB für einen T-75 - Kolben, 5 ml Trypsin, mit 5 ml Medium auslöschen spülen Platte mit 5 ml Medium für insgesamt 15 ml).
HINWEIS: Trypsinisierung Zeiten zwischen Zelltypen variieren kann, aber typischerweise zwischen 5 und 15 min auftreten. Alternative Zelle detachment Mittel (zB Versene) verwendet werden , um Zellen zu sammeln , falls gewünscht. - Zählen von Zellen (ein Minimum von 100 oder per Protokoll des Herstellers) von Aliquots der Zellsuspension trypsinisiert unter Verwendung eines Hämozytometers oder anderen Zell Zählvorrichtung während Zentrifugieren der Massenzellsuspension (90-110 xg, 5 min). Re-suspendieren Zellpellet nach der Zentrifugation in einem minimalen Volumen von PBS oder Wachstumsmedium und NACHZÄHLUNG wenn die anfängliche trypsiniert Zellsuspension zu verdünnen.
- Re-suspendieren Zellen in einem minimalen Volumen von PBS und aliquote Teile für jedes Gel Zustand in Mikrozentrifugenröhrchen, so dass 5000 Zellen / & mgr; l, wenn es mit dem Gel-Lösung (vor der Polymerisation) gemischt wird.
HINWEIS: Typische Zell Aliquots enthalten 300.000-500.000 Zellen und sind ausreichend 60-100 ul Gel / Zellsuspension zu bilden, die 3-5 x 20 & mgr; l-Gelen mit 5.000 Zellen / & mgr; l verwendet werden können. Höhere oder niedrigere Zelldichten für die Verkapselung verwendet werden können, abhängig von der Menge an Zell-Zellvs. Zell-Matrix-Kontakt gewünscht sind, und sollte für jede Anwendung bestimmt werden. - Zentrifugenzelle / PBS Aliquots (90-110 xg, 5 min).
- Sorgfältig absaugen PBS aus Zellpellet in Mikrozentrifugenröhrchen direkt vor der Einkapselung.
HINWEIS: Wenn Zellen sind empfindlich gegenüber Scherkräften kann die zweite Zentrifugationsschritt durch Zählen (zB Hämozytometer) und anschließend Aliquotieren der Zellsuspension trypsinisiert (Trypsin + Medien + Zellen) in Abschnitte für jede Gelzustand benötigt beseitigt werden. Diese Aliquots werden einmal zentrifugiert (90-110 xg, 5 min) und das Trypsin + Medium wird abgesaugt, ein Zellpellet für die Verkapselung zu verlassen.
- Nach Standard sterilen Kulturverfahren Säugerzelle, trypsinize und Zellen von Interesse von den Platten zu sammeln. Um das Trypsin mit Wachstumsmedium Quench nach der Ablösung auftritt (zB für einen T-75 - Kolben, 5 ml Trypsin, mit 5 ml Medium auslöschen spülen Platte mit 5 ml Medium für insgesamt 15 ml).
- Einkapseln von Zellen in nicht strukturierten Hydrogele.
- Unmittelbar nach PBS Ansaugen suspendieren pelletierten Zellen in PEG4SH, Pep2Alloc, Pep1Alloc, LAP und PBS + PS + FZ, wie in der Tabelle auf eine Endkonzentration von 5000 Zellen / & mgr; l errechnet.
- Schimmel und polymerisieren Hydrogele als Beschribed in Schritten 2.1.2 bis 2.1.6.
HINWEIS: Wenn Zellen in Glasobjektformen Einkapseln darauf geachtet werden muss, wenn der obere Objektträger Nachpolymerisation Entfernen des Gels zu verhindern Scherung, die zum Zelltod führen kann. Um Hilfe bei der Entfernung des Gels aus der Form, Dia-Formen können in sterilem PBS oder Wachstumsmedium nach der Polymerisation gebracht werden, um die Dichtung und Hydrogel zu benetzen, wodurch es einfacher, um den Oberschlitten entfernen. Verfahren diese Scher gänzlich zu verhindern, ist die Verwendung von Spritzenformen. - Rinse Gele 3 x 10 min in einem Wachstumsmedium zu entfernen, nicht umgesetzten Spezies und überschüssiges LAP.
- Inkubieren Gelen in Wachstumsmedium bei 37 ° C und 5% CO 2 bis zum gewünschten Zeitpunkt für die weitere Analyse. Aufzufüllen Medium alle 48 h oder bestimmt für die Anwendung (beispielsweise typische Zuführungsintervall für spezifische Zelltyp und Medium).
- Einkapseln von Zellen und Photopatterning in Gegenwart von Zellen.
- Unmittelbar nach PBS AbsaugenSuspend pelletierten Zellen in PEG4SH, Pep2Alloc, LAP und PBS + PS + FZ, wie in der Tabelle auf eine Endkonzentration von 5000 Zellen / & mgr; l errechnet. Lassen eine angemessene Konzentration an freien Thiolen (zB 2 mm) für eine spätere Reaktion mit Pep1Alloc.
- Mold, polymerisieren, und das Muster Hydrogele wie in den Schritten 2.2.2 bis 2.2.8 beschrieben.
- Rinse Gelen 3 x 10 min in einem Wachstumsmedium nach dem Strukturieren nicht umgesetzten Spezies und überschüssigem LAP zu entfernen.
- Inkubieren Gelen in Wachstumsmedium bei 37 ° C und 5% CO 2 bis zum gewünschten Zeitpunkt für die weitere Analyse. Füllt Medium alle 48 Stunden oder so für die Anwendung bestimmt.
5. Die Ermittlung der Viability und die metabolische Aktivität von verkapselten Zellen
- Führen Sie Live / Dead Zytotoxizitätstest Encapsulated Cell Viability (4A) zu bestimmen.
- Entfernen Wachstumsmedium aus Gelen und spülen Sie 3 x 15 min mit PBS Diffusion von Medium zu ermöglichen, von gels.
- Thaw Live / Dead-Zytotoxizitätstest Lösungen (Ethidiumhomodimer-1 und Calcein AM).
- Hinzufügen 2 & mgr; l der 2 mM Ethidium Homodimer-1 und 0,5 & mgr; l der 4 mM Calcein AM Lösungen zu 1 ml sterilem PBS. Vortex vollständige Vermischung zu gewährleisten.
- In 300 ul Färbungslösung zu jeder Spritze Form Gel in 48-Well-Platten, oder genug, um die Oberfläche des Gels auf einem Glasobjektträger in einer sterilen Schale zu bedecken, und für 45 min inkubiert.
- Entfernen Sie überschüssige Färbelösung und spülen überschüssige Farbstoff aus den Gelen zu entfernen (3 x 15 min mit PBS).
- Bild auf einem konfokalen Mikroskop (z-Stapel-Bilder) oder auf einem Epi-Fluoreszenzmikroskop mit z-Stack-Fähigkeit bei 10X und 488/525 nm Ex / Em. Quantifizierung der Zahl der lebensfähigen Zellen durch den z-Stapel vorsteht und Zählen der Anzahl von lebenden (grün gesamten Zellkörper) und tote (rot Kerne) Zellen, die mit Bildbearbeitungssoftware.
- Führen Sie die metabolische Aktivität Assay Zellaktivität post-Verkapselung (Figu zu bestimmenre 4B).
- 24 Stunden vor, Futtermittel eingekapselten Zellen mit frischem Wachstumsmedium zu untersuchen.
HINWEIS: In mittleren bis ein paar zusätzliche Vertiefungen (enthaltend keine Gele oder Gele ohne Zellen) als Kontrolle (Hintergrund Lesungen). - Zu dem Zeitpunkt, von Interesse, tauen MTS Reagenzlösung.
HINWEIS: Um die metabolische Aktivität im Laufe der Zeit ist, ein Anfangszeitpunkt (12-24 Stunden nach der Verkapselung) als zum Vergleich zu späteren Zeitpunkten Referenz empfohlen, um zu bestimmen. - Hinzufügen MTS-Reagens in jede Vertiefung (20 & mgr; l pro 100 & mgr; l Wachstumsmedium).
- Inkubieren Proben für 1-4 Stunden bei 37 ° C und 5% CO 2, den Anweisungen des Herstellers.
HINWEIS: Die Inkubationszeiten ausreichend sein sollte, für Zellen MTS zu reduzieren und aus dem Gel Diffusion des Formazan-Produkt ermöglichen. Folglich dickere Gele wie Spritzenspitze Gele können längere Inkubationszeiten (ca. 4 h) benötigen für eine ausreichende MTS Reduktion und Diffusion. - Je 100 & mgr; l reduziert MTS / Mediumin saubere Vertiefungen einer 96-Well-Platte und Aufzeichnung der Absorption bei 490 nm auf einem Plattenleser.
- Ziehen Sie die Hintergrundabsorption für Vertiefungen ohne Zellen, die aus Probenabsorptionswerte mit Baseline-Absorptionswerte zu erzeugen.
- 24 Stunden vor, Futtermittel eingekapselten Zellen mit frischem Wachstumsmedium zu untersuchen.
Ergebnisse
Die Einrichtung und Verfahren photoencapsulate Zellen und anschließend photopattern Gelen eingekapselten Zellen enthält , die in Abbildung 1 dargestellt ist, und ein Beispiel für die Stammlösungen Herstellung einer 10 Gew% Gel zu bilden , in Tabelle 1 bereitgestellt. Unter Verwendung der Tabelle 1, die Menge an Monomeren (PEG4SH , Pep2Alloc, ± Pep1Alloc) und Photoinitiator (LAP) erforderlichen Hydrogele polymerisiert wird berechnet. Auf der Grundlage dieser Berechnungen wurden Stammlösungen von PEG4SH, Pep1Alloc, Pep2Alloc und LAP hergestellt und gemischt mit und ohne Pep1Alloc zur Bildung und Photopatterning Gele, bzw. (1A). Anschließend werden die Zellen von den Platten, gezählt und zentrifugiert , in geeigneten Mengen für die Verkapselung (1B) gesammelt. Das Zellpellet wird in gelbildende Lösung (Peptid / Polymer / LAP in PBS), und die Zelle / Monomer-Mischungen werden auf Glas oder Spritze mol übertragen resuspendiertds. Die Zellen werden innerhalb des Hydrogels bei Anwendung von Licht (1-5 Minuten von 10 mW / cm 2 bei 365 nm) (1C) eingekapselt. Für Photostrukturierungs (1D) werden Gele mit Pep1Alloc und LAP für 30 min bis 1 h und 30 min, wodurch die Diffusion des Peptids und Initiator in die polymerisierte Matrix getränkt. Diese Peptid-beladenen Gele werden mit Photomasken mit gewünschten Mustern bedeckt und auf eine zweite Dosis von Licht ausgesetzt (1 min), die die Peptide auf freie Thiole in der Matrix zu konjugieren. Anhänger Anbindehaltung sind nur kovalent in Regionen an das Gel gebunden Licht ausgesetzt, entsprechende Zell-Matrix - Interaktionen zu erleichtern und imitiert wichtigsten mechanischen und biochemischen Eigenschaften der nativen Zelle Mikroumgebung in Richtung Zellfunktion und Schicksal in - vitro - Untersuchung.
Ellman-Test bietet eine einfache und kostengünstige Methode Gel Modifikation und Peptid Einarbeitung innerhalb von photopatte zu quantifizierenrned Substrate. Gemusterte und nicht strukturierte Gele (dh Gele mit oder ohne Peptid - Modifikation) werden in Ellman-Reaktionspuffer nach der Polymerisation durchtränkt. Als nächstes Cystein - Standards , und die in Puffer getränkte Gele werden in 48-Well - Platten gegeben und mit Ellman-Reagens (2A, links) inkubiert. Nach 1 Stunde und 30 Minuten wurden Aliquots von Proben werden in einzelnen Vertiefungen einer Platte mit 96 Vertiefungen gegeben, und die Extinktion wird bei 405 nm aufgezeichnet. Eine Kalibrierungskurve (2A, rechts) von den Cystein - Standards aufgetragen (Absorption vs Konzentration, linear fit), und die Menge der freien Thiole in Gele können auf der Grundlage ihrer Verdünnungsfaktor bestimmt werden. Diese freien Thiol - Konzentrationen für verschiedene Polymerisation und Photostrukturierungs Bedingungen einer 10 Gew% igen Gels sind in 2B gezeigt. Gele polymerisiert 1 oder 5 min ohne Pep1Alloc (blaue Balken, I = 1 min und II = 5 min) haben statistisch ähnlich frei Thiolkonzentrationen, was darauf hinweist tHut eine schnelle Reaktion auftritt und Gelieren ist innerhalb von 1 min (two-tailed t-Test, p> 0,05). Somit zusätzliche Belichtung (2-5 Minuten) nicht zu einer weiteren Umwandlung von funktionellen Gruppen. Gele polymerisiert für 1 min ohne Pep1Alloc wurden mit Pep1Alloc (3 mg / ml) und LAP (2,2 mM) für 30 und 90 min (grüne Balken, II = 30 min und IV = 90 min) und ausgesetzt auf eine zweite Dosis von Licht durchtränkt für 1 min. Die Abnahme der freien Thiole (60-80% in Bezug auf die 1 min Zustand) zeigt effiziente Modifizierung von Gelen mit anhänge cues unter diesen Bedingungen. Wenn höhere Änderung gewünscht wird, erhöhte Konzentrationen von Pep1Alloc Lösung kann in die Zugänglichkeit von Pep1Alloc zu freien Thiolen verwendet werden stärker verdünnten Peptidlösungen Umwandlung begrenzen können; So haben wir, dass Konzentrationen von bis zu 20 mg / ml Pep1Alloc produzieren> 90% Umwandlung von freien Thiolen gefunden.
Einzigartig ist, können Muster von Peptiden an das Hydrogel hinzugefügtwerden schnell mit Ellman-Reagenz (3A, unter 5 min) abgebildet. Jedoch Visualisierung des Musters wird im Laufe der Zeit verloren (größer als 5 min) durch Diffusion des gelben TNB 2- Dianion durch das Gel. Zur Abbildungsauflösung und beobachten Muster in drei Dimensionen (x-, y-, und z-Ebenen) und in Gegenwart von Zellen, fluoreszierenden Peptidaddition (AF488Pep1Alloc) verbessern, können verwendet werden. In 3B x-, y- und z sind-Projektionen von Bildstapeln mit einem konfokalen Mikroskop aufgenommen gezeigt, was zeigt Musterauflösung (& mgr; m - Skala).
Ungefähr (94 ± 2)% und (94 ± 1)% der hMSCs innerhalb abbaubare Gele eingekapselt (Pep2Alloc = GPQG ↓ WGQ) lebensfähig bleiben (grüne Zellkörper) 1 und 6 Tage nach der Verkapselung jeweils mit wenigen toten Zellen (rot Kerne ) beobachtet (4A). Ferner wird bei 6 Tage nach der Einkapselung beobachtet hMSC Spreizung ( rong> 4A, Einschub), was darauf hinweist , dass die Zellen mit Integrin-bindenden RGDS modifiziert mit diesen MMP-abbaubaren Matrizen umzubauen und zu interagieren. Metabolischer Aktivitätstests an Zellen in nicht abbaubaren Gelen gekapselt ausgeführt (Pep2Alloc = RGKGRK) 1 und 3 Tage nach der Einkapselung (4B) ein zweites Maß für die Lebensfähigkeit der Zellen liefern und zeigen , dass Zellen aktiv bleiben für die verschiedenen photoencapsulation und Photostrukturierungs Bedingungen getestet mit Ellman-Test (2B). Insbesondere gibt es keinen signifikanten Unterschied in der metabolischen Aktivität zwischen 30 min und 90 min Inkubationen mit Pep1Alloc + LAP (Bedingungen III und IV) und die anfängliche Verkapselung (Bedingungen I und II), was darauf hinweist, dass das Verfahren für den Einsatz von Photostrukturierungs geeignet ist, in das Vorhandensein von verkapselten Zellen (t-Test, p> 0,05 two-tailed).
2fig1.jpg "/>
Abb . 1: Einrichtung für Zellen innerhalb von Hydrogelen und anschließend Photopatterning mit biochemischen Cue (A) Stammlösungen von Makromeren und Photoinitiator hergestellt und gemischt (PEG4SH = Rückgrat, Pep2Alloc = vernetzen, Pep1Alloc = Anhänger Kleberest (RGDS) einzuschliessen LAP = Photoinitiator ). (B) Die Zellen werden für die Verkapselung gesammelt. (C) Die Zellen werden mit Makromer Lösungen gemischt , ohne oder mit Integrin-bindenden Peptide (PEG4SH / Pep2Alloc / LAP oder PEG4SH / Pep2Alloc / Pep1Alloc / LAP bezeichnet) und sind bei der Einwirkung von Licht verkapselt. (D) Die Gele überschüssigen Thiolgruppen während der Gelbildung enthält (hier PEG4SH / Pep2Alloc / LAP, gebildet mit 2 mM überschüssigem Thiol) mit einer einzigen Alloc - Gruppe (Pep1Alloc beispiels funktionalisierten mit biochemischer Signale durch die anschließende Zugabe von Peptiden strukturiert werden, RGDS, IKVAV, etc.) Zelladhäsion zu förderninnerhalb spezifischer Regionen des Gels. Hier Strukturierung von Gelen mit fluoreszenzmarkierten RGDS angezeigt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
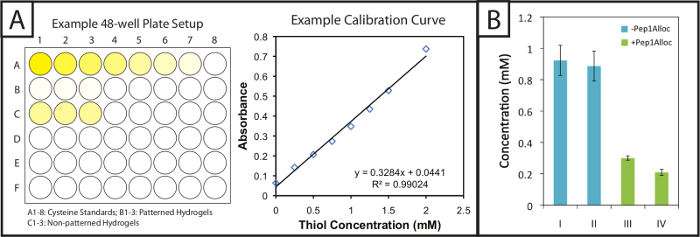
Fig . 2: Quantitative Ellman-Assay - Einrichtung und Ergebnisse Modifikation von gemusterten Hydrogele zu bewerten (A) Gele und Cystein Standards werden in 48-Well - Platten mit Ellman-Reagenz inkubiert. Eine lineare Standardkurve aufgetragen Cysteinkonzentration in Gel-Proben zu bestimmen. (B) überschüssige freie Thiole werden innerhalb Hydrogele während der Gelbildung inkorporiert und verbraucht bei der Musterbildung mit einem Anhänger alloc-Peptid (I = 1 min Polymerisation; II = 5 min Polymerisation; III = 30 min Inkubation mit Pep1Alloc; IV = 90 min Inkubation wi th Pep1Alloc; sowohl III und IV polymerisiert und mit Licht für 1 min gemustert). Die dargestellten Daten zeigen den Mittelwert (n = 3) mit Fehlerbalken den Standardfehler zeigt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
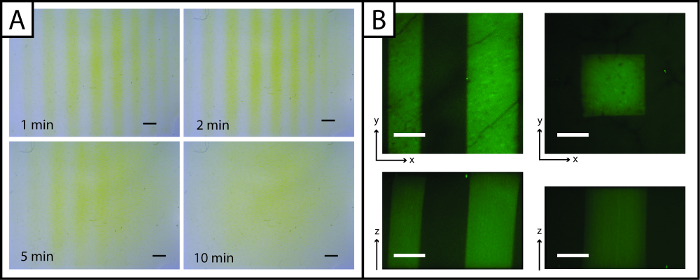
Fig . 3: Ellman-Assay und Fluoreszenzbilder photostrukturierten Hydrogele zu visualisieren (A) Reagenz des Ellman kann schnell erkannt werden , Muster (Linien) in der x- und y-Ebenen (gelb = unstrukturierte Region, Maßstabsbalken = 1 mm). (; 200 & mgr; m Maßstab; 10X Wasser-Tauchziel, Ex / Em 488/525 nm grün = gemusterten Region) (B) Fluoreszierende Peptide können in der x-, y- und z-Ebenen zu beobachten Muster verwendet werden.large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
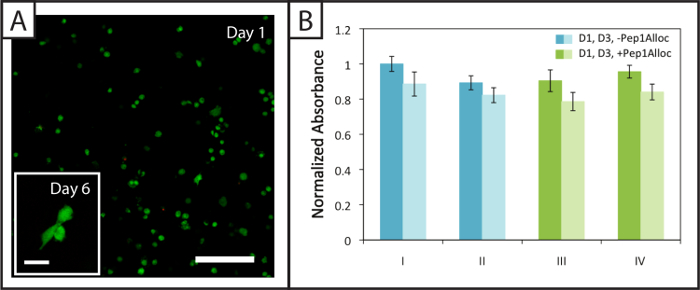
. Abbildung 4: Viability und die metabolische Aktivität von Zellen in nicht abbaubaren photostrukturiert Hydrogele (A) Beispiel konfokalen Z-Stapel (z-Projektion; 10X Wasser-Tauchziel) der lebensfähigen (grün; Ex / Em 488/525 nm) und tot hMSCs (rot; Ex / Em 543/580 nm) eingekapselt Hydrogele 24 Stunden nach der Verkapselung (Maßstabsbalken = 200 & mgr; m). Die Zellen verteilt innerhalb dieser Hydrogele 6 Tage nach der Verkapselung (kleines Bild Bild, Maßstabsbalken = 50 & mgr; m). (B) Zellen sind metabolisch aktiv 1 und 3 Tage (dunkle und helle Stäbe, beziehungsweise) post-Verkapselung für die verschiedenen Polymerisation (I = 1 min Polymerisation; II = 5 min Polymerisation) und Musterbedingungen (III = 30 min Inkubation mit Pep1Alloc ; IV = 90 min incubation mit Pep1Alloc; beide polymerisiert und für 1 min mit Licht strukturiert). Die dargestellten Daten zeigen den Mittelwert (n = 3) mit Fehlerbalken den Standardfehler zeigt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
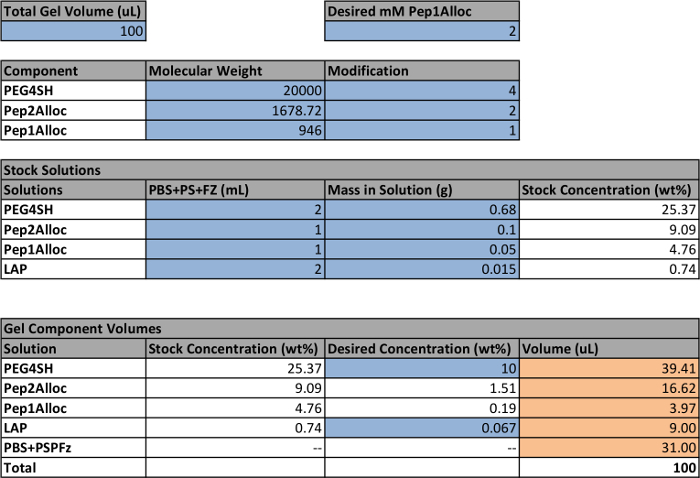
Tabelle 1: Beispiel - Setup Volumen der Stammlösungen berechnen für Hydrogele Herstellung Zellen in der Tabelle , die blau markiert sind , zeigen benutzerdefinierte Parameter;. die übrigen Mengen werden auf der Grundlage dieser Einstellungen berechnet. Die endgültigen Volumen für jede Stammlösung ein Gel zu machen sind orange markiert. Die weißen Zellen enthalten Formeln verwendet, um die endgültige Volumen auf den benutzerdefinierten Parametern zu berechnen. Beachten Sie, dass eine Konzentration von 2,2 mM LAP bis 0,067 Gew% entspricht.
Diskussion
Das hier vorgestellte Verfahren zeigt Techniken, die von Thiol-En-Klick-Chemie gebildeten Zellen innerhalb von Hydrogelen photoencapsulate und photopattern anschließend die Gele mit biochemischen Signale. Die Verwendung von Licht, um anfänglich Hydrogele bilden können homogene Vermischung und Suspension der Zellen in der Polymerlösung vor der Polymerisation. Schnelle Polymerisation "Sperren" das Gel in der Form der definierten Form und kapselt Zellen innerhalb des Hydrogels Netzwerk suspendiert. Gele können auch in zahlreiche verschiedene Formen geformt werden (beispielsweise Glasobjektträger oder Spritzenspitzen) in Abhängigkeit von der gewünschten Endanwendung. Beispielsweise für die 3D-Kultur eingekapselten Zellen in Hydrogelen Glasobjektträger angebracht sind besonders nützlich für Bildgebungsanwendungen als Lichtdämpfung innerhalb einer dünnen Probe begrenzt ist. Spritzenformen können für eine schnelle Verkapselung von Zellen verwendet werden, so dass eine größere Anzahl von Proben in kurzer Zeit hergestellt werden (im Vergleich zu Glas-Objektträgers), die für die Experimente verwendet werden können, erfordern eine große Anzahl von Zellen wie Zytometrie oder qPCR fließen. Anschließend kann diese Gele dann mit biochemischen cues gemustert werden , um gewünschte zelluläre Antworten , wie beispielsweise Differenzierung oder Invasion hervorzurufen. 30,31
Assays für die Lebensfähigkeit und die Stoffwechselaktivität zeigen das Überleben von Zellen für das Materialsystem und Strukturieren Bedingungen dargestellt. Beachten Sie, dass die metabolische Aktivität bis zum Tag 3 in nicht abbaubare Gele (RGKGRK Peptid vernetzen) überwacht wurde, um die ersten Auswirkungen der Polymerisation und Musterbedingungen auf die Zellfunktion zu beurteilen. Zusätzlich wird ein Membranintegrität Test (Live / Dead Lebensfähigkeit / Zytotoxizität Färbung) von hMSCs bei 1 und 6 Tage nach der Einkapselung in Gelen mit einem abbaubaren Peptid vernetzen formuliert (GPQGIWGQ) unterstützt, dass die Zellen lebensfähig bleiben und nach 1 Woche in Kultur zu verbreiten. Die Lebensfähigkeit von zusätzlichen Zelllinien wurde für Photopatterning Bedingungen 32 ähnlich denen berichtetverwendet hier und für das beschriebene Hydrogelsystem ausgewertet werden können Live / Dead-Färbung und die metabolische Aktivität Assays verwendet. Während wir Probleme mit der Lebensfähigkeit der Zellen nicht beobachtet haben, mit diesem Materialsystem und damit verbundene Verfahren (4.2 und 4.3), können einige Zelltypen zu radikalischem und / oder Lichteinwirkung empfindlich sein. In diesem Fall können Benutzer betrachten nicht-photoinitiierte Materialsysteme verwenden, wie beispielsweise Azid-Alkin, 12 FXIII, 31 oder Diels Alder-basierte Hydrogelbildung Chemien. 33
Facile Techniken Musterungs biochemischer Signale innerhalb Gelen zu detektieren und zu quantifizieren, ebenfalls dargestellt werden (3.1 und 3.2). Ellman-Assay ist von besonderem Interesse , weil die Reagenzien im Handel erhältlich und keine zusätzlichen Verarbeitungsschritte oder synthetischen teurer Reagenzien (beispielsweise fluoreszenzmarkierte Peptid) erforderlich sind. Ellman-Assay kann verwendet werden, um genau die Modifikation von freien Thiolen mit biochemischer Signale unter differe bestimmennt Photostrukturierungs Bedingungen sowie schnell Muster zu visualisieren. Für die Peptid Inkorporation Quantifizieren der Thiolfunktion Konzentration vor und nach der Musterbildung, als quantitatives Maß der Peptid Inkorporation wird direkt mit Ellman-Assay beurteilt. Während diese Art der Quantifizierungs mit fluoreszenzmarkierten Peptiden, 34 bildbasierte Quantifizierung erfordert zeitaufwendige Handhabung und Analyseschritte (beispielsweise die Synthese eines fluoreszenzmarkierten Peptids und die Erzeugung einer Kalibrierungskurve in Beziehung Fluoreszenz Peptidkonzentration durchgeführt werden Verwendung von Bildanalyse). Für die Bildgebung Peptid Einarbeitung kann Ellman-Reagenz direkt auf die Proben und sofort visualisiert angewendet werden. Während auf die x- und y-Ebenen für Modellvisualisierung beschränkt, kann die Technik als einfache Routineverfahren verwendet werden, um zu bestimmen, ob Matrizen freien Thiolgruppen strukturiert worden enthält. Es ist wichtig zu beachten, dass Ellman-Test nicht c istonsidered cytocompatible, also, während sie verwendet werden kann, zu beobachten und zu quantifizieren photopatterns, kann sie nicht in Gegenwart von Zellen durchgeführt werden. Zum Abbilden Strukturierung in drei Dimensionen und in Gegenwart von Zellen, bleibt die Konjugation von fluoreszierenden Peptide innerhalb Hydrogelmatrices ein leistungsfähiges und weit verbreiteter Ansatz. Auflösung der Muster kann in der x- ausgewertet werden, y- und z-Ebenen unter Verwendung der konfokalen Mikroskopie, und dieses Verfahren ist cytocompatible so dass Zellen in strukturierten Bereichen oder nicht gemusterten Bereiche identifiziert werden kann. Zusammengenommen Ellman-Assay und Imaging-basierte Techniken sind ergänzende Instrumente für Forscher sowohl quantitativ zu beurteilen und qualitativ die Photopatterning biochemischer Signale innerhalb des Materialsystem.
Photoclick oder breiter photoinitiiert, Chemien für die Bildung und Modifikation von Hydrogelen in Gegenwart von Zellen, sind zahlreich. Die Form, Kapselung und Strukturierungstechniken präsentiert werden, gehören nicht limITED zu dem Materialsystem beschrieben und können auf alternative lichtbasierte Chemien, wie Thiol-Alkin, 35 Azid-Alkin, 4 und andere Thiol-En - Chemien (beispielsweise Thiol-norbornen), 10,13 als auch angewendet werden , wie mit verschiedene Photoinitiatoren wie Irgacure 2959, Eosin Y und Campherchinon. Hinweis : Benutzer können müssen Prozedurparameter (zB Inkubationszeiten, Polymerisationszeiten, Zelldichte) anpassen , um sicherzustellen , dass die Bedingungen für diese anderen Systeme cytocompatible bleiben. Da der Strukturierungsprozess eine Diffusion des alloc-modifizierten Peptids (s) in das Hydrogel (2.2.3-2.2.5) erfordert, kann dieses Verfahren am nützlichsten für die Zugabe von Integrin-Bindungseinheiten (zB Peptide oder extrazelluläre Matrixprotein nachzuweisen Fragmente) an das Hydrogel, wo Befestigung des Liganden an das Netzwerk zur Erzeugung von Zugkräften durch die Zelle und Voll Integrin - Aktivierung erforderlich ist. 36 Note, für Biomoleküle , die möglicherweisewerden in ähnlicher Weise aktiv in Lösung oder auf Immobilisierung (zB Wachstumsfaktoren oder Zytokine), der Inkubationsschritt für Einheit Diffusion (~ 1 h) in das Hydrogel könnte dazu führen , Ereignisse zu signalisieren , die Strukturierung Ergebnisse Konvolut. Andere Verfahren wurden für die Wachstumsfaktor - Immobilisierung oder lokale Sequestrierung für ihre Strukturierung etabliert. 37-39 Zusätzlich Musterauflösung wird durch die Kontrolle über die Belichtung bestimmt. Hier Photomasken ermöglichen die Erzeugung von Mustern durch das Gel Tiefe und in der x- und y-Ebenen; jedoch größere räumliche Kontrolle über Musterungs biochemischer Signale innerhalb Gele können mit alternativen Verfahren zur Bestrahlung wie beispielsweise die Verwendung eines Zwei-Photonen - konfokalen Mikroskop erreicht werden , zu erzeugen Muster in der x-, y- und z- Ebene. 34,40 Schließlich ist es wichtig zu beachten, dass, während das Materialsystem in diesem Verfahren verwendet nur anfänglich mit biochemischer Signale modifiziert wird, orthogonal Photoclick Chemien verwendet werden könnte alte zu ermöglichenRationen in Matrixeigenschaften über die Zeit. 12 Das Verfahren und Techniken , die hier vorgestellt für die Erstellung von synthetischen Matrizen mit gut definierten und raum - zeitlich-gesteuerte Eigenschaften Vielfalt an die aktuellen Konzepte. Insbesondere ist die kommerzielle Verfügbarkeit von Reagenzien und Materialien in diesem Verfahren verwendet wird, wird bei der Verwendung von Hydrogel-basierte Biomaterialien für Anwendungen in kontrollierten Zellkultur interessiert zu einer Vielzahl von Forschern nützlich sein.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde von den Delaware COBRE Programme in Drug Discovery und in Advanced Biomaterials von Institutional Development Awards vom National Institute of Medical Sciences Generäle an den National Institutes of Health (P20GM104316 und P30 GM110758-01, jeweils), die Pew Charitable Trusts finanziert unterstützt (00026178), ein National Science Foundation Career Award (DMR-1253906), die Burroughs Wellcome Fund (1.006.787) und der National Science Foundation IGERT SBE2 Programm an der University of Delaware (Stipendium für L. Sawicki). Die Autoren danken dem Delaware Biotechnology Institute BioImaging Center an der University of Delaware für die Ausbildung und den Zugang zu der konfokalen Mikroskopie, Frau Katherine Wiley für die Unterstützung während der Videoaufnahme, Mr. Matthew Rehmann für hMSCs isoliert aus Knochenmark, Prof. Christopher J großzügig Bereitstellung . Kloxin und Herr Stephen Ma für die großzügige Bereitstellung von Photomasken, und für die Verwendung des automatischen Plattenleser Prof. Wilfred Chen.
Materialien
| Name | Company | Catalog Number | Comments |
| Custom Peptides | Various Vendors | ---- | Peptides may also be synthesized via standard SPPS techniques with materials from vendors including ChemImpex and ChemPep. |
| 4-arm PEG Thiol, MW 20k | JenKem USA | 4ARM-SH | Listed under Multi-arm Homofunctional PEGs. PEG4SH may also be synthesized as previously referenced. |
| Lithium Phenyl-2,4,6-trimethylbenzoylphosphinate | Colorado Photopolymer Solutions | Li-TPO | |
| Dimethyl Phenylphosphonite | Sigma Aldrich | 149470 | Caution, causes severe skin burns and eye damage. Wear protective gloves, clothing, and eye protection. |
| 2,4,6-Trimethylbenzoyl Chloride | Sigma Aldrich | 682519 | Caution, causes severe skin burns and eye damage. Wear protective gloves, clothing, and eye protection. |
| Lithium Bromide | Sigma Aldrich | 213225 | |
| 2-Butanone | Sigma Aldrich | 360473 | |
| Flask, Round Bottom, 100 ml | Chemglass | CG-1506-05 | |
| 80 ml Filter Funnel, Buchner, Medium Frit | Chemglass | CG-1402-L-02 | Filter paper inside a regular glass funnel may be used if desired. |
| Magnetic Stir Bars | Various Vendors | ---- | |
| Magnetic Stirring and Hot Plate | Various Vendors | ---- | |
| Vacuum Dessicator | Various Vendors | ---- | |
| Deuterium Oxide | Acros Organics | 16630 | |
| Dulbecco's Phosphate Buffered Saline | ThermoFisher Scientific | 14190-250 | |
| Penicillin Streptomycin | ThermoFisher Scientific | 15070-063 | |
| Fungizone | ThermoFisher Scientific | 15290-018 | |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher Scientific | 15400-054 | Select appropriate medium and trypsin depending on cell type. |
| Microcentrifuge tubes | Various Vendors | ---- | 1.5 or 2 ml sizes, sterile. |
| BD Syringe with Slip (Luer) Tips (Without Needle) | Fisher Scientific | 14-823-16H | Product number listed here is for a 1 ml syringe (16H), Various sizes are available (14-823-XX). |
| Fisherfinest Premium Plain Glass Microscope Slides | Fisher Scientific | 12-544-1 | |
| High-Purity Silicone Rubber, 0.010" Thick, 6" x 8" Sheet, 55A Durometer (Gasket) | McMaster Carr | 87315K62 | |
| Ethanol, 200 Proof | Decon Labs | 2701 | |
| RainX, Original | Amazon | 800002243 | May be purchased from other vendors. |
| Sigmacote | Sigma Aldrich | SL2 | |
| Photomasks | Advance Reproductions Corporation | ---- | Photomask Division, different designs may be printed as desired. |
| DTNB; Ellman's Reagent; 5,5-dithio-bis(2-nitrobenzoic acid) | ThermoFisher Scientific | PI-22582 | |
| Sodium Phosphate Dibasic | Sigma Aldrich | S5136 | |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E6758 | |
| Sodium Hydroxide, Pellets/Certified ACS | Fisher Scientific | S318 | |
| Orthophosphoric Acid | Alfa Aesar | 33266 | |
| Cysteine Hydrochloride Monohydrate | Sigma Aldrich | C7880 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | ThermoFisher Scientific | L-3224 | |
| CellTiter 96 Aqueous One Solution Assay | Promega | G3582 | |
| Centrifuge | Various Vendors | ---- | Capable of speeds at 90-110 x g. |
| Multiwell Plate Reader | Various Vendors | ---- | Capable of reading absorbance at 405 nm in a 96-well plate. |
| Epifluorescent or Confocal Microscope | Various Vendors | ---- | To visualize peptide patterns and cells within hydrogels. |
| Omnicure Exfo Series 2000 | Excelitas Technologies | ---- | Alternate light systems may be used to polymerize hydrogels. |
| Zeiss Zen Lite Software | Zeiss | ---- | Available at zeiss.com; compatible with images taken on Zeiss microscopes |
| ImageJ | NIH | ---- | Available at imagej.nih.gov; applicable for general image analysis |
Referenzen
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew Chemie - Int Ed. 40 (11), 2004-2021 (2001).
- Xi, W., Scott, T. F., Kloxin, C. J., Bowman, C. N. Click Chemistry in Materials Science. Adv Funct Mater. 24 (18), 2572-2590 (2014).
- Azagarsamy, M. A., Anseth, K. S. Bioorthogonal click chemistry: An indispensable tool to create multifaceted cell culture scaffolds. ACS Macro Lett. 2 (1), 5-9 (2013).
- Adzima, B. J., Tao, Y., Kloxin, C. J., DeForest, C. A., Anseth, K. S., Bowman, C. N. Spatial and temporal control of the alkyne-azide cycloaddition by photoinitiated Cu(II) reduction. Nat Chem. 3 (3), 256-259 (2011).
- Hoyle, C. E., Bowman, C. N. Thiol-ene click chemistry. Angew Chemie - Int Ed. 49 (9), 1540-1573 (2010).
- Fan, Y., Deng, C., Cheng, R., Meng, F., Zhong, Z. In situ forming hydrogels via catalyst-free and bioorthogonal "tetrazole-Alkene" photo-click chemistry. Biomacromolecules. 14 (8), 2814-2821 (2013).
- Burdick, J. A., Murphy, W. L. Moving from static to dynamic complexity in hydrogel design. Nat Commun. 3, 1269 (2012).
- Rehmann, M. S., Kloxin, A. M. Tunable and dynamic soft materials for three-dimensional cell culture. Soft Matter. 9 (29), 6737-6746 (2013).
- Yang, T., Long, H., Malkoch, M., Gamstedt, K. E., Berglund, L., Hult, A. Characterization of well-defined poly(ethylene glycol) hydrogels prepared by thiol-ene chemistry. J Polym Sci Part A Polym Chem. 49 (18), 4044-4054 (2011).
- Fairbanks, B. D., et al. A versatile synthetic extracellular matrix mimic via thiol-norbornene photopolymerization. Adv Mater. 21 (48), 5005-5010 (2009).
- Roberts, J. J., Bryant, S. J. Comparison of photopolymerizable thiol-ene PEG and acrylate-based PEG hydrogels for cartilage development. Biomaterials. 34 (38), 9969-9979 (2013).
- DeForest, C. A., Polizzotti, B. D., Anseth, K. S. Sequential click reactions for synthesizing and patterning three-dimensional cell microenvironments. Nat Mater. 8 (8), 659-664 (2009).
- Lin, C. C., Ki, C. S., Shih, H. Thiol-norbornene photoclick hydrogels for tissue engineering applications. J Appl Polym Sci. 132 (8), (2015).
- Sawicki, L. A., Kloxin, A. M. Design of thiol-ene photoclick hydrogels using facile techniques for cell culture applications. Biomater Sci. 2 (11), 1612-1626 (2014).
- Patterson, J., Hubbell, J. A. Enhanced proteolytic degradation of molecularly engineered PEG hydrogels in response to MMP-1 and MMP-2. Biomaterials. 31 (30), 7836-7845 (2010).
- Fairbanks, B. D., Singh, S. P., Bowman, C. N., Anseth, K. S. Photodegradable, photoadaptable hydrogels via radical-mediated disulfide fragmentation reaction. Macromolecules. 44 (8), 2444-2450 (2011).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Yang, F., et al. The effect of incorporating RGD adhesive peptide in polyethylene glycol diacrylate hydrogel on osteogenesis of bone marrow stromal cells. Biomaterials. 26 (30), 5991-5998 (2005).
- Wacker, B. K., et al. Endothelial cell migration on RGD-peptide-containing PEG hydrogels in the presence of sphingosine 1-phosphate. Biophys J. 94 (1), 273-285 (2008).
- Wilson, M. J., Liliensiek, S. J., Murphy, C. J., Murphy, W. L., Nealey, P. F. Hydrogels with well-defined peptide-hydrogel spacing and concentration: impact on epithelial cell behavior. Soft Matter. 8 (2), 390-398 (2012).
- Qiong Liu, S., et al. Injectable biodegradable polyethylene glycol/ RGD peptide hybrid hydrogels for in vitro chondrogenesis of human mesenchymal stern cellsa. Macromol Rapid Commun. 31 (13), 1148-1154 (2010).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126 (4), 677-689 (2006).
- Levental, I., Georges, P. C., Janmey, P. A. Soft biological materials and their impact on cell function. Soft Matter. 3 (3), 299-306 (2007).
- Lin, C. C., Raza, A., Shih, H. PEG hydrogels formed by thiol-ene photo-click chemistry and their effect on the formation and recovery of insulin-secreting cell spheroids. Biomaterials. 32 (36), 9685-9695 (2011).
- Khetan, S., Burdick, J. Cellular encapsulation in 3D hydrogels for tissue engineering. J Vis Exp. (32), e1590 (2009).
- Bryant, S. J., Nuttelman, C. R., Anseth, K. S. Cytocompatibility of UV and visible light photoinitiating systems on cultured NIH/3T3 fibroblasts in vitro. J Biomater Sci Polym Ed. 11 (5), 439-457 (2000).
- Burdick, J. A., Chung, C., Jia, X., Randolph, M. A., Langer, R. Controlled Degradation and Mechanical Behavior of Photopolymerized Hyaluronic Acid Networks Controlled Degradation and Mechanical Behavior of Photopolymerized Hyaluronic Acid Networks. Society. 6 (1), 386-391 (2005).
- Marsano, E., Gagliardi, S., Ghioni, F., Bianchi, E. Behaviour of gels based on (hydroxypropyl) cellulose methacrylate. Polymer (Guildf). 41 (21), 7691-7698 (2000).
- Bryant, S. J., Anseth, K. S. Photopolymerization of Hydrogel Scaffolds. Scaffolding Tissue Eng. , 71-90 (2005).
- Khetan, S., Burdick, J. A. Patterning hydrogels in three dimensions towards controlling cellular interactions. Soft Matter. 7 (3), 830-838 (2011).
- Mosiewicz, K. A., et al. In situ cell manipulation through enzymatic hydrogel photopatterning. Nat Mater. 12 (11), 1072-1078 (2013).
- Williams, C. G., Malik, A. N., Kim, T. K., Manson, P. N., Elisseeff, J. H. Variable cytocompatibility of six cell lines with photoinitiators used for polymerizing hydrogels and cell encapsulation. Biomaterials. 26 (11), 1211-1218 (2005).
- Nimmo, C. M., Owen, S. C., Shoichet, M. S. . Diels - Alder Click Cross-Linked Hyaluronic Acid Hydrogels for Tissue Engineering. , 824-830 (2011).
- DeForest, C. A., Anseth, K. S. Cytocompatible click-based hydrogels with dynamically tunable properties through orthogonal photoconjugation and photocleavage reactions. Nat Chem. 3 (12), 925-931 (2011).
- Fairbanks, B. D., Sims, E. A., Anseth, K. S., Bowman, C. N. Reaction rates and mechanisms for radical, photoinitated addition of thiols to alkynes, and implications for thiol-yne photopolymerizations and click reactions. Macromolecules. 43 (9), 4113-4119 (2010).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Wylie, R. G., et al. Spatially controlled simultaneous patterning of multiple growth factors in three-dimensional hydrogels. Nat Mater. 10 (10), 799-806 (2011).
- Pompe, T., Salchert, K., Alberti, K., Zandstra, P., Werner, C. Immobilization of growth factors on solid supports for the modulation of stem cell fate. Nat Protoc. 5 (6), 1042-1050 (2010).
- Hudalla, G. A., Murphy, W. L. Biomaterials that regulate growth factor activity via bioinspired interactions. Adv Funct Mater. 21 (10), 1754-1768 (2011).
- Lee, S. H., Moon, J. J., West, J. L. Three-dimensional micropatterning of bioactive hydrogels via two-photon laser scanning photolithography for guided 3D cell migration. Biomaterials. 29 (20), 2962-2968 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten