Method Article
Formation et Patterning Light-médiée hydrogels pour la culture cellulaire Applications
Dans cet article
Résumé
We describe a sequential process for light-mediated formation and subsequent biochemical patterning of synthetic hydrogel matrices for three-dimensional cell culture applications. The construction and modification of hydrogels with cytocompatible photoclick chemistry is demonstrated. Additionally, facile techniques to quantify and observe patterns and determine cell viability within these hydrogels are presented.
Résumé
Cliquez sur chimies ont été étudiés pour une utilisation dans de nombreuses applications de biomatériaux, y compris la délivrance de médicaments, l'ingénierie tissulaire, et de la culture cellulaire. En particulier, la lumière médiée par clic des réactions telles que des réactions de thiol-ène et thiol-yne photoamorcées, les moyens de contrôle spatiotemporel sur les propriétés des matériaux et de permettre la conception de systèmes avec un degré élevé de contrôle de la propriété dirigée par l'utilisateur. Fabrication et modification des biomatériaux à base hydrogel en utilisant la précision offerte par la lumière et la polyvalence offerte par ces chimies thiol-X photoclick sont d'un intérêt croissant, en particulier pour la culture de cellules à l'intérieur bien définies, microenvironnements biomimétiques. Ici, nous décrivons des procédés pour la photoencapsulation des cellules et photopatterning ultérieur des signaux biochimiques à l'intérieur des matrices d'hydrogel à l'aide de blocs de construction modulaires polyvalents et polymérisées par une réaction photoclick thiol-ène. Plus précisément, une approche est présentée pour constructing hydrogels à partir allyloxycarbonyle (Alloc) reticulations peptide -functionalized et pendants fragments peptidiques et les poly thiol à fonctionnalité (éthylène glycol) (PEG), qui polymérisent rapidement en présence de lithium acylphosphinate photoinitiateur et des doses cytocompatible de longue ultraviolets de longueurs d'onde (UV). techniques Facile à visualiser photopatterning et quantifier la concentration de peptides ajoutés sont décrits. En outre, les procédés sont mis en place pour les cellules d'encapsulation, en particulier les cellules souches mésenchymateuses humaines, et la détermination de la viabilité et l'activité. Tandis que la formation et la structuration initiale d'hydrogels thiol alloc sont présentés ici, ces techniques largement peuvent être appliquées à un certain nombre de systèmes de matériaux d' autre lumière et initiée par voie radicalaire (par exemple, un thiol-norbornène, thiol-acrylate) pour produire des substrats à motifs.
Introduction
Cliquez sur chimies sont de plus en plus utilisés dans la conception de matériaux pour de nombreuses applications biomédicales, y compris la délivrance de médicaments, l' ingénierie tissulaire, et de la culture cellulaire contrôlée, en raison de leurs, réactivités cytocompatible efficaces, et souvent sélectives. 1-3 chimies Photoclick qui utilisent la lumière pour déclencher ou initier des réactions (par exemple, un azide-alcyne, 4 thiol-ène, et 5 tétrazole-alcène 6) présentent un intérêt particulier pour la formation ou la modification de biomatériaux. Taux rapide dans les conditions et le contrôle de quand et doux où ils ont lieu avec de la lumière rendent ces réactions bien adaptées pour le contrôle réalisé par l' utilisateur propriétés biomatériaux en présence de cellules 7,8 En particulier., Chimies thiol-ène photoclick ont été utilisés pour générer des biomatériaux à base d' hydrogel, ayant des propriétés mécaniques robustes et 5,9 pour l'encapsulation d'une grande variété de types de cellules, y compris, mais nont limitée à, des cellules humaines souches mésenchymateuses (CSMh), les fibroblastes, les chondrocytes et les cellules pancréatiques, avec la promesse de la culture et de la livraison cellulaire. 10,11 De plus, ces chimies ont été utilisés pour la structuration spatiale des signaux biochimiques pour imiter les aspects clés de microenvironnements cellulaires natifs et faciliter les interactions cellule-matrice appropriées, y compris l' adhérence, la différenciation et l' invasion. 3,12
Pour la construction d'hydrogels thiol-ène avec de la lumière, des peptides contenant des cystéines (thiol) sont couramment mis à réagir avec des polymères fonctionnalisés avec des acrylates ou norbornènes ( «ène») pour la polymérisation photoinitiée rapide dans des conditions cytocompatible. 13 Élargir cette boîte à outils, nous avons cherché à établir méthodes pour la formation d'hydrogel avec de nouveaux blocs de construction polyvalent et accessible qui nécessitaient un traitement synthétique minimal ou disponibles dans le commerce en vue de leur large utilisation comme matrices extracellulaires synthétiques.Un pour pendentif, des groupes de liaison à l' intégrine pour promouvoir l' adhésion cellulaire [K (alloc) GWGRGDS = Pep1Alloc] ou deux pour réticulations non-dégradables ou de cellules-dégradable [K (: 14 Plus précisément, les peptides ont été modifiés avec allyloxycarbonyle (Alloc) lysines -protected alloc) RGKGRKGK (alloc) G ou KK (alloc) GGPQGIWGQGK (alloc) K = Pep2Alloc, respectivement]. Avec ces séquences, les conditions ont été établies pour une réaction rapide (1-5 min) avec quatre bras thiol modifié par un poly (éthylène glycol) (PEG4SH) en utilisant des doses cytocompatible de la lumière UV à grande longueur d'onde (10 mW / cm2 à 365 nm) , et le photoinitiateur lithium phényl-2,4,6-trimethylbenzoylphosphinate (LAP). Les hydrogels résultants étaient stables dans des conditions de culture cellulaire pendant des semaines. Pour permettre la dégradation et le remodelage entraîné cellules, un peptide clivable enzymatiquement a été incorporé dans les reticulations de gel ( par exemple, GPQGIWGQ), 15 et une cellule primaire modèle, les cellules souches mésenchymateuses humaines (hMSC), est restée très viable après encapsulation et during culture dans ces matrices. En outre, les peptides ont été spatialement à motifs au sein de ces matériaux, et CSMh demeurer viables et métaboliquement actives dans des conditions de photopatterning. Des séquences alternées pendant peptidiques, non représentés ici (par exemple, IKVAV, YIGSR, GFOGER, etc.) peut également être incorporé dans des matrices pour sonder les interactions des cellules supplémentaires avec le micro - environnement environnant. Ces résultats sont prometteurs pour l'application de ces matériaux à base d'hydrogel pour (3D) la culture de cellules en trois dimensions et de la livraison à l'étude des interactions directes et cellule-matrice pour une variété de types de cellules.
Ici, des méthodes pour photoencapsulate les cellules et les indices biochimiques photopattern ensuite au sein du système d'hydrogel proposé sont présentés (figure 1). Techniques d'observer et de quantifier ces photopatterns aussi sont démontrés: notamment, i) l'utilisation qualitative et quantitative de l'essai d'Ellman pour déterminer les adaptation des thiols libres dans des substrats à motifs et ii) l'utilisation qualitative complémentaire de peptides fluorescents (AF488Pep1Alloc) pour observer ces modèles en trois dimensions. En outre, des essais pour déterminer la viabilité (vivant mort de viabilité / cytotoxicité coloration /) et l'activité métabolique (MTS; 3- (4,5-diméthylthiazol-2-yl) -5- (3-carboxyméthoxyphényl) -2- (4-sulfophényl) -2H-tétrazolium) sont présentés de telle sorte que les utilisateurs peuvent déterminer la cytocompatibilité de photoencapsulation et photopatterning conditions pour différentes lignées cellulaires au sein de matrices d'hydrogel. Bien que le protocole est démontré pour un système photoclick d'hydrogel à base de lumière facile, les techniques peuvent être appliquées à de nombreux autres systèmes d'hydrogel radicalaire initiée pour photoencapsulation et photopatterning en présence de cellules.
Protocole
1. Préparation des matériaux pour la Formation Hydrogel
- Synthétiser pendentif (Pep1Alloc, AF488Pep1Alloc) et des peptides de réticulation (Pep2Alloc) par synthèse peptidique en phase solide standard (SPPS) techniques et thiol-polymère fonctionnalisé par procédure en trois étapes pour la modification des groupes terminaux (PEG4SH). 14,16 Alternativement, acheter PEG4SH (M n ~ 20 kDa) Pep1Alloc et Pep2Alloc dans le commerce.
- Synthétiser le photoinitiateur (LAP) par la réaction en deux étapes décrites ci - dessous. 14,17 Effectuer les étapes de synthèse (1.2.1-1.2.11) dans une hotte et faire preuve de prudence lors de la manipulation des produits chimiques (porter des gants, des vêtements et des lunettes) . LAP peut également être acheté dans le commerce.
- Sec toute la verrerie dans un four (> 2 h, 80 ° C).
- Ajouter une barre d'agitation à une seule cols vide à fond rond (100 ml) et le couvercle avec un septum.
- Fixer le ballon au-dessus d'une plaque d'agitation magnétique à chaud avec un support de bague et collier.
- jensert une aiguille (18 G) à travers la cloison et laisser l'extrémité extérieure ouverte à l'atmosphère. Insérez une deuxième aiguille fixée à une conduite de gaz inerte. Ouvrez la ligne de gaz inerte (par exemple, l' argon ou de l' azote) et purger le ballon pendant 10-15 min.
NOTE: Le système sera purgé en continu avec un gaz inerte, l'argon ou de l'azote, tout au long de la réaction. - Transfert de 1,5 g (~ 1,4 ml) phénylphosphonite de diméthyle (ATTENTION) dans le ballon, à l'aide d'une seringue avec une aiguille pour percer à travers le septum. Tournez sur la plaque d'agitation (vitesse moyenne) et veillez à ce que le contenu ne splash pas sur les côtés du ballon.
- Ajouter 1,6 g (~ 1,46 ml) de chlorure de 2,4,6-triméthylbenzoyle (ATTENTION) goutte à goutte dans le flacon contenant le phénylphosphonite de diméthyle, à l'aide d'une seringue avec une aiguille pour percer le septum.
- Couvrir le récipient de réaction avec du papier pour protéger de la lumière et remuer pendant 18 heures sous argon ou de l'azote.
- Le lendemain, augmenter la hauteur du ballon, placer un bain d'huile sur l'agitateur, unNd soigneusement abaisser la fiole dans le bain d'huile. Chauffer le bain et le flacon à 50 ° C, tout en maintenant une agitation magnétique.
- Dissoudre 3,05 g de bromure de lithium dans 50 ml de 2-butanone. Soulever le flacon hors du bain d'huile et ajoute la solution de bromure de lithium dans le ballon à fond rond, en enlevant brièvement la cloison à verser dans le ballon.
- Sceller le ballon à nouveau avec le septum (ATTENTION: Septum aura toujours une aiguille menant aux lignes d'argon et une aiguille pour évacuer), abaisser la fiole de nouveau dans un bain d'huile chauffé, et laisser la réaction se dérouler pendant 10 min. Un précipité solide se forme.
- Après 10 minutes, éteindre l'argon, enlever le ballon de la chaleur, et laisser reposer le mélange pendant 4 heures (recouverts d'une feuille à l'abri de la lumière comme initiateur sensible à la lumière a été produit. Gardez l'endroit de l'aiguille de ventilation.
- Verser dans un produit fritte entonnoir en verre ou entonnoir recouverte de papier filtre approprié. filtrat de rinçage 3 fois avec 50 ml de 2-butanone pour rEDéplacez tout le bromure de lithium qui n'a pas réagi.
- On sèche ( d' abord sur paillasse puis en dessicateur sous vide) et à analyser le produit par RMN 1 H dans D 2 O. des pics caractéristiques à 1,8 à 1,9 (6H, s), de 2,1 à 2,2 (3H, s), de 6,7 à 6,8 (2H, s), 7,3 à 7,4 (2H, m), 7,4 à 7,5 (1H, m) et 7,5 -7,7 (2H, m). 14,17
- Utilisez une feuille de calcul pour calculer le volume et la concentration de chaque solution mère (PEG4SH, Pep1Alloc, Pep2Alloc, LAP) qui doit être prêt à faire des hydrogels (tableau 1). Pour faire des gels non-motifs, veiller à ce que [SH] = [Alloc] de sorte que tous les groupes réactifs sont consommés pendant la polymérisation. Si photopatterning de gels est prévu, y compris un excès de thiol pendant la formation de gel à base de stoechiométrie (par exemple de 0,2 à 5 mM, [SH]> [Alloc]) pour une réaction ultérieure avec Pep1Alloc.
REMARQUE: Gels doit contenir plus de 5 pour cent en poids (% en poids) PEG4SH pour assurer une polymérisation rapide (moins de 5 minutes). Cependant, en poids plus faible plage de%s peuvent être explorées si l'application appelle pour des hydrogels avec des modules inférieurs (par exemple, <0,5 kPa); polymérisation doit être vérifié et ajusté en conséquence pour ces faibles compositions% en poids. De même, la concentration Pep1Alloc peut être ajustée pour différentes applications (par exemple, 0,2 à 5 mM) tel que rapporté dans la littérature pour des peptides à fonction thiol. 18-21 concentration LAP est recommandé d' environ 0,067% en poids (2,2 mM) ou moins, tel qu'il est décrit, en tant que des concentrations plus élevées peuvent diminuer la viabilité cellulaire. - Préparer des solutions mères de Pep1Alloc, Pep2Alloc, PEG4SH et LAP dans des conditions stériles pour la culture cellulaire basé sur des calculs dans le tableau 1.
- Et pour Pep1Alloc Pep2Alloc, peser individuellement la masse totale de Pep1Alloc et Pep2Alloc de la synthèse peptidique et les dissoudre dans une solution saline stérile tamponnée au phosphate (PBS) contenant 1% de pénicilline / streptomycine (PS) et 0,5 ug / ml de Fungizone (FZ). Les concentrations typiques de prêts gamme de solutions d'achat d'actionsde 20 à 100 mg / ml de peptide. Mélanger ces stocks pour obtenir des gels avec des modules finale pertinente pour les applications de tissus mous (module de Young ~ 0,5-5 kPa). 22,23 aliquote et conserver à -20 ° C jusqu'à utilisation.
- Pour PEG4SH, peser PEG4SH dans un tube à centrifuger stérile et dissoudre dans PBS + PS + FZ. Les concentrations typiques de cette gamme de solution mère de 250-430 mg / ml (20-30% de PEG4SH en poids).
- Pour LAP, peser LAP dans un tube à centrifuger stérile et dissoudre dans PBS + PS + FZ à une concentration finale de 7,5 mg / ml.
REMARQUE: la préparation de nouvelles solutions de PEG4SH et LAP est recommandé pour chaque encapsulation ou d'une expérience de gel pour assurer des temps de polymérisation cohérentes.
- Préparer une seringue stérile Tip Moules pour formage hydrogels.
- Découpez soigneusement les conseils hors des seringues de 1 ml en utilisant une lame de rasoir, puis retirer les pistons des arbres de seringue.
- Immerger les arbres de seringues et pistons dans 70% d'éthanol pendant 15 min und place dans une hotte de culture cellulaire stérile pour sécher (30 min). Si des gouttes en excès d'éthanol restent à l'intérieur arbre de seringue, utiliser le piston pour les pousser hors.
- Préparer verre stérile Glisser Moules pour former des hydrogels.
- Faire tremper les lames de verre (multiples de 2) et des joints en caoutchouc (0,254 mm d'épaisseur, 2 petits morceaux utilisés comme cales, un rectangle avec des disques percé, ou en forme de cadre carré) dans 70% d'éthanol pendant 15 min, et dans stérile hotte de culture cellulaire sécher.
- Manteau moitié des diapositives stérilisées avec revêtement anti-adhésif selon les instructions du fabricant pour empêcher l' adhésion de la partie supérieure du gel à la surface de glissement (par exemple, s'il y a 4 toboggans, 2 toboggans seront revêtus d'anti-adhésif). Ceux-ci serviront de la partie supérieure du moule coulissant en verre.
- Calibrer la lampe pour seringue ou de diapositives de verre moules.
Remarque: Pour ces expériences, une lampe à arc à mercure avec un ensemble d'adaptateur de filtre extérieur et le filtre externe 365 nm a été utilisée. Autre lampes qui produisent des intensités appropriées de longueur d' onde de la lumière UV peut être utilisée comme indiqué par les autres. 24-27- Fixer une lentille de collimation à la fin du guide de lumière rempli de liquide pour assurer une intensité relativement même la lumière dans tous les échantillons. Au besoin, ajuster la distance du guide de lumière de l'échantillon (s) pour atteindre une taille de spot qui couvrira des échantillons d'intérêt.
- Placez un moule de la seringue de coupe dans un support de tube à centrifuger (pour maintenir la seringue moule en position verticale). Tenir le radiomètre à la hauteur de la pointe de la seringue où les échantillons seront maintenus et ajuster l' obturateur (% ouvert) pour atteindre une intensité lumineuse de 10 mW / cm 2 à 365 nm. Enregistrer les paramètres ajustés pour une utilisation ultérieure.
- Placez un moule de lame de verre sur le dessus d'une surface stérile (par exemple, la partie supérieure d'une boîte de pointe de la pipette dans une enceinte de sécurité biologique). Tenez le détecteur de radiomètre à la hauteur du moule de lame de verre et d'ajuster l'obturateur (% ouvert) pour atteindre une intensité lumineuse de 10 mW / cm 2 à 365 nm. Enregistrer les paramètres ajustés pour une utilisation ultérieure.
2. Formation Hydrogel et Photopatterning
- Préparation d'hydrogels non-motifs.
NOTE: A ce stade, dans le protocole, si hydrogels doivent être utilisés dans des applications de culture de cellules, toutes les étapes suivantes doivent être effectuées dans des conditions stériles dans une armoire stérile ou capot.- Mélanger des solutions mères de PEG4SH, Pep2Alloc, Pep1Alloc, LAP et PBS + PS + FZ selon le calcul de feuille de calcul (voir le tableau 1 par exemple). Pipeter la solution de précurseur de gel résultante vigoureusement pour assurer un mélange uniforme de la solution.
- Préparer hydrogels épais moulés dans des conseils de seringue par pipetage 10-20 ul de la solution de précurseur de gel (PEG / Pep / LAP / PBS) dans la pointe d'une seringue stérile de coupe. Faire un seul gel par seringue, environ 0,5-1,5 mm d'épaisseur basés sur le volume et le diamètre de la seringue.
NOTE: Les volumes plus importants peuvent être explorées basés surla taille du gel désiré, où les limites supérieures peuvent exister en fonction des limitations diffusionnelles au cours de Pep1Alloc photopatterning et / ou de nutriments / déchets vers / à partir des cellules encapsulées au cours de la culture cellulaire. - Préparer des hydrogels minces dans des moules de lame de verre en plaçant le joint d'étanchéité en caoutchouc (0,254 mm d'épaisseur) sur les bords de la lamelle de verre non revêtu. Introduire à la pipette une solution de précurseur de gel de 5 à 10 pi (simple ou multiple 5-10 gels pi peut être réalisée par pipetage d'un ou plusieurs points de solution sur une seule lame) sur la lame de verre non revêtue et placer la lame de verre revêtue d'anti-adhérente au-dessus de la solution de gel (gels plus grands, jusqu'à la taille de la lame de verre, peuvent être effectués en fonction de l'application finale). Fixer les lames de verre avec de petits clips de liant pour stabiliser.
- La place des moules sous la lampe et régler l'intensité de la lampe (par exemple,% obturateur ouvert) pour atteindre 10 mW / cm 2 à la surface du gel pour les moules de pointe de la seringue ou verre moules en fonction de glisser sur des mesures à l' étape 1.7.2 et1.7.3, respectivement.
- Appliquer de la lumière pendant 1 à 5 min pour permettre une polymérisation complète de gels. Utiliser une durée de polymérisation plus courts pour des gels dont la teneur en PEG4SH supérieur (8% en poids ou plus, 1 min) et plus longue pour les gels à faible teneur PEG4SH (5-8% en poids, de 3 à 5 minutes) pour produire des hydrogels complètement polymérisés avec des modules à l'intérieur la gamme des tissus mous (0,5-5 kPa).
- La place des gels de moules de pointe de la seringue dans une plaque stérile non traitée de 48 puits, et les diapositives lieu de verre dans un plat stérile.
- Rinçage 3 x 15 min avec du milieu de culture cellulaire ou un tampon approprié (par exemple du PBS + PS + FZ, le tampon de réaction d'Ellman) en se basant sur des expériences envisagées, comme détaillé ci - dessous.
- Préparation de Patterned hydrogels.
- Mélanger des solutions mères de PEG4SH, Pep2Alloc, LAP et PBS + PS + FZ selon le calcul du tableur, laissant des thiols libres (0,2-5 mM) pour la réaction ultérieure avec Pep1Alloc. Pipeter la solution de précurseur vigoureusement pour assurer un mélange uniforme de la solution.
- Préparer hydrogels épais et minces comme stipulé dans les étapes 2.1.2 à 2.1.6.
NOTE: Ne pas placer des gels dans un milieu de croissance avant photopatterning. Thiols libres peuvent être consommés par des espèces dans le milieu de croissance (par exemple, la formation de disulfure avec des protéines contenant des thiols) et ne permettra pas de motif du gel sans étapes de traitement supplémentaires (par exemple, la réduction des liaisons disulfure). - Préparer des solutions de Pep1Alloc (concentration finale ~ 3-20 mg / ml) et 2,2 mM LAP.
- Couvrir gels préformés avec une solution / LAP Pep1Alloc et incuber pendant 1 heure à 37 ° C.
- Retirer solution Pep1Alloc / LAP excès. Si les gels ont été moulés dans un embout de la seringue, utiliser une spatule pour transférer soigneusement les gels de la plaque de 48 puits dans lequel ils sont en incubation à une lame de verre stérile pour un motif.
- Placer un photomasque avec le motif souhaité directement sur des gels à glissière moulé par syringe- et du verre. Assurez-vous que la partie imprimée du masque en contact avec le gel pour patt optimalfidélité ern (c. -à- masque doit lire à droite et être côté émulsion vers le bas). Placer les échantillons sous la lampe et irradient pendant 1 min avec les réglages de lampe utilisés pour des lames de verre (étape 1.7.3).
- Après la structuration, gels lieu seringue moulé en une plaque traitée culture non-tissus stériles, 48 puits, et le lieu de verre gels qui sont collés sur les lames de verre dans une boîte stérile slide-moulé.
- Rinçage 3 x 15 min avec du milieu de culture cellulaire ou un tampon approprié (par exemple du PBS + PS + FZ, le tampon de réaction d'Ellman) en se basant sur des expériences envisagées.
3. Visualisation et quantification des Photopatterning
- Essai d'Ellman pour détecter et quantifier des thiols libres dans Photopatterned hydrogels.
- Préparer la réaction du tampon de Ellman, la solution de travail de la cystéine, les normes et le réactif d'Ellman, comme décrit ci-dessous.
- Tampon pour la réaction d'Ellman, on dissout 2,4 g de phosphate de sodium dibasique (Na 2 HPO4) et l' acide éthylènediaminetétraacétique (EDTA) dans 200 ml Dih 2 O (0,1 M de Na 2 HPO 4, 1 mM d' EDTA) 74,4 mg. Ajuster le pH à 7,5-8 avec des solutions d'hydroxyde de sodium (NaOH) ou l' acide phosphorique (H 3 PO 4).
- Pour Solution de travail cystéine, dissoudre 5,27 mg cystéine dans 15 ml de tampon de réaction (mM de cystéine 2).
- Des étalons Cysteine, diluer la solution de travail de cystéine dans un tampon de réaction à une concentration finale de 2, 1,5, 1,25, 1, 0,75, 0,5, 0,25 et 0 mM cystéine.
- Pour le réactif de Ellman, dissoudre 4 mg de réactif de Ellman dans 1 ml de tampon de réaction. Traitement par ultrasons pour dissoudre complètement le réactif de Ellman.
- Quantifier la concentration de thiols libres dans des gels avec le dosage d'Ellman (figure 2).
NOTE: 5 hydrogels ul 'minces', moulé entre des lames de verre, sont décrites dans la procédure ci-dessous et recommandé pour permettre la diffusion rapide du réactif t de Ellmanrâce le gel (ie, il prend le réactif plus de temps pour diffuser à travers des gels épais).- Déterminer le volume de gel gonflé de «minces» gels 5 pi (V S) sur la base du rapport volumétrique de gonflement, Q.
- Faire trois 20 gels ul «épais» en utilisant des moules de seringue. La place des gels dans le tampon de réaction d'Ellman pour 24 heures et par la suite peser (équilibre gonflé de masse, M S). Lyophiliser les gels et peser ensuite (masse sèche, M D).
- En utilisant les masses mesurées pour gels épais, calculer le volumétrique rapport de gonflement 28 par Q = 1 + ρ polymère ρ solvant (-1 M S / M D) où polymère ρ / = 1,07 g / cm 3 pour le PEG, 29 ρ solvant = 1,0 g / cm 3 pour PBS / H 2 O.
- Calculer la masse sèche théorique du gel pour être utilisé pour le dosage d'Ellman (ici, «mince» gels 5 pi sont généralement used), en additionnant les masses des composants individuels PEG4SH, Pep1Alloc et Pep2Alloc (M D = M + M PEG4SH Pep1Alloc + M Pep2Alloc). Par exemple, un gel de 5 ul contenant 10% en poids PEG4SH contient environ 0,000535 g de PEG tel que calculé par M PEG4SH = 0,005 x 1,07 cm 3 g / cm 3 x 0,10. Pep1Alloc et Pep2Alloc masses peuvent être calculées d'une manière similaire sur la base de% en poids dans la solution (voir la feuille de calcul pour les valeurs), en supposant que ρ ≈ 1,0 g / cm 3 pour les solutions aqueuses.
NOTE: Gels peut également être séché et pesé au lieu de calculer la masse sèche théorique. Cependant, il peut être difficile de mesurer systématiquement la masse sèche des minces, 5 gels ul. - Sur la base de la masse sèche prédite et la valeur Q déterminée à partir de gels «épais», calculer la masse gonflée prédit M S pour le gel «mince» (équation à l' étape 3.1.2.1.1). Supposons que ρ ≈ 1,0 g / cm 3, alors M S ≈ V S. Utilisez cette calculée V S pour effectuer le test de Ellman quantitative.
NOTE: La méthode ci - dessus est recommandé de déterminer V s pour les gels gonflés que les «minces» gels 5 pi sont difficiles à transférer pour le pesage.
- Formulaire minces hydrogels pour un motif tel que décrit dans la section 2.2 (5 volume pi). Plus précisément, faire des gels avec excès thiols libres et 'pattern' la moitié de ces échantillons avec Pep1Alloc en utilisant une lamelle claire pour inonder d' exposer l'ensemble du gel avec de la lumière (par exemple, 6 gels totaux avec un excès de thiol: 3 non modifié non-'patterned 'et 3' un motif).
NOTE: Pour cet essai, «modelée» gels sont exposés à la lumière crue sans photomasque. Cette méthode est utilisée pour déterminer le nombre de thiols libres consommés dans la totalité de l'échantillon de gel et de démontrer l'efficacité avec les thiols libres peuvent être modifiés avec le peptide. A partir de cette information,le nombre de thiols libres consommés au cours d'une formation de motifs photomasque peut être prédite sur la base de l'épaisseur du gel et de la zone de motif (régions exposées à la lumière). - Place "motif" et non'patterned 'des gels dans des puits d'une plaque à 48 puits et rinçage 3 x 15 min avec le tampon de réaction d'Ellman pour permettre la diffusion d'espèces non réagis du gel et de gonflement à l'équilibre de se produire.
- Ajouter le tampon de réaction supplémentaire Ellman aux gels rincées avec la réaction de telle sorte que le tampon de V est un multiple de 20 ul. Par exemple, si V est prédite S 15 ul, ajouter le tampon de réaction 5 pi (20 pi), et si V est prédite S 30 ul, ajouter 10 ul de tampon de réaction (40 pi).
- Pipeter les normes de cystéine dans les puits individuels (ne contenant pas de gels) d'une plaque de 96 puits par multiples de 20 pi en fonction du volume utilisé dans l'étape précédente ( par exemple, si l'étape précédente avait V S + supplémentaire réaction buffer = 40 ul, ajouter 40 pi de chaque norme à des puits individuels vides).
- Diluer le réactif d'Ellman dans un tampon de réaction (multiples de 180 tampon de réaction pl + 3,6 ul de réactif d'Ellman, par exemple, pour 20 183,6 367,2 pi ou pi à 40 pi dans l' étape 3.1.2.5).
- Ajouter le réactif de Ellman dilué aux puits contenant des normes et des échantillons. Pour les échantillons de 20 ul, ajouter 183,6 pi de solution à chaque puits. Le double de cette quantité de réactif de Ellman dilué pour 40 échantillons pi (ou à l'échelle en conséquence en fonction de la taille de l'échantillon).
- Incuber ou placer sur un agitateur pendant 1 h et 30 min (à température ambiante) ou jusqu'à ce que la couleur de la solution correspond à la couleur des gels par inspection visuelle afin d'assurer une diffusion suffisante du jaune dianion 2-nitro-5-thiobenzoate (TNB 2-), qui est généré lors de la réaction du réactif de Ellman , avec des thiols libres, à partir du gel.
- Prendre 100 pi de solution à partir d'échantillons et sormes et placer dans des puits d'une plaque de 96 puits.
- Lire l'absorbance à 405 nm sur un lecteur de plaque.
- Pour traiter les données, tracer la courbe standard (échantillons de l'étape 3.1.1.3) (absorbance par rapport à la concentration) et adapter une fonction linéaire. En utilisant la fonction linéaire, la concentration de thiols libres dans la solution de «gel dilué" (gel + tampon de réaction) peut être calculée en se basant sur les lectures d'absorbance. Enfin, compte tenu de la «dilution» avec un tampon de réaction, déterminer la concentration en thiol libre dans les gels sans tampon de réaction. (Par exemple, si 15 gel ul a été dilué avec un tampon de réaction de 5 pi, multiplier par 20/15).
- Déterminer le volume de gel gonflé de «minces» gels 5 pi (V S) sur la base du rapport volumétrique de gonflement, Q.
- Visualisation des photopatterns avec le réactif d'Ellman (figure 3A).
- Faire tremper les hydrogels minces modelées avec Pep1Alloc dans le tampon de réaction d'Ellman pendant 1 heure.
- Retirer le tampon de réaction en excès en l'essuyant doucement sur les bords de l'hydrogel avec un tissu.
- Le réactif de Ellman pipette directement sur la surface du gel. Immédiatement image sur un microscope optique à 10X ou stéréomicroscope avec une caméra couleur.
Note: Les gels doivent être visualisés immédiatement , car les modes de visualisation se dissipent dans les 5 minutes que le TNB jaune 2- ions produit par clivage du réactif de Ellman , après réaction avec les thiols dans la région non-modelée diffuse dans le gel. régions non-motifs apparaissent légèrement jaune à l'œil nu; pour une meilleure résolution et des motifs plus petits, le grossissement (par exemple, l' utilisation d'un microscope) est nécessaire.
- Préparer la réaction du tampon de Ellman, la solution de travail de la cystéine, les normes et le réactif d'Ellman, comme décrit ci-dessous.
- Visualisation des Photopatterns avec fluorescentes Peptides (figure 3B).
- Pour visualiser des motifs avec une résolution plus élevée ou en trois dimensions, un photopattern Pep1Alloc AF488 modifié (ou similaire peptide fluorescent) aux gels à l'étape 2.2.
- Image sur un microscope à fluorescence. Un microscope confocal peut être utilisé ici pour prendre z-stack images du gel de telle sorte que le motif peut être observé dans les directions x, y et z avions.
NOTE: Avec la fluorescence, les gels doivent être protégés de la lumière pour assurer la stabilité du fluorophore AF488 et la fluorescence maximale. Gels ne doivent pas être immédiatement imagé depuis le peptide fluorescent est assez stable si elle est protégée de la lumière (magasin dans un récipient enveloppé dans une feuille à 4 ° C).
4. Cellule Encapsulation en hydrogels et Photopatterning
- La collecte et la préparation de cellules pour Encapsulation.
- Après les procédures stériles standards de culture de cellules de mammifères, trypsiniser et recueillir des cellules d'intérêt à partir de plaques. Quench la trypsine avec un milieu de croissance après le détachement se produit (par exemple, pour un flacon T-75, 5 ml de trypsine, éteindre avec 5 ml de milieu, rincer plaque avec 5 ml de milieu pour un total de 15 ml).
REMARQUE: Les temps trypsination peuvent varier entre les types cellulaires mais se produisent typiquement entre 5 et 15 min. detachmen cellulaires Autrest agents (par exemple, versène) peuvent être utilisés pour recueillir des cellules si on le souhaite. - Nombre de cellules (d'un minimum de 100 ou selon le protocole du fabricant) à partir aliquotes de la suspension de cellules trypsinisées à l'aide d'un hémocytomètre ou un autre dispositif de comptage de cellules pendant la centrifugation de la suspension cellulaire en vrac (90 à 110 x g, 5 min). Re-suspendre culot cellulaire après centrifugation dans un volume minimal de PBS ou un milieu de croissance et recompte si la suspension initiale de cellules trypsinisées est trop diluée.
- Remettre en suspension les cellules dans un volume minimal de STP et des portions aliquotes pour chaque condition de gel dans des microtubes de sorte qu'il y aura 5000 cellules / ul lorsqu'elle est mélangée avec la solution de gel (avant la polymérisation).
REMARQUE: Des aliquotes de cellules typiques contiennent 300,000-500,000 cellules et sont suffisantes pour faire 60-100 ul d'une suspension de gel / cellule qui peut être utilisée pour 3-5 x 20 pi avec des gels de 5000 cellules / ul. Des densités plus élevées ou plus basses cellulaires peuvent être utilisées pour l'encapsulation, en fonction de la quantité de cellule à cellulevs contact cellule-matrice désirée, respectivement, et doit être déterminée pour chaque application. - Centrifugeuse cellules / aliquotes PBS (90-110 xg, 5 min).
- Aspirer soigneusement PBS de culot cellulaire dans un tube à centrifuger juste avant encapsulation.
Remarque: si des cellules sont sensibles aux forces de cisaillement, la seconde étape de centrifugation peut être éliminé par le comptage (par exemple, hémocytomètre) et aliquotage ensuite la suspension de cellules traitées à la trypsine (Trypsine + media + cellules) dans des portions requises pour chaque état de gel. Ces aliquotes sont centrifugées une fois (90 à 110 x g, 5 min) et la trypsine + milieu est aspiré, laissant un culot cellulaire d'encapsulation.
- Après les procédures stériles standards de culture de cellules de mammifères, trypsiniser et recueillir des cellules d'intérêt à partir de plaques. Quench la trypsine avec un milieu de croissance après le détachement se produit (par exemple, pour un flacon T-75, 5 ml de trypsine, éteindre avec 5 ml de milieu, rincer plaque avec 5 ml de milieu pour un total de 15 ml).
- Cellules encapsulant dans des hydrogels non modelés.
- Immédiatement après l'aspiration PBS, suspendre les cellules granulées dans PEG4SH, Pep2Alloc, Pep1Alloc, LAP et PBS + PS + FZ tel que calculé dans la feuille de calcul à une concentration finale de 5000 cellules / ul.
- Mold et polymériser hydrogels que described dans les étapes 2.1.2 à 2.1.6.
REMARQUE: Lors de l'encapsulation des cellules dans des moules de diapositives de verre, il faut prendre soin lors du retrait du chariot supérieur post-polymérisation pour éviter le cisaillement du gel, ce qui peut entraîner la mort cellulaire. Pour aider à l'élimination du gel à partir du moule, les moules de glissement peuvent être placés dans du PBS stérile ou un milieu de croissance après la polymérisation à mouiller le joint et l'hydrogel, ce qui rend plus facile d'enlever la lame supérieure. Procédé pour empêcher tout ce cisaillement se fait par l'utilisation de moules de seringue. - gels de rinçage 3 x 10 min dans un milieu de croissance pour éliminer les espèces ayant pas réagi et l'excès de LAP.
- Incuber gels dans un milieu de croissance à 37 ° C et 5% de CO 2 jusqu'à ce que le point de temps souhaité pour une analyse ultérieure. Reconstituer moyenne toutes les 48 heures ou comme déterminé pour l'application (par exemple, l' intervalle d'alimentation typique pour le type de cellule spécifique et moyenne).
- Encapsulation Cellules et Photopatterning en présence de cellules.
- Immédiatement après l'aspiration du PBS,suspendre les cellules granulées dans PEG4SH, Pep2Alloc, LAP et PBS + PS + FZ tel que calculé dans la feuille de calcul à une concentration finale de 5000 cellules / ul. Laisser une concentration appropriée de thiols libres (par exemple, 2 mM) pour la réaction ultérieure avec Pep1Alloc.
- Mold, polymériser et hydrogels de motif tel que décrit dans les étapes 2.2.2 à 2.2.8.
- gels de rinçage 3 x 10 min dans un milieu de croissance après avoir dessiné pour éliminer les espèces non réagis et l'excès de LAP.
- Incuber gels dans un milieu de croissance à 37 ° C et 5% de CO 2 jusqu'à ce que le point de temps souhaité pour une analyse ultérieure. Reconstituer moyenne toutes les 48 heures ou comme déterminé pour l'application.
5. Détermination de l'activité Viabilité et métabolique des cellules encapsulées
- Effectuer en direct / Dead Test de cytotoxicité pour déterminer encapsulé Viabilité cellulaire (Figure 4A).
- Retirer le milieu de croissance à partir de gels et rincer 3 x 15 min avec du PBS pour permettre la diffusion de milieu de gels.
- mortes solutions Décongeler en direct / dosage de cytotoxicité (éthidium homodimère-1 et calcéine AM).
- Ajouter 2 ul des mM éthidium 2 homodimère-1 et 0,5 ul des solutions calcéine AM 4 mM à 1 ml de PBS stérile. Vortex pour assurer un mélange complet.
- Ajouter 300 pi de solution de coloration à chaque moule de gel de seringue dans des plaques à 48 puits, soit suffisante pour couvrir la surface du gel sur une lame de verre dans une boîte stérile et laisser incuber pendant 45 min.
- Retirer la solution de coloration en excès et rincer pour éliminer l'excès de colorant à partir des gels (3 x 15 min avec du PBS).
- Image sur un microscope confocal (images z-stack) ou sur un microscope à épifluorescence avec capacité z-stack à 10X et 488/525 nm Ex / Em. Quantifier le nombre de cellules viables en projetant les z-piles et en comptant le nombre de direct (vert tout au long corps cellulaire) et morts (noyaux rouges) cellules avec un logiciel d'imagerie.
- Effectuer dosage de l' activité métabolique pour déterminer l' activité de la cellule post-encapsulation (Figure 4B).
- 24 heures avant l'essai, les cellules encapsulées d'alimentation avec un milieu de croissance frais.
NOTE: Ajouter moyenne à quelques puits supplémentaires (ne contenant pas de gels ou de gels sans cellules) comme contrôle (lectures de fond). - Au point d'intérêt de temps, décongeler solution de réactif MTS.
NOTE: Afin de déterminer l'activité métabolique au fil du temps, un point de temps initial (12-24 h post-encapsulation) est recommandée comme une référence pour la comparaison avec des points de temps plus tard. - Ajouter réactif MTS à chaque puits (20 pi par 100 pi milieu de croissance).
- Incuber échantillons pour 1-4 heures à 37 ° C et 5% de CO 2, selon les instructions du fabricant.
REMARQUE: Les temps d'incubation doit être suffisante pour que les cellules afin de réduire la MTS et permettre la diffusion du produit formazan du gel. Par conséquent, les gels épais tels que des gels de pointe de la seringue peuvent nécessiter de plus longues durées d'incubation (~ 4 h) pour la réduction suffisante de MTS et de diffusion. - Pipeter 100 pi réduite MTS / Mediumdans des puits propres d'une plaque à 96 puits et enregistrer l'absorbance à 490 nm sur un lecteur de plaque.
- Soustraire l'absorbance de fond des puits sans cellules à partir des valeurs d'absorbance échantillon pour générer des valeurs d'absorbance baselined.
- 24 heures avant l'essai, les cellules encapsulées d'alimentation avec un milieu de croissance frais.
Résultats
La configuration et la procédure à photoencapsulate cellules et gels ensuite photopattern contenant des cellules encapsulées est représenté sur la figure 1, et un exemple pour la préparation de solutions mères pour former un gel à 10% en poids est fourni dans le tableau 1. En utilisant le tableau 1, la quantité de monomères (PEG4SH , Pep2Alloc, ± Pep1Alloc) et photoinitiateur (LAP) nécessaire pour polymériser hydrogels est calculé. Sur la base de ces calculs, des solutions mères de PEG4SH, Pep1Alloc, Pep2Alloc et LAP sont préparés et mélangés avec et sans Pep1Alloc pour former et photopatterning gels, respectivement (figure 1A). Par la suite, les cellules sont recueillies à partir des plaques, comptées et centrifugés dans des quantités appropriées pour l' encapsulation (figure 1B). Le culot cellulaire est remis en suspension dans une solution gélifiante (peptide / polymère / LAP dans du PBS), et des mélanges de cellules / monomères sont transférés sur du verre ou d'une seringue en moleds. Les cellules sont encapsulées dans l'hydrogel lors de l' application de la lumière (1-5 minutes de 10 mW / cm 2 à 365 nm) (figure 1C). Pour photopatterning (figure 1D), les gels sont trempés avec Pep1Alloc et LAP pendant 30 min à 1 h et 30 min, ce qui permet la diffusion de peptide et de l' initiateur dans la matrice polymérisée. Ces gels de peptides chargés sont recouverts photomasques avec des motifs souhaités et exposés à une deuxième dose de lumière (1 min) pour conjuguer les peptides à des thiols libres dans la matrice. Longes Pendentif ne sont liés de manière covalente au gel dans les régions exposées à la lumière, ce qui facilite les interactions cellule-matrice appropriés et en imitant les propriétés mécaniques et biochimiques clés du microenvironnement cellulaire natif vers sonder la fonction des cellules et le sort in vitro.
Le dosage d'Ellman fournit une méthode facile et peu coûteux de quantifier la modification de gel et de peptide incorporation dans les photopattesubstrats RNED. Modelés et gels non-motif (c. -à- gels avec ou sans modification de peptide) sont trempées dans un tampon de réaction post-polymérisation d'Ellman. Ensuite, les normes de la cystéine et les gels trempés dans du tampon sont placés dans des plaques à 48 puits et mises en incubation avec le réactif d'Ellman (figure 2A, à gauche). Au bout de 1 heure 30 minutes, des aliquotes d'échantillons sont placés dans des puits individuels d'une plaque à 96 puits et l'absorbance est enregistrée à 405 nm. Une courbe d'étalonnage (figure 2A, à droite) par rapport aux normes de cystéine est représentée graphiquement (absorbance fonction de la concentration, ajustement linéaire), et la quantité de thiols libres dans des gels peut être déterminée en fonction de leur facteur de dilution. Ces concentrations thiol libres pour différentes conditions de polymérisation et photopatterning d'un gel à 10% en poids sont indiqués dans la figure 2B. Gels polymérisé pendant 1 ou 5 minutes sans Pep1Alloc (barres bleues, I = 1 min et II = 5 min) ont des concentrations statistiquement semblables thiol libres, ce qui indique tchapeau une réaction rapide se produit et la gélification est complète en 1 min (t-test bilatéral, p> 0,05). Ainsi, une exposition supplémentaire à la lumière (2-5 minutes) ne conduit pas à une conversion ultérieure de groupes fonctionnels. Gels polymérisé pendant 1 min sans Pep1Alloc ont été imbibés Pep1Alloc (3 mg / ml) et LAP (2,2 mM) pendant 30 à 90 min (barres vertes, II = 30 min et IV = 90 min) et soumis à une deuxième dose de lumière pendant 1 min. La diminution des thiols libres (60-80% par rapport à la condition 1 min) indique une modification efficace des gels avec pendentif indices dans ces conditions. Si la modification est souhaitée plus élevée, l'augmentation des concentrations de solution Pep1Alloc peuvent être utilisés comme l'accessibilité des Pep1Alloc à des thiols libres dans des solutions plus diluées de peptides peuvent limiter la conversion; par exemple, nous avons constaté que des concentrations allant jusqu'à 20 mg / ml Pep1Alloc produisent une conversion> 90% des thiols libres.
Unique, les modèles de peptides ajoutés à l'hydrogel peutimager rapidement avec le réactif d'Ellman (figure 3A, de moins de 5 minutes). Toutefois, la visualisation du motif est perdue au cours du temps (supérieure à 5 minutes) en raison de la diffusion du jaune TNB 2- dianion à travers le gel. Pour améliorer la résolution d'imagerie et observer des modèles en trois dimensions (x, y et z-avions) et en présence de cellules, addition de peptide fluorescent (AF488Pep1Alloc) peut être utilisé. La figure 3B x, y et z projections des piles d'images prises avec un microscope confocal sont représentés, ce qui démontre la résolution du motif (échelle um).
Environ (94 ± 2)% et (94 ± 1)% de CSMh encapsulées dans des gels biodégradables (Pep2Alloc = GPQG ↓ WGQ) restent (corps verts cellulaires) viables 1 et 6 jours après l'encapsulation, respectivement, avec peu de cellules mortes (noyaux rouges ) observée (figure 4A). En outre, CSMh étalement est observée à 6 jours après l'encapsulation ( Rong> Figure 4A, encart), ce qui indique que les cellules peuvent remodeler et interagir avec ces matrices MMP-dégradables modifiés par RGDS liaison à l' intégrine. Dosages d'activité métaboliques effectuées sur des cellules encapsulées dans des gels non-dégradables (Pep2Alloc = RGKGRK) 1 et 3 jours après l'encapsulation (figure 4B) fournir une seconde mesure de la viabilité cellulaire et démontrent que les cellules restent actives pour les différentes conditions de photoencapsulation et photopatterning testés avec le dosage d'Ellman (figure 2B). En particulier, il n'y a pas de différence significative dans l'activité métabolique entre 30 min et 90 min incubations avec Pep1Alloc + LAP (conditions III et IV) et l'encapsulation initiale (conditions I et II), ce qui indique que la procédure est appropriée pour des applications de photopatterning dans la présence de cellules encapsulées (deux-tailed test t, p> 0,05).
2fig1.jpg "/>
Figure 1:. Configuration pour l' encapsulation des cellules dans les hydrogels et photopatterning ensuite avec cue biochimique (A) Les solutions mères de macromères et photoinitiateur sont préparés et mélangés (PEG4SH = épine dorsale, Pep2Alloc = réticuler, Pep1Alloc = pendentif fragment adhésif (RGDS), LAP = photoinitiateur ). (B) Les cellules sont recueillies pour l' encapsulation. (C) Les cellules sont mélangées avec des solutions macromères sans ou avec des peptides de liaison à l' intégrine (PEG4SH / Pep2Alloc / LAP ou PEG4SH / Pep2Alloc / Pep1Alloc / LAP, respectivement) et sont encapsulées lors de l' exposition à la lumière. (D) Gels contenant des groupes thiol en excès pendant la formation du gel (ici PEG4SH / Pep2Alloc / LAP formé avec 2 mM en excès de thiol) peuvent être modelées avec des indices biochimiques par l'addition subséquente de peptides fonctionnalisés par un groupe alloc unique (Pep1Alloc, par exemple, RGDS, IKVAV, etc.) pour favoriser l' adhérence cellulaireau sein des régions spécifiques du gel. Ici, la structuration des gels avec RGDS marquées par fluorescence est affichée. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
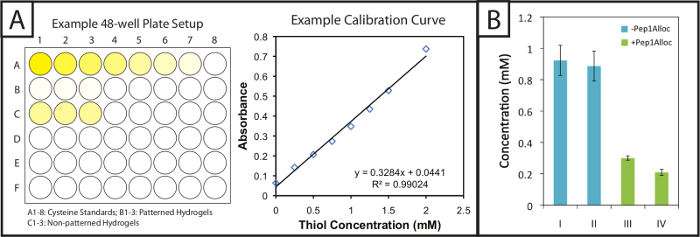
Figure 2:. La configuration et les résultats du test de Ellman quantitative pour évaluer la modification des hydrogels à motifs (A) Gels et les normes de cysteine sont incubées dans des plaques à 48 puits avec le réactif d'Ellman. Une courbe standard linéaire est tracée pour déterminer la concentration de cystéine dans des échantillons de gel. (B) des thiols libres en excès sont incorporés dans les hydrogels pendant la formation du gel et consommées lors patterning avec un alloc du peptide suspension (polymérisation min I = 1; II = 5 min polymérisation; III = 30 min d' incubation avec Pep1Alloc; IV = 90 min d' incubation wi e Pep1Alloc; à la fois III et IV polymérisées et modelées avec de la lumière pendant 1 minute). Les données présentées illustrent la moyenne (n = 3) avec des barres d'erreur indiquant l'erreur standard. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
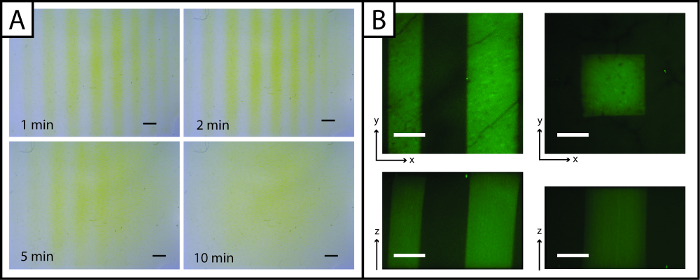
Figure 3:. Essai de Ellman et des images fluorescentes pour visualiser hydrogels photopatterned réactif de (A) Ellman peut être utilisé pour détecter rapidement les modèles (lignes) dans le x et y avions (jaune = région sans motif, barre d'échelle = 1 mm). (B) peptides fluorescents peuvent être utilisés pour observer des modèles dans le x, y et z-plans (vert = région à motifs; 200 bar um échelle; 10X objectif d' eau par immersion; Ex / Em 488/525 nm).large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
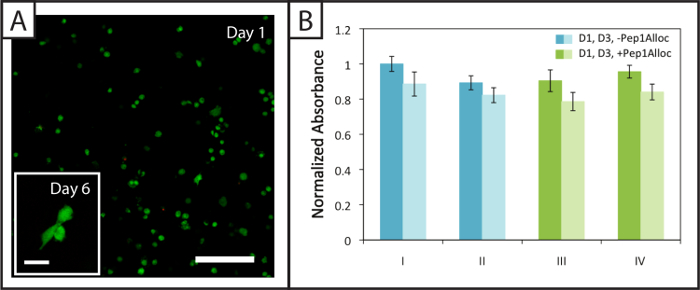
. Figure 4: Viabilité et l' activité métabolique des cellules à l' intérieur des hydrogels photopatterned non-dégradables (A) Exemple confocale z-stack (z-projection; 10X objectif eau-trempage) de viable (vert; Ex / Em 488/525 nm) et des morts CSMh (rouge; Ex / Em 543/580 nm) encapsulé dans des hydrogels 24 h post-encapsulation (barre d'échelle = 200 um). Les cellules réparties au sein de ces hydrogels 6 jours après encapsulation (image encart, barre d'échelle = 50 pm). (B) Les cellules sont métaboliquement actives 1 et 3 jours (barres sombres et claires, respectivement) post-encapsulation pour les différentes polymérisation (polymérisation = 1 min I; II = 5 min polymérisation) et les conditions de formation de motifs (III = 30 min d' incubation avec Pep1Alloc ; IV = 90 min incubation avec Pep1Alloc; à la fois polymérisé et modelé avec de la lumière pendant 1 min). Les données présentées illustrent la moyenne (n = 3) avec des barres d'erreur indiquant l'erreur standard. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
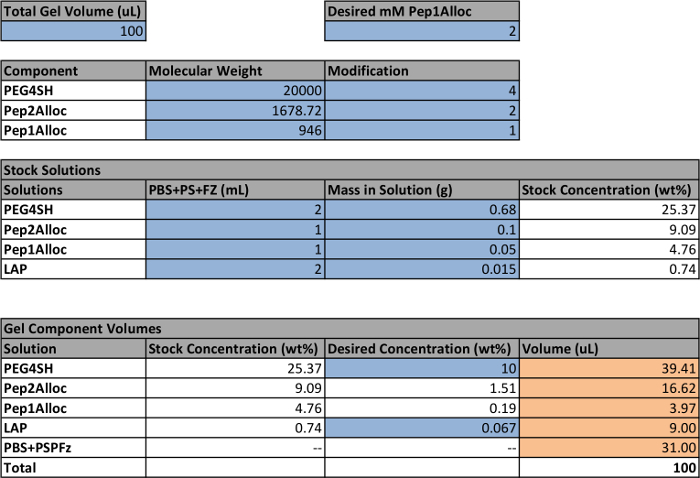
Tableau 1: exemple de configuration pour calculer les volumes de solutions d'achat d'actions pour faire hydrogels cellules dans la feuille de calcul qui sont mis en évidence en bleu indiquent les paramètres définis par l' utilisateur;. les autres quantités sont calculées en fonction de ces paramètres. Les volumes finaux pour chaque solution mère pour faire un gel sont mis en évidence en orange. Les globules blancs contiennent des formules utilisées pour calculer les volumes finaux sur la base des paramètres définis par l'utilisateur. A noter qu'une concentration de 2,2 mM LAP est équivalent à 0,067% en poids.
Discussion
La procédure présentée ici montre des techniques pour photoencapsulate cellules dans des hydrogels formés par thiol-ène chimie clic, puis photopattern les gels avec des indices biochimiques. L'utilisation de la lumière pour former un premier temps hydrogels permet un mélange homogène et à la suspension des cellules dans la solution de polymère avant la polymérisation. Rapid polymérisation "serrures" le gel dans la forme du moule défini et encapsule les cellules au sein du réseau d'hydrogel suspendu. Gels peuvent également être moulés dans de nombreuses formes différentes (par exemple, des lames de verre ou Conseils de seringues) en fonction de l'application finale souhaitée. Par exemple, les cellules encapsulées pour la culture 3D hydrogels attachés à des lames de verre sont particulièrement utiles pour les applications d'imagerie comme atténuation de la lumière est limitée dans un échantillon mince. moules de seringues peuvent être utilisés pour l'encapsulation rapide des cellules, ce qui permet un plus grand nombre d'échantillons à préparer dans un court laps de temps (par rapport à lame de verres) qui peuvent être utilisés pour des expériences nécessitant un grand nombre de cellules telles que la cytométrie de flux ou qPCR. Par la suite, ces gels peuvent ensuite être modelés avec des indices biochimiques pour obtenir des réponses cellulaires désirées telles que la différenciation ou de l' invasion. 30,31
Des dosages pour la viabilité et l'activité métabolique indiquent la survie des cellules du système des matériaux et des conditions de formation de motifs présentés. Notez que l'activité métabolique a été suivie jusqu'à ce jour 3 dans des gels non-dégradables (RGKGRK peptide réticuler) pour évaluer les premiers effets des conditions de polymérisation et de structuration sur la fonction cellulaire. En outre, un test d'intégrité de la membrane (live morte viabilité / cytotoxicité coloration /) de CSMh à 1 et 6 jours après l'encapsulation dans des gels formulés avec un peptide réticuler dégradable (GPQGIWGQ) soutient que les cellules restent viables et la propagation de 1 semaine dans la culture. La viabilité des lignées cellulaires supplémentaires ont été rapportés dans des conditions de photopatterning 32 similaires à cellesutilisé ici et peut être évalué pour le système d'hydrogel décrit en utilisant une coloration vivants / morts et des dosages de l'activité métabolique. Bien que nous n'avons pas observé des problèmes avec la viabilité des cellules en utilisant ce système de matériaux et les procédures connexes (4.2 et 4.3), certains types de cellules peuvent être sensibles à des radicaux libres et / ou exposition à la lumière. Dans ce cas, les utilisateurs peuvent envisager d' utiliser des systèmes de matériaux non-photoamorcées, comme l' azoture-alcyne, 12 FXIII, 31 ou chimies de formation d'hydrogel à base de Alder Diels. 33
techniques Facile pour détecter et quantifier la structuration de signaux biochimiques dans les gels sont également présentés (3.1 et 3.2). L'analyse d'Ellman est particulièrement intéressante parce que les réactifs sont disponibles dans le commerce et aucune des étapes de traitement supplémentaires ou des réactifs de synthèse plus coûteux (par exemple, un peptide marqué par fluorescence) sont nécessaires. Le dosage d'Ellman peut être utilisé pour déterminer avec précision la modification des thiols libres avec des indices biochimiques sous différephotopatterning nt conditions, ainsi que de visualiser rapidement les modèles. Pour quantifier le peptide incorporation, la concentration en fonction thiol avant et après la structuration, comme une mesure quantitative du peptide incorporation, est évalué directement avec le test d'Ellman. Bien que ce type de dosage peut être effectué avec des peptides marquées par fluorescence, 34 quantification basée sur l' imagerie nécessite plus de traitement et d' analyse des mesures qui prennent du temps (par exemple, la synthèse d'un peptide et la génération marquée par fluorescence d'une courbe d'étalonnage rapportent la fluorescence à la concentration du peptide en utilisant l'analyse de l'image). Pour l'imagerie incorporation du peptide, le réactif d'Ellman peut être appliqué directement à des échantillons et immédiatement visualisé. Bien que limité au x et y avions pour motif la visualisation, la technique peut être utilisée comme une méthode simple, la routine pour déterminer si des matrices contenant des groupes thiol libres ont été modelé. Il est important de noter que l'analyse d'Ellman est pas ccytocompatible onsidered, si bien qu'il peut être utilisé pour observer et quantifier photopatterns, il ne peut pas être fait en présence de cellules. Formation de motifs pour former une image en trois dimensions et en présence de cellules, la conjugaison de peptides fluorescents dans des matrices d'hydrogel reste une approche puissante et la plus utilisée. La résolution des motifs peut être évaluée dans les directions x, y et z plans en utilisant la microscopie confocale, et cette méthode est cytocompatible de telle sorte que les cellules dans les régions à motifs ou régions sans motifs peuvent être identifiés. Pris ensemble, les techniques d'analyse et fondées sur l'imagerie de Ellman sont des outils complémentaires pour les chercheurs d'évaluer quantitativement et qualitativement l'photopatterning des signaux biochimiques au sein du système des matériaux.
Photoclick, ou plus largement photoinitiée, chimies pour la formation et la modification des hydrogels en présence de cellules sont nombreuses. Les moulage, encapsulation et structuration des techniques présentées ici ne sont pas limitée au système matériel décrit et peut être appliquée à des chimies basées sur la lumière de remplacement, comme thiol alcyne, 35 azide alcyne, 4 et autres chimies thiol-ène (par exemple un thiol norbornène), 10,13, ainsi qu'avec différents photoinitiateurs, tels que Irgacure 2959, l'éosine Y, et de la camphoquinone. Remarque, les utilisateurs peuvent avoir besoin d'ajuster les paramètres de procédure (par exemple, des temps d'incubation, le temps de polymérisation, la densité cellulaire) pour veiller à ce que les conditions restent cytocompatible pour ces autres systèmes. Etant donné que le processus de mise en forme nécessite la diffusion du peptide (s) modifié par alloc dans l'hydrogel (2.2.3-2.2.5), ce procédé peut se révéler plus utiles pour l'addition de groupements de liaison à l' intégrine (par exemple, des peptides ou des protéines de la matrice extracellulaire fragments) à l'hydrogel, où la fixation du ligand au réseau est nécessaire pour la génération de forces de traction par l'activation complète des cellules et des intégrines. 36 noter que pour les biomolécules qui peuventêtre tout aussi actif en solution ou à l' immobilisation (par exemple, des facteurs de croissance ou des cytokines), l'étape d'incubation de la diffusion de la fraction (~ 1 h) dans l'hydrogel pourrait conduire à des événements qui convolute les résultats de formation de motifs de signalisation. D' autres méthodes ont été établies pour l' immobilisation du facteur de croissance ou de séquestration locale pour leur structuration. 37-39 En outre, la résolution de motif est dictée par le contrôle de l' exposition lumineuse. Ici, les photomasques permettent la création de motifs sur toute la profondeur du gel et dans les axes x et y plans; cependant, un plus grand contrôle sur l' espace de motif de signaux biochimiques à l'intérieur des gels peut être réalisée avec d' autres méthodes d'irradiation telles que l'utilisation d'un microscope confocal à deux photons pour générer des motifs dans les directions x, y et z- avions. 34,40 Enfin, il est important de noter que si le système matériau utilisé dans ce procédé est seulement d'abord modifié avec des indices biochimiques chimies photoclick orthogonales pourraient être utilisés pour permettre alterations dans les propriétés de la matrice au fil du temps. 12 La procédure et les techniques présentées ici ajoutent la diversité des approches actuelles pour créer des matrices synthétiques avec des propriétés bien définies et spatiotemporellement contrôlées. En particulier, la disponibilité commerciale des réactifs et des matériaux utilisés dans cette procédure sera utile à un large éventail de chercheurs intéressés par l'utilisation de biomatériaux à base d'hydrogel pour des applications en culture cellulaire contrôlée.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Ce travail a été soutenu par les programmes du Delaware Cobre dans la découverte de médicaments et en biomatériaux de pointe financés par les prix de développement institutionnel de l'Institut national des sciences médicales Généraux des Instituts nationaux de la santé (P20GM104316 et P30 GM110758-01, respectivement), les Pew Charitable Trusts (00026178), un Prix national de carrière science Foundation (DMR-1253906), le Fonds Burroughs Wellcome (1006787), et le programme national science Foundation IGERT SBE2 à l'Université du Delaware (de bourses à L. Sawicki). Les auteurs remercient le Centre BioImaging Delaware Institut de biotechnologie à l'Université du Delaware pour la formation et l'accès à la microscopie confocale, Mme Katherine Wiley pour l'assistance pendant le tournage de la vidéo, M. Matthew Rehmann pour fournir généreusement CSMh isolées à partir de la moelle osseuse, le professeur Christopher J . Kloxin et M. Stephen Ma pour fournir généreusement photomasques, et le professeur Wilfred Chen pour l'utilisation du lecteur de plaque automatique.
matériels
| Name | Company | Catalog Number | Comments |
| Custom Peptides | Various Vendors | ---- | Peptides may also be synthesized via standard SPPS techniques with materials from vendors including ChemImpex and ChemPep. |
| 4-arm PEG Thiol, MW 20k | JenKem USA | 4ARM-SH | Listed under Multi-arm Homofunctional PEGs. PEG4SH may also be synthesized as previously referenced. |
| Lithium Phenyl-2,4,6-trimethylbenzoylphosphinate | Colorado Photopolymer Solutions | Li-TPO | |
| Dimethyl Phenylphosphonite | Sigma Aldrich | 149470 | Caution, causes severe skin burns and eye damage. Wear protective gloves, clothing, and eye protection. |
| 2,4,6-Trimethylbenzoyl Chloride | Sigma Aldrich | 682519 | Caution, causes severe skin burns and eye damage. Wear protective gloves, clothing, and eye protection. |
| Lithium Bromide | Sigma Aldrich | 213225 | |
| 2-Butanone | Sigma Aldrich | 360473 | |
| Flask, Round Bottom, 100 ml | Chemglass | CG-1506-05 | |
| 80 ml Filter Funnel, Buchner, Medium Frit | Chemglass | CG-1402-L-02 | Filter paper inside a regular glass funnel may be used if desired. |
| Magnetic Stir Bars | Various Vendors | ---- | |
| Magnetic Stirring and Hot Plate | Various Vendors | ---- | |
| Vacuum Dessicator | Various Vendors | ---- | |
| Deuterium Oxide | Acros Organics | 16630 | |
| Dulbecco's Phosphate Buffered Saline | ThermoFisher Scientific | 14190-250 | |
| Penicillin Streptomycin | ThermoFisher Scientific | 15070-063 | |
| Fungizone | ThermoFisher Scientific | 15290-018 | |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher Scientific | 15400-054 | Select appropriate medium and trypsin depending on cell type. |
| Microcentrifuge tubes | Various Vendors | ---- | 1.5 or 2 ml sizes, sterile. |
| BD Syringe with Slip (Luer) Tips (Without Needle) | Fisher Scientific | 14-823-16H | Product number listed here is for a 1 ml syringe (16H), Various sizes are available (14-823-XX). |
| Fisherfinest Premium Plain Glass Microscope Slides | Fisher Scientific | 12-544-1 | |
| High-Purity Silicone Rubber, 0.010" Thick, 6" x 8" Sheet, 55A Durometer (Gasket) | McMaster Carr | 87315K62 | |
| Ethanol, 200 Proof | Decon Labs | 2701 | |
| RainX, Original | Amazon | 800002243 | May be purchased from other vendors. |
| Sigmacote | Sigma Aldrich | SL2 | |
| Photomasks | Advance Reproductions Corporation | ---- | Photomask Division, different designs may be printed as desired. |
| DTNB; Ellman's Reagent; 5,5-dithio-bis(2-nitrobenzoic acid) | ThermoFisher Scientific | PI-22582 | |
| Sodium Phosphate Dibasic | Sigma Aldrich | S5136 | |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E6758 | |
| Sodium Hydroxide, Pellets/Certified ACS | Fisher Scientific | S318 | |
| Orthophosphoric Acid | Alfa Aesar | 33266 | |
| Cysteine Hydrochloride Monohydrate | Sigma Aldrich | C7880 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | ThermoFisher Scientific | L-3224 | |
| CellTiter 96 Aqueous One Solution Assay | Promega | G3582 | |
| Centrifuge | Various Vendors | ---- | Capable of speeds at 90-110 x g. |
| Multiwell Plate Reader | Various Vendors | ---- | Capable of reading absorbance at 405 nm in a 96-well plate. |
| Epifluorescent or Confocal Microscope | Various Vendors | ---- | To visualize peptide patterns and cells within hydrogels. |
| Omnicure Exfo Series 2000 | Excelitas Technologies | ---- | Alternate light systems may be used to polymerize hydrogels. |
| Zeiss Zen Lite Software | Zeiss | ---- | Available at zeiss.com; compatible with images taken on Zeiss microscopes |
| ImageJ | NIH | ---- | Available at imagej.nih.gov; applicable for general image analysis |
Références
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew Chemie - Int Ed. 40 (11), 2004-2021 (2001).
- Xi, W., Scott, T. F., Kloxin, C. J., Bowman, C. N. Click Chemistry in Materials Science. Adv Funct Mater. 24 (18), 2572-2590 (2014).
- Azagarsamy, M. A., Anseth, K. S. Bioorthogonal click chemistry: An indispensable tool to create multifaceted cell culture scaffolds. ACS Macro Lett. 2 (1), 5-9 (2013).
- Adzima, B. J., Tao, Y., Kloxin, C. J., DeForest, C. A., Anseth, K. S., Bowman, C. N. Spatial and temporal control of the alkyne-azide cycloaddition by photoinitiated Cu(II) reduction. Nat Chem. 3 (3), 256-259 (2011).
- Hoyle, C. E., Bowman, C. N. Thiol-ene click chemistry. Angew Chemie - Int Ed. 49 (9), 1540-1573 (2010).
- Fan, Y., Deng, C., Cheng, R., Meng, F., Zhong, Z. In situ forming hydrogels via catalyst-free and bioorthogonal "tetrazole-Alkene" photo-click chemistry. Biomacromolecules. 14 (8), 2814-2821 (2013).
- Burdick, J. A., Murphy, W. L. Moving from static to dynamic complexity in hydrogel design. Nat Commun. 3, 1269 (2012).
- Rehmann, M. S., Kloxin, A. M. Tunable and dynamic soft materials for three-dimensional cell culture. Soft Matter. 9 (29), 6737-6746 (2013).
- Yang, T., Long, H., Malkoch, M., Gamstedt, K. E., Berglund, L., Hult, A. Characterization of well-defined poly(ethylene glycol) hydrogels prepared by thiol-ene chemistry. J Polym Sci Part A Polym Chem. 49 (18), 4044-4054 (2011).
- Fairbanks, B. D., et al. A versatile synthetic extracellular matrix mimic via thiol-norbornene photopolymerization. Adv Mater. 21 (48), 5005-5010 (2009).
- Roberts, J. J., Bryant, S. J. Comparison of photopolymerizable thiol-ene PEG and acrylate-based PEG hydrogels for cartilage development. Biomaterials. 34 (38), 9969-9979 (2013).
- DeForest, C. A., Polizzotti, B. D., Anseth, K. S. Sequential click reactions for synthesizing and patterning three-dimensional cell microenvironments. Nat Mater. 8 (8), 659-664 (2009).
- Lin, C. C., Ki, C. S., Shih, H. Thiol-norbornene photoclick hydrogels for tissue engineering applications. J Appl Polym Sci. 132 (8), (2015).
- Sawicki, L. A., Kloxin, A. M. Design of thiol-ene photoclick hydrogels using facile techniques for cell culture applications. Biomater Sci. 2 (11), 1612-1626 (2014).
- Patterson, J., Hubbell, J. A. Enhanced proteolytic degradation of molecularly engineered PEG hydrogels in response to MMP-1 and MMP-2. Biomaterials. 31 (30), 7836-7845 (2010).
- Fairbanks, B. D., Singh, S. P., Bowman, C. N., Anseth, K. S. Photodegradable, photoadaptable hydrogels via radical-mediated disulfide fragmentation reaction. Macromolecules. 44 (8), 2444-2450 (2011).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Yang, F., et al. The effect of incorporating RGD adhesive peptide in polyethylene glycol diacrylate hydrogel on osteogenesis of bone marrow stromal cells. Biomaterials. 26 (30), 5991-5998 (2005).
- Wacker, B. K., et al. Endothelial cell migration on RGD-peptide-containing PEG hydrogels in the presence of sphingosine 1-phosphate. Biophys J. 94 (1), 273-285 (2008).
- Wilson, M. J., Liliensiek, S. J., Murphy, C. J., Murphy, W. L., Nealey, P. F. Hydrogels with well-defined peptide-hydrogel spacing and concentration: impact on epithelial cell behavior. Soft Matter. 8 (2), 390-398 (2012).
- Qiong Liu, S., et al. Injectable biodegradable polyethylene glycol/ RGD peptide hybrid hydrogels for in vitro chondrogenesis of human mesenchymal stern cellsa. Macromol Rapid Commun. 31 (13), 1148-1154 (2010).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126 (4), 677-689 (2006).
- Levental, I., Georges, P. C., Janmey, P. A. Soft biological materials and their impact on cell function. Soft Matter. 3 (3), 299-306 (2007).
- Lin, C. C., Raza, A., Shih, H. PEG hydrogels formed by thiol-ene photo-click chemistry and their effect on the formation and recovery of insulin-secreting cell spheroids. Biomaterials. 32 (36), 9685-9695 (2011).
- Khetan, S., Burdick, J. Cellular encapsulation in 3D hydrogels for tissue engineering. J Vis Exp. (32), e1590 (2009).
- Bryant, S. J., Nuttelman, C. R., Anseth, K. S. Cytocompatibility of UV and visible light photoinitiating systems on cultured NIH/3T3 fibroblasts in vitro. J Biomater Sci Polym Ed. 11 (5), 439-457 (2000).
- Burdick, J. A., Chung, C., Jia, X., Randolph, M. A., Langer, R. Controlled Degradation and Mechanical Behavior of Photopolymerized Hyaluronic Acid Networks Controlled Degradation and Mechanical Behavior of Photopolymerized Hyaluronic Acid Networks. Society. 6 (1), 386-391 (2005).
- Marsano, E., Gagliardi, S., Ghioni, F., Bianchi, E. Behaviour of gels based on (hydroxypropyl) cellulose methacrylate. Polymer (Guildf). 41 (21), 7691-7698 (2000).
- Bryant, S. J., Anseth, K. S. Photopolymerization of Hydrogel Scaffolds. Scaffolding Tissue Eng. , 71-90 (2005).
- Khetan, S., Burdick, J. A. Patterning hydrogels in three dimensions towards controlling cellular interactions. Soft Matter. 7 (3), 830-838 (2011).
- Mosiewicz, K. A., et al. In situ cell manipulation through enzymatic hydrogel photopatterning. Nat Mater. 12 (11), 1072-1078 (2013).
- Williams, C. G., Malik, A. N., Kim, T. K., Manson, P. N., Elisseeff, J. H. Variable cytocompatibility of six cell lines with photoinitiators used for polymerizing hydrogels and cell encapsulation. Biomaterials. 26 (11), 1211-1218 (2005).
- Nimmo, C. M., Owen, S. C., Shoichet, M. S. . Diels - Alder Click Cross-Linked Hyaluronic Acid Hydrogels for Tissue Engineering. , 824-830 (2011).
- DeForest, C. A., Anseth, K. S. Cytocompatible click-based hydrogels with dynamically tunable properties through orthogonal photoconjugation and photocleavage reactions. Nat Chem. 3 (12), 925-931 (2011).
- Fairbanks, B. D., Sims, E. A., Anseth, K. S., Bowman, C. N. Reaction rates and mechanisms for radical, photoinitated addition of thiols to alkynes, and implications for thiol-yne photopolymerizations and click reactions. Macromolecules. 43 (9), 4113-4119 (2010).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Wylie, R. G., et al. Spatially controlled simultaneous patterning of multiple growth factors in three-dimensional hydrogels. Nat Mater. 10 (10), 799-806 (2011).
- Pompe, T., Salchert, K., Alberti, K., Zandstra, P., Werner, C. Immobilization of growth factors on solid supports for the modulation of stem cell fate. Nat Protoc. 5 (6), 1042-1050 (2010).
- Hudalla, G. A., Murphy, W. L. Biomaterials that regulate growth factor activity via bioinspired interactions. Adv Funct Mater. 21 (10), 1754-1768 (2011).
- Lee, S. H., Moon, J. J., West, J. L. Three-dimensional micropatterning of bioactive hydrogels via two-photon laser scanning photolithography for guided 3D cell migration. Biomaterials. 29 (20), 2962-2968 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon