Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Facile und umweltfreundliche Weg zu fabrizieren Poly (Milchsäure) Scaffolds mit Graded Porengröße
In diesem Artikel
Zusammenfassung
In this work, poly(lactic acid)/polyethylene glycol (PLA/PEG) scaffolds were prepared by using a combination of melt mixing and selective leaching. The method herein discussed permitted to develop three-layer scaffolds by highly controlling both porosity and pore size. The mechanical properties were also evaluated in a physiological environment.
Zusammenfassung
Over the recent years, functionally graded scaffolds (FGS) gaineda crucial role for manufacturing of devices for tissue engineering. The importance of this new field of biomaterials research is due to the necessity to develop implants capable of mimicking the complex functionality of the various tissues, including a continuous change from one structure or composition to another. In this latter context, one topic of main interest concerns the design of appropriate scaffolds for bone-cartilage interface tissue. In this study, three-layered scaffolds with graded pore size were achieved by melt mixing poly(lactic acid) (PLA), sodium chloride (NaCl) and polyethylene glycol (PEG). Pore size distributions were controlled by NaCl granulometry and PEG solvation. Scaffolds were characterized from a morphological and mechanical point of view. A correlation between the preparation method, the pore architecture and compressive mechanical behavior was found. The interface adhesion strength was quantitatively evaluated by using a custom-designed interfacial strength test. Furthermore, in order to imitate the human physiology, mechanical tests were also performed in phosphate buffered saline (PBS) solution at 37 °C. The method herein presented provides a high control of porosity, pore size distribution and mechanical performance, thus offering the possibility to fabricate three-layered scaffolds with tailored properties by following a simple and eco-friendly route.
Einleitung
The interest in biodegradable polymers has grown in importance during the last years both in academia and in the industry, due to the rising concerns regarding plastic waste and the reduction in using non-renewable sources1-7. In particular, biocompatible and biodegradable synthetic polymers are widespread in several biomedical application fields, such as drug controlled release8,9, absorbable suture threads8,10, bioprocess intensification11 and tissue engineering12.
Tissue engineering focuses on the development of devices capable to restore and maintain normal function in diseased or injured tissues. Most of the native tissues are composed by different types of cells and extracellular matrices (ECMs) in specific spatial hierarchies. For example, articular cartilage (AC) consists of different zones with varying types and orientations of collagen fibers and collagen-binding proteins. Moreover, cartilage and bone show significantly different hierarchical structures. In this context, the preparation of multilayer scaffolds with engineered properties in each layer could allow replacing heterogeneous tissues by taking into accounts all the local microenvironments of these complex systems13,14.
Based on the cellular/biological and/or physical-chemical characteristics of the scaffolds, the main strategies adopted by the tissue engineering can be divided into monophasic, biphasic, and triphasic. Biphasic and triphasic approaches (BTA) use two or three different pores architectures, materials, or fillers to prepare multilayered functional devices. Furthermore, a single material can be used to achieve biphasic or triphasic devices, as long as it is possible to create a gradient in its physical properties12.
Cell migration plays a key-role in the morphogenesis, inflammation, wound healing and tumor metastasis. Cell movement is encouraged by the presence of a gradient of chemical-physical properties from the surface to the core of the device. Therefore, biomaterials fulfilling the above discussed requirements can be helpful in studying cell migration. In addition to chemical gradients that trigger cells migration (chemotaxis), mechanical properties of cells culture substrate can also lead to cell movement (mechanotaxis)15.
The multilayer structure can also provide the tunable release of specific drugs incorporated within the polymer matrix, by changing the specific area of the layer or the amount of loaded drugs.
Over the past decade, in order to develop scaffolds possessing a discrete or continuous gradient of morphological properties, such as porosity or pore size, several approaches have been presented16-31. The most recent papers focused on the preparation of BTA by adopting: particle leaching 12,28,32, gas foaming technique16, electrospinning17-19, layer by layer casting technique20, rapid prototyping21,22, thermally induced phase separation (TIPS)22, centrifugation freeze drying24,25, triply periodic minimal surfaces (TPMS)26, freeze casting27-30.
Within the frame of this work, we present a fast and simple route to achieve PLA-based three-layer porous scaffolds (TLS), by combining melt mixing, compression molding and salt leaching. Differently from most of the technologies commonly used for scaffold production, the strategy herein adopted can be considered fully eco-friendly, since it does not require any toxic solvent potentially dangerous for environment and for living cells and tissues32. The basic processing-structure-property relationships established in this study by analyzing both morphological features and mechanical behavior of fabricated devices provide guidance to future advances in designing multifunctional graded scaffolds with specific target properties.
Protokoll
1. Scaffold Fabrication
- Mahlen NaCl in einem Labormischer für 20 min trocknen und es auf einem Erhitzer auf 100 ° C.
- Setzen Sie den getrockneten NaCl (45 g zum Zeitpunkt) in einer Siebmaschine 30 Minuten bei der höchsten verfügbaren Frequenz ohne in Resonanz auftritt. Sammeln sechs Salzfraktionen, im Bereich von 500 um bis 1000 um (M 500); von 300 um bis 500 um (M 300); von 100 um bis 200 um (M 100); von 90 um bis 100 (M 90); von 45 & mgr; m bis 65 & mgr; m (M 45) und schließlich 10 M mit Salzpartikel Größe kleiner als 45 um , wie in Abbildung 1 schematisch dargestellt.
- Vakuum-Trocknen über Nacht alle Materialien, um hydrolytische Spaltung bei der Verarbeitung zu vermeiden. Für jedes Material wählen, die Temperatur, um den Trocknungsgrad ohne Überwindung zu maximieren - im Falle von Polymeren, - die Glasübergangs. Daher T = 90 ° C für PLA und T = 25 ° C für PEG, T = 105 ° C für NaCl wählen.
- FütternPLA, PEG und NaCl, mit einem Gewichtsprozentzusammensetzung 20/5/75 jeweils zu einem Chargenmischer Betriebs bei T = 190 ° C, und n = 60 rpm und dann verarbeiten, bis ein konstanter Wert des Drehmoments zu erreichen, in der Regel nach ca. 10 Minuten. Danach sammeln schnell das erhaltene Material.
- Bereiten Sie die Monoschichten durch eine Laborpresse bei 210 ° C betrieben wird, legen Sie die Mischungen in geeigneten zylindrischen Formen mit einem Durchmesser von 10 mm und einer Höhe von 3 mm und halten sie für 60 Sekunden bei Umgebungsdruck und 3 Minuten bei 180 bar . Danach kühlen die Mischungen bei Raumtemperatur, um den Druck von 180 bar gehalten wurde.
- Versammlung der Drei-Schichten über Formpressen
- Bereiten Sie jede einzelne Schicht in der gleichen Weise wie in (1.5), aber unter Verwendung unterschiedlicher Formen, dh einen Durchmesser von 10 mm und einer Höhe von 1 mm. Schließlich erhalten 6 Scheiben mit einem Durchmesser von 10 mm und einer Höhe von 1 mm, mit sechs unterschiedlichen Teilchengrößen: M 500, M 300, M 100,
- for Montage dreischichtige Gerüst A (TLS A), häufen sich M 500, M 300 und M 100 innerhalb der zylindrischen Form und kompressions formen sie in einer Laborpresse für 60 Sekunden bei Umgebungsdruck und 3 Minuten bei 210 ° C, der bei 180 bar und abgekühlt, dann bei Raumtemperatur, um den Druck von 180 bar gehalten wurde.
HINWEIS: Bereiten Sie die TSL B von M aufeinander stapeln 90, M 45 und M 10 in den gleichen Formen und führen die Formpressen Betrieb durch das gleiche Verfahren wie für die TLS-A verwendet folgende
- Entfernen Sie die Platten aus den zylindrischen Formen und steckte sie in einem siedenden Wasserbad entmineralisiert, ohne sich zu rühren. 3 Stunden nach, entfernen Sie die erhaltenen porösen Strukturen aus dem Bad und lassen Sie sie für 12 Stunden bei Raumtemperatur in einer chemischen Haube trocken.
2. Morphologische Analyse
- Werten die Morphologien der Gerüste durch Rasterelektronenmikroskopie.
- Überwinden Sie die Proben unter flüssigem Stickstoff und befestigen Sie dann dieProben auf einem Aluminium Stub einen Klebstoff Kohlenstoffband verwendet wird. Schließlich Sputter-coate mit Gold für 90 s unter Argonatmosphäre vor der Abbildung, um während der Prüfung elektrostatische Entladungen zu vermeiden.
3. Scaffold Porengröße
- Aufwendige die durch SEM-Analyse erhaltenen Bilder mit einer Bildverarbeitungssoftware können die Porengrößenverteilung des Gerüsts zu erkennen.
HINWEIS: In dieser Arbeit wird die Verteilungsanalyse Porengröße wurde zuvor eine MATLAB-basierte Software durchgeführt 33 beschrieben
4. Porösität
- Wiegen der Proben vor dem Auslaugen und bewerten die theoretische Porosität nach dem folgenden Ausdruck:
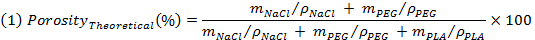
HINWEIS: M NaCl, m und m PEG PLA, sind jeweils die theoretische Masse von NaCl, PEG und PLA, durch homogene Mischungen übernehmen. Ter Dichten (ρ) von NaCl, PEG und PLA jeweils 2,16 g / cm 3, 1,12 g / cm 3 e 1,24 g / cm 3. - Wiegen Sie die Proben nach dem Auslaugen und Trocknen, um die scheinbare Dichte der Proben (ρ Gerüst) zu beurteilen, und dann auszuwerten die reale Porosität als der Kehrwert des Verhältnisses zwischen der scheinbaren Dichte des Gerüsts und die Dichte des nicht-porösen PLA durch Verwendung von Ausdruck (2).
HINWEIS: Es drückt das Verhältnis zwischen dem Leervolumen des Gerüsts und das volle Volumen des Gerüsts (leer + voll).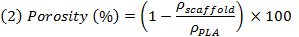
5. Mechanische Eigenschaften
- Testen Sie die Proben unter Druckmodus einen Zug-Maschine, ausgerüstet mit einer 1 kN Lastzelle. Stellen Sie einen konstanten Verformungsgeschwindigkeit von 1 mm min -1.
- Um die mechanische Leistung der Proben in physiologischer Umgebung zu untersuchen, statten die dynamometer mit einem Bad mit (PBS) (pH = 7,4) bei 37 ° C und den Test mit dem gleichen Aufbau wie in Punkt 5.1 beschrieben durchführen.
- Vor jeder Messung in feuchter Umgebung, genießen Sie die Proben mit PBS in einem Vakuumflasche für 5 Minuten, um PBS zu lassen alle Poren füllen. Danach ermöglichen es die Gerüste für 15 min bei 37 ° C in PBS zu bleiben, um die Solltemperatur zu erreichen.
- Bestimmung der Grenzflächenhaftfestigkeit (IAS) zwischen den Schichten von TL und TL A B durch eine anwendungsspezifische Grenzflächenfestigkeit Testausrüstung verwendet, die mit einer mechanischen Prüfmaschine nach einem Verfahren in der Literatur beschrieben 32,34.
- Befestigen Sie das Gerüst auf der Anlage und sorgen für die korrekte Ausrichtung mit der Wägezelle und Grundplatte der Maschine. Bringen Sie die Gerüst Proben auf Aluminiumtest Stubs durch eine hohe Viskosität Klebstoff und legen Sie sie in das Gerät zum Testen.
- Für den nassen Zustand Test, Hydrat die Proben in PBS für 1 Stunde prioder zum Testen. Verwenden einer 1 kN Lastzelle unter einer Zugbelastung bei einer Dehnungsgeschwindigkeit von 1 mm aufgetragen min -1.
Hinweis: Berücksichtigen Sie, dass der Ausfall entweder bei der Zugfestigkeit von einer der Schichten oder wegen der Ablösung an den Schnittstellen auftreten können. Bewerten Sie die IAS als die maximale Stärke der Spannungs-Dehnungs-Kurve.
Ergebnisse
Der Einfluss von NaCl Partikelgröße auf der Porenarchitektur der Gerüste wurde qualitativ und quantitativ bewertet , indem die Morphologie der Proben untersucht und die Porengrößenverteilung durch Bildanalyse zu berechnen, jeweils 2a Figur -. F zeigt SEM - Aufnahmen von einschichtigen Gerüste resultierende von Salz-Auslaugung von Materialien mit unterschiedlichen NaCl Partikelgrößen enthält.
Diskussion
Der erste wichtige Schritt ist die Optimierung der Effizienz Siebung. Die hohe Kontrolle der NaCl-Partikelgröße ist von grundlegender Bedeutung für die Herstellung Gerüst mit gewünschten Porengrößenverteilung. Ein weiterer wichtiger Schritt ist die Vermeidung der Bruch der dünnen PLA Monolayern während der Probenentnahme aus der Form. Die Bildverarbeitungs Analyse möglicherweise nicht repräsentativ für das gesamte Gerät.
Während Zugversuche kann die Probe losreißen von dem Ger...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was financially supported by INSTM.
Materialien
| Name | Company | Catalog Number | Comments |
| Poly(lactic acid) | NatureWorks | PLA 2002D | |
| Poly(ethylene glycol) | Sigma | 83797-1KG-F | |
| Sodium Cloride | Sigma | 793566-5KG-D | |
| Phosfate Buffer Solution | Sigma | P5368-10PAK | |
| Laboratory Mixer | Brabender | PLE 330 - Plasticorder | |
| Laboratory Press | Carver | ||
| Scanning Electron Microscopy | Phenom-world | ProX | |
| Universal Testing Machine | Instron | 3365 (UK) | |
| BioPuls Bath | Instron, Norwood | ||
| Sieving Machine | Endecotts | E.V.F.1. | |
| Vacuum Oven | ISCO | NSV9035 | |
| Precision Balance | Sartorius | AX224 |
Referenzen
- Scaffaro, R., Morreale, M., Lo Re, G., Mantia, F. P. La Degradation of Mater-Bi®/wood flour biocomposites in active sewage sludge. Polymer Degradation and Stability. 94 (8), 1220-1229 (2009).
- Scaffaro, R., Botta, L., Passaglia, E., Oberhauser, W., Frediani, M., Di Landro, L. Comparison of different processing methods to prepare poly(lactid acid)-hydrotalcite composites. Polymer Engineering & Science. 54 (8), 1804-1810 (2014).
- Thakur, V. K., Thakur, M. K. Recent advances in graft copolymerization and applications of chitosan: A review. ACS Sustainable Chemistry and Engineering. 2 (12), 2637-2652 (2014).
- Thakur, V. K., Thakur, M. K. Recent advances in green hydrogels from lignin: A review. International Journal of Biological Macromolecules. 72, 834-847 (2015).
- Thakur, V. K., Kessler, M. R. Self-healing polymer nanocomposite materials: A review. Polymer. 69, 369-383 (2015).
- Thakur, V. K., Thakur, M. K. Recent trends in hydrogels based on psyllium polysaccharide: a review. Journal of Cleaner Production. 82, 1-15 (2014).
- Voicu, S. I., Condruz, R. M., et al. Sericin Covalent Immobilization onto Cellulose Acetate Membrane for Biomedical Applications. ACS Sustainable Chemistry & Engineering. 4 (3), 1765-1774 (2016).
- Scaffaro, R., Botta, L., Sanfilippo, M., Gallo, G., Palazzolo, G., Puglia, A. M. Combining in the melt physical and biological properties of poly(caprolactone) and chlorhexidine to obtain antimicrobial surgical monofilaments. Applied Microbiology and Biotechnology. 97 (1), 99-109 (2013).
- Scaffaro, R., Maio, A., et al. Synthesis and self-assembly of a PEGylated-graphene aerogel. Composites Science and Technology. 128, 193-200 (2016).
- Scaffaro, R., Botta, L., Gallo, G., Puglia, A. M. Influence of Drawing on the Antimicrobial and Physical Properties of Chlorhexidine-Compounded Poly(caprolactone) Monofilaments. Macromolecular Materials and Engineering. 12 (300), 1268-1277 (2015).
- Scaffaro, R., Lopresti, F., et al. Effect of PCL/PEG-Based Membranes on Actinorhodin Production in Streptomyces coelicolor Cultivations. Macromolecular bioscience. 16 (5), 686-693 (2016).
- Scaffaro, R., Lopresti, F., Botta, L., Rigogliuso, S., Ghersi, G. Melt Processed PCL/PEG Scaffold With Discrete Pore Size Gradient for Selective Cellular Infiltration. Macromolecular Materials and Engineering. 301 (2), 182-190 (2016).
- Yousefi, A. -. M., Hoque, M. E., Prasad, R. G. S. V., Uth, N. Current strategies in multiphasic scaffold design for osteochondral tissue engineering: A review. Journal of Biomedical Materials Research Part A. 103 (7), 2460-2481 (2015).
- Gillette, B. M., Rossen, N. S., et al. Engineering extracellular matrix structure in 3D multiphase tissues. Biomaterials. 32 (32), 8067-8076 (2011).
- Seidi, A., Ramalingam, M., Elloumi-Hannachi, I., Ostrovidov, S., Khademhosseini, A. Gradient biomaterials for soft-to-hard interface tissue engineering. Acta Biomaterialia. 7 (4), 1441-1451 (2011).
- Son, J. S., Kim, S. G., et al. Hydroxyapatite/polylactide biphasic combination scaffold loaded with dexamethasone for bone regeneration. Journal of Biomedical Materials Research - Part A. 99 (4), 638-647 (2011).
- Sundararaghavan, H. G., Burdick, J. A. Gradients with depth in electrospun fibrous scaffolds for directed cell behavior. Biomacromolecules. 12 (6), 2344-2350 (2011).
- Zou, B., Liu, Y., Luo, X., Chen, F., Guo, X., Li, X. Electrospun fibrous scaffolds with continuous gradations in mineral contents and biological cues for manipulating cellular behaviors. Acta biomaterialia. 8 (4), 1576-1585 (2012).
- Nedjari, S., Schlatter, G., Hébraud, A. Thick electrospun honeycomb scaffolds with controlled pore size. Materials Letters. 142, 180-183 (2015).
- Yusong, P., Qianqian, S., Chengling, P., Jing, W. Prediction of mechanical properties of multilayer gradient hydroxyapatite reinforced poly(vinyl alcohol) gel biomaterial. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 101 (5), 729-735 (2013).
- Kim, Y. B., Kim, G. Functionally graded PCL/β-TCP biocomposites in a multilayered structure for bone tissue regeneration. Applied Physics A: Materials Science and Processing. 108 (4), 949-959 (2012).
- Sudarmadji, N., Tan, J. Y., Leong, K. F., Chua, C. K., Loh, Y. T. Investigation of the mechanical properties and porosity relationships in selective laser-sintered polyhedral for functionally graded scaffolds. Acta biomaterialia. 7 (2), 530-537 (2011).
- Molladavoodi, S., Gorbet, M., Medley, J., Kwon, H. J. Investigation of microstructure, mechanical properties and cellular viability of poly(L-lactic acid) tissue engineering scaffolds prepared by different thermally induced phase separation protocols. Journal of the mechanical behavior of biomedical materials. 17, 186-197 (2013).
- Oh, S. H., Kim, T. H., Il Im, G., Lee, J. H. Investigation of pore size effect on chondrogenic differentiation of adipose stem cells using a pore size gradient scaffold. Biomacromolecules. 11 (8), 1948-1955 (2010).
- Lin, L., Gao, H., Dong, Y. Bone regeneration using a freeze-dried 3D gradient-structured scaffold incorporating OIC-A006-loaded PLGA microspheres based on β-TCP/PLGA. Journal of Materials Science: Materials in Medicine. 26 (1), 3 (2015).
- Yoo, D. Heterogeneous minimal surface porous scaffold design using the distance field and radial basis functions. Medical engineering & physics. 34 (5), 625-639 (2012).
- Soon, Y. -. M., Shin, K. -. H., Koh, Y. -. H., Lee, J. -. H., Choi, W. -. Y., Kim, H. -. E. Fabrication and compressive strength of porous hydroxyapatite scaffolds with a functionally graded core/shell structure. Journal of the European Ceramic Society. 31 (1-2), 13-18 (2011).
- Scaffaro, R., Lopresti, F., Botta, L., Maio, A. Mechanical behavior of Polylactic acid/Polycaprolactone porous layered functional composites. Composites Part B: Engineering. 98, 70-77 (2016).
- Halili, A. N., Hasirci, N., Hasirci, V. A multilayer tissue engineered meniscus substitute. Journal of Materials Science: Materials in Medicine. 25 (4), 1195-1209 (2014).
- Bai, H., Wang, D., et al. Biomimetic gradient scaffold from ice-templating for self-seeding of cells with capillary effect. Acta Biomaterialia. 20, 113-119 (2015).
- Algul, D., Sipahi, H., Aydin, A., Kelleci, F., Ozdatli, S., Yener, F. G. Biocompatibility of biomimetic multilayered alginate-chitosan/β-TCP scaffold for osteochondral tissue. International Journal of Biological Macromolecules. 79, 363-369 (2015).
- Scaffaro, R., Lopresti, F., Botta, L., Rigogliuso, S., Ghersi, G. Preparation of three-layered porous PLA/PEG scaffold relationship between morphology , mechanical behavior and cell permeability. Journal of the Mechanical Behavior of Biomedical Materials. 54, 8-20 (2016).
- Lo Re, G., Lopresti, F., Petrucci, G., Scaffaro, R. A facile method to determine pore size distribution in porous scaffold by using image processing. Micron. 76, 37-45 (2015).
- Levingstone, T. J., Matsiko, A., Dickson, G. R., O'Brien, F. J., Gleeson, J. P. A biomimetic multi-layered collagen-based scaffold for osteochondral repair. Acta Biomaterialia. 10 (5), 1996-2004 (2014).
- Scaffaro, R., Botta, L., Maio, A., Mistretta, M. C., La Mantia, F. P. Effect of Graphene Nanoplatelets on the Physical and Antimicrobial Properties of Biopolymer-Based Nanocomposites. Materials. 9 (5), 351 (2016).
- Maio, A., Fucarino, R., Khatibi, R., Rosselli, S., Bruno, M., Scaffaro, R. A novel approach to prevent graphene oxide re-aggregation during the melt compounding with polymers. Composites Science and Technology. 119, 131-137 (2015).
- Maio, A., Agnello, S., et al. A rapid and eco-friendly route to synthesize graphene-doped silica nanohybrids. Journal of Alloys and Compounds. 664, 428-438 (2015).
- Maio, A., Giallombardo, D., Scaffaro, R., Piccionello, A. P., Pibiri, I. Synthesis of a fluorinated graphene oxide-silica nanohybrid: improving oxygen affinity. RSC Advances. 6 (52), 46037-46047 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten