Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
A Facile et écologique Route pour fabriquer poly (acide lactique) Échafaudages avec Graded Pore Taille
Dans cet article
Résumé
In this work, poly(lactic acid)/polyethylene glycol (PLA/PEG) scaffolds were prepared by using a combination of melt mixing and selective leaching. The method herein discussed permitted to develop three-layer scaffolds by highly controlling both porosity and pore size. The mechanical properties were also evaluated in a physiological environment.
Résumé
Over the recent years, functionally graded scaffolds (FGS) gaineda crucial role for manufacturing of devices for tissue engineering. The importance of this new field of biomaterials research is due to the necessity to develop implants capable of mimicking the complex functionality of the various tissues, including a continuous change from one structure or composition to another. In this latter context, one topic of main interest concerns the design of appropriate scaffolds for bone-cartilage interface tissue. In this study, three-layered scaffolds with graded pore size were achieved by melt mixing poly(lactic acid) (PLA), sodium chloride (NaCl) and polyethylene glycol (PEG). Pore size distributions were controlled by NaCl granulometry and PEG solvation. Scaffolds were characterized from a morphological and mechanical point of view. A correlation between the preparation method, the pore architecture and compressive mechanical behavior was found. The interface adhesion strength was quantitatively evaluated by using a custom-designed interfacial strength test. Furthermore, in order to imitate the human physiology, mechanical tests were also performed in phosphate buffered saline (PBS) solution at 37 °C. The method herein presented provides a high control of porosity, pore size distribution and mechanical performance, thus offering the possibility to fabricate three-layered scaffolds with tailored properties by following a simple and eco-friendly route.
Introduction
The interest in biodegradable polymers has grown in importance during the last years both in academia and in the industry, due to the rising concerns regarding plastic waste and the reduction in using non-renewable sources1-7. In particular, biocompatible and biodegradable synthetic polymers are widespread in several biomedical application fields, such as drug controlled release8,9, absorbable suture threads8,10, bioprocess intensification11 and tissue engineering12.
Tissue engineering focuses on the development of devices capable to restore and maintain normal function in diseased or injured tissues. Most of the native tissues are composed by different types of cells and extracellular matrices (ECMs) in specific spatial hierarchies. For example, articular cartilage (AC) consists of different zones with varying types and orientations of collagen fibers and collagen-binding proteins. Moreover, cartilage and bone show significantly different hierarchical structures. In this context, the preparation of multilayer scaffolds with engineered properties in each layer could allow replacing heterogeneous tissues by taking into accounts all the local microenvironments of these complex systems13,14.
Based on the cellular/biological and/or physical-chemical characteristics of the scaffolds, the main strategies adopted by the tissue engineering can be divided into monophasic, biphasic, and triphasic. Biphasic and triphasic approaches (BTA) use two or three different pores architectures, materials, or fillers to prepare multilayered functional devices. Furthermore, a single material can be used to achieve biphasic or triphasic devices, as long as it is possible to create a gradient in its physical properties12.
Cell migration plays a key-role in the morphogenesis, inflammation, wound healing and tumor metastasis. Cell movement is encouraged by the presence of a gradient of chemical-physical properties from the surface to the core of the device. Therefore, biomaterials fulfilling the above discussed requirements can be helpful in studying cell migration. In addition to chemical gradients that trigger cells migration (chemotaxis), mechanical properties of cells culture substrate can also lead to cell movement (mechanotaxis)15.
The multilayer structure can also provide the tunable release of specific drugs incorporated within the polymer matrix, by changing the specific area of the layer or the amount of loaded drugs.
Over the past decade, in order to develop scaffolds possessing a discrete or continuous gradient of morphological properties, such as porosity or pore size, several approaches have been presented16-31. The most recent papers focused on the preparation of BTA by adopting: particle leaching 12,28,32, gas foaming technique16, electrospinning17-19, layer by layer casting technique20, rapid prototyping21,22, thermally induced phase separation (TIPS)22, centrifugation freeze drying24,25, triply periodic minimal surfaces (TPMS)26, freeze casting27-30.
Within the frame of this work, we present a fast and simple route to achieve PLA-based three-layer porous scaffolds (TLS), by combining melt mixing, compression molding and salt leaching. Differently from most of the technologies commonly used for scaffold production, the strategy herein adopted can be considered fully eco-friendly, since it does not require any toxic solvent potentially dangerous for environment and for living cells and tissues32. The basic processing-structure-property relationships established in this study by analyzing both morphological features and mechanical behavior of fabricated devices provide guidance to future advances in designing multifunctional graded scaffolds with specific target properties.
Protocole
1. Échafaudages Fabrication
- Broyer NaCl dans un mélangeur de laboratoire pendant 20 min et le sécher sur un radiateur à 100 ° C.
- Mettre le NaCl a séché (45 g au moment) dans une machine à tamiser pendant 30 minutes à la fréquence la plus élevée disponible sans se produisant dans la résonance. Collecter des six fractions de sel allant de 500 um à 1000 pm (M 500); de 300 pm à 500 pm (M 300); de 100 pm à 200 pm (M 100); de 90 à 100 um (M 90); de 45 um à 65 um (M 45) et enfin M 10 avec des particules de sel de taille inférieure à 45 um comme schématisé sur la figure 1.
- Vacuum sécher pendant la nuit tous les matériaux afin d'éviter la scission hydrolytique au cours du traitement. Pour chaque matériau, sélectionner la température afin de maximiser le degré de séchage sans surmonter - dans le cas des polymères - la transition vitreuse. Par conséquent, pour choisir T = 90 ° C pour le PLA et T = 25 ° C pour le PEG, T = 105 ° C pendant NaCl.
- nourrirPLA, le PEG et du NaCl, avec une composition en pourcentage en poids 20/5/75 respectivement à une commande de mélangeur discontinu à T = 190 ° C et n = 60 tours par minute, puis les traiter jusqu'à obtenir une valeur constante du couple, habituellement au bout d'environ 10 minutes. Par la suite, la collecte rapide de la matière résultante.
- Préparer les mono-couches en utilisant une presse de laboratoire fonctionnant à 210 ° C, mettre les mélanges dans des moules cylindriques appropriés avec un diamètre de 10 mm et une hauteur de 3 mm et de les conserver pendant 60 secondes à la pression ambiante et 3 minutes à 180 bar . Par la suite, refroidir les mélanges à la température ambiante, en maintenant la pression de 180 bars.
- Assemblée des Trois-couches par moulage par compression
- Préparer chaque couche unique de la même manière que celle décrite dans (1.5), mais en utilisant des moules différents, à savoir ayant un diamètre de 10 mm et une hauteur de 1 mm. Enfin, obtenir 6 disques ayant un diamètre de 10 mm et une hauteur de 1 mm, contenant six différentes tailles de particules: M 500, M 300, M 100,
- for assembler trois couches échafaudage A (TLS A), empiler M 500, M 300 et M 100 à l'intérieur du moule cylindrique et compression mouler les dans une presse de laboratoire fonctionnant à 210 ° C pendant 60 secondes à la pression ambiante et 3 minutes à 180 bar et ensuite refroidi à température ambiante, en maintenant la pression de 180 bar.
REMARQUE: Préparer le TSL B en empilant les uns des autres M 90, M 45 et M 10 dans les mêmes moules et d'effectuer l'opération de moulage par compression en suivant la même procédure que celle utilisée pour TLS A.
- Retirez les disques des moules cylindriques et les mettre dans un bain d'eau bouillante déminéralisée, sans agitation. 3 heures après, retirer les structures poreuses résultant du bain et laissez-les sécher pendant 12 heures à la température ambiante dans une hotte chimique.
2. Analyse morphologique
- Évaluer les morphologies des échafauds par microscopie électronique à balayage.
- Décomposer les échantillons sous azote liquide, puis fixer leéchantillons sur un talon d'aluminium à l'aide d'un ruban adhésif de carbone. Enfin, par pulvérisation cathodique coate d'or pendant 90 s sous atmosphère d'argon avant l'imagerie afin d'éviter une décharge électrostatique pendant le test.
3. Échafaudages Pore Taille
- Élaborer les images obtenues par analyse par MEB avec un logiciel de traitement d'image capable de reconnaître la distribution de la taille des pores de l'échafaudage.
NOTE: Dans ce travail , l'analyse de la distribution de la taille des pores a été réalisée à l' aide d' un logiciel basé sur MATLAB décrit précédemment 33
4. porosité
- Pondérer les échantillons avant la lixiviation et à évaluer la porosité théorique selon l'expression suivante:
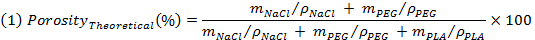
REMARQUE: M de NaCl, m et m PEG PLA sont respectivement la masse théorique de NaCl, le PEG, PLA et, en supposant que des mélanges homogènes. Til a des densités (ρ) de NaCl, le PEG et le PLA sont respectivement de 2,16 g / cm3, 1,12 g / cm 3 e 1,24 g / cm 3. - Pondérer les échantillons après le lessivage et le séchage, afin d'évaluer la densité apparente des échantillons (ρ échafaudage), puis d' évaluer la réelle porosité comme l'inverse du rapport entre la densité apparente de l'échafaudage et la densité non poreuse PLA par en utilisant l'expression (2).
NOTE: Il exprime le rapport entre le volume vide de l'échafaudage et le volume complet de l'échafaud (vide + plein).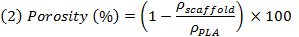
5. Propriétés mécaniques
- Tester les échantillons selon le mode de compression utilisant une machine de traction équipée d'une cellule 1 kN de charge. Réglez une vitesse de déformation constante de 1 mm min -1.
- Afin d'étudier les performances mécaniques des échantillons dans l'environnement physiologique, équiper le dynamometer avec un bain contenant (PBS), (pH = 7,4) à 37 ° C et effectuer le test avec la même configuration que celle décrite au point 5.1.
- Avant chaque mesure dans un environnement humide, tremper les échantillons avec du PBS dans une fiole à vide pendant 5 minutes afin de laisser PBS remplir tous les pores. Par la suite, permettent aux échafauds de rester dans PBS à 37 ° C pendant 15 minutes pour atteindre la température de consigne.
- Déterminer la force d'adhérence interfaciale (IAS) entre les couches de TL A et B TL en utilisant un équipement de test de résistance interfaciale conçu sur mesure, relié à une machine d' essai mécanique suivant une méthode décrite dans la littérature 32,34.
- Fixer l'échafaud sur la plate-forme et d'assurer son alignement correct avec la cellule et la base de la charge du cylindre de la machine. Fixer les échantillons d'échafaudage à des bouts de test d'aluminium en utilisant un adhésif à haute viscosité et les placer dans l'équipement pour les tests.
- Pour le test de l'état humide, hydrater les échantillons dans PBS pendant 1 h priou à l'essai. Utiliser une cellule kN 1 de charge, sous une charge de traction appliquée à un taux de 1 mm min -1 souche.
NOTE: Prendre en compte que l'échec peut se produire soit à la résistance à la rupture de l'une des couches ou à cause de délaminage au niveau des interfaces. Évaluer l'IAS comme la force maximale de la courbe contrainte-déformation.
Résultats
L'influence de la taille des particules de NaCl sur l'architecture des pores de l'échafaudage a été évaluée qualitativement et quantitativement en examinant la morphologie des échantillons et le calcul de la distribution de taille des pores par analyse d'image, respectivement , la figure 2A -. F montre des micrographies MEB des échafaudages mono-couches résultantes sel de lixiviation de matériaux contenant différentes grosseurs ...
Discussion
La première étape critique est l'optimisation de l'efficacité tamiser. Le contrôle élevé de la taille des particules de NaCl est fondamentale pour la préparation d'échafaudage avec une distribution de taille de pores souhaitée. Une autre étape essentielle est d'éviter la rupture des minces monocouches PLA lors de l'extraction de l'échantillon du moule. L'analyse de traitement d'image pourrait ne pas être représentative de l'ensemble du dispositif.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
This work was financially supported by INSTM.
matériels
| Name | Company | Catalog Number | Comments |
| Poly(lactic acid) | NatureWorks | PLA 2002D | |
| Poly(ethylene glycol) | Sigma | 83797-1KG-F | |
| Sodium Cloride | Sigma | 793566-5KG-D | |
| Phosfate Buffer Solution | Sigma | P5368-10PAK | |
| Laboratory Mixer | Brabender | PLE 330 - Plasticorder | |
| Laboratory Press | Carver | ||
| Scanning Electron Microscopy | Phenom-world | ProX | |
| Universal Testing Machine | Instron | 3365 (UK) | |
| BioPuls Bath | Instron, Norwood | ||
| Sieving Machine | Endecotts | E.V.F.1. | |
| Vacuum Oven | ISCO | NSV9035 | |
| Precision Balance | Sartorius | AX224 |
Références
- Scaffaro, R., Morreale, M., Lo Re, G., Mantia, F. P. La Degradation of Mater-Bi®/wood flour biocomposites in active sewage sludge. Polymer Degradation and Stability. 94 (8), 1220-1229 (2009).
- Scaffaro, R., Botta, L., Passaglia, E., Oberhauser, W., Frediani, M., Di Landro, L. Comparison of different processing methods to prepare poly(lactid acid)-hydrotalcite composites. Polymer Engineering & Science. 54 (8), 1804-1810 (2014).
- Thakur, V. K., Thakur, M. K. Recent advances in graft copolymerization and applications of chitosan: A review. ACS Sustainable Chemistry and Engineering. 2 (12), 2637-2652 (2014).
- Thakur, V. K., Thakur, M. K. Recent advances in green hydrogels from lignin: A review. International Journal of Biological Macromolecules. 72, 834-847 (2015).
- Thakur, V. K., Kessler, M. R. Self-healing polymer nanocomposite materials: A review. Polymer. 69, 369-383 (2015).
- Thakur, V. K., Thakur, M. K. Recent trends in hydrogels based on psyllium polysaccharide: a review. Journal of Cleaner Production. 82, 1-15 (2014).
- Voicu, S. I., Condruz, R. M., et al. Sericin Covalent Immobilization onto Cellulose Acetate Membrane for Biomedical Applications. ACS Sustainable Chemistry & Engineering. 4 (3), 1765-1774 (2016).
- Scaffaro, R., Botta, L., Sanfilippo, M., Gallo, G., Palazzolo, G., Puglia, A. M. Combining in the melt physical and biological properties of poly(caprolactone) and chlorhexidine to obtain antimicrobial surgical monofilaments. Applied Microbiology and Biotechnology. 97 (1), 99-109 (2013).
- Scaffaro, R., Maio, A., et al. Synthesis and self-assembly of a PEGylated-graphene aerogel. Composites Science and Technology. 128, 193-200 (2016).
- Scaffaro, R., Botta, L., Gallo, G., Puglia, A. M. Influence of Drawing on the Antimicrobial and Physical Properties of Chlorhexidine-Compounded Poly(caprolactone) Monofilaments. Macromolecular Materials and Engineering. 12 (300), 1268-1277 (2015).
- Scaffaro, R., Lopresti, F., et al. Effect of PCL/PEG-Based Membranes on Actinorhodin Production in Streptomyces coelicolor Cultivations. Macromolecular bioscience. 16 (5), 686-693 (2016).
- Scaffaro, R., Lopresti, F., Botta, L., Rigogliuso, S., Ghersi, G. Melt Processed PCL/PEG Scaffold With Discrete Pore Size Gradient for Selective Cellular Infiltration. Macromolecular Materials and Engineering. 301 (2), 182-190 (2016).
- Yousefi, A. -. M., Hoque, M. E., Prasad, R. G. S. V., Uth, N. Current strategies in multiphasic scaffold design for osteochondral tissue engineering: A review. Journal of Biomedical Materials Research Part A. 103 (7), 2460-2481 (2015).
- Gillette, B. M., Rossen, N. S., et al. Engineering extracellular matrix structure in 3D multiphase tissues. Biomaterials. 32 (32), 8067-8076 (2011).
- Seidi, A., Ramalingam, M., Elloumi-Hannachi, I., Ostrovidov, S., Khademhosseini, A. Gradient biomaterials for soft-to-hard interface tissue engineering. Acta Biomaterialia. 7 (4), 1441-1451 (2011).
- Son, J. S., Kim, S. G., et al. Hydroxyapatite/polylactide biphasic combination scaffold loaded with dexamethasone for bone regeneration. Journal of Biomedical Materials Research - Part A. 99 (4), 638-647 (2011).
- Sundararaghavan, H. G., Burdick, J. A. Gradients with depth in electrospun fibrous scaffolds for directed cell behavior. Biomacromolecules. 12 (6), 2344-2350 (2011).
- Zou, B., Liu, Y., Luo, X., Chen, F., Guo, X., Li, X. Electrospun fibrous scaffolds with continuous gradations in mineral contents and biological cues for manipulating cellular behaviors. Acta biomaterialia. 8 (4), 1576-1585 (2012).
- Nedjari, S., Schlatter, G., Hébraud, A. Thick electrospun honeycomb scaffolds with controlled pore size. Materials Letters. 142, 180-183 (2015).
- Yusong, P., Qianqian, S., Chengling, P., Jing, W. Prediction of mechanical properties of multilayer gradient hydroxyapatite reinforced poly(vinyl alcohol) gel biomaterial. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 101 (5), 729-735 (2013).
- Kim, Y. B., Kim, G. Functionally graded PCL/β-TCP biocomposites in a multilayered structure for bone tissue regeneration. Applied Physics A: Materials Science and Processing. 108 (4), 949-959 (2012).
- Sudarmadji, N., Tan, J. Y., Leong, K. F., Chua, C. K., Loh, Y. T. Investigation of the mechanical properties and porosity relationships in selective laser-sintered polyhedral for functionally graded scaffolds. Acta biomaterialia. 7 (2), 530-537 (2011).
- Molladavoodi, S., Gorbet, M., Medley, J., Kwon, H. J. Investigation of microstructure, mechanical properties and cellular viability of poly(L-lactic acid) tissue engineering scaffolds prepared by different thermally induced phase separation protocols. Journal of the mechanical behavior of biomedical materials. 17, 186-197 (2013).
- Oh, S. H., Kim, T. H., Il Im, G., Lee, J. H. Investigation of pore size effect on chondrogenic differentiation of adipose stem cells using a pore size gradient scaffold. Biomacromolecules. 11 (8), 1948-1955 (2010).
- Lin, L., Gao, H., Dong, Y. Bone regeneration using a freeze-dried 3D gradient-structured scaffold incorporating OIC-A006-loaded PLGA microspheres based on β-TCP/PLGA. Journal of Materials Science: Materials in Medicine. 26 (1), 3 (2015).
- Yoo, D. Heterogeneous minimal surface porous scaffold design using the distance field and radial basis functions. Medical engineering & physics. 34 (5), 625-639 (2012).
- Soon, Y. -. M., Shin, K. -. H., Koh, Y. -. H., Lee, J. -. H., Choi, W. -. Y., Kim, H. -. E. Fabrication and compressive strength of porous hydroxyapatite scaffolds with a functionally graded core/shell structure. Journal of the European Ceramic Society. 31 (1-2), 13-18 (2011).
- Scaffaro, R., Lopresti, F., Botta, L., Maio, A. Mechanical behavior of Polylactic acid/Polycaprolactone porous layered functional composites. Composites Part B: Engineering. 98, 70-77 (2016).
- Halili, A. N., Hasirci, N., Hasirci, V. A multilayer tissue engineered meniscus substitute. Journal of Materials Science: Materials in Medicine. 25 (4), 1195-1209 (2014).
- Bai, H., Wang, D., et al. Biomimetic gradient scaffold from ice-templating for self-seeding of cells with capillary effect. Acta Biomaterialia. 20, 113-119 (2015).
- Algul, D., Sipahi, H., Aydin, A., Kelleci, F., Ozdatli, S., Yener, F. G. Biocompatibility of biomimetic multilayered alginate-chitosan/β-TCP scaffold for osteochondral tissue. International Journal of Biological Macromolecules. 79, 363-369 (2015).
- Scaffaro, R., Lopresti, F., Botta, L., Rigogliuso, S., Ghersi, G. Preparation of three-layered porous PLA/PEG scaffold relationship between morphology , mechanical behavior and cell permeability. Journal of the Mechanical Behavior of Biomedical Materials. 54, 8-20 (2016).
- Lo Re, G., Lopresti, F., Petrucci, G., Scaffaro, R. A facile method to determine pore size distribution in porous scaffold by using image processing. Micron. 76, 37-45 (2015).
- Levingstone, T. J., Matsiko, A., Dickson, G. R., O'Brien, F. J., Gleeson, J. P. A biomimetic multi-layered collagen-based scaffold for osteochondral repair. Acta Biomaterialia. 10 (5), 1996-2004 (2014).
- Scaffaro, R., Botta, L., Maio, A., Mistretta, M. C., La Mantia, F. P. Effect of Graphene Nanoplatelets on the Physical and Antimicrobial Properties of Biopolymer-Based Nanocomposites. Materials. 9 (5), 351 (2016).
- Maio, A., Fucarino, R., Khatibi, R., Rosselli, S., Bruno, M., Scaffaro, R. A novel approach to prevent graphene oxide re-aggregation during the melt compounding with polymers. Composites Science and Technology. 119, 131-137 (2015).
- Maio, A., Agnello, S., et al. A rapid and eco-friendly route to synthesize graphene-doped silica nanohybrids. Journal of Alloys and Compounds. 664, 428-438 (2015).
- Maio, A., Giallombardo, D., Scaffaro, R., Piccionello, A. P., Pibiri, I. Synthesis of a fluorinated graphene oxide-silica nanohybrid: improving oxygen affinity. RSC Advances. 6 (52), 46037-46047 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon