Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Facile и экологически чистый маршрут сфабриковать поли (молочная кислота) Строительные леса с градуированными Размер пор
В этой статье
Резюме
In this work, poly(lactic acid)/polyethylene glycol (PLA/PEG) scaffolds were prepared by using a combination of melt mixing and selective leaching. The method herein discussed permitted to develop three-layer scaffolds by highly controlling both porosity and pore size. The mechanical properties were also evaluated in a physiological environment.
Аннотация
Over the recent years, functionally graded scaffolds (FGS) gaineda crucial role for manufacturing of devices for tissue engineering. The importance of this new field of biomaterials research is due to the necessity to develop implants capable of mimicking the complex functionality of the various tissues, including a continuous change from one structure or composition to another. In this latter context, one topic of main interest concerns the design of appropriate scaffolds for bone-cartilage interface tissue. In this study, three-layered scaffolds with graded pore size were achieved by melt mixing poly(lactic acid) (PLA), sodium chloride (NaCl) and polyethylene glycol (PEG). Pore size distributions were controlled by NaCl granulometry and PEG solvation. Scaffolds were characterized from a morphological and mechanical point of view. A correlation between the preparation method, the pore architecture and compressive mechanical behavior was found. The interface adhesion strength was quantitatively evaluated by using a custom-designed interfacial strength test. Furthermore, in order to imitate the human physiology, mechanical tests were also performed in phosphate buffered saline (PBS) solution at 37 °C. The method herein presented provides a high control of porosity, pore size distribution and mechanical performance, thus offering the possibility to fabricate three-layered scaffolds with tailored properties by following a simple and eco-friendly route.
Введение
The interest in biodegradable polymers has grown in importance during the last years both in academia and in the industry, due to the rising concerns regarding plastic waste and the reduction in using non-renewable sources1-7. In particular, biocompatible and biodegradable synthetic polymers are widespread in several biomedical application fields, such as drug controlled release8,9, absorbable suture threads8,10, bioprocess intensification11 and tissue engineering12.
Tissue engineering focuses on the development of devices capable to restore and maintain normal function in diseased or injured tissues. Most of the native tissues are composed by different types of cells and extracellular matrices (ECMs) in specific spatial hierarchies. For example, articular cartilage (AC) consists of different zones with varying types and orientations of collagen fibers and collagen-binding proteins. Moreover, cartilage and bone show significantly different hierarchical structures. In this context, the preparation of multilayer scaffolds with engineered properties in each layer could allow replacing heterogeneous tissues by taking into accounts all the local microenvironments of these complex systems13,14.
Based on the cellular/biological and/or physical-chemical characteristics of the scaffolds, the main strategies adopted by the tissue engineering can be divided into monophasic, biphasic, and triphasic. Biphasic and triphasic approaches (BTA) use two or three different pores architectures, materials, or fillers to prepare multilayered functional devices. Furthermore, a single material can be used to achieve biphasic or triphasic devices, as long as it is possible to create a gradient in its physical properties12.
Cell migration plays a key-role in the morphogenesis, inflammation, wound healing and tumor metastasis. Cell movement is encouraged by the presence of a gradient of chemical-physical properties from the surface to the core of the device. Therefore, biomaterials fulfilling the above discussed requirements can be helpful in studying cell migration. In addition to chemical gradients that trigger cells migration (chemotaxis), mechanical properties of cells culture substrate can also lead to cell movement (mechanotaxis)15.
The multilayer structure can also provide the tunable release of specific drugs incorporated within the polymer matrix, by changing the specific area of the layer or the amount of loaded drugs.
Over the past decade, in order to develop scaffolds possessing a discrete or continuous gradient of morphological properties, such as porosity or pore size, several approaches have been presented16-31. The most recent papers focused on the preparation of BTA by adopting: particle leaching 12,28,32, gas foaming technique16, electrospinning17-19, layer by layer casting technique20, rapid prototyping21,22, thermally induced phase separation (TIPS)22, centrifugation freeze drying24,25, triply periodic minimal surfaces (TPMS)26, freeze casting27-30.
Within the frame of this work, we present a fast and simple route to achieve PLA-based three-layer porous scaffolds (TLS), by combining melt mixing, compression molding and salt leaching. Differently from most of the technologies commonly used for scaffold production, the strategy herein adopted can be considered fully eco-friendly, since it does not require any toxic solvent potentially dangerous for environment and for living cells and tissues32. The basic processing-structure-property relationships established in this study by analyzing both morphological features and mechanical behavior of fabricated devices provide guidance to future advances in designing multifunctional graded scaffolds with specific target properties.
протокол
1. Эшафот Fabrication
- Измельчите NaCl в лабораторном смесителе в течение 20 мин и высушить его на нагреватель при 100 ° С.
- Помещенный высушенного NaCl (45 г в момент времени) в просеивание в течение 30 минут при самой высокой возможной частоты без происходящих в резонансе. Сбор шесть солевые фракций, в пределах от 500 мкм до 1000 мкм (М 500); от 300 мкм до 500 мкм (М 300); от 100 мкм до 200 мкм (М 100); от 90 мкм до 100 (М 90); от 45 мкм до 65 мкм (М 45) и , наконец , M 10 с содержанием соли частиц размером менее 45 мкм , как схематизированы на рисунке 1.
- Вакуум высохнуть в течение ночи все материалы, с тем чтобы избежать гидролитического расщепления во время обработки. Для каждого материала, выбрать температуру, чтобы максимизировать степень сушки без преодоления - в случае полимеров - перехода стекла. Таким образом, выбор T = 90 ° C для PLA и Т = 25 ° C для PEG, Т = 105 ° С в течение NaCl.
- КормPLA, ПЭГ и NaCl, с весовой процент состава 20/5/75 соответственно, к эксплуатации смеситель периодического действия при Т = 190 ° С и п = 60 оборотов в минуту и затем обработать их до достижения постоянного значения крутящего момента, как правило, после того, как о 10 минут. После этого, быстро собрать полученный материал.
- Подготовьте монослоя с помощью лабораторного пресс, работающий при температуре 210 ° С, положить смесей в соответствующих цилиндрических формах с диаметром 10 мм и высотой 3 мм и держать их в течение 60 секунд при давлении окружающей среды и 3 мин при давлении 180 бар , После охлаждения смеси при комнатной температуре, поддерживая давление 180 бар.
- Сборка из трех слоев с помощью компрессионного формования
- Подготовка каждого один слой таким же образом, что и описанный в (1.5), но с использованием различных форм, т.е., имеющий диаметр 10 мм и высотой 1 мм. И, наконец, получить 6 дисков, имеющих диаметр 10 мм и высотой 1 мм, содержащий шесть различных размеров частиц: М 500, М 300, М 100,
- FoR сборки трехслойный подмости А (TLS-А), накопиться M 500, M 300 и M 100 внутри цилиндрической формы и компрессионного формования их в лабораторной пресс, работающий при температуре 210 ° С в течение 60 с при давлении окружающей среды и 3 минуты при 180 бар и затем охлаждают при комнатной температуре, поддерживая давление 180 бар.
Примечание: Подготовка TSL B путем укладки друг на друга М 90, М 45 и М 10 в тех же пресс-форм и проведения спрессованных операции, следуя той же процедуре, что используется для TLS А.
- Удалите диски из цилиндрических пресс-форм и поместить их в кипящей деминерализованной водяной бане с, без перемешивания. 3 ч после того, как, уводит полученную пористую структуру из ванны и дайте им высохнуть в течение 12 часов при комнатной температуре в химическом колпаком.
2. морфологический анализ
- Оценка морфологией каркасах с помощью сканирующей электронной микроскопии.
- Ломайте образцы под жидким азотом, а затем прикрепитеОбразцы на алюминиевой заглушкой, используя клейкую ленту. углеродную Наконец, бормотать-Coate с золотом в течение 90 секунд в атмосфере аргона до визуализации во избежание электростатического разряда во время испытания.
3. Эшафот Размер пор
- Выработать изображения, полученные с помощью анализа SEM с программным обеспечением для обработки изображений, способного распознавать распределение пор по размерам эшафота.
Примечание: В данной работе проведен анализ распределения пор по размерам был проведен с использованием MATLAB на основе программного обеспечения , ранее описанный 33
4. Пористость
- Взвесьте образцы перед выщелачиванием и оценить теоретическую пористость в соответствии со следующим выражением:
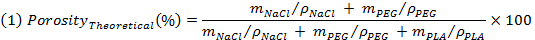
Примечание: М NaCl, м PEG и м PLA, соответственно теоретическая масса NaCl, ПЭГ и ПЛА, в предположении однородных смесей. Tон плотности (ρ) из NaCl, ПЭГ и PLA соответственно 2,16 г / см 3, 1,12 г / см 3 е 1,24 г / см 3. - Взвешивание образцов после промывки и сушки для того , чтобы оценить кажущуюся плотность образцов (ρ каркасных), а затем оценить реальную пористость в виде обратной величины соотношения между кажущейся плотности помост и плотности непористого PLA путем используя выражение (2).
ПРИМЕЧАНИЕ: Это выражает отношение между пустой объем строительных лесов и полного объема строительных лесов (пустой + полный).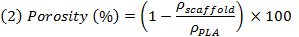
5. Механические свойства
- Тестирование образцов в режиме сжатия с использованием разрывной машины, оснащенный 1 кН динамометр. Установить постоянную скорость деформации 1 мм мин -1.
- Для исследования механических характеристик образцов в физиологической среде, оборудовать dynamometeR с ванной, содержащей (PBS), (рН = 7,4) при температуре 37 ° С и проводили тест с той же установке, что и описанный в пункте 5.1.
- Перед каждым измерением во влажной среде, замочить образцы с PBS в вакуумной колбе, в течение 5 мин, чтобы позволить PBS заполнить все поры. После этого позволить каркасы остаться в PBS при 37 ° С в течение 15 мин, чтобы достичь заданной температуры.
- Определить межфазное прочность сцепления (IAS) между слоями TL A и TL B с помощью специально разработанной межфазное испытания на прочность оборудования, подключенного к механической испытательной машины следуя методике , описанной в литературе 32,34.
- Закрепите леску на буровой установке и обеспечить его правильное совмещение с тензодатчика и базовой плиты машины. Приложить образцы строительных лесов к испытанию алюминиевых заглушек с помощью клея высокой вязкости и поместить их в оборудование для тестирования.
- Для условия испытания мокрой, увлажняют образцы в PBS в течение 1 ч ПОИили для тестирования. С помощью 1 кН динамометрический элемент, под растягивающей нагрузкой , приложенной скорости деформации 1 мм мин -1.
Примечание: Примите во внимание, что сбой может происходить либо на предел прочности на растяжение одного из слоев или из-за отслоения на границах раздела. Оценка МСФО в качестве максимальной прочности кривой напряженно-деформированного состояния.
Результаты
Влияние NaCl размера частиц на поровой архитектуры каркасах оценивали качественно и количественно с помощью исследования морфологии образцов и расчета распределения пор по размерам методом анализа изображений, соответственно , рис 2а - е . Показывает...
Обсуждение
Первый важный шаг заключается в оптимизации эффективности просеивания. Высокий контроль размера частиц NaCl является основой для подготовки строительных лесов с требуемым распределением пор по размерам. Другим важным шагом является избежать перелома тонких монослоев PLA во время извле...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was financially supported by INSTM.
Материалы
| Name | Company | Catalog Number | Comments |
| Poly(lactic acid) | NatureWorks | PLA 2002D | |
| Poly(ethylene glycol) | Sigma | 83797-1KG-F | |
| Sodium Cloride | Sigma | 793566-5KG-D | |
| Phosfate Buffer Solution | Sigma | P5368-10PAK | |
| Laboratory Mixer | Brabender | PLE 330 - Plasticorder | |
| Laboratory Press | Carver | ||
| Scanning Electron Microscopy | Phenom-world | ProX | |
| Universal Testing Machine | Instron | 3365 (UK) | |
| BioPuls Bath | Instron, Norwood | ||
| Sieving Machine | Endecotts | E.V.F.1. | |
| Vacuum Oven | ISCO | NSV9035 | |
| Precision Balance | Sartorius | AX224 |
Ссылки
- Scaffaro, R., Morreale, M., Lo Re, G., Mantia, F. P. La Degradation of Mater-Bi®/wood flour biocomposites in active sewage sludge. Polymer Degradation and Stability. 94 (8), 1220-1229 (2009).
- Scaffaro, R., Botta, L., Passaglia, E., Oberhauser, W., Frediani, M., Di Landro, L. Comparison of different processing methods to prepare poly(lactid acid)-hydrotalcite composites. Polymer Engineering & Science. 54 (8), 1804-1810 (2014).
- Thakur, V. K., Thakur, M. K. Recent advances in graft copolymerization and applications of chitosan: A review. ACS Sustainable Chemistry and Engineering. 2 (12), 2637-2652 (2014).
- Thakur, V. K., Thakur, M. K. Recent advances in green hydrogels from lignin: A review. International Journal of Biological Macromolecules. 72, 834-847 (2015).
- Thakur, V. K., Kessler, M. R. Self-healing polymer nanocomposite materials: A review. Polymer. 69, 369-383 (2015).
- Thakur, V. K., Thakur, M. K. Recent trends in hydrogels based on psyllium polysaccharide: a review. Journal of Cleaner Production. 82, 1-15 (2014).
- Voicu, S. I., Condruz, R. M., et al. Sericin Covalent Immobilization onto Cellulose Acetate Membrane for Biomedical Applications. ACS Sustainable Chemistry & Engineering. 4 (3), 1765-1774 (2016).
- Scaffaro, R., Botta, L., Sanfilippo, M., Gallo, G., Palazzolo, G., Puglia, A. M. Combining in the melt physical and biological properties of poly(caprolactone) and chlorhexidine to obtain antimicrobial surgical monofilaments. Applied Microbiology and Biotechnology. 97 (1), 99-109 (2013).
- Scaffaro, R., Maio, A., et al. Synthesis and self-assembly of a PEGylated-graphene aerogel. Composites Science and Technology. 128, 193-200 (2016).
- Scaffaro, R., Botta, L., Gallo, G., Puglia, A. M. Influence of Drawing on the Antimicrobial and Physical Properties of Chlorhexidine-Compounded Poly(caprolactone) Monofilaments. Macromolecular Materials and Engineering. 12 (300), 1268-1277 (2015).
- Scaffaro, R., Lopresti, F., et al. Effect of PCL/PEG-Based Membranes on Actinorhodin Production in Streptomyces coelicolor Cultivations. Macromolecular bioscience. 16 (5), 686-693 (2016).
- Scaffaro, R., Lopresti, F., Botta, L., Rigogliuso, S., Ghersi, G. Melt Processed PCL/PEG Scaffold With Discrete Pore Size Gradient for Selective Cellular Infiltration. Macromolecular Materials and Engineering. 301 (2), 182-190 (2016).
- Yousefi, A. -. M., Hoque, M. E., Prasad, R. G. S. V., Uth, N. Current strategies in multiphasic scaffold design for osteochondral tissue engineering: A review. Journal of Biomedical Materials Research Part A. 103 (7), 2460-2481 (2015).
- Gillette, B. M., Rossen, N. S., et al. Engineering extracellular matrix structure in 3D multiphase tissues. Biomaterials. 32 (32), 8067-8076 (2011).
- Seidi, A., Ramalingam, M., Elloumi-Hannachi, I., Ostrovidov, S., Khademhosseini, A. Gradient biomaterials for soft-to-hard interface tissue engineering. Acta Biomaterialia. 7 (4), 1441-1451 (2011).
- Son, J. S., Kim, S. G., et al. Hydroxyapatite/polylactide biphasic combination scaffold loaded with dexamethasone for bone regeneration. Journal of Biomedical Materials Research - Part A. 99 (4), 638-647 (2011).
- Sundararaghavan, H. G., Burdick, J. A. Gradients with depth in electrospun fibrous scaffolds for directed cell behavior. Biomacromolecules. 12 (6), 2344-2350 (2011).
- Zou, B., Liu, Y., Luo, X., Chen, F., Guo, X., Li, X. Electrospun fibrous scaffolds with continuous gradations in mineral contents and biological cues for manipulating cellular behaviors. Acta biomaterialia. 8 (4), 1576-1585 (2012).
- Nedjari, S., Schlatter, G., Hébraud, A. Thick electrospun honeycomb scaffolds with controlled pore size. Materials Letters. 142, 180-183 (2015).
- Yusong, P., Qianqian, S., Chengling, P., Jing, W. Prediction of mechanical properties of multilayer gradient hydroxyapatite reinforced poly(vinyl alcohol) gel biomaterial. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 101 (5), 729-735 (2013).
- Kim, Y. B., Kim, G. Functionally graded PCL/β-TCP biocomposites in a multilayered structure for bone tissue regeneration. Applied Physics A: Materials Science and Processing. 108 (4), 949-959 (2012).
- Sudarmadji, N., Tan, J. Y., Leong, K. F., Chua, C. K., Loh, Y. T. Investigation of the mechanical properties and porosity relationships in selective laser-sintered polyhedral for functionally graded scaffolds. Acta biomaterialia. 7 (2), 530-537 (2011).
- Molladavoodi, S., Gorbet, M., Medley, J., Kwon, H. J. Investigation of microstructure, mechanical properties and cellular viability of poly(L-lactic acid) tissue engineering scaffolds prepared by different thermally induced phase separation protocols. Journal of the mechanical behavior of biomedical materials. 17, 186-197 (2013).
- Oh, S. H., Kim, T. H., Il Im, G., Lee, J. H. Investigation of pore size effect on chondrogenic differentiation of adipose stem cells using a pore size gradient scaffold. Biomacromolecules. 11 (8), 1948-1955 (2010).
- Lin, L., Gao, H., Dong, Y. Bone regeneration using a freeze-dried 3D gradient-structured scaffold incorporating OIC-A006-loaded PLGA microspheres based on β-TCP/PLGA. Journal of Materials Science: Materials in Medicine. 26 (1), 3 (2015).
- Yoo, D. Heterogeneous minimal surface porous scaffold design using the distance field and radial basis functions. Medical engineering & physics. 34 (5), 625-639 (2012).
- Soon, Y. -. M., Shin, K. -. H., Koh, Y. -. H., Lee, J. -. H., Choi, W. -. Y., Kim, H. -. E. Fabrication and compressive strength of porous hydroxyapatite scaffolds with a functionally graded core/shell structure. Journal of the European Ceramic Society. 31 (1-2), 13-18 (2011).
- Scaffaro, R., Lopresti, F., Botta, L., Maio, A. Mechanical behavior of Polylactic acid/Polycaprolactone porous layered functional composites. Composites Part B: Engineering. 98, 70-77 (2016).
- Halili, A. N., Hasirci, N., Hasirci, V. A multilayer tissue engineered meniscus substitute. Journal of Materials Science: Materials in Medicine. 25 (4), 1195-1209 (2014).
- Bai, H., Wang, D., et al. Biomimetic gradient scaffold from ice-templating for self-seeding of cells with capillary effect. Acta Biomaterialia. 20, 113-119 (2015).
- Algul, D., Sipahi, H., Aydin, A., Kelleci, F., Ozdatli, S., Yener, F. G. Biocompatibility of biomimetic multilayered alginate-chitosan/β-TCP scaffold for osteochondral tissue. International Journal of Biological Macromolecules. 79, 363-369 (2015).
- Scaffaro, R., Lopresti, F., Botta, L., Rigogliuso, S., Ghersi, G. Preparation of three-layered porous PLA/PEG scaffold relationship between morphology , mechanical behavior and cell permeability. Journal of the Mechanical Behavior of Biomedical Materials. 54, 8-20 (2016).
- Lo Re, G., Lopresti, F., Petrucci, G., Scaffaro, R. A facile method to determine pore size distribution in porous scaffold by using image processing. Micron. 76, 37-45 (2015).
- Levingstone, T. J., Matsiko, A., Dickson, G. R., O'Brien, F. J., Gleeson, J. P. A biomimetic multi-layered collagen-based scaffold for osteochondral repair. Acta Biomaterialia. 10 (5), 1996-2004 (2014).
- Scaffaro, R., Botta, L., Maio, A., Mistretta, M. C., La Mantia, F. P. Effect of Graphene Nanoplatelets on the Physical and Antimicrobial Properties of Biopolymer-Based Nanocomposites. Materials. 9 (5), 351 (2016).
- Maio, A., Fucarino, R., Khatibi, R., Rosselli, S., Bruno, M., Scaffaro, R. A novel approach to prevent graphene oxide re-aggregation during the melt compounding with polymers. Composites Science and Technology. 119, 131-137 (2015).
- Maio, A., Agnello, S., et al. A rapid and eco-friendly route to synthesize graphene-doped silica nanohybrids. Journal of Alloys and Compounds. 664, 428-438 (2015).
- Maio, A., Giallombardo, D., Scaffaro, R., Piccionello, A. P., Pibiri, I. Synthesis of a fluorinated graphene oxide-silica nanohybrid: improving oxygen affinity. RSC Advances. 6 (52), 46037-46047 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены